Способ идентификации соединения, пригодного для лечения воспалительного состояния ротовой полости
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и представляет собой способ идентификации соединения, пригодного для лечения гингивита, включающий: взаимодействие первого гингивального образца, полученного от млекопитающего, страдающего от гингивита, с исследуемым соединением; взаимодействие второго гингивального образца из ротовой полости млекопитающего с положительным контролем - соединением, подавляющим экспрессию одной или более матриксных металлопротеиназ (галогенированный дифениловый эфир); измерение степени, с которой экспрессия одной или более матриксных металлопротеиназ подавляется с помощью исследуемого соединения; измерение степени, с которой экспрессия одной или более из матриксных металлопротеиназ подавляется с помощью положительного контроля; и сравнение степени, с которой экспрессия одной или более из матриксных металлопротеиназ подавляется с помощью исследуемого соединения, со степенью, с которой экспрессия одной или более из матриксных металлопротеиназ подавляется с помощью положительного контроля; в котором исследуемое соединение, которое подавляет экспрессию одной или более из матриксных металлопротеиназ в равной или большей степени, чем положительный контроль, является соединением, пригодным для лечения гингивита; где одна или более матриксных металлопротеиназ, для которых измеряют экспрессию, включают, по меньшей мере, ММР-9 и ММР-13. 6 з.п. ф-лы, 2 пр., 4 табл., 3 ил.
Реферат
УРОВЕНЬ ТЕХНИКИ
Периодонтит характеризуется, частично, неправильной и чрезмерной деградацией периодонтального органического матрикса. Этот матрикс включает десну, периодонтальную связку, цементное вещество зубов и альвеолярную кость. По меньшей мере, часть разрушения матрикса опосредована сверхсинтезом матриксных металлопротеиназ (MMP), семейства цинк-зависимых эндопептидаз. MMP также способствуют резорбции костной ткани, разрушая остеоидную ткань (то есть деминерализованный и недавно синтезированный костный матрикс), затем разрушая матрикс. Эти явления приводят к клиническому проявлению периодонтита, включая атрофию десен, образование патологического десневого кармана, потерю прикрепления и возможную потерю зуба.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение включает способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включающий взаимодействие клетки во рту млекопитающего с агентом, который подавляет, по меньшей мере, одну матриксную металлопротеиназу, выбранную из группы, состоящей из MMP-9 и MMP-13, в котором подавление металлопротеиназы коррелируется с сокращением, по меньшей мере, одного симптома, связанного с периодонтитом.
Изобретение также включает способ идентификации соединения, пригодного для лечения периодонтита у млекопитающего, способ, включающий взаимодействие клетки с исследуемым соединением и определение, подавляет ли исследуемое соединение, по меньшей мере, одну матриксную металлопротеиназу, выбранную из группы, состоящей из MMP-9 и MMP-13, в котором подавление, по меньшей мере, одной матриксной металлопротеиназы является показателем, что исследуемое соединение является пригодным для лечения периодонтита.
Изобретение также включает способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для подавления, по меньшей мере, одной матриксной металлопротеиназы в ротовой полости млекопитающего, причем матриксная металлопротеиназа выбрана из группы, состоящей из MMP-9 и MMP-13, в котором подавление матриксной металлопротеиназы приводит к лечению периодонтита у млекопитающего.
Изобретение дополнительно включает способ сокращения патологического превышения активности матриксной металлопротеиназы в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения активности матриксной металлопротеиназы в ротовой полости млекопитающего, причем матриксная металлопротеиназа выбрана из группы, состоящей из MMP-9 и MMP-13, в котором ингибирование активности матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина.
Изобретение включает способ сокращения патологического избытка матриксной металлопротеиназы в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения уровня матриксной металлопротеиназы в ротовой полости млекопитающего, в котором ингибирование уровня матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина и в котором матриксная металлопротеиназа выбрана из группы, состоящей из MMP-9 и MMP-13.
В одном варианте осуществления способ включает пероральную композицию, содержащую 0-36% вес. кремнийсодержащего полирующего компонента; 0,25-0,35% вес., по существу, нерастворимого в воде некатионного антибактериального агента, выбранного из группы, состоящей из галогенированных дифениловых эфиров, галогенированных салициланилидов, бензойных эфиров, галогенированных карбанилидов и фенольных соединений; и эффективное количество 0,01-4,0% вес. агента, увеличивающего антибактериальную активность, который улучшает доставку и плотное соединение вышеуказанного антибактериального агента и удержание его на поверхности зуба и десны, в котором вышеуказанный агент, увеличивающий антибактериальную активность, представляет собой (i) сополимер малеиновой кислоты или ангидрида с другим инертным этиленненасыщенным полимеризующимся мономером или (ii) полимер поли(бета-стиролфосфоновой кислоты) или поли(альфа-стиролфосфоновой кислоты) или сополимер любой стиролфосфоновой кислоты с другим этиленненасыщенным мономером, и композицию, необязательно дополнительно содержащую источник, обеспечивающий количество фторид-ионов, достаточное для доставки от 25 ч./млн до 5000 ч./млн фторид-ионов. В одном варианте осуществления пероральная композиция содержит 0,01-36% вес. кремнийсодержащего полирующего компонента. В другом варианте осуществления пероральная композиция не содержит кремнийсодержащего полирующего компонента.
В одном варианте осуществления способ включает пероральную композицию, содержащую эффективное количество против зубного налета, по меньшей мере, одной растворимой в воде линейной молекулярно дегидратированной полифосфатной соли в качестве необходимого агента против зубного налета, эффективное количество против зубного камня, по существу, нерастворимого в воде некатионного антибактериального соединения в качестве необходимого агента против зубного камня, и необязательно источник, обеспечивающий количество фторид-ионов, достаточное для доставки от 25 ч./млн до 5000 ч./млн фторид-ионов. В одном аспекте 2,4,4'-трихлор-2'-гидроксидифениловый эфир присутствует в композиции в концентрации от 1 ч./млн до 100 ч./млн.
В одном варианте осуществления пероральная композиция представляет собой жидкость для полоскания ротовой полости или средство для полоскания ротовой полости. В одном аспекте жидкость для полоскания ротовой полости или средство для полоскания ротовой полости не содержит кремнийсодержащего полирующего агента.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 иллюстрирует эффект 2,4,4'-трихлор-2'-гидроксидифенилового эфира на TNFα-индуцированную MMP-9 выработку моноцитов.
Фигура 2 иллюстрирует эффект 2,4,4'-трихлор-2'-гидроксидифенилового эфира на ПТГ-индуцированную MMP-13 выработку остеобластов.
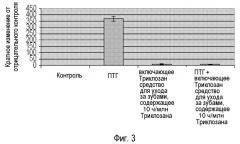
Фигура 3 иллюстрирует эффект средства для ухода за зубами настоящего изобретения на выработку MMP-13, индуцированную ПТГ, в остеобластах.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Три основные разрушительные MMP при периодонтите представляют собой MMP-8, MMP-9 и MMP-13. MMP-8 и MMP-13 представляют собой коллагеназы и MMP-9 представляет собой желатиназу. Все три фермента могут быть обнаружены в пораженной корневой оболочке и гингивальной десневой жидкости. Уровни этих ферментов положительно коррелируются с клиническими признаками периодонтита. Таким образом, повышенные или «выше нормального» уровни, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 представляют собой признак периодонтита. Измерения можно проводить, используя ферменты MMP-8, MMP-9 и MMP-13, РНК или биологической активности.
В настоящем описании далее теперь показано, что пероральную композицию, содержащую 2,4,4'-трихлор-2'-гидроксидифениловый эфир (триклозан), можно использовать для уменьшения уровней, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего. В одном варианте осуществления пероральная композиция представляет собой средство для ухода за зубами. В другом варианте осуществления пероральная композиция включает, например, жидкость для полоскания ротовой полости, накладку или гель. В другом аспекте антибактериальное соединение можно использовать для уменьшения уровней, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего.
Во всей заявке используется, что диапазоны применяют в качестве условного обозначения для описания всех без исключения величин, которые находятся в пределах диапазона. Любая величина в пределах диапазона может быть выбрана как конец диапазона. Кроме того, все ссылки, процитированные в настоящем описании, включены в настоящее описание в полном объеме посредством ссылки. В случае противоречия в определениях в настоящем раскрытии и определениях в процитированной ссылке, настоящее раскрытие имеет преимущественную силу.
Используемый в настоящем описании термин «периодонтит» относится к неправильному и чрезмерному разрушению периодонтального органического матрикса, включая десну, периодонтальную связку, цементное вещество зубов и альвеолярную кость. Клиническое проявление периодонтита включает, но не ограничивается ими, атрофию десен, образование патологического десневого кармана, потерю прикрепления матрикса, потерю зуба и костной массы. Периодонтит может быть охарактеризован как начальный периодонтит, умеренный периодонтит или осложненный периодонтит. Однако периодонтит не должен быть ограничен только теми симптомами и осложнениями, изложенными в настоящем описании, как будет очевидно специалисту в данной области техники. Начальный периодонтит клинически проявляется, среди других симптомов, одним или более из: кровотечение при зондировании; присутствие карманов (3-4 мм); локализованные области рецессии мягких тканей; потеря прикрепления (3-4 мм); потеря костной массы (например, горизонтальная); и класс I инвазии зоны разделения корней многокорневых зубов. Умеренный периодонтит клинически проявляется, среди других симптомов, одним или более из: присутствие карманов (4-6 мм); присутствие потери прикрепления (4-6 мм); кровотечение при зондировании; степень I и/или степень II инвазии зоны разделения корней многокорневых зубов; класс I подвижности зуба; потеря костной массы (например, горизонтальная и/или вертикальная); и потеря 1/3 поддерживающей альвеолярной кости (то есть отношение коронки к корню 1:1). Осложненный периодонтит клинически проявляется одним или более из: кровотечение при зондировании; присутствие карманов (более чем 6 мм); потеря прикрепления (более чем 6 мм); степень II и/или степень III инвазии зоны разделения корней многокорневых зубов; класс II и/или класс III подвижности зуба; потеря костной массы (например, горизонтальная и/или вертикальная); и потеря более 1/3 поддерживающей альвеолярной кости (то есть отношение коронки к корню 2:1 или более). Периодонтит делится на формы, включая, но не ограничиваясь ими: периодонтит взрослых (например, связанный с налетом); ранний периодонтит (например, препубертатный, ювенильный, быстро развивающийся и подобные); периодонтит, связанный с системными заболеваниями; некротический язвенный периодонтит; устойчивый периодонтит; периимплантит и подобные.
Используемый в настоящем описании термин «лечение» относится к обнаруживаемому улучшению неблагоприятного состояния и/или сокращению симптомов состояния после взаимодействия млекопитающего с пероральной композицией изобретения и/или согласно способу изобретения.
Следует понимать, что термин «лечение периодонтита» включает предотвращения периодонтита у млекопитающего, так же как ингибирование развития одного или более существующих ранее состояний, связанных с периодонтитом у млекопитающего. Используемые в настоящем описании термины «ингибировать» и «ингибирование» относятся к частичному ингибированию или полному ингибированию периодонтита по сравнению с состоянием без лечения, такому как терапевтическое лечение и/или профилактика результатов. Лечение периодонтита согласно изобретению, следовательно, включает сокращение, ингибирование, улучшение, уменьшение, снижение, прекращение или устранение одного или более симптомов и/или осложнений, изложенных в настоящем описании.
Используемый в настоящем описании «патологический избыток» относится к активности выше принятого нормального уровня. Например, «патологический избыток» активности матриксной металлопротеиназы представляет собой уровень активности матриксной металлопротеиназы, который является выше уровня, обычно обнаруживаемого при здоровом состоянии. Используемый в настоящем описании «патологический избыток активности матриксной металлопротеиназы» является уровнем активности матриксной металлопротеиназы, связанным с периодонтитом.
Используемый в настоящем описании термин «подавление» относится к сокращению ферментативной активности, сокращению уровня ферментативной активности, сокращению уровня протеина и/или нуклеиновой кислоты, кодирующей такой протеин, или сокращению биохимического эффекта присутствия протеина, такого как один или более из MMP-8, MMP-9 и MMP-13.
В одном аспекте изобретение обеспечивает способ сокращения патологического избытка, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения уровня матриксной металлопротеиназы в ротовой полости млекопитающего, в котором ингибирование уровня матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина.
В настоящем описании изложено, что MMP, такие как MMP-8, MMP-9 или MMP-13, можно уменьшить в ротовой полости с помощью одного из многочисленных путей. В одном варианте осуществления MMP можно уменьшить в ротовой полости с помощью подавления MMP на уровне нуклеиновой кислоты, как изложено в другом месте в настоящем описании. Такое сокращение может привести к сокращению одной или более нуклеиновых кислот, кодирующих MMP (например, мРНК), и фермента MMP, экспрессированного в ротовой полости. Сокращение мРНК, кодирующей MMP, например, можно производить с помощью одного или более из многочисленных способов, как будет очевидно специалисту в данной области техники при использовании раскрытия, изложенного в настоящем описании. Примеры включают сокращение транскрипции мРНК, кодирующей MMP, и разрушение/удаление мРНК, кодирующей MMP.
В другом варианте осуществления MMP можно уменьшить в ротовой полости, непосредственно уменьшая количество фермента MMP. Сокращение фермента MMP можно производить с помощью одного или более из многочисленных способов, как будет очевидно специалисту в данной области техники при использовании раскрытия, изложенного в настоящем описании. Примеры включают, например, ингибирование фермента с помощью низкомолекулярного ингибитора, ингибирование с помощью природной или биологически-полученной молекулы, протеолитическое разрушение фермента и основанное на сродстве очищение фермента из ротовой полости. В настоящей заявке описано, что агент, который уменьшает одну или более из MMP-8, MMP-9 или MMP-13, может быть агентом, таким как 2,4,4'-трихлор-2'-гидроксидифениловый эфир (ТРИКЛОЗАН) или он может быть другим антибактериальным агентом. В другом аспекте агент может быть отличным от антибактериального агента. Также изобретение обеспечивает способы лечения субъекта, пораженного периодонтитом.
В одном аспекте изобретения способ обеспечивает сокращение патологического избытка активности матриксной металлопротеиназы в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения активности матриксной металлопротеиназы, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего, в котором ингибирование активности матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина. В другом аспекте введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир, проводят в количестве, которое является эффективным для снижения уровня, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего, в котором снижение уровня матриксной металлопротеиназы приводит к сокращению полной ферментативной активности металлопротеиназы, приводящему к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина. В одном варианте осуществления патологический избыток одной или более MMP можно уменьшить, как описано в другом месте в настоящей заявке, относительно сокращения количества MMP в ротовой полости млекопитающего. Таким образом, MMP можно уменьшить в одном или обоих уровнях нуклеиновой кислоты и протеина. Как описано в другом месте настоящей заявки, сокращение патологического избытка одного или более таких MMP может обеспечить лечение периодонтита у млекопитающего.
В другом аспекте изобретение обеспечивает способ сокращения активности, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13 в ротовой полости млекопитающего, нуждающегося в таком лечении, включающий введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для уменьшения уровня матриксной металлопротеиназы в ротовой полости млекопитающего, в котором ингибирование уровня матриксной металлопротеиназы приводит к ингибированию чрезмерного разрушения компонентов соединительной ткани матриксного протеина. В одном варианте осуществления активность одного или более MMP можно уменьшить, как описано в другом месте в настоящей заявке, относительно сокращения количества протеина MMP в ротовой полости млекопитающего. Таким образом, MMP можно уменьшить в одном или обоих уровнях нуклеиновой кислоты и протеина, таким образом, уменьшая активность MMP в ротовой полости, или непосредственно уменьшая активность MMP, или косвенно уменьшая уровень MMP протеина и/или нуклеиновой кислоты.
В другом аспекте изобретение обеспечивает способы лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включающие взаимодействие клетки в ротовой полости млекопитающего с агентом, который подавляет одну или обе, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13. Согласно изобретению подавление металлопротеиназы коррелируется с сокращением, по меньшей мере, одного симптома, связанного с периодонтитом.
MMP, такие как MMP-8, MMP-9 или MMP-13, можно подавлять на уровне нуклеиновой кислоты. Посредством неограничивающего примера MMP можно подавлять согласно изобретению с помощью подавления мРНК, кодирующей MMP. В одном варианте осуществления способ изобретения включает взаимодействие ротовой полости млекопитающего с агентом, который подавляет одну или более из MMP-8, MMP-9 или MMP-13. В настоящей заявке описано, что агент, который подавляет одну или более из MMP-8, MMP-9 или MMP-13, может быть агентом, таким как ТРИКЛОЗАН, или он может быть другим антибактериальным агентом. В другом аспекте агент может быть отличным от антибактериального агента. Также, изобретение обеспечивает способы лечения индивида, пораженного периодонтитом.
В другом аспекте изобретение обеспечивает способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении. В одном варианте осуществления способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включает введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для подавления, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13, в котором подавление матриксной металлопротеиназы приводит к лечению периодонтита у млекопитающего. В другом варианте осуществления способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включает введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для снижения уровня, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13, в котором снижение уровня матриксной металлопротеиназы приводит к лечению периодонтита у млекопитающего. В еще другом варианте осуществления способ лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включает введение в ротовую полость млекопитающего пероральной композиции, содержащей 2,4,4'-трихлор-2'-гидроксидифениловый эфир в количестве, которое является эффективным для снижения уровня активности, по меньшей мере, одной из MMP-8, MMP-9 и MMP-13, в котором снижение уровня активности матриксной металлопротеиназы приводит к лечению периодонтита у млекопитающего.
В способе лечения периодонтита с помощью введения в ротовую полость млекопитающего пероральной композиции активность одной или более MMP может быть уменьшена, как описано в другом месте настоящей заявки, относительно сокращения количества MMP в ротовой полости млекопитающего. Таким образом, MMP может быть снижена при уровне одного или обоих из нуклеиновой кислоты и протеина, таким образом, уменьшая активность MMP в ротовой полости. Подобно этому, подавление MMP или сокращение уровня MMP может быть затронуто действием уровней или нуклеиновой кислоты, или протеина, как описано подробно в другом месте в настоящей заявке.
В другом аспекте изобретение обеспечивает способ идентификации соединения, пригодного для лечения периодонтита у млекопитающего, нуждающегося в таком лечении, включающий взаимодействие клетки с исследуемым соединением и определение, подавляет ли исследуемое соединение одну или обе, по меньшей мере, из одной из MMP-8, MMP-9 и MMP-13. Подавление, по меньшей мере, одной из матриксных металлопротеиназ является показателем, что исследуемое соединение является пригодным для лечения периодонтита.
В одном варианте осуществления способ лечения периодонтита включает введение агента, идентифицированного с помощью анализа скрининга, описанного в настоящей заявке, или комбинации агентов, которые ингибируют один или более маркеров периодонтита, в котором, по меньшей мере, один из агентов представляет собой агент, идентифицированный с помощью анализа скрининга, описанного в настоящей заявке.
В одном варианте осуществления изобретение обеспечивает способ лечения периодонтита, включающий стадию введения терапевтически эффективного количества агента, которое ингибирует периодонтальное заболевание и/или периодонтальное нарушение у субъекта, нуждающегося в таком лечении. В настоящей заявке определено, что терапевтически эффективное количество агента (то есть эффективная дозировка) располагается в диапазоне от 0,001 до 30 мг/кг массы тела, предпочтительно от 0,01 до 25 мг/кг массы тела, более предпочтительно от 0,1 до 20 мг/кг массы тела и еще более предпочтительно от 1 до 10 мг/кг, от 2 до 9 мг/кг, от 3 до 8 мг/кг, от 4 до 7 мг/кг или от 5 до 6 мг/кг массы тела. Специалист в данной области техники оценит, что определенные факторы могут влиять на дозировку, необходимую для эффективного лечения субъекта, включая, но не ограничиваясь ими, тяжесть заболевания или нарушения, предыдущие методы лечения, общее состояние здоровья и/или возраст субъекта и другие присутствующие заболевания. Кроме того, лечение субъекта с помощью терапевтически эффективного количества ингибитора может включать единичный курс лечения, или предпочтительно, может включать серию курсов лечения. Следует также отметить, что эффективная дозировка, используемая для лечения, может увеличиться или уменьшиться в течение курса определенного лечения. В настоящей заявке описано, что изменения в дозировке могут следовать из результатов диагностического исследования.
Специалист в данной области техники определит, как обнаружить присутствие периодонтита. Дополнительно, специалист в данной области техники определит, как идентифицировать повышенный уровень одной или более из MMP-8, MMP-9 и MMP-13. Характерный способ для детектирования присутствия или отсутствия периодонтита у млекопитающего включает получение биологического образца из ротовой полости исследуемого субъекта и взаимодействие биологического образца с соединением или агентом, способным определить один или более маркеров периодонтита (то есть MMP-8, MMP-9 или MMP-13), описанных в настоящей заявке, например, маркерная нуклеиновая кислота (например, в том числе мРНК, геномная ДНК) или маркерный пептид (например, в том числе фрагмент пептида или протеин), кодируемый маркерной нуклеиновой кислотой, так что присутствие маркерной нуклеиновой кислоты или маркерного пептида, кодируемого нуклеиновой кислотой, детектируют в биологическом образце. В одном варианте осуществления агент для детектирования маркерной мРНК или геномной ДНК представляет собой меченый зонд нуклеиновой кислоты, способный к гибридизации с маркерной мРНК или геномной ДНК. Зонд нуклеиновой кислоты может быть, например, маркерной нуклеиновой кислотой по всей длине или ее частью. Другие подходящие зонды для применения в диагностических исследованиях изобретения описаны в настоящей заявке. В другом варианте осуществления активность маркера периодонтита используют как способ детектирования маркера (то есть активность MMP-8, MMP-9 или MMP-13). Любое известное на данный момент или позже разработанное исследование для детектирования активности маркера охвачено в настоящем описании.
В другом варианте осуществления агент для детектирования маркерного пептида представляет собой антитело, способное к связыванию с маркерным пептидом, такое как антитело с определяемой меткой. Антитела могут быть поликлональными или моноклональными. Можно использовать интактное антитело или его фрагмент (например Fab или F(ab').sub.2). Полагают, что термин «меченый» относительно зонда или антитела охватывает прямое мечение зонда или антитела с помощью связывания (то есть, физического соединения) детектируемого вещества с зондом или антителом, так же как непрямое мечение зонда или антитела с помощью взаимодействия с другим реагентом, который непосредственно метят. Примеры непрямого мечения включают детектирование первичного антитела, используя флуоресцентно меченное вторичное антитело и меченый на конце ДНК-зонд с биотином, так что он может быть детектирован флуоресцентно меченным стрептавидином.
Полагают, что используемый в настоящем описании термин «биологический образец» включает ткани, клетки и биологические жидкости, выделенные из ротовой полости субъекта, так же как ткани, клетки и жидкости, находящиеся в пределах ротовой полости субъекта. Таким образом, способ детектирования изобретения можно использовать для детектирования маркерной мРНК, пептида (например, протеина) или геномной ДНК в биологическом образце in vitro так же как in vivo. Посредством неограничивающего примера методы in vitro для детектирования маркерной мРНК включают Нозерн-гибридизации и гибридизации in situ. Методы in vitro для детектирования маркерного пептида включают твердофазный иммуноферментный анализ (ELISA), вестерн-блоттинг, иммунопреципитацию и иммунофлуоресценцию. Методы in vitro для детектирования маркерной геномной ДНК включают Саузерн-гибридизацию. Методы in vivo для детектирования маркерного пептида включают введение в ротовую полость субъекта меченого антимаркерного антитела. Например, антитело может быть мечено радиоактивным маркером, присутствие которого и местоположение у субъекта можно детектировать с помощью стандартных методов воспроизведения изображения.
В одном варианте осуществления способы дополнительно включают получение контрольного биологического образца от контрольного субъекта, взаимодействие контрольного образца с соединением или агентом, способным детектировать маркерные пептиды, мРНК или геномную ДНК, так что присутствие маркерного пептида, мРНК или геномной ДНК детектируют в биологическом образце, и сравнение присутствия маркерных пептидов, мРНК или геномной ДНК в контрольном образце с присутствием маркерного пептида, мРНК или геномной ДНК в исследуемом образце. Альтернативно, присутствие маркерного пептида, мРНК или геномной ДНК в исследуемом образце можно сравнить с информацией в базе данных или на диаграмме для проведения детектирования или диагноза. В другом варианте осуществления способы дополнительно включают использование контрольного биологического образца, полученного от субъекта, имеющего периодонтит, в которых контрольный образец получали от субъекта до начала заболевания периодонтитом (то есть когда субъект был здоров или в «нормальном» состоянии без периодонтита).
Посредством неограничивающего примера уровень MMP-9 можно определить in vitro с помощью взаимодействия клетки с TNFα. В одном варианте осуществления клетка представляет собой моноцит. После взаимодействия клетки с TNFα уровень MMP-9 детектируют или при уровне протеина, или нуклеиновой кислоты. В одном аспекте уровень MMP-9 также определяют in vitro с помощью взаимодействия клетки с TNFα в присутствии антибактериального агента. В одном варианте осуществления антибактериальный агент представляет собой 2,4,4'-трихлор-2'-гидроксидифениловый эфир. В другом варианте осуществления агент представляет собой доксициклин. В другом аспекте агент может быть отличным от антибактериального агента. В одном варианте осуществления агент представляет собой ингибитор MMP.
В одном варианте осуществления изобретения измерение подавления MMP-9 с помощью детектирования уровня MMP-9 определяют in vitro при взаимодействии клетки с TNFα в присутствии агента, такого как антибактериальный агент, и с помощью сравнения уровня MMP-9, установленного in vitro, при взаимодействии клетки с TNFα при отсутствии антибактериального агента, в котором экспериментальные условия являются иным образом идентичными. Более низкий уровень MMP-9 протеина, нуклеиновой кислоты или ферментативной активности в присутствии антибактериального агента, чем при отсутствии антибактериального агента, является показателем, что антибактериальное соединение подавляет MMP-9. Основываясь на раскрытии, изложенном в настоящем описании, следует понимать, что одинаковые способы могут быть использованы для оценки MMP-8 и/или MMP-13.
Следует понимать, что in vitro измерение подавления MMP-8, MMP-9 и/или MMP-13 может коррелироваться с in vivo эффектом, наблюдением или результатом. В одном аспекте подавление металлопротеиназы, измеренное in vitro, является подтверждением наблюдения in vivo, включая, но не ограничиваясь ими, лечение периодонтита, способ сокращения патологического избытка металлопротеиназы и/или активности металлопротеиназы in vivo и способ идентификации соединения, пригодного для лечения периодонтита и/или уменьшения патологического избытка металлопротеиназы и/или активности металлопротеиназы in vivo. См., например, Golub et al., Inflamm. Res. (1997) 46:310-9, Preshaw et al., J. Clin. Periodontol. (2004) 31:697-707; Mantyla et al., J. Periodontal. Res. (2003) 38:436-439; Lorencini et al., Histol. Histopathol. (2009) 24:157-166; и Pozo et al., J. Periodontal Res. (2005) 40:199-207. В другом аспекте подавление металлопротеиназы, измеренное in vitro, является прогнозирующим параметром результата in vivo, включая, но не ограничиваясь ими, лечение периодонтита, способ сокращения патологического избытка металлопротеиназы и/или активности металлопротеиназы in vivo и способ идентификации соединения, пригодного для лечения периодонтита и/или уменьшения патологического избытка металлопротеиназы и/или активности металлопротеиназы in vivo.
Посредством другого неограничивающего примера уровень MMP-13 может быть определен in vitro при взаимодействии клетки с паратиреоидным гормоном (ПТГ). В одном варианте осуществления клетка представляет собой остеобласт. После взаимодействия клетки с ПТГ уровень MMP-13 детектируют или при уровне протеина, или нуклеиновой кислоты. В одном аспекте уровень MMP-13 также определяют in vitro с помощью взаимодействия клетки с ПТГ в присутствии антибактериального агента. В одном варианте осуществления антибактериальный агент представляет собой 2,4,4'-трихлор-2'-гидроксидифениловый эфир. Более низкий уровень MMP-13 протеина, нуклеиновой кислоты или ферментативной активности в присутствии антибактериального агента, чем при отсутствии антибактериального агента, является показателем, что антибактериальное соединение подавляет MMP-13.
В одном аспекте способность пероральной композиции, описанной в настоящей заявке, лечить периодонтит определяют при сравнении эффекта 2,4,4'-трихлор-2'-гидроксидифенилового эфира при подавлении металлопротеиназы с эффектом пероральной композиции при подавлении металлопротеиназы. В другом аспекте способность любой пероральной композиции лечить периодонтит определяют при сравнении эффекта пероральной композиции или in vivo, или in vitro с эффектом пероральной композиции, описанной в настоящей заявке.
Изобретение дополнительно включает пероральную композицию, такую как, например, средство для ухода за зубами, гель, накладку, жидкость для полоскания полости рта или спрей для применения в способе изобретения. В одном аспекте пероральная композиция содержит антибактериальный агент. В типичном варианте осуществления антибактериальный агент представляет собой некатионный антибактериальный агент. См., например, патент США № 5288480, который включен в настоящее описание в полном объеме посредством ссылки. Некатионный антибактериальный агент присутствует в пероральной композиции в эффективном против налета количестве 0,25-0,35% вес., предпочтительно 0,3%. Антибактериальный агент является, по существу, нерастворимым в воде, подразумевая, что его растворимость является менее чем 1% вес. в воде при 25°С и может быть даже менее чем 0,1%. Например, когда пероральная композиция представляет собой жидкость для полоскания полости рта, концентрацию антибактериального агента можно уменьшить до 10 раз по сравнению с той, которую используют в другом средстве для ухода за зубами, таком как зубная паста. В одном варианте осуществления антибактериальный агент представляет собой 2,4,4'-трихлор-2'-гидроксидифениловый эфир. В другом варианте осуществления пероральная композиция содержит два или более антибактериальных агентов.
В одном варианте осуществления агент, усиливающий антибактериальную активность (AEA), увеличивает доставку антибактериального агента и удерживание его на поверхностях рта. В одном аспекте AEA содержит вязкий материал. См. патент США № 5288480 для описаний материалов и композиций, пригодных для материалов AEA настоящего изобретения, так же как для общих описаний пероральных композиций, таких как композиции средства для ухода за зубами, пригодные в настоящем изобретении. Посредством неограничивающего примера клейкий материал в композиции представляет собой полимер, имеющий среднечисловую молекулярную массу между 100000 и 2500000 включительно. В одном аспекте клейкий материал выбран из полимеров поливинилфосфоновой кислоты, поли(1-фосфонопропен)сульфоновой кислоты, поли(бета-стиролфосфоновой кислоты), альфа-стиролфосфоновой кислоты, синтетического анионного полимерного поликарбоксилата, малеинового ангидрида, малеиновой кислоты и метилвинилового эфира. В другом аспекте клейкая молекула представляет собой полимер метилвинилового эфира и малеинового ангидрида. Агент, усиливающий антибактериальную активность, можно использовать при уровне, который представляет собой 0,01% вес.-4,0% вес. пероральной композиции.
Используемая в настоящем описании «увеличивающая доставку группа» относится к группе, которая присоединяет или, по существу, адгезионно, когезионно или иначе связывает AEA (несущий антибактериальный агент) с ротовыми (например, зуб и десна) поверхностями, таким образом «доставляя» антибактериальный агент таким поверхностям. Органическая увеличивающая удерживание группа, обычно гидрофобная, присоединяет или иначе связывает антибактериальный агент с AEA, таким образом способствуя удерживанию антибактериального агента с AEA и косвенно на поверхностях рта. В некоторых случаях присоединение антибактериального агента происходит через его физическое удерживание с помощью AEA, особенно когда AEA представляет собой поперечно сшитый полимер, структура которого неотъемлемо обеспечивает увеличенные области для такого удерживания. Присутствие с более высокой молекулярной массой более