Применение apl пептида для лечения воспалительной болезни кишечника и диабета типа 1
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для лечения болезни Крона, язвенного колита и сахарного диабета типа 1. Для этого применяют APL пептид или его аналоги, полученные из человеческого белка теплового шока размером 60 kDa (hps60) для получения фармацевтической композиции. Также предложены фармацевтическая композиция и применение лекарственного препарата для индукции апоптоза патогенных клонов Т-клеток у пациентов с воспалительной болезнью кишечника или диабетом типа 1. Группа изобретений обладает иммуномодулирующим действием и позволяет регулировать механизмы периферической толерантности в желудочно-кишечном тракте.3 н. и 7 з.п.ф-лы.6 илл.6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к медицине, в частности к применению APL пептида (Altered Peptide Ligand (измененный пептидный лиганд), сокращенно APL) или его аналогов для лечения воспалительной болезни кишечника (такой как болезнь Крона и язвенный колит) и сахарного диабета типа 1.
Описание достигнутого уровня
Воспалительная болезнь кишечника, такая как болезнь Крона и язвенный колит, возникает в результате активации T-клеток собственной пластинки слизистой кишечника, сопряженной с мощными эффекторными функциями в отношении симбиотической флоры. Однако точный механизм, который ведет к хронической активации этих лимфоцитов, остается неизвестным (Balfour R (2006) Mechanism of Disease: pathogenesis of Crohn's disease and ulcerative colitis. Nature clinical practice. Gastroenterology and Hepatology 3 (7): 390-407).
В желудочно-кишечном тракте живет приблизительно 2×104 бактерий, и это иммунологическое давление представляет чрезвычайно мощный вызов для иммунной системы, которая должна осуществлять балансировку между соответствующей реакцией на патогенные организмы и толерантностью к безвредным организмам. Иммунная система слизистой использует несколько механизмов для того, чтобы избежать неконтролируемого воспалительного ответа, такие как снижение уровня активированных T-клеток апоптозом (Peppelenbosch MP and van Deventer SJH (2004) T cell apoptosis and inflammatory bowel disease. Gut 53: 1556-1558).
Иммунная система в нормальных условиях быстро уничтожает инфекции инвазивными энтеробактериями, осуществляет отрицательную регуляцию врожденных иммунных реакций и излечивает поврежденную слизистую без стимуляции эффекторных T-клеточных ответов. Тогда как иммунная система генетически восприимчивых организмов-хозяев неспособна генерировать соответствующие врожденные иммунные реакции и/или выработать толерогенный иммунный ответ на комменсальные микробные агенты с последующей активацией патогенных T-клеточных ответов на комменсальные бактерии, что ведет к хроническому воспалению кишечника (Podolsky DK (2002) Inflammatory bowel disease. N Engl J Med 347: 417-29).
Таким образом, воспалительная болезнь кишечника является результатом несостоятельности механизмов, которые должны соответствующим образом контролировать воспалительные процессы, запущенные факторами окружающей среды, такими как острая кишечная инфекция. Резистентность к апоптозу T-клеток, отсутствие ответа на ингибирующие сигналы и непрерывное воздействие просветных антигенов и адъювантов помогают поддерживать воспалительную реакцию (Mudter J and Neurath MF (2007) Apoptosis of T cells and the control of inflammatory bowel disease: therapeutic implications. Gut 56: 293-303).
Болезнь Крона характеризуется повышенным рекрутингом макрофагов, нейтрофилов и T-клеток в кишечник, который ведет к усилению экспрессии костимулирующих молекул и молекул адгезии, а также провоспалительных цитокинов, родственных TH1 (T-клеточный хелпер 1, сокращенно TH1), например, интерлейкина (IL)-6 (IL-6) и фактора некроза опухолевой ткани-альфа (TNF-a), и TH17 клеточных ответов (T-клеточный хелпер 17, сокращенно TH17), таких как IL-12, IL-23 и IL-27 (Balfour R (2006) Mechanism of Disease: pathogenesis of Crohn's disease and ulcerative colitis. Nature clinical practice. Gastroenterology and Hepatology 3 (7): 390-407).
Множество воспалительных клеток в кишечнике определяется процессом клеточного рекрутинга, пролиферацией и гибелью клеток в результате некроза или апоптоза. T-клетки собственной пластинки из нормальной слизистой кишечника чувствительны к гибели клеток, индуцированной активацией (через систему Fas/FasL), которая способна контролировать пролиферацию лимфоцитов (Bu P et al. (2001) Apoptosis: one of the mechanisms that maintains unresponsiveness of the intestinal mucosal immune system. J Immunol 166: 6399-6403). Однако, согласно имеющимся данным, T-клетки собственной пластинки у пациентов с болезнью Крона резистентны к апоптозу, что ведет к разрастанию популяции активированных эффекторных TH1, которое может внести определенный вклад в длительность течения болезни и хроническое воспаление (Boirivant M et al. (1999) Lamina propria T cells in Crohn's disease and other gastrointestinal inflammation show defective CD2 pathroute-induced apoptosis. Gastroenterology 116: 557-565).
Апоптозный дефект в T-клетках слизистой у пациентов с болезнью Крона связан с дисбалансом между пропорциями антиапоптозных молекул типа Bcl-2 и проапоптозных молекул, таких как Bax, который пролонгирует выживание этих клеток и ведет к устойчивости к апоптозным сигналам (Ina К. et al. (1999) Resistence of Crohn's disease T cells of multiple apoptotic signals is associated with Bcl2/Bax mucosal imbalance. J Immunol 163:1081-90; Itoh J et al. (2001) Decreased Bax expression by mucosal T cells favours resistance to apoptosis in Crohn's disease. Gut 49: 35-41). С другой стороны, Sturm с соавторами исследовали свойства клеточного цикла Т-клеток слизистой у пациентов с болезнью Крона, язвенным колитом и у здоровых индивидуумов, в качестве контролей. Они показали, что T-клетки у пациентов с болезнью Крона обладают удивительной способностью к клеточному размножению, за счет более быстрого цикла, в сравнении с клетками слизистой у пациентов с язвенным колитом или здоровых контрольных индивидуумов, вероятно, как результат дефекта апоптоза, зависимого от активации. Они смогли объяснить, почему слизистая у пациентов с болезнью Крона содержит избыточное количество T-клеток, что указывает на состояние гиперактивности, а также на потерю толерантности к комменсальным бактериям (Sturm A et al. (2004) Divergent cell cycle kinetics underlies the distinct functional capacity of mucosal T cells in Crohn's disease and ulcerative colitis. Gut 53:1624-1631).
Эти экспериментальные данные подтверждают тот факт, что болезнь Крона является расстройством, при котором события клеточной пролиферации перевешивают уровни гибели клеток от апоптоза, что ведет к аккумуляции реактивных T-клеток в сайте воспаления и может представлять собой важный фактор патогенеза этого заболевания. В этом смысле наиболее эффективными биологическими средствами, используемыми при лечении этого заболевания, могут быть, по-видимому, такие средства, которые индуцируют апоптоз моноцитов и Т-клеток, например, антитела к TNFa, IL-12 или IL-6 рецептору (Liigering et al. (2001) Infliximab induces apoptosis in monocytes from patients with chronic Crohn's disease by using it activates to caspase dependent pathroute. Gastroenterology 121: 1145-57; (Stallmach et al. (2004) An interleukin 12 p40-lgG2b coalition protein abrogates T cell mediated inflammation: anti-inflammatory activity in Crohn's disease and experimental colitis in alive. Gut 53: 339-45; Atreya R et al. (2000) Blockade of interleukin 6 trans-signaling suppresses T-cell resistance against apoptosis in chronic intestinal inflammation: evidence in Crohn's disease and experimental colitis in alive. Nat Med 6: 583-588). В частности, антитела к TNFa представляют собой важный фактор, полезный для индукции длительной ремиссии у устойчивых к стероидной терапии пациентов с болезнью Крона.
Инфликсимаб представляет собой химерное моноклональное антитело (AcM), которое содержит вариабельную область из мышиной молекулы и константную область из молекулы человеческого иммуноглобулина G1 (lgG1), которое способно связываться с очень сильной аффинностью и выраженной специфичностью и со свободным, и связанным TNFa с нейтрализацией их эффектов (Knight DMK et al. (1993) Construction and initial characterization of a mouse-human chimeric anti-TNF antibody. Mol Immunol 30: 1443-1453). Этанерцепт представляет собой рекомбинантный белок, который содержит две мономерных цепи растворимой части рецептора человеческого фактора некроза опухолевой ткани 2 (TNFR2), слитый с Fc частью человеческого lgG1 (Mohler KM et al. (1993) Soluble tumor necrosis factor (TNF) receptors are effective therapeutic agents in lethal endotoxemia and function simultaneously as both TNF carriers and TNF antagonists. J Immunol 151: 1548-1561). Эта молекула успешно использовалась при лечении других воспалительных заболеваний, таких как ревматоидный артрит (RA) (Moreland LW et al. (1999) Etanercept therapy in rheumatoid arthritis. To randomized, controlled trial. Ann Intern Med 130: 478-486). Однако этанерцепт, в отличие от инфликсимаба, не дает клинических эффектов при болезни Крона. Van den Brande и соавторы показали, что различия в эффективности двух этих препаратов при лечении болезни Крона связаны со способностью инфликсимаба индуцировать апоптоз моноцитов и активированных T-клеток собственной пластинки (Van de Brande JMH et al. (2003) Infliximab but not Etanercept induces apoptosis in lamina propria T - Lymphocytes from patients with Crohn's disease. Gastroenterology 124: 1774-1785). Этанерцепт не индуцирует клеточный апоптоз, как инфликсимаб, эффективность которого при лечении болезни Крона, как это предполагается, связано с его проапоптозной активностью.
Было высказано предположение, что клинические результаты, полученные при лечении пациентов с болезнью Крона инфликсимабом и другими лекарственными средствами, которые индуцируют апоптоз T-клеток слизистой, связаны со способностью таких препаратов восстанавливать апоптоз Т-клеток в компартменте слизистой оболочки кишечника, что может быть важным фактором, определяющим успешность лечения болезни Крона.
В настоящее время применение инфликсимаба рассматривается как наиболее успешная стратегия лечения пациентов с болезнью Крона. Такая терапия также применялась с обнадеживающими результатами в случае пациентов с язвенным колитом. Однако эта терапия приводит к развитию целой серии побочных реакций, таких как рост заболеваемости таких пациентов, в частности, туберкулезом и микоплазмозом, в связи с тем, что при этом происходит обширная супрессия иммунитета (Kooloos WM. (2007) Potential role of pharmacogenetics in anti-TNF treatment of rheumatoid arthritis and Crohn's disease. Drug Discovery Today 12: 125-31). Соответственно, в настоящее время возникла насущная потребность в разработке терапевтических стратегий, которые позволяли бы специфично удалять патогенные клетки, не вызывая при этом выраженной супрессии иммунитета.
С этой целью в последние годы применялись антиген-специфичные подходы к лечению, направленные на регуляцию иммунного ответа, а не на его супрессию. В этой связи стали использоваться аутоантигенные или APL пептиды, вводимые в таких условиях, чтобы индуцировать механизмы периферической толерантности (Prakken В et al. (2004) Epitope-specific immunotheraphy induces immune deviation of proinflammatory T cells in RA. PNAS 12 (101): 4228-33; Ben-David H et al. (2005) Down-regulation of myasthenogenic T cell response by to dual altered peptide ligand via CD4+CD25+-regulated events leading to apoptosis. PNAS 102 (6): 2028-33; Paas-Rozner M et al. (2001) The nature of the active suppression of responses associated with experimental autoimmune myasthenia gravis by a dual altered peptide ligand administered by different routes. PNAS 98 (22): 12642-7).
APL представляют собой аналоги иммуногенных пептидов с несколькими замещениями в необходимых позициях для контакта с Т-клеточным рецептором или главным комплексом совместимости тканей, которые препятствуют или модифицируют каскаду/каскад событий, нужному/нужный для полной активации T- клеток (Bielekova В and Martin R (2001) Antigen-specific immunomodulation via altered peptide ligands. J Mol Med 79: 552-65). Возможность манипулировать в экспериментальном режиме свойствами пептидных лигандов позволяет соответствующим образом менять природу, течение и выраженность клеточного иммунного ответа. В заявке на международный патент No. WO 2006/032216 описаны APL пептиды, полученные из человеческого белка теплового шока размером 60 kDa (сокращенно Hsp60), а также использование фармацевтического препарата на основе таких пептидов для лечения ревматоидного артрита. Сахарный диабет типа 1 представляет собой аутоиммунное орган-специфичное заболевание, опосредованное T-клетками, которые разрушают клетки поджелудочной железы, продуцирующей инсулин, что ведет к разбалансировке метаболизма глюкозы (Brown L and Eisenbarth GS (1990) Type 1 diabetes: A chronic autoimmune disease of human, mouse, and rat. Annu Rev Immunol 8: 647-79). Клинические симптомы этого заболевания появляются после того, как иммунная система разрушит около 80-90% клеток поджелудочной железы. В настоящее время ведутся поиски способа безопасной, специфичной и эффективной терапии, направленной на выключение аутоиммунного процесса до наступления выраженного повреждения клеток поджелудочной железы, с тем чтобы сохранить эндогенную продукцию инсулина. Индукция толерантности рассматривалась как основная стратегия, распространяемая на лечение диабета типа 1. Irun Cohen и соавторы запатентовали применение человеческих пептидов Hsp60 для диагностики и лечения этого заболевания (патент No. US 6682897).
Описание изобретения
Настоящее изобретение решает указанную выше проблему, предлагая новый подход к лечению воспалительной болезни кишечника (такой как болезнь Крона и язвенный колит) и сахарного диабета типа 1. Суть изобретения состоит в использовании иммуномодулирующего пептида APL или его аналогов, полученных из человеческого Hsp60, в создании фармацевтического препарата для лечения воспалительной болезни кишечника и сахарного диабета типа 1. Данный пептид с последовательностью SIDLKDKYKNIGAKLVQLVANNTNEEA приведен в списке последовательностей как Seq ID No. 1.
Данный пептид способствует индукции апоптоза активированных Т-клеток собственной пластинки слизистой кишечника и периферической крови у пациентов с болезнью Крона, приводя к ингибированию клонов T-клеток, вовлекаемых в патогенез этого заболевания, не вызывая неспецифической супрессии иммунной системы, как это происходит при использовании TNFα антител. Использование этого иммуномодулирующего APL пептида или его аналогов для лечения воспалительной болезни кишечника связано с его способностью нейтрализовать клоны T-клеток, вовлекаемые в характерный для этого заболевания воспалительный процесс.
Фармацевтический препарат по настоящему изобретению характеризуется высокой специфичностью, определяемой нейтрализацией патогенных активированных T-клеток. Этот факт заметно повышает безопасность препарата по настоящему изобретению, поскольку минимизируются побочные реакции типа оппортунистических инфекций, вызывающих туберкулез и микоплазмоз, ассоциированные с обширной супрессией иммунитета, вызываемой использованием таких препаратов, как инфликсимаб, или достигается также минимизация развития новообразований, таких как лимфомы, наблюдаемых при использовании метотрексата. Использование указанного выше иммномодулирующего пептида при получении лекарственного средства для лечения воспалительной болезни кишечника также демонстрирует определенное преимущество тем, что независимо от способа его парентерального введения (например, интрадермального, подкожного или внутривенного), его активный ингредиент подвергается практически полному биораспределению в желудочно-кишечный тракт: желудок, тонкий кишечник и толстую кишку. Кроме того, указанный пептид остается в этих органах в течение необходимого периода времени для проявления его биологической активности. Как отмечалось ранее, при болезни кишечника в желудочно-кишечном тракте происходит неконтролируемая активация эффекторных T-клеток против комменсальной флоры. Биораспределение данного пептида и его способность индуцировать апоптоз патогенных просветных T-клеток является основанием для использования этого APL пептида при лечении болезни Крона и язвенного колита. Использование фармацевтической композиции по настоящему изобретению может быть распространено также на другие воспалительные заболевания, характеризующиеся эпизодами рецидивов-ремиссий, при которых аутореактивные T-клетки также играют важную роль, как и при диабете типа 1.
APL, идентифицированный в списке последовательностей как Seq ID No. 1, предлагается в заявке на международный патент WO 2006.032216, для использования в качестве фармацевтического препарата, созданного на основе данного пептида, для лечения ревматоидного артрита. Однако в указанном патенте не заявляется и не предполагается использование данного пептида для лечения воспалительной болезни кишечника и сахарного диабета типа 1.
Воспалительная болезнь кишечника не считается аутоиммунным заболеванием, поскольку иммунная реакция против аутоантигенов не отвечает за начало и поддержание воспаления, и по меньшей мере до настоящего момента причинная связь с аутоантигенами была неизвестна, в отличие от ситуации с аутоиммунными заболеваниями. Этиология этих заболеваний связана с наличием комменсальной флоры и иммунной реакцией против комменсальных организмов. Одним из первых экспериментальных подтверждений указанного факта является невозможность индуцировать экспериментальную воспалительную болезнь кишечника в стерильных условиях, если не восстановлена кишечная флора (Chandran et al. (2003) Inflammatory bowel disease: dysfunction of GALT and gut bacterial flora (II). Surgeon 1:125-136; Strober et al. (2002) The immunology of mucosal models of inflammation. Annu. Rev. Immunol 20:495-549). В этой связи было высказано предположение, что бактериальные антигены отвечают за индукцию этого заболевания.
В патенте US 6682897 Irun Cohen и соавторы описали использование человеческих пептидов Hsp60 для диагностики и лечения диабета типа 1. Последовательность, идентифицированная в списке последовательностей как Seq ID No. 1, не была включена в указанный патент, а также не рассматривалась биологическая активность, соответствующая пептиду Seq ID No. 1. В отличие от указанных авторов авторы настоящего изобретения описывают использование пептида Seq ID No. 1, APL пептида, полученного из человеческого Hsp60, для индукции апоптоза патогенных T-клеток, участвующих в развитии этой патологии.
Приведенные в настоящем изобретении примеры впервые демонстрируют свойства пептида Seq ID No. 1, связанные с его биораспределением в желудочно-кишечном тракте и с его способностью индуцировать апоптоз патогенных клонов T-клеток, что открывает возможность использования этого пептида при лечении болезни Крона, язвенного колита и диабета типа 1. Специалисты в данной области не могли предсказать новое применение пептида, заявленное в настоящем изобретении, на основании тех элементов, которые были приведены в заявке на международный патент 2006/032216.
Пептид с последовательностью, идентифицированной в списке последовательностей как Seq ID No. 1, или его аналоги могут быть получены стандартными способами пептидного синтеза, а уровень и качество индуцированных в экспериментах иммунных реакций могут быть оценены в рамках тех способов, которые будут далее описаны в примерах или в аналогичных тестах.
В контексте настоящего изобретения термин «аналог» относится к APL пептидам, которые включают одно или несколько различий в описанной последовательности (Seq ID No.1), но сохраняют ту же биологическую активность, что и описанный пептид. Указанная модификация может представлять собой замещение, делецию или встраивание одной аминокислоты, предпочтительно замещение. Аналог может включать предпочтительно менее 9 модификаций, более предпочтительно менее 6 модификаций и еще более предпочтительно менее 2 модификаций в указанном пептиде.
Настоящее изобретение также относится к фармацевтической композиции для лечения воспалительной болезни кишечника и диабета типа 1, которая включает APL пептид, полученный из человеческого Hsp60, идентифицированный в списке последовательностей как Seq ID No. 1, или его аналоги. Количества вводимого в фармацевтическую композицию пептида по настоящему изобретению должны быть такими, чтобы обеспечивать эффективный иммунный ответ в организме-хозяине. Эффективное количество представляет собой такое вводимое количество, которое вызывает индукцию апоптоза T-клеток, что значительно ослабляет воспалительные признаки болезни Крона и выключает воспалительные акценты в желудочно-кишечном тракте, которые характерны для данного заболевания. В ходе лечения количество фармацевтической композиции, вводимой пациенту, может варьировать в зависимости от ряда факторов, таких как возраст, пол пациента, общее состояние здоровья и в целом уровень иммунологической реакции.
Настоящее изобретение также относится к способу лечения воспалительной болезни кишечника (такой как болезнь Крона и язвенный колит) и диабета типа 1, который включает введение пациенту эффективных количеств фармацевтических композиций, которые включают пептид, идентифицированный в списке последовательностей как Seq ID No. 1, или его аналоги. В соответствии с настоящим изобретением в ходе лечения воспалительной болезни кишечника (такой как болезнь Крона и язвенный колит) и диабета типа 1 фармацевтическую композицию вводят парентеральным или слизистым способом. В соответствии с настоящим изобретением указанную фармацевтическую композицию вводят парентеральным способом, выбранным из группы, которая включает интрадермальный способ, внутримышечный способ и внутривенный способ. В другом варианте осуществления настоящего изобретения, указанную фармацевтическую композицию вводят слизистым способом, выбранным из группы, которая включает ректальный путь введения и пероральный способ. В связи с природой рассматриваемых заболеваний APL пептид или его аналоги могут представлять собой часть композиций, вводимых в виде клизмы, или они могут быть представлены в виде форм, разрешенных для перорального введения.
Краткое описание чертежей
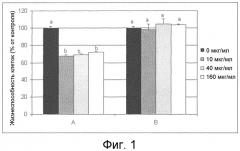
Фиг. 1. Эффект пептида с последовательностью Seq ID No. 1 на жизнеспособность мононуклеарных клеток периферической крови у пациентов с активной болезнью Крона (A) и у здоровых доноров (B). Различные буквы указывают значимые статистические различия между отрицательным контролем (0 мкг/мл) и исследуемым в данной группе пептидом в каждой из доз.
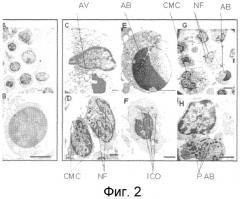
Фиг. 2. Трансмиссионная электронная микроскопия, использованная для демонстрации апоптоза, индуцированного пептидом с последовательностью Seq ID No. 1 в мононуклеарных клетках периферической крови у пациентов с болезнью Крона. Панели A, B: необработанные клетки (отрицательный контроль). Панели C-H: клетки, обработанные пептидом с последовательностью Seq ID No. 1 (40 мкг/мл). Выраженная вакуоляризация (AV); фрагментация ядра (NF); перинуклеарная конденсация и миграция хроматина (CMC); интактные цитоплазматические органеллы (ICO); апоптозные тела (AB); фагоцитоз апоптозных тел (P AB).
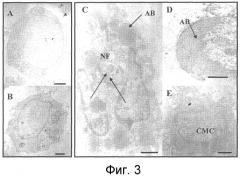
Фиг. 3. Трансмиссионная электронная микроскопия, использованная для демонстрации апоптоза, индуцированного пептидом с последовательностью Seq ID No. 1 в мононуклеарных клетках из собственной пластинки слизистой кишечника у пациентов с болезнью Крона. Панели A, B: необработанные клетки (отрицательный контроль). Панели C-D: клетки, обработанные пептидом с последовательностью Seq ID No. 1 (40 мкг/мл). Фрагментация ядра (NF); перинуклеарная конденсация и миграция хроматина (CMC); апоптозное тело (AB).
Фиг 4. Эффект пептида с последовательностью Seq ID No. 1 на жизнеспособность мононуклеарных клеток у пациента с неактивной болезнью Крона (A). На оси Х, A: неактивированные клетки с анти-CD3 антителом, B: активированные клетки с анти-CD3 антителом. Различные буквы указывают значимые статистические различия между отрицательным контролем (0 мкг/мл) и исследуемым в данной группе пептидом в каждой из доз.
Фиг. 5. Трансмиссионная электронная микроскопия, использованная для демонстрации апоптоза, индуцированного пептидом с последовательностью Seq ID No. 1 в мононуклеарных клетках у пациентов с сахарным диабетом типа 1. Панели A, B: необработанные клетки (отрицательный контроль). Панели C-D: клетки, обработанные пептидом с последовательностью Seq ID No. 1 (40 мкг/мл). Фрагментация ядра (NF); перинуклеарная конденсация и миграция хроматина (CMC); апоптозное тело (AB); фагоцитоз апоптозных тел (P AB).
Фиг 6. Исследование биораспределения пептида с последовательностью Seq ID No. 1 у крыс линии Льюис. A: внутривенное введение 0,25 мг/кг веса тела. B: внутривенное введение 1 мг/кг веса тела. C: интрадермальное введение 0,25 мг/кг веса тела. D: интрадермальное введение 1 мг/кг веса тела. Проанализированы следующие ткани: 1 - печень; 2 - селезенка; 3 - почки; 4 - сердце; 5 - легкие; 6 - цервикальный ганглий; 7 -аксиллярный-плечевой ганглий; 8 - брыжеечный ганглий; 9 - тазовый узел; 10 - щитовидная железа; 11 - желудок; 12 - тонкая кишка; 13 - толстая кишка.
ПРИМЕРЫ
Пример 1. Эффект APL пептида с последовательностью Seq ID No. 1 на жизнеспособность мононуклеарных клеток периферической крови у пациентов с активной болезнью Крона (A) и у здоровых доноров
Кровь от пациентов с болезнью Крона и здоровых доноров отбирали венной пункцией и вносили в стерильные пробирки, содержащие раствор антикоагулянта (цитрат натрия 123 мМ, одноосновной фосфат натрия 18,5 мМ, лимонная кислота 17 мМ и глюкоза 141,5 мМ). Кровь от каждого пациента разбавляли в соотношении 1:2 фосфатно-буферным солевым раствором 1X (сокращенно ФБР 1X) и добавляли 5 мл полученного разведения к 3 мл Ficoll-Paque™ Plus (Amersham, Biosciences AB, Sweden) в центрифужных пробирках на 15 мл и затем центрифугировали в течение 30 мин со скоростью 1200 об./мин. Экстрагировали кольцо, соответствующее мононуклеарным клеткам. Затем клетки дважды промывали с использованием 15 мл ФБР 1X и после каждой промывки проводили центрифугирование со скоростью 900 об./мин. В конце процедуры осадок клеток суспендировали в буфере RPMI 1640, содержащем 10% фетальной сыворотки теленка, и добавляли пенициллин (100 Ед/мл), стрептомицин (100 мкг/мл), HEPES 25 мМ/л и L-глютамин 2 мМ (все реактивы приобретены от компании Gibco BRL). В разбавленной клеточной суспензии (разбавление в соотношении 1:20 с использованием RPMI с добавками и в соотношении 1:2 с использованием триптана синего (Boehringer Mannheim, Germany) подсчитывали число клеток в счетной камере Нейбауэра.
Мононуклеарные клетки высевали с плотностью 105 клеток/лунку в 96-луночные планшеты с плоским дном (Costar, USA) до конечного объема 100 мкл и обрабатывали в тройном повторе разными концентрациями APL пептида (Seq ID No. 1): 10, 40 и 160 мкг/мл в течение 72 часов. Необработанные клетки использовали в качестве контроля для оценки базального роста.
Эффект APL пептида на жизнеспособность клеток определяли с использованием бромида 3-(4,5-диметилдиазол-2-ил)-2,5-дифенилтетразолия (MTT, Sigma, USA), в соответствии с протоколом производителя. MTT восстанавливается митохондриальными дегидрогеназами, имеющимися в метаболически активных клетках, до формазанового продукта, который не растворим в среде для культуральной ткани. Количество формазанового продукта, определенное по поглощению при длине волны 562 нм, прямо пропорционально количеству живых клеток в культуре. После культивирования клеток при температуре 37°C во влажной среде с 5% содержанием CO2 в течение 72 часов к каждой лунке добавляли по 20 мкл MTT (5 мкг/мл). Далее планшеты инкубировали в течение 4 часов в соответствующих культуральных условиях. После этого добавляли 100 мкл 2-бутанольного раствора (додецилсульфата натрия (ДСН) в концентрации 20%, 2-бутанол в концентрации 50% и 5 мл 2N хлористоводородной кислоты) и содержимое каждой лунки гомогенизировали при осторожном пипетировании. Далее планшеты помещали в условиях перемешивания в течение 30 минут при температуре 37°C для полного растворения формазанового продукта. В итоге, определяли поглощение при длине волны 562 нм на счетчике для 96-луночных планшетов.
Использовали программное обеспечение GraphPad Prism для статистического анализа. Полученные данные выражали в виде среднего значения +/- СКО. Для анализа использовали статистический критерий Крускала-Валлиса (Kruskal-Wallis), который представляет собой непараметрический критерий для множественных сравнений. Далее использовали критерий Данна (Dunn) для идентификации тех групп, где среды статистически различаются. Величина p<0,05 оценивалась как статистически значимая.
Как показано на фиг. 1, обработка APL пептидом значительно снизила жизнеспособность мононуклеарных клеток периферической крови от пациентов с активной болезнью Крона для всех исследованных доз пептида в сравнении с необработанными клетками (p < 0,001). Однако обработка этим пептидом не влияла на жизнеспособность мононуклеарных клеток от здоровых доноров (ни для одной из исследованных в этом эксперименте доз APL пептида). Полученный результат дает основание говорить о специфичности механизма гибели клеток, индуцированного пептидом, в клетках от пациентов с активной болезнью Крона. Приведенные результаты являются репрезентативными для пяти пациентов с активной болезнью Крона и пяти здоровых доноров.
Пример 2. Идентификация механизма гибели клеток, индуцированного APL пептидом в мононуклеарных клетках периферической крови от пациентов с болезнью Крона, по данным трансмиссионной электронной микроскопии
Для выяснения, опосредован ли механизм гибели клеток, индуцированный APL пептидом (идентифицированным в настоящем изобретении как Seq ID No. 1), в мононуклеарных клетках периферической крови пациентов с активной болезнью Крона, полученные образцы анализировали с использованием трансмиссионной электронной микроскопии (ТЭМ). Эта методика позволяет визуализировать морфологические показатели апоптозных клеток, которые являются неоспоримым критерием наличия апоптоза. Эти показатели включают следующие: электронно-плотное ядро (перинуклеарная миграция хроматина на ранней фазе), фрагментация ядра, дезорганизованные и интактные цитоплазматические органеллы, огромные и хорошо различимые вакуоли, изменения в клеточной поверхности и дезинтеграция клетки в апоптозных телах. Процесс фагоцитоза апоптозных тел соседними клетками также может быть виден при использовании данной техники (White M et al. (2004) A morphologic approach to detect apoptosis based on electron microscopy. Methods Mol Biol 285: 105-11).
Мононуклеарные клетки, выделенные из периферической крови (10×106 клеток) пациентов с болезнью Крона, культивировали как без APL пептида, так и при добавлении APL пептида в концентрации 40 мкг/мл в течение 72 часов. Необработанные клетки использовали в качестве контроля для данного анализа. После 72-часовой инкубации образцы фиксировали с использованием 1% раствора глютаральдегида и 4% параформальдегида в 0,1 M фосфатном буфере в течение 1 часа. Далее клетки промывали в ФБР 1X и обрабатывали 2% раствором тетраоксида осмия в течение 1 часа. Затем клетки промывали дважды 0,1 М кокодилатным буфером и образцы дегидратировали под действием возрастающих концентраций спирта (30-100%). После этого клетки подвергали инфильтрации в эпоксидную смолу Spurr (Spurr AR (1969) A low-viscosity epoxy resin embedding medium for electron microscopy. J Ultrastruct Head 26(1): 31-43) и проводили полимеризацию при температуре 70°C в течение 24 часов. Делали ультратонкие срезы (40 нм) с использованием ультрамикротома (Nova, LKB) и помещали их на никелевую решетку. Далее указанные образцы окрашивали раствором ацетата уранила, суспендированного в метаноле, выдерживая 5 минут. Анализ проводили с использованием электронного микроскопа JEOL/JEM 2000 EX (JEOL, Japan).
На фиг. 2 приведены результаты, полученные при проведении ТЭМ на мононуклеарных клетках от пациентов с активной болезнью Крона. Как видно на представленной фотографии, необработанные клетки имеют нормальную морфологию (A, B). Однако в клетках, обработанных APL пептидом (Seq ID No. 1), можно видеть морфологические изменения, характерные для апоптозного процесса (C-H). В частности, заметны конденсация и миграция хроматина к периферии ядра (CMC), что является одним из самых ранних изменений, происходящих в ходе апоптоза в ядре клеток (N). В этих образцах отмечаются также фрагментация ядра (NF) и апоптозные тела (AB). И даже по наличию клеточных осколков можно сделать вывод о том, что происходит фагоцитоз апоптозных тел (P AB). Цитоплазматические органеллы остаются интактными (ICO), как видно на фиг. 2F, что является характерным признаком гибели клеток при апоптозе. Таким образом, эти результаты показывают, что механизм гибели клеток, индуцированный APL пептидом в мононуклеарных клетках пациентов с активной болезнью Крона, опосредован апоптозом.
Анализ клеток от этих пациентов, проведенный с использованием ТЭМ, позволил также идентифицировать клеточную популяцию среди мононуклеарных клеток, которая подвергается апоптозу. Это удалось выяснить благодаря тому, что лейкоциты крови (моноциты, лимфоциты и полиморфонуклеарные клетки) имеют разную морфологию. Авторы определили, что среди мононуклеарных клеток именно лимфоциты представляют ту популяцию, которая подвергается апоптозу. С морфологической точки зрения, лимфоциты меньше, чем моноциты, также имеют округлое ядро и меньше цитоплазмы в клетке. Кроме того, лимфоциты не демонстрируют ядро с рыхлым хроматином или в форме подковы, что характерно для моноцитов (Junqueira LC and Cameiro J (2005) Basic Histology. Sixth edition. Editorial Masson, Barcelona, Spain).
Пример 3. Идентификация механизма гибели клеток, индуцированного APL пептидом, на мононуклеарных клетках собственной пластинки у пациентов с болезнью Крона
У пациентов, при наличии информированного согласия, получали образцы из тканей кишечника, соответствующих воспаленным очажкам. Образцы поддерживали в холодном сбалансированном солевом растворе Хэнкса без магния и кальция (HBSS). Мононуклеарные клетки собственной пластинки выделяли из указанных тканей по методу, включающему использование дитиотрейтола/этилендиаминтетрауксусной кислоты /коллагеназы, описанному Bull and Bookman (Bull DMK and Bookman MA (1977) Isolation and functional characterization of human intestinal mucosal lymphoid cells. J Clin Invest 59: 966-974), с модификациями, выполненными Van Tol и соавторами (Van Tol EA et al. (1992) The CD56 adhesion molecule is the major determinant for detecting non-major histocompatibility complex-restricted cytotoxic mononuclear cells from the intestinal lamina propria. Eur J Immunol 22: 23-29).
Мононуклеарные клетки собственной пластинки от пациентов с болезнью Крона (10×106 клеток) культивировали без APL пептида и при добавлении APL пептида (40 мкг/мл) в течение 72 часов. Анализ по методу ТЭМ (фиг. 3) показал, что этот пептид индуцирует апоптозную гибель большей части данной популяции, поскольку в клетках, обработанных APL пептидом, наблюдались некоторые морфологические признаки именно этого типа гибели клеток (C-E), такие как миграция хроматина к периферии ядра (CMC), фрагментация ядра (NF) и апоптозные тела (AB). Тогда как необработанные клетки имеют нормальную морфологию (A-B).
Пример 4. Снижение жизнеспособности мононуклеарных клеток периферической крови у пациента с неактивной болезнью Крона после их обработки анти-CD3 антителом
Мононуклеарные клетки периферической крови от пациента с неактивной болезнью Крона активировали анти-CD3 антителом (e-Biosciences) в течение 72 часов при температуре 37°C, во влажной атмосфере с 5% содержанием CO2. Добавление анти-CD3 приводит к поликлональной активации T-клеток в клеточной популяции. Активированные лимфоциты промывали раствором ФБР 1X и затем инкубировали (1×105 клеток) в течение 1 часа с разными концентрациями (10, 40 и 160 мкг/мл) APL пептида (Seq ID No.1). Мононуклеарные клетки периферической крови, которые культивировали в течение 72 часов без анти-CD3 антитела, использовали в качестве контроля для теста на активацию (неактивированные клетки). По истечении этого периода времени указанные клетки культивировали с теми же концентрациями APL пептида.
Жизнеспособность клеток определяли по MTT методу, описанному в примере 1. Как видно из фиг. 4A, APL пептид не снижает жизнеспособность мононуклеарных клеток у пациента с неактивной болезнью Крона. Однако этот пептид существенно снижал жизнеспособность указанных клеток, которые были предварительно активированы анти-CD3 антителом (B). Этот результат в сочетании с данными, приведенными в примерах 1 и 2, где пептид не влиял на жизнеспособность мононуклеарных клеток у здоровых доноров (пример 1), а также идентификация лимфоцитов как основной популяции мононуклеарных клеток у пациентов с активной болезнью Крона, которая подвергается апоптозу (пример 2), дают основание полагать, что APL пептид (Seq ID No.1) способен индуцировать апоптоз патогенных активированных T-клеток с высокой специфичностью.
Пример 5. Оценка эффекта APL пептида на жизнеспособность мононуклеарных клеток периферической крови у пациентов с сахарным диабетом типа 1
Мононуклеарные клетки периферической крови от пациентов с сахарным диабетом типа 1 выделяли путем центрифугирования с использованием Ficoll - Paque™ PLUS, как было описано в примере 1. Для этого 10×106 клеток обрабатывали APL пептидом (40 мкг/мл) в течение 72 часов. Необработанные клетки служили в качестве контроля для данного теста. Как показано на фиг. 5, клетки, обработанные этим пептидом, демонстрируют описанную ранее морфологию (в примере 2), характерную для клеток в процессе апоптоза (панели C-D). С другой стороны, необработанные клетки (панели A-B) имеют нормальную морфологию. Полученный результат показывает, что данный APL пептид индуцирует апоптоз в мононуклеарных клетках у пациентов с сахарным диабетом типа 1.
Пример 6. Исследование биораспределения APL пептида (идентифицированного как Seq ID No. 1) на крысах линии Льюис
APL пептид (идентифицированный как Seq ID No. 1) метили изотопом I125 и вводили крысам линии Льюис в дозах 0,25 мг и 1 мг/кг веса тела внутривенным и интрадермальным способом. В каждой экспериментальной группе умерщвили по шесть животных через 4 и 24 часа после инокуляции пептида. В разных органах определяли уровень радиоактивности. Результаты выражали в виде % от введенной дозы радиоактивности/г ткани.
Проведенное исследование показало, что исследуемый пептид подвергается биораспределению в желудочно-кишечный тракт: желудок, тонкую кишку и толстую кишку, и остается в этих органах в течение периода времени, необходимо