Способ детекции дегенеративных мышечных заболеваний и способ определения терапевтической эффективности при заболеваниях
Иллюстрации
Показать всеИзобретение относится к способу ранней детекции мышечных дегенеративных заболеваний и к способу прогнозирования и/или определения терапевтической эффективности терапевтического средства и/или способа терапии заболеваний посредством измерения тетранор-PGDM (11,15-диоксо-9α-гидрокси-2,3,4,5-тетранорпростан-1,20-диовой кислоты) в образце мочи субъекта и сравнения его содержания относительно образца, выделенного у здорового индивидуума. Мышечное дегенеративное заболевание у пациента обнаружено, если концентрация или содержание тетранор-PGDM в образце, выделенном у пациента, превышает концентрацию или содержание тетранор-PGDM в образце, выделенном у здорового индивидуума. Определяют эффективность терапевтического средства и/или способа терапии мышечного дегенеративного заболевания путем сравнения содержания тетранор-PGDM в образце, выделенном у пациента с мышечным дегенеративным заболеванием до и после введения терапевтического средства. Если измеренное содержание тетранор-PGDM в образце значительно или незначительно уменьшается после введения терапевтического средства, то способ терапии является эффективным. Изобретение также относится к набору для диагностики мышечных дегенеративных заболеваний, который включает антитело к тетранор-PGDM, меченный тетранор-PGDM и, необязательно, по меньшей мере одно соединение, выбранное из группы, состоящей из антитела к иммуноглобулину, разбавляющего раствора для образца, разбавляющего раствора для антитела и меченного тетранор-PGDM, стандарта тетранор-PGDM известной концентрации, субстрата для иммуноферментного анализа и останавливающего раствора для иммуноферментного анализа. Изобретение является эффективным и простым в исполнении. 4 н. и 3 з.п. ф-лы, 1 табл., 1 пр., 2 ил.
Реферат
Область техники
Настоящее изобретение относится к способу ранней детекции мышечных дегенеративных заболеваний и к способу прогнозирования и/или определения терапевтического средства и/или способу терапии.
Предшествующий уровень техники
Группы заболеваний, включающих мышечные нарушения или некроз мышц, называют миопатией. Типичными примерами этого заболевания являются мышечная дистрофия и амиотрофия. Мышечная дистрофия является собирательным термином, применяемым к наследственным заболеваниям, характеризующимся постепенно развивающейся мышечной слабостью и атрофией. Прогрессирующая мышечная дистрофия поражает наибольшее количество пациентов и вызывает наследственную прогрессирующую мышечную слабость. Амиотрофия представляет собой нейрогенное заболевание, вызываемое повреждениями в двигательном нерве.
Типом мышечной дистрофии, поражающим наибольшее количество пациентов, является мышечная дистрофия Дюшена, которая представляет собой сцепленное с полом рецессивное наследственное заболевание, развивающееся только у мужчин. Заболевание поражает от 3 до 5 индивидуумов на 100000 жителей и 1 из от 2000 до 3000 новорожденных мальчиков. В основном заболевание развивается в возрасте приблизительно от 3 до 5 лет в виде нарушений при ходьбе и при стоянии, таких как проблемы при беге и частые падения. Способность к хождению теряется к возрасту приблизительно 10 лет. За этими симптомами следуют быстро прогрессирующая деформация позвоночника и артрогрипоз, которые во многих случаях ведут к дыхательной недостаточности и с меньшей частотой к сердечной недостаточности и пневмонии.
Тесты, применяемые для диагностики мышечной дистрофии, включают анализ крови, тестирование проводимости нерва, электромиографию, биопсию мышц и анализ ДНК. Посредством тестирования проводимости нерва определяют возникновение нарушения подвижности или нарушение восприятия в результате периферической нейропатии или выявляют участок повреждения или степень повреждения. В исследовании измеряют скорость проведения импульса при электростимуляции нерва. По характеру тестирования для него необходимо специальное оборудование, и т.к. электростимуляцию применяют прямо к нерву, исследование в некоторой степени является трудным, т.к. вызывает шок, боль и дискомфорт.
Электромиография определяет, возникает ли нарушение подвижности в мышце или нерве, или выявляет участок повреждения или степень повреждения. Для исследования необходимо специальное оборудование и оно вызывает боль при введении иглы в мышцу. Доступна безболезненная поверхностная электромиография; однако измерение необходимо проводить на оборудовании для тестирования.
Для мышечной биопсии необходим сбор мышечной ткани, таким образом, она является инвазивной и неудобной. Анализ ДНК, необходимый для диагностики мышечных дистрофий Дюшена и Беккера, вызываемых мутацией в гене дистрофина, для мышечных дегенеративных заболеваний не применяют, т.к. у него отсутствует универсальность.
При анализе крови в основном выявляют креатинкиназу. Креатинкиназа представляет собой фермент, содержащийся преимущественно в растворимых фракциях скелетных мышц и сердечной мышцы, и проникает в кровь из поврежденных клеток. Поврежденная или отмершая скелетная мышца значительно повышает уровни креатинкиназы в крови, и таким образом, такие высокие уровни креатинкиназы можно использовать для диагностики мышечной дистрофии. Однако, т.к. уровни креатинкиназы в крови также могут повышаться при других заболеваниях, дифференциальная диагностика, основанная только на концентрации креатинкиназы, затруднительна и проводится одновременно с другими анализами.
Анализ крови, при котором измеряют креатинкиназу в крови, также проводят при других прогрессирующих мышечных дистрофиях и заболеваниях, включающих повреждение или гибель мышц, обусловленных дефектами нервов. Однако, как выше отмечено, высокий уровень креатинкиназы в крови также наблюдают при других заболеваниях, отличных от мышечных нарушений и некроза мышц, и необходимы другие маркеры мышечных нарушений и некроза мышц.
Таким образом существует необходимость в способе или диагностическом наборе, позволяющем использовать раннюю и простую диагностику мышечных дегенеративных заболеваний, таких как мышечная дистрофия.
Известно, что 11,15-диоксо-9α-гидрокси-2,3,4,5-тетранорпростан-1,20-диовая кислота (далее в настоящем документе тетранор-PGDM) является метаболитом простагландина D2 (далее в настоящем документе PGD2) и существует публикация о том, что тетранор-PGDM, выделяющийся с мочой, повышается при воспалительных реакциях у людей и мышей и что тетранор-PGDM представляет собой маркер, отражающий продукцию PGD2 (непатентная литература 1).
Также существуют публикации о том, что повышенную экспрессию гематопоэтической простагландин-D-синтетазы (далее в настоящем документе HPGDS), которая катализирует продукцию PGD2, наблюдают в поврежденных участках при мышечных дегенеративных заболеваниях, таких как мышечная дистрофия, и что PGD2 вовлечен в профилактику и положительную динамику при развитии заболевания (патентная литература 1, непатентная литература 2).
Однако известно, что тетранор-PGDM в высоких концентрациях определяют в виде экскреции в моче пациентов с мышечными дегенеративными заболеваниями и что концентрация тетранор-PGDM значительно возрастает при введении ингибитора HPGDS.
Список литературы
Патентная литература
Патентная литература 1: Japanese Unexamined Patent Publication No. 2005-119984
Непатентная литература
Непатентная литература 1: J.Biol.Chem, Vol.283, No.2, 1179-1188 (2008)
Непатентная литература 2: Acta Neuropathol, 104, 377-384 (2002)
Сущность изобретения
Техническая задача
Целью настоящего изобретения является предоставление эффективного способа диагностики мышечного дегенеративного заболевания посредством измерения в моче тетранор-PGDM и способа определения терапевтической эффективности терапевтического средства и/или способа терапии для таких заболеваний.
Другой целью настоящего изобретения является предоставление диагностического набора для мышечного дегенеративного заболевания для определения тетранор-PGDM.
Решение задачи
Авторы настоящего изобретения для достижения указанных выше целей провели тщательные исследования и осуществили изобретение, основанное на приведенных ниже открытиях.
1) Уровень PGD2, метаболита тетранор-PGDM, в моче животного с моделью мышечной дистрофии возрастает по сравнению с нормальными животными.
2) Введение известного ингибитора синтеза PGD2 животному с моделью мышечной дистрофии понижает количество тетранор-PGDM, выделяемого с мочой.
Настоящее изобретение относится к способу детекции мышечного дегенеративного заболевания, набору для диагностического определения мышечного дегенеративного заболевания и набору для прогнозирования и/или определения эффективности терапевтического средства и/или способа терапии мышечного дегенеративного заболевания, как указано ниже.
Пункт 1. Способ детекции мышечного дегенеративного заболевания, где способ включает стадию измерения содержания тетранор-PGDM в образце, выделенном у индивидуума.
Пункт 2. Способ определения эффективности терапевтического средства и/или способа терапии мышечного дегенеративного заболевания, где способ включает стадию измерения содержания тетранор-PGDM в образце, выделенном у пациента с мышечным дегенеративным заболеванием.
Пункт 3. Способ по п. 1 или 2, где образец представляет собой мочу.
Пункт 4. Способ по любому из пп. 1-3, где тетранор-PGDM определяют посредством высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (ВЭЖХ-MS/MS), иммуноферментного анализа (EIA), радиоиммунологического анализа (RIA), флуоресцентного иммунологического анализа (FIA), твердофазного иммуноферментного анализа (ELISA) или ферментативным способом.
Пункт 5. Способ по п. 1 или 2, где мышечное дегенеративное заболевание представляет собой прогрессирующую мышечную дистрофию, наследственную мышечную дистрофию, тазово-плечевую мышечную дистрофию, плече-лопаточно-лицевую мышечную дистрофию, миотоническую мышечную дистрофию, боковой амиотрофический склероз или миопатию.
Пункт 6. Набор для диагностического определения мышечного дегенеративного заболевания, где набор содержит антитело к тетранор-PGDM.
Пункт. 7. Набор для прогнозирования и/или определения эффективности терапевтического средства и/или способа терапии мышечного дегенеративного заболевания, где набор содержит антитело к тетранор-PGDM.
Пункт 8. Набор по п.6 или 7, содержащий антитела к тетранор-PGDM, меченный тетранор-PGDM и необязательно по меньшей мере одно соединение, выбранное из группы, состоящей из антитела к иммуноглобулину, разбавляющего раствора для образца, разбавляющего раствора для антитела и меченного тетранор-PGDM, стандарта тетранор-PGDM известной концентрации, субстрата для иммуноферментного анализа и останавливающего раствора для иммуноферментного анализа.
Полезные эффекты по изобретению
Настоящее изобретение позволяет использовать простую и раннюю диагностику мышечного дегенеративного заболевания посредством измерения тетранор-PGDM в образце, выделенном у индивидуума, и эффективное определение терапевтической эффективности терапевтического средства и/или способа терапии для такого заболевания.
Настоящее изобретение также можно использовать в качестве диагностического набора для простой диагностики мышечного дегенеративного заболевания посредством такого маркера, как увеличение тетранор-PGDM в моче.
Краткое описание фигур
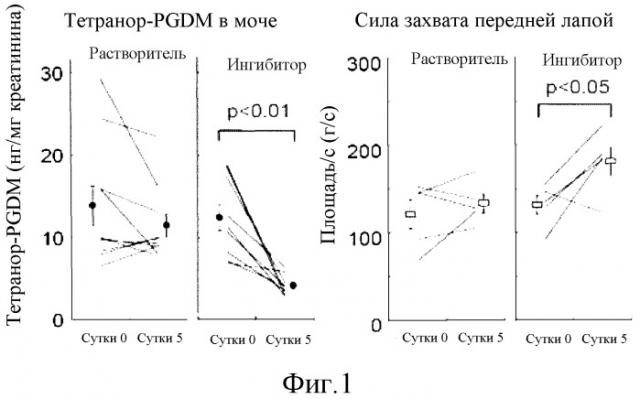
Фиг. 1 представляет собой график, демонстрирующий изменения концентрации тетранор-PGDM в моче и силы захвата передней лапой мыши mdx, которой вводили ингибитор HPGDS.
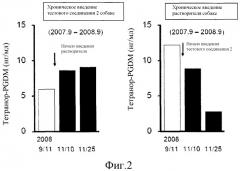
Фиг. 2 представляет собой график, демонстрирующий изменения концентрации тетранор-PGDM в моче после введения растворителя приблизительно через один год введения ингибитора HPGDS (слева) и изменения концентрации тетранор-PGDM в моче собаки с мышечной дистрофией (CXMDJ), получавшей растворитель приблизительно один год до введения ингибитора (справа).
Описание вариантов осуществления
Настоящее изобретение обеспечивает диагностику мышечных дегенеративных заболеваний с использованием тетранор-PGDM в качестве показателя и возможность эффективного определения терапевтической эффективности терапевтических средств и/или способов терапии этих заболеваний. Кроме того, с применением тетранор-PGDM в качестве маркера по изобретению можно получать диагностический набор для этих заболеваний или набор для прогнозирования и/или определения эффективности терапевтических средств и/или терапевтических способов для мышечных дегенеративных заболеваний.
По варианту осуществления настоящего изобретения заболевание, вызывающее мышечное нарушение или некроз мышц, можно детектировать или диагностировать посредством измерения тетранор-PGDM в образце, полученном у индивидуума, пораженного или потенциально пораженного мышечным дегенеративным заболеванием. Как правило, у индивидуума можно диагностировать мышечное дегенеративное заболевание, когда концентрация или содержание тетранор-PGDM в образце превышает предопределенное значение. Предопределенное значение тетранор-PGDM в образце, полученном у индивидуума, можно определять посредством измерения тетранор-PGDM в образцах, полученных у здорового индивидуума и пациента с мышечным дегенеративным заболеванием.
Способом определения эффективности терапевтических средств и/или способом терапии сравнивают измеренные значения тетранор-PGDM в образце, полученном у пациента с мышечным дегенеративным заболеванием до и после лечения/введения терапевтическим средством. Этим способом определяют, является ли лечение терапевтическим средством/введение терапевтического средства эффективным, когда измеренное значение тетранор-PGDM в образце значительно или немного снижено после лечения терапевтическим средством/введения терапевтического средства. С другой стороны, этим способом определяют, является ли терапевтическое средство/способ терапии неэффективным, когда нет значительных или небольших значимых отличий в измеренных значениях тетранор-PGDM в образце до и после лечения терапевтическим средством/введения терапевтического средства.
По другому аспекту настоящего изобретения можно получать диагностический набор для детекции тетранор-PGDM в образце на основе антител.
Как применяют в настоящем документе, "индивидуум" относится к млекопитающим, включая, например, людей, обезьян, крупный рогатый скот, лошадей, крыс, мышей, морских свинок, кроликов, собак, кошек, овец и коз. Предпочтительно индивидуумом является человек.
Измеряемый способом по настоящему изобретению тетранор-PGDM обнаруживают в виде метаболита PGD2 в моче. Также тетранор-PGDM можно найти в крови и стуле. Предпочтительно по настоящему изобретению образец, получаемый у индивидуума, представляет собой мочу, стул, кровь, плазму крови или сыворотку, более предпочтительно мочу.
Как применяют в настоящем документе, термин "измерение" включает детекцию, количественное определение и полуколичественное определение. По существу "измерение тетранор-PGDM" означает детекцию тетранор-PGDM в образце и измерение уровня экспрессии. Также термин включает определение, находится ли уровень экспрессии на предопределенном значении или больше его, другими словами, детекцию экспрессии, когда уровень экспрессии находится на предопределенном значении или больше него.
Примеры способа, который можно использовать для измерения тетранор-PGDM, включают способ газовой хроматографии-масс-спектрометрии (GC-MS), ВЭЖХ, высокоэффективную жидкостную хроматографию в сочетании с тандемной масс-спектрометрией (ВЭЖХ-MS/MS), иммуноферментный анализ (EIA), радиоиммунологический анализ (RIA), флуоресцентный иммунологический анализ (FIA), твердофазный иммуноферментный анализ (ELISA) и ферментный способ. Из этих способов предпочтительным является высокоэффективная жидкостная хроматография в сочетании с тандемной масс-спектрометрией (ВЭЖХ-MS/MS) и, с точки зрения простоты способа, предпочтительными являются иммунологические анализы с применением антител к тетранор-PGDM, в частности иммуноферментный анализ (EIA), радиоиммунологический анализ (RIA), флуоресцентный иммунологический анализ (FIA) и твердофазный иммуноферментный анализ (ELISA), особенно предпочтительными являются иммуноферментный анализ (EIA) и твердофазный иммуноферментный анализ (ELISA).
Примеры мышечного дегенеративного заболевания включают прогрессирующую мышечную дистрофию, наследственную мышечную дистрофию, тазово-плечевую мышечную дистрофию, плече-лопаточно-лицевую мышечную дистрофию, миотоническую мышечную дистрофию, боковой амиотрофический склероз, миопатию, растяжение мышц, кардиомиопатию (инфаркт миокарда) и диабетические заболевания периферических сосудов (нарушение гладкой мускулатуры сосудов). Предпочтительными являются мышечные дистрофии и боковой амиотрофический склероз, так же как и прогрессирующая мышечная дистрофия, наследственная дистрофия, тазово-плечевая мышечная дистрофия, плече-лопаточно-лицевая мышечная дистрофия и миотоническая мышечная дистрофия.
Терапевтическое средство, которое можно использовать для определения терапевтической эффективности для мышечного дегенеративного заболевания, конкретно не ограничено и можно использовать любое терапевтическое средство, включая, например, ингибиторы гематопоэтической простагландин-D-синтетазы (HPGDS) и антагонисты рецепторов простагландина D, среди которых предпочтительными являются ингибиторы гематопоэтической простагландин-D-синтетазы (HPGDS).
Концентрацию тетранор-PGDM предпочтительно измерять в образце посредством иммунологического анализа, т.к. он легко обеспечивает одновременное измерение большого количества образцов.
Антитела к тетранор-PGDM, применяемые в иммунологическом анализе и наборе, могут представлять собой поликлональные антитела или моноклональные антитела.
В отношении получения антител поликлональные антитела и моноклональные антитела можно получать посредством введения тетранор-PGDM и иммунизации животного (крысы, мыши, морской свинки, кролика, собаки, кошки, овцы, козы и т.д.). Альтернативно, поликлональные антитела и моноклональные антитела можно получать из сыворотки, полученной у животного (крысы, мыши, морской свинки, кролика, собаки, кошки, овцы, козы и т.д.) и обработанной известным способом после предопределенного периода времени после интервального введения животному смеси суспензий подходящего адъюванта и тетранор-PGDM, связанного с подходящим белком, например таким, как бычий сывороточный альбумин (BSA), глобулин, тиреоглобулин и гемоцианин.
В частности, моноклональные антитела можно получать из гибридом, получаемых посредством слияния миеломных клеток и клеток, продуцирующих моноклональное антитело, получаемых из селезенки после иммунизации животного иммуногеном, для которого используют тетранор-PGDM, используемый для получения поликлональных антител и необязательно связанный с подходящим белком.
Гибридомы можно получать, как указано ниже. Как указано выше тетранор-PGDM, получаемый один или как комплекс с белком, совместно с полным адъювантом Фрейнда интраперитонеально, внутривенно или подкожно вводят подходящему животному (такому, как мышь, крыса и кролик) каждые 2-3 недели разделенными частями с иммунизацией животного. Затем клетки, продуцирующие антитело, из селезенки или других органов подвергают слиянию с опухолевыми клетками, такими как миеломные клетки, которые могут пролиферировать в тестовой пробирке. Клетки можно подвергать слиянию, применяя стандартный способ с полиэтиленгликолем Kohler and Milstein (Nature, vol. 256, 495(1975)) или с применением вируса Сендай.
Иммунологический анализ тетранор-PGDM проводят с применением антител к тетранор-PGDM, получаемых как указано выше. Предпочтительно иммунологический анализ проводят известными способами конкурентного иммунологического анализа, нацеленными на измеряемое вещество тетранор-PGDM. Примеры таких способов включают иммуноферментный анализ (EIA), флуоресцентный иммунологический анализ, люминесцентный иммунологический анализ и радиоиммунологический анализ (RIA), классифицируемые по метящему веществу. Из этих способов особенно предпочтительным является иммуноферментный анализ (EIA).
Как правило, для конкурентного способа применяют меченые антигены. Примеры метящих веществ включают ферменты, флуоресцентные вещества, люминесцентные вещества и радиоактивные изотопы. Конъюгацию между метящим веществом и антигенами проводят известными способами, посредством которых формируют ковалентную связь или нековалентную связь. Примеры таких способов конъюгации включают способ формирования ковалентной связи с применением, например, конденсирующего средства и способ, в котором используют различные сшивающие средства (см., например, Tanpakushitsu Kakusan Kouso (PNE), Separate Volume 31, pp. 37 до 45 (1985)). Ковалентное связывание можно использовать для получения меченого антигена посредством использования функциональной группы, находящейся на антигенах, или посредством связывания функциональной группы, такой как тиоловая группа, аминогруппа, карбоксильная группа и гидроксильная группа, после введения этих групп обычным способом. Способом нековалентного связывания может являться, например, способ физической адсорбции.
Предпочтительно тетранор-PGDM определяют посредством иммунологического анализа, например, как указано ниже. Тетранор-PGDM в образце количественно определяют по количеству меченного антигена, связавшегося с антителами или не связавшегося с антителами, посредством конкурентной реакции между предопределенным количеством меченого тетранор-PGDM, антителом к тетранор-PGDM и образцом, содержащим тетранор-PGDM (в частности, образцом мочи).
Меченые антигены, связанные с антителами, можно отделять от несвязанных меченых антигенов посредством добавления антител к иммуноглобулину и отделения осажденных конъюгатов (меченый антиген)-(антитело к тетранор-PGDM)-(антитело к иммуноглобулину) с последующим измерением метящего вещества, которое связывается с конъюгатами или которое не связывается с конъюгатами. Также можно проводить способ, называемый иммуноферментным анализом, способом двойных антител, применяя способ, в котором используют угольный фильтр. Также можно проводить анализ антитела к иммуноглобулину посредством измерения антител к иммуноглобулину, связанных с твердой фазой, или посредством измерения метящего вещества, которое связывается с твердой фазой или не связывается с твердой фазой. Антитела к иммуноглобулину можно связывать с твердой фазой известными способами, например такими, как способ физической адсорбции, способ химического связывания, в котором используют сшивающие средства или ковалентную связь, и способ связывания, в котором используют связь авидин-биотин. Способ измерения метящего вещества следует выбирать по типу применяемого метящего вещества.
Набор по настоящему изобретению содержит антитела к тетранор-PGDM. В более предпочтительном варианте осуществления набор содержит меченый тетранор-PGDM и антитела к тетранор-PGDM. При необходимости набор также может содержать, например, антитела к иммуноглобулинам, связывающиеся с антителами к тетранор-PGDM, разбавляющий раствор для образца, разбавляющий раствор для антител и меченого тетранор-PGDM и стандарт тетранор-PGDM известной концентрации. Для иммуноферментного анализа (EIA) набор может дополнительно содержать, например, субстрат и останавливающий раствор.
По настоящему изобретению образец, применяемый для измерения тетранор-PGDM, может конкретно представлять собой, например, мочу, собранную у людей.
Способом определения эффективности для пациентов с мышечным дегенеративным заболеванием сравнивают измеряемые значения тетранор-PGDM в образце (в частности, в моче) до и после введения терапевтического средства.
Образец может представлять собой объединенные образцы мочи, собранной в течение суток, или для измерения можно непосредственно использовать отобранный образец. Собранную мочу до применения в измерении можно хранить при комнатной температуре, предпочтительно при низкой температуре.
Тетранор-PGDM в образце можно измерять относительно общего количества отобранного образца или относительно части отобранного образца с учетом поправки на вещества сравнения, такие как креатинин.
Для простоты способа тетранор-PGDM в образце предпочтительно измерять в части отобранного образца с учетом поправки на креатинин.
Ниже описано предопределенное значение, используемое в настоящем документе.
Предопределенное значение, используемое для определения терапевтической эффективности для пациентов с мышечным дегенеративным заболеванием, можно определять посредством измерения тетранор-PGDM в образце здорового индивидуума и пациента, и каждое измеренное значение можно применять для определения "предопределенного значения" как критерия для определения наличия или отсутствия терапевтической эффективности при обычном способе.
Например, когда в качестве образца используют мочу, предопределенное значение предпочтительно определять, используя совокупное количество суточной мочи каждого здорового индивидуума и пациента с мышечным дегенеративным заболеванием или мочу, собранную в настоящий момент.
В способе определения терапевтической эффективности посредством измерения тетранор-PGDM концентрацию тетранор-PGDM, содержащегося в моче пациента до введения терапевтического средства при контролируемом лечении, применяют как предопределенное значение, а терапевтическое средство и/или способ терапии лечения определяют как эффективное, если концентрация тетранор-PGDM в моче является значительно или незначительно меньшей, чем предопределенное значение. Затем продолжают выполнение способа терапии и/или введение терапевтического средства. С другой стороны, если в моче отсутствует значительное или незначительное снижение концентрации тетранор-PGDM, то способ терапии и/или терапевтическое средство определяют как неэффективное и ведут поиск других терапевтических средств и/или терапевтических способов.
Примеры
Настоящее изобретение более подробно описано ниже посредством примера. Однако следует отметить, что изобретение не ограничено следующим ниже примером.
Пример 1
1. Материалы и способы
1) Материалы и образцы
В качестве животных с моделью мышечной дистрофии использовали указанных ниже животных.
Мышь с мышечной дистрофией: mdx (C57B1/10 ScSn; доступна в JAX Laboratories).
Собака с мышечной дистрофией: CXMDJ (CXMDJ; доступна в National Center of Neurology and Psychiatry).
Для сравнения в качестве контроля использовали животных той же линии.
Мышь дикого типа (C57BL/10 ScSn; доступна в JAX Laboratories).
Обычный бигль (доступен в National Center of Neurology and Psychiatry).
2) Тестируемые соединения
Использовали указанные ниже тестируемые соединения, доступные как известные ингибиторы гематопоэтической простагландин-D-синтетазы (HPGDS).
Тестируемое соединение 1: 4-бензгидрилокси-1-[3-(1Н-тетразол-5-ил)пропил]пиперидин (Jpn. J. Pharmacol., 78, 1-10 (1998)).
Тестируемое соединение 2: N-метокси-N-метил-4-(5-бензоилбензимидазол-2-ил-3,5-диметилпиррол-2-карбоксамид (W02007007778).
3) Сбор мочи мыши
Мышам mdx в возрасте 4 недель перорально в дозе 30 мг/кг в течение 5 суток вводили растворитель (0,5% раствор метилцеллюлозы) или тестируемое соединение 1. Используя камеру для исследования метаболизма мыши, собирали мочу приблизительно в течение 12 часов до введения тестируемого соединения 1 и через 5 суток после введения. Для сравнения также собирали мочу мышей дикого типа того же возраста и той же линии, используемой в качестве контроля. Концентрацию креатинина в моче измеряли, используя набор для измерения (L-type Wako CRE•M, Wako Pure Chemical Industries, Ltd.).
4) Сбор мочи собаки
CXMDJ перорально вводили растворитель (0,5% раствор метилцеллюлозы) или тестируемое соединение 2 приблизительно в течение 1 года с последующим введением тестируемого соединения 2 собаке, которой вводили растворитель, и растворителя собаке, которой вводили тестируемое соединение 2. Мочу собирали до перевода с растворителя на тестируемое соединение 2 и с тестируемого соединения 2 на растворитель. Мочу собирали в течение всего времени после того, как сменяли вводимый раствор. Для сравнения использовали мочу, также собранную у нормальных гончих.
5) Предварительная обработка мочи
Мочу (200 мкл), собранную у мышей или собак, смешивали с 5 нг меченным дейтерием тетранор-PGDM-d6 (Cayman Chemical), применяемым в качестве внутреннего стандарта. Объем очищенной водой доводили до 2 мл и pH доводили до 3. Затем мочу вводили в картридж Sep-Pak Vac C18 (Waters), уравновешивали ацетонитрилом (5 мл) и очищали водой (5 мл). Образец промывали 10% раствором ацетонитрила (5 мл), составленного с использованием очищенной воды, и гексаном (10 мл), и до высушивания под струей азота элюировали этилацетатом (5 мл). Остаток растворяли в 10% растворе ацетонитрила (100 мкл), составленного с использованием очищенной воды, и применяли в качестве измеряемого образца.
6) Измерение тетранор-PGDM
Для измерения уровней тетранор-PGDM использовали предварительно обработанный образец мочи. Для измерения использовали устройство для высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (ВЭЖХ-MS/MS). Для измерения использовали устройство ВЭЖХ Prominence System (системный контролер CBM-20A, два приемных устройства LC-20AD, интерактивный деаэратор DGU-20A3, термостат колонки CTO-20A, автоматический дозатор SIL-20AC с функцией охлаждения, Shimadzu Corporation), предколонку InertsilODS3 (внутренний диаметр 2,1 мм × длина 50 мм; GL Science) и разделительную колонку InertsilODS3 (внутренний диаметр 2,1 мм × длина 250 мм; GL Science). Градиент концентрации подвижной фазы составлял от 0,01% до 0,2% муравьиной кислоты или 0,01% до 0,2% уксусной кислоты и ацетонитрила или ацетонитрила/метанола (90:10). Скорость потока составляла 0,2 мл/мин. Термостат колонки устанавливали на 37°C, а автоматический дозатор - на 4°C. Для участка MS/MS применяли тройной квадрупольный масс-спектрометр (4000 Q TRAP LC/MS/MS система, Applied Biosystems), в котором в качестве источника ионов использовали ионизацию распылением в электрическом поле. Для количественного определения применяли MRM (мониторинг множественных реакций). В этом способе из множества исходных ионов (ион-предшественник) и ионов-фрагментов, получаемых в результате CID (вызванной столкновениями диссоциации), конкретно отбирают только настоящие исходные ионы и из области выбранных ионов точно количественно определяют исходные ионы. В частности, ионизацией распылением в электрическом поле получают исходные ионы молекулы-мишени, и эти исходные ионы изолируют посредством первого масс-спектрометра (Q1). На участке столкновения (Q2) посредством CID (вызванной столкновениями диссоциации) получают ионы-фрагменты, характерные для исходных ионов. Затем на втором масс-спектрометре (Q3) отбирают ионы-фрагменты и регистрируют в создаваемом детектором нисходящем потоке. Тетранор-PGDM (массовое число 328) регистрировали, используя любой из ионов с массой/зарядом (массовым числом - зарядом) 155, 143 и 109, получаемых при дальнейшем распаде ионов-продуктов с массой/зарядом 327 посредством CID (вызванной столкновениями диссоциации). Внутренний стандарт тетранор-PGDM-d6 (массовое число 334) регистрировали, используя любой из ионов-продуктов с массой/зарядом (массовым числом - зарядом) 161, 149 и 109, получаемых при дальнейшем распаде ионов-продуктов с массой/зарядом 333 посредством CID (вызванной столкновениями диссоциации). Анализ данных проводили посредством программного обеспечения Analyst Version 1.4.1, прилагаемым к MS/MS. Расчеты площади проводили для пиков, получаемых в конечной масс-хроматограмме от тетранор-PGDM, и каждый пик количественно определяли по стандартной кривой, полученной для образца-стандарта. При количественном определении делали поправку с использованием величины площади пика, полученного от тетранор-PGDM-d6, вводимого в качестве внутреннего стандарта для поправки эффективности экстракции и эффективности ионизации в каждом анализе.
7) Оценка симптомов
Для оценки симптомов мышей mdx измеряли силу захвата передней лапой, применяя динамометр для измерения силы захвата для мышей (счетчик напряжения; BrainSienceldea). Каждое измерение проводили в течение 2 мин и рассчитывали среднее значение пяти попыток.
2. Результаты
1) Уровни концентрации тетранор-PGDM в моче мышей mdx являются повышенными.
Концентрация тетранор-PGDM у мышей mdx после поправки на концентрацию креатинина в моче составляла 17,8±0,8 нг/мг креатинина (среднее значение ± среднеквадратическая ошибка, p<0,0003), значение приблизительно в три раза выше, чем значение 6,8±1,0 нг/мг креатинина (среднее значение ± среднеквадратическая ошибка), полученное у мышей дикого типа. Этот результат позволяет предположить, что концентрацию тетранор-PGDM в моче можно использовать в качестве маркера развития симптомов при мышечной дистрофии в моче.
2) Ингибитор HPGDS снижает симптомы у мышей mdx и понижает концентрацию тетранор-PGDM в моче.
Оценивают эффект ингибитора HPGDS на симптомы у мышей mdx. В отличие от группы, которой вводили растворитель и в которой не отмечали достоверного изменения силы захвата передней лапой, мыши mdx, которым несколько раз перорально вводили тестируемое соединение 1, демонстрировали значительное увеличение силы захвата передней лапой (фиг. 1, справа). Концентрация тетранор-PGDM, измеренная в моче тех же мышей mdx, в группе, которой вводили тестируемое соединение 1, была значительно ниже (фиг. 1, слева). Результат позволяет предположить, что существует корреляция между снижением симптомов и изменением концентрации тетранор-PGDM в моче мышей mdx.
3) Уровни концентрации тетранор-PGDM в моче CXMDJ являются повышенными.
Уровни концентрации тетранор-PGDM в моче собаки CXMDJ с моделью мышечной дистрофии по сравнению с нормальными собаками являлись повышенными, а концентрация тетранор-PGDM в моче CXMDJ, которой вводили тестируемое соединение 2 (таблица 1), снижалась. Этот результат позволяет предположить, что концентрацию тетранор-PGDM можно использовать в качестве маркера развития симптомов при мышечной дистрофии в моче.
| Таблица 1 | |
| Концентрация тетранор-PGDM в моче собак с моделью мышечной дистрофии | |
| Концентрация тетранор-PGDM (нг/мл) | |
| Нормальная собака (1) | 5,9 |
| Нормальная собака (1) | 9,3 |
| Нормальная собака (1) | 5,0 |
| Нормальная собака (1) | 5,8 |
| Собака CXMDJ | 27,8 |
| Собака CXMDJ, которой вводили ингибитор HPGDS | 17,9 |
4) Введение ингибитора HPGDS снижает концентрацию тетранор-PGDM в моче CXMDJ.
У CXMDJ, которым вводили растворитель после перорального введения тестируемого соединения 2 приблизительно в течение 1 года (фиг. 2, слева), концентрация тетранор-PGDM в моче повышалась, а показатели симптомов усугублялись. С другой стороны, у CXMDJ, которым вводили ингибитор после перорального введения растворителя приблизительно в течение 1 года (фиг. 2, справа), концентрация тетранор-PGDM в моче понижалась и показатели симптомов улучшались. Эти результаты позволяют предположить, что изменения концентрации тетранор-PGDM в моче можно использовать в качестве маркера для определения или прогнозирования эффекта введения терапевтического средства при мышечной дистрофии.
1. Способ детекции мышечного дегенеративного заболевания, где способ включает стадииa) измерения содержания тетранор-PGDM в образце, выделенном у пациента;b) сравнения содержания тетранор-PGDM в образце, выделенном у пациента, относительно образца, выделенного у здорового индивидуума,где мышечное дегенеративное заболевание у пациента обнаружено, если концентрация или содержание тетранор-PGDM в образце, выделенном у пациента, превышает концентрацию или содержание тетранор-PGDM в образце, выделенном у здорового индивидуума.
2. Способ определения эффективности терапевтического средства и/или способа терапии мышечного дегенеративного заболевания,где способ включает стадию измерения содержания тетранор-PGDM в образце, выделенном у пациента с мышечным дегенеративным заболеванием до и после введения терапевтического средства;где способ терапии является эффективным, если измеренное содержание тетранор-PGDM в образце значительно или незначительно уменьшается после введения терапевтического средства.
3. Способ по п.1 или 2, где образец представляет собой мочу.
4. Способ по п.1 или 2, где тетранор-PGDM определяют посредством высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (ВЭЖХ-MS/MS), иммуноферментного анализа (EIA), радиоиммунологического анализа (RIA), флуоресцентного иммунологического анализа (FIA), твердофазного иммуноферментного анализа (ELISA) или ферментативного способа.
5. Способ по п.1 или 2, где мышечное дегенеративное заболевание представляет собой прогрессирующую мышечную дистрофию, наследственную мышечную дистрофию, тазово-плечевую мышечную дистрофию, плече-лопаточно-лицевую мышечную дистрофию, миотоническую мышечную дистрофию, боковой амиотрофический склероз или миопатию.
6. Набор для диагностического определения мышечного дегенеративного заболевания,где набор содержит антитело к тетранор-PGDM, меченный тетранор-PGDM и, необязательно, по меньшей мере одно соединение, выбранное из группы, состоящей из антитела к иммуноглобулину, разбавляющего раствора для образца, разбавляющего раствора для антитела и меченного тетранор-PGDM, стандарта тетранор-PGDM известной концентрации, субстрата для иммуноферментного анализа и останавливающего раствора для иммуноферментного анализа.
7. Набор для прогнозирования и/или определения эффективности терапевтического средства и/или способа терапии мышечного дегенеративного заболевания, где набор содержит антитело к тетранор-PGDM, меченный тетранор-PGDM и, необязательно, по меньшей мере одно соединение, выбра