Имплантируемые продукты, содержащие наночастицы
Иллюстрации
Показать всеИзобретение относится к применению твердого медицинского продукта, который нагревается под действием переменного магнитного поля, для терапевтического последующего лечения после хирургического удаления опухолей и раковых язв. Медицинский продукт представляет собой хирургический имплантат, предоставленный в форме физиологически приемлемой ткани, губки или пленки. В медицинском продукте содержатся магнитные частицы, которые будут образовывать тепло при возбуждении под действием переменного магнитного поля и, таким образом, будут нагревать медицинский продукт. Изобретение обеспечивает значительное улучшение последующего лечения после операции на раковой опухоли по сравнению с химиотерапией. 20 з.п. ф-лы, 14 пр.
Реферат
Настоящее изобретение относится к имплантируемым продуктам, содержащим наночастицы, и к их применению в медицине, в частности, для последующего термотерапевтического лечения после хирургического удаления опухолей и раковых язв.
После хирургического удаления опухолевой ткани, почти всегда возникают проблемы, связанные с тем, что в организме все еще сохраняются опухолевые клетки (неполная резекция). После закрытия раны, эти опухолевые клетки снова смогут расти и образовывать более крупные опухоли и/или метастазы. По этой причине осуществляют последующее химиотерапевтическое лечение, которое является для пациента серьезным стрессом. При этом нужно удалить минимальное количество здоровой ткани, и оперирующий хирург должен идти на компромисс между, предпочтительно, полной резекцией опухоли и удалением минимального количества здоровой ткани.
Цель настоящего изобретения состоит в том, чтобы предоставить продукты и способы для более эффективного последующего лечения после операции на раковой опухоли.
Цель достигается с помощью независимых пунктов формулы изобретения. Дополнительные предпочтительные варианты осуществления следуют из независимых пунктов формулы изобретения, примеров и описания.
К удивлению, было обнаружено, что имплантируемые медицинские продукты, содержащие наночастицы, нагревающиеся в переменном магнитном поле, обладают способностью к значительному улучшению последующего лечения после операции на раковой опухоли по сравнению с химиотерапией, если эти медицинские продукты имплантированы или помещены в операционную область.
Поэтому настоящее изобретение относится к твердым или гелеобразным медицинским продуктам, нагревающимся в переменном магнитном поле, в котором медицинский продукт присутствует в форме физиологически приемлемой ткани, губки, пленки или геля, где магнитные частицы, содержащиеся в медицинском продукте, образуют тепло, когда возбуждаются переменным магнитным полем и, таким образом, нагревают медицинский продукт.
Для патентоспособного медицинского продукта принципиально важно, чтобы эти частицы, т.е. частицы, возбуждаемые переменным магнитным полем, были стационарно внедрены в медицинский продукт или приклеены к нему.
Водные растворы магнитных частиц обычно получают или для того, чтобы направить частицы, нагруженные фармакологическими лекарственными средствами в определенное целевое местоположение с помощью статического магнитного поля, или водные растворы частиц, возбуждаемых в переменном магнитном поле, инъецируют непосредственно в опухоль для того, чтобы частицы накапливались в опухолевых клетках и разрушали опухолевые клетки при помощи образуемого тепла. В первую очередь тепло образуется за счет рассеивания энергии гистерезисного нагрева частиц.
Патентоспособные медицинские продукты не являются водными или физиологическими водными растворами или суспензиями магнитных частиц, а представляют собой твердые или гелеобразные носители, такие как ткань или пленка, в которую стационарно внедрены частицы. При условии, что это не относится к биоразрушаемым медицинским продуктам, частицы будут постоянно оставаться внутри медицинского продукта, а медицинский продукт будет постоянно оставаться в имплантированном месте, подобно зубному имплантату или искусственному коленному суставу.
Поскольку частицы, постоянно остающиеся в медицинском продукте, не будут вымываться за счет диффузии, а только будут высвобождаться за счет процесса деградации в случае с биоразрушаемыми медицинскими продуктами, то область, в которую помещен имплантированный медицинский продукт, все еще сможет нагреваться после желаемого периода времени, т.е. через одну неделю после имплантации, через один месяц после имплантации, через один год после имплантации, а также через десять лет после имплантации.
Предпочтительные варианты осуществления настоящего изобретения относятся к биоразрушаемым медицинским продуктам, которые разрушаются организмами человека и животных с различными скоростями в зависимости от показаний. Однако частицы высвобождаются из этого медицинского продукта не посредством диффузии, а лишь в рамках биологического разрушения. Таким образом, этот биорассасывающийся медицинский продукт будет подвергаться растворению, при котором остающиеся фрагменты медицинского продукта, подвергающегося растворению, могут и далее нагреваться под действием переменного магнитного поля.
Однако для патентоспособных медицинских продуктов принципиально важно, чтобы они были гибкими или деформируемыми и обладали способностью повторять контуры поверхности ткани или органа или операционной области после хирургического удаления опухоли. Таким образом, патентоспособные медицинские продукты представлены в форме тканей, которые можно помещать на ткани или органы или в операционную область и которые будут повторять неровные поверхности без труда, или в форме геля, пленкообразующей композиции или пленкообразующего спрея, свойства которых позволяют наносить их на любые неровные поверхности.
В настоящем документе операционная область относится к области, которая ограничена самыми внешними краями хирургической раны. Другими словами, операционная область представляет собой переходную область или граничную область между опухолью и здоровой тканью. Последующее лечение этой области играет очень важную роль в предотвращении образования рецидивов.
Медицинские продукты, описываемые в настоящем документе, накладываются, наносятся в виде покрытия на операционную область и, в случае спрея, распыляются на операционную область и, таким образом, предоставляются для последующего лечения хирургической раны после операции на опухоли.
Таким образом, патентоспособные медицинские продукты первоначально не предназначены для системного применения, а для имплантации в операционную область. Поскольку патентоспособные медицинские продукты будут оставаться в операционной области, предпочтительно на протяжении последующей химиотерапии, патентоспособные медицинские продукты являются биоразрушаемыми в соответствии с временными рамками запланированных сеансов терапии и подвергаются биологическому рассасыванию в течение более длительного периода времени или не являются разрушаемыми.
Важно, чтобы патентоспособные медицинские продукты, предпочтительно биоразрушаемые или медленно биоразрушаемые медицинские продукты, были представлены не в негнущейся форме, а могли эластично принимать форму поверхности операционной области, которая должна быть накрыта.
Таким образом, предпочтительны, в частности, гибкие, высокоэластичные, легко принимающие другие формы или бесформенные медицинские продукты или носители для нагревающихся частиц.
Таким образом, все медицинские продукты по изобретению представляют собой эластичные и неметаллические носители, которые принимают заданную форму поверхности и максимально покрывают ее, и, кроме того, пригодны для введения магнитных частиц, в частности, суперпарамагнитных наночастиц. Предпочтительными биоразрушаемыми патентоспособными медицинскими продуктами являются медицинская целлюлоза, перевязочный материал, помещаемые в раны приспособления, хирургический шовный материал, компрессы, губки, медицинские ткани, мази, гели или пленкообразующие спреи.
Медицинская целлюлоза и медицинские ткани предпочтительно образуют двухмерные структуры с низкой плотностью, которые импрегнированны частицами. Магнитные частицы прикрепляют к волокнистой структуре этого медицинского продукта, который после операции помещают внутрь раны в операционную область в сухом или предварительно увлажненном виде.
Губки или биоразрушаемые пористые трехмерные структуры, которые, в основном, могут содержать магнитные частицы на поверхности и в полостях внутри пористой структуры, а также в самом губчатом материале, представляют собой другой вид патентоспособных медицинских продуктов. После операции эти губки помещают внутрь раны, где они будут заполнять операционную область полностью или только частично. Магнитные частицы могут высвобождаться из этих губчатых структур, в которых эти частицы также могут присутствовать в прочно связанной форме. Может происходить высвобождение только слабо связанных частиц посредством диффузии из полостей пористой структуры, а также посредством биоразрушения губчатой структуры, если частицы встроены или внедрены в сам материал с губчатой структурой.
Патентоспособные медицинские продукты предназначены для имплантации в организм человека и животного и должны быть физиологически приемлемыми. Важно, чтобы патентоспособные медицинские продукты присутствовали не в жидкой форме в виде раствора или суспензии, а в виде вязкого или плотного или пленкообразующего или твердого состава, так чтобы после имплантации медицинский продукт обязательно оставался в желаемом положении.
Также важно, чтобы медицинский продукт подходил для любых поверхностей, т.е. чтобы он повторял контуры поверхности.
В настоящем документе, носитель магнитных частиц обозначается как «медицинский продукт», а ткани, целлюлозы, гели, пленкообразующие композиции и т.д., подробно описываемые в настоящем документе, служат в качестве «носителей», которые могут быть биоразрушаемыми или биостабильными и не обладают магнитными свойствами и, таким образом, без магнитных частиц не нагреваются в переменном магнитном поле. Носители, выполненные из неживого вещества, могут содержать рентгеновские метки или контрастные среды и связывать частицы, предпочтительно за счет склеивания и/или ковалентных связей. Однако главным образом частицы, не являющиеся биоразрушаемыми, будут рассеивать тепло посредством возбуждения в переменном магнитном поле и, таким образом, будут не только нагревать сами себя, но также носитель, то есть, иными словами весь медицинский продукт целиком, а также окружающую ткань. Кроме того, фармакологические лекарственные средства, например, цитостатики, могут быть внедрены в медицинский продукт, как описано ниже, и высвобождаться под действием диффузии и/или биоразрушения носителя и/или образования тепла и/или переменного магнитного поля, чтобы прежде всего бороться с опухолевыми клетками.
В настоящем документе, любая используемая в медицинских целях ткань или целлюлоза обозначается как «ткань», из которой изготавливают перевязочный материал, помещаемые в раны приспособления, бинты или другую медицинскую ткань или материю.
Фраза «биоразрушаемый медицинский продукт» в явной форме относится только к матрице для магнитных частиц, но не к самим магнитным частицам, которые обычно не являются биоразрушаемыми. Следовательно, биоразрушаемыми являются медицинская целлюлоза, перевязочный материал, помещаемые в раны приспособления, хирургический шовный материал, компрессы, губки, медицинские ткани, мази, гели или пленкообразующие спреи, в которые встраивают или на которые наносят магнитные частицы. Таким образом, матрица для магнитных частиц разрушаемого медицинского продукта с магнитными частицами, т.е. медицинский продукт без магнитных частиц, является биоразрушаемой, а магнитные частицы обычно будут оставаться или аккумулироваться в опухолевой ткани или злокачественных клетках, соответственно, и они почти не будут подвергаться биологическому разрушению или их покрытие будет подвергаться биологическому разрушению частично, а магнитное ядро обычно не будет подвергаться биологическому разрушению.
Область, в которой присутствовала удаленная опухоль или удаленная раковая ткань, обозначают как операционную область.
Другие предпочтительные альтернативные варианты патентоспособных медицинских продуктов представляют собой жидкие или гелеобразные составы в форме мазей, кремов, гелей и спреев, в частности, пленкообразующих спреев. Эти составы содержат магнитные частицы и должны наноситься или распыляться на операционную область после удаления опухоли.
За исключением магнитных частиц, патентоспособные медицинские продукты предпочтительно являются биоразрушаемыми и, следовательно, будут полностью растворяться предпочтительно в течение от одного до двенадцати месяцев, более предпочтительно от одного до шести месяцев, при этом содержащиеся магнитные частицы также будут высвобождаться.
Принцип функционирования патентоспособных медицинских продуктов состоит в том, что они должны покрывать операционную область в максимально возможной степени для того, чтобы магнитные частицы оказались настолько близко к сохранившимся злокачественным клеткам или сохранившейся раковой ткани, насколько это возможно. Магнитные частицы и, предпочтительно, суперпарамагнитные частицы могут нагреваться в переменном магнитном поле, и при этом еще сохранившиеся злокачественные клетки будут уничтожены посредством термотерапии. В настоящем документе магнитные частицы, содержащиеся в патентоспособном медицинском продукте, будут нагревать медицинский продукт целиком, а магнитные частицы, диффундирующие за пределы медицинского продукта, будут нагревать злокачественные клетки, к которым они будут прилипать или в которые они будут проникать.
Кроме того, термотерапевтическое лечение может дополнять обычную химиотерапию или лучевую терапию, поскольку термотерапевтическое лечение ведет к сравнительно небольшим неблагоприятным воздействиям и может осуществляться одновременно с химеотерапевтическим лечением. Поскольку патентоспособные медицинские продукты должны покрывать операционную область или должны заполнять операционную область в максимально возможной степени, то, соответственно, патентоспособные медицинские продукты предпочтительно находятся в непосредственном контакте со все еще сохранившимися злокачественными клетками и все еще сохранившейся раковой тканью, которые могут быть убиты особенно эффективным способом при непосредственной близости магнитных частиц. Следовательно, термотерапевтическое лечение патентоспособными медицинскими продуктами является значительно более избирательным и щадящим, чем химиотерапия и лучевая терапия.
В одном из предпочтительных вариантов осуществления настоящего изобретения по меньшей мере одно фармакологически активное соединение, предпочтительно противораковое лекарственное средство, связано с указанными магнитными частицами. Примеры подходящих противораковых лекарственных средств включают: актиномицин, аминоглютетимид, амсакрин, анастрозол, антагонисты пуриновых или пиримидиновых оснований, антрациклин, ингибиторы ароматазы, аспарагиназы, антиэстрогены, бексаротен, блеомицин, бусерелин, бусульфан, производные камптотецина, капецитабин, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, циклофосфамид, цитарабин (цитозинарабинозид), алкилирующие цитостатики, дакарбазин, дактиномицин, даунорубицин, доцетаксел, доксорубицин (адриамицин), эпирубицин, эстрамустин, этопозид, эксеместан, флударабин, фторурацил, антагонисты фолиевой кислоты, форместан, гемцитабин, глюкокортикоиды, гозерелин, гормоны и антагонисты гормонов, гикамтин, гидроксимочевина, идарубицин, ифосфамид, иматиниб, иринотекан, летрозол, лейпрорелин, ломустин, мелфалан, меркапто-пурин, метотрексат, милтефозин, митомицин, ингибиторы митоза, митоксантрон, нимустин, оксалиплатин, паклитаксел, пентостатин, прокарбазин, тамоксифен, темозоломид, тенипозид, тестолактон, тиотепа, тиогуанин, ингибиторы топоизомеразы, топотекан, треосульфан, третиноин, трипторелин, трофосфамид, винбластин, винкристин, виндезин, винорелбин, антибиотики с цитостатической активностью.
Отделение по меньшей мере одного терапевтически активного лекарственного средства от частиц дополнительно может быть достигнуто или инициировано с помощью переменного магнитного поля. Таким образом, можно добиться, чтобы термотерапевтическое лечение дополнялось антипролиферативным лекарственным средством непосредственно в операционной области, что снова будет увеличивать эффективность. Конечно, в настоящем документе также возможно проводить дополнительную химиотерапию или лучевую терапию параллельно или раздельно во времени.
По меньшей мере одно фармакологическое лекарственное средство не должно быть обязательно привязано к частицам, предпочтительно наночастицам. Оно может дополнительно содержаться в патентоспособном медицинском продукте или наноситься на его поверхность без привязывания к частицам.
Связывание лекарственного средства с частицами имеет преимущество, которое заключается в том, что будет происходить предпочтительное, нацеленное на мишень высвобождение, поскольку лекарственное средство вместе с частицами может проникать в злокачественные клетки или может присоединяться к злокачественным клеткам, а высвобождение может быть индуцировано магнитным полем.
В этом контексте, «вызванный» или «индуцированный магнитным полем» обозначает, что в отношении некоторого объекта переменное магнитное поле или импульс вызывает непосредственно высвобождение или отделение, или что отделение лекарственного средства происходит опосредовано, например, под действием ферментов или образующегося тепла.
Таким образом, содержащие наночастицы медицинские продукты в форме медицинской целлюлозы, перевязочного материала, помещаемых в раны приспособлений, хирургического шовного материала, компрессов, медицинских губок, медицинских тканей, мазей, гелей или пленкообразующих спреев могут дополнительно содержать по меньшей мере одно фармакологическое лекарственное средство, предпочтительно противораковое вещество. Подходящие лекарственные средства, а также связывание с частицами, подробно описано ниже.
Указанные имплантаты и имплантируемые медицинские продукты нагреваются в переменном магнитном поле посредством приложения внешнего переменного магнитного поля после применения медицинских продуктов или биоразрушаемых медицинских продуктов в операционной области.
Нагревание частиц происходит в переменном магнитном поле, при этом напряженность переменного магнитного поля предпочтительно находится в диапазоне от 1 до 25 кА/м, более предпочтительно в диапазоне от 2 до 18 кА/м, а частота находится предпочтительно в диапазоне от 5 до 5000 кГц, более предпочтительно в диапазоне от 10 до 1000 кГц.
Под действием тепла высвобождаются магнитные частицы, предпочтительно суперпарамагнитные наночастицы, а также необязательно присутствующие лекарственные средства, которые затем будут присоединяться к злокачественным клеткам и убивать их. Указанная щадящая терапия, включающая термотерапию, применима, в частности, в сочетании с другими лечебными процедурами, такими как лучевая терапия и/или химиотерапия.
Магнитные частицы
По изобретению, любые магнитные частицы могут быть использованы при условии, что они нагреваются под действием переменного магнитного поля.
Таким образом, предпочтительны микрочастицы и, в частности, наночастицы, и суперпарамагнитные микрочастицы и, в частности, наночастицы.
Указанные наночастицы предпочтительно отличаются наличием магнитного, более предпочтительно суперпарамагнитного, ядра. Предпочтительными материалами являются маггемит, магнетит, железоникелевые сплавы, никелемедные сплавы или кобальтникелевые сплавы, такие как FeNi или CoNi.
Для улучшения магнитных характеристик, в магнитном ядре также может использоваться второй слой. Это будет вести к более сильному результирующему коэрцитивному полю по сравнению с наночастицами с однослойным ядром. Первый слой ядра может быть выполнен из суперпарамагнитного вещества, а второй слой ядра может быть выполнен из вещества, которое отличается от вещества первого слоя ядра. На это ядро могут быть нанесены дополнительные слои, которые, например, будут нести лекарственные средства. Многослойные частицы для инфильтрирования опухолевых клеток конъюгатами частиц и лекарственных средств описаны в заявке WO 98/58673 A.
Ядро или ядра сами по себе состоят из магнитного вещества, предпочтительно из ферромагнитного, антиферромагнитного, ферримагнитного, антиферримагнитного или суперпарамагнитного вещества, более предпочтительно выполнены из оксида железа, в частности суперпарамагнитного оксида железа или из чистого железа, предоставленного с оксидной пленкой. Такие наночастицы могут нагреваться под действием переменного магнитного поля, предпочтительно при напряженности магнитного поля в диапазоне от 2 до 25 кА/м и при частоте, которая предпочтительно находится в диапазоне от 5 до 5000 кГц. С помощью этого способа возможно нагревание ткани, содержащей наночастицы, более чем до 50°C. Таких высоких температур можно добиться, если опухолевой клеткой будет абсорбировано вплоть до 800 пг железа в форме наночастиц или более. Следовательно, наночастицы не могут покидать целевую область в течение более длительного периода времени, и, таким образом, нагревание может быть приложено к опухоли, к тому же неоднократно, с высокой точностью и без взаимодействия с внешней средой. Нагревание основано на выделении тепла при поступательном и вращательном движении в результате процесса магнитной релаксации, а также потерь гистерезисного тепла.
Наночастицы предпочтительно состоят из оксида железа и, в частности, из магнетита (Fe3O4), маггемита (γ-Fe2O3) или из смесей обоих оксидов. В основном, предпочтительные наночастицы можно определить с помощью формулы FeOx, где x обозначает рациональное число от 1 до 2. Наночастицы характеризуются диаметром предпочтительно менее 500 нм. Наночастицы предпочтительно имеют средний диаметр 15 нм или предпочтительно их диаметр находится в диапазоне от 1 до 200 нм и, в частности, предпочтительно в диапазоне от 5 до 30 нм.
Получение наночастиц без лекарственного средства, а также без покрытия, подробно описано в DE 4428851 A.
По изобретению, помимо магнитных веществ с формулой FeOx, где x представляет собой рациональное число в диапазоне от 1,0 до 2,0, можно использовать вещества с общей формулой MFe2O4, где M = Co, Ni, Mn, Zn, Cd, Ba, или другие ферриты.
Также возможна конфигурация наночастиц с другим металлическим ядром вместо оксида железа. В настоящем документе следует назвать такие металлы, как золото, серебро, платина, медь, кобальт, никель, железо, марганец, самарий, неодимий, иридий, осмий, рутений, родий, палладий или сплавы вышеперечисленных металлов.
Однако также можно получать наночастицы из немагнитного вещества, такого как диоксид кремния (SiO2). Более того, также пригодны частицы из диоксида кремния или полимера, в который внедрены и/или к которому присоединены магнитные вещества, такие как вышеупомянутые магнитные вещества.
Кроме того, можно получать магнитные частицы, на поверхности которых присутствуют химические структуры, такие как антитела, нуклеиновые кислоты, пептиды, аптамеры или другие молекулы, которые обладают способностью к избирательному связыванию с мишенью, что будет увеличивать аффинность частиц к выродившимся клеткам. Такие модификации поверхности увеличивают аффинность к злокачественным клеткам за счет распознавания специфических поверхностных структур на выродившихся клетках. Предпочтительные химические структуры, которые обеспечивают магнитным частицам способность к избирательному связыванию с мишенью, представляют собой, например, поликлональные антитела, моноклональные антитела, гуманизированные антитела, антитела человека, химерные антитела, рекомбинантные антитела, биспецифические антитела, фрагменты антител, аптамеры, Fab-фрагменты, Fc-фрагменты, пептиды, пептидомиметики, олигомеры с пропусками, рибозимы, CpG-олигомеры, дезоксирибозимы, РНК-переключатели, а также липиды.
В предпочтительном варианте осуществления настоящего изобретения между наночастицами и терапевтически активными веществами необязательно могут быть образованы связи. Может иметь место образование связи с лекарственным средством за счет ковалентных или преимущественно ковалентных связей и/или достаточно сильных ионных связей, соединения включения или образования комплексных связей, так что неконтролируемое высвобождение лекарственного средства будет в значительной степени предотвращено. Высвобождение лекарственного средства не под влиянием переменного магнитного поля рассматривается как неконтролируемое высвобождение.
В качестве терапевтически активных веществ могут быть выбраны антипролиферативные, противомиграционные, антиангиогенные, антитромбические, противовоспалительные, антифлогистивные, цитостатические, цитотоксические, противосвертывающие, антибактериальные, противовирусные и/или противогрибковые лекарственные средства, где предпочтительными являются антипролиферативные, противомиграционные, антиангиогенные, цитостатические и/или цитотоксические лекарственные средства, а также нуклеиновые кислоты, аминокислоты, пептиды, белки, углеводы, липиды, гликопротеины, гликаны или липопротеины с антипролиферативными, противомиграционными, антиангиогенными, антитромбическими, противовоспалительными, антифлогистивными, цитостатическими, цитотоксическими, противосвертывающими, антибактериальными, противовирусными и/или противогрибковыми свойствами. Кроме того, эти вещества могут представлять собой радиосенсибилизирующие средства или сенсибилизирующие средства или усиливающие средства для других, также комбинированных, обычных способов лечения злокачественных опухолей, или содержат такие сенсибилизирующие средства.
Алкилирующие средства, антибиотики с цитостатическими свойствами, антиметаболиты, ингибиторы микротрубочек и ингибиторы топоизомеразы, содержащие платину соединения и другие цитостатические средства, такие как аспарагиназа, третиноин, алкалоиды, токсины подофила, таксаны и Милтефозин®, гормоны, иммуномодуляторы, моноклональные антитела, трансдукторы сигналов (молекулы сигнальной трансдукции) и цитокины среди прочих можно использовать в качестве цитотоксических и/или цитостатических соединений, т.е. химических соединений с цитотоксическими и/или цитостатическими свойствами.
В качестве примеров алкилирующих средств среди прочего можно назвать хлорэтамин, циклофосфамид, трофосфамид, ифосфамид, мелфалан, хлорамбуцил, бусульфан, тиотепа, кармустин, ломустин, дакарбазин, прокарбазин, темозоломид, треосульфан, эстрамустин и нимустин.
Примерами антибиотиков с цитостатическими свойствами являются даунорубицин, доксорубицин (адриамицин), дактиномицин, митомицин C, блеомицин, эпирубицин (4-эпи-адриамицин), идарубицин, митоксантрон и амсакрин.
Метотрексат, 5-фторурацил, 6-тиогуанин, 6-меркаптопурин, флударабин, кладрибин, пентостатин, гемцитабин, азатиоприн, ралтитрексед, капецитабин, цитозин-арабинозид, тиогуанин и меркаптопурин могут быть названы в качестве примеров антиметаболитов (антиметаболические лекарственные средства).
Винкристин, винбластин, виндезин, этопозид, а также тенипозид среди прочих принадлежат к классу алкалоидов и токсинов подофила. Кроме того, по изобретению можно использовать содержащие платину соединения. Например, в качестве содержащих платину соединений отмечались цисплатин, карбоплатин и оксаплатин. Например, такие алкалоиды, как алкалоиды барвинка (винкристин, винбластин, виндезин, винорелбин) и таксаны (паклитаксел/Таксол®, паклитаксел и доцетаксел), а также производные паклитаксела принадлежат к ингибиторам микротрубочек. Токсины подофила (этопозид, тенипозид) и алкалоиды камптотеки (камптотецин, топотекан и иринотекан) могут быть приведены в качестве ингибиторов топоизомеразы.
Например, гидрокарбамиды (гидроксимочевина), иматиниб, Милтефозин®, амсакрин, пентостатин, бексаротен, третиноин и аспарагиназа можно рассматривать в качестве других цитостатических лекарственных средств (другие цитостатические средства). Представителями класса моноклональных антител являются трастузумаб (также известен как Герцептин®), алемтузумаб (также известен как Мабкампат®) и ритуксимаб (также известен как Мабтера®).
По изобретению, также такие гормоны, как глюкокортикоиды (преднизон), эстрогены (фосфэстрол, эстрамустин), LHRH (бусерелин, гозерелин, лейпрорелин, трипторелин), флутамид, ципротеронацетат, тамоксифен, торемифен, аминоглютетимид, форместан, эксеместан, летрозол и анастрозол можно использовать. Интерлейкин-2, интерферон-α, интерферон-γ, эритропоэтин, G-CSF, трастузумаб (Герцептин®), ритуксимаб (Мабтера®), гефитиниб (Иресса®), ибритумомаб (Зевалин®), левамизол, а также ретиноиды принадлежат к классам иммуномодуляторов, цитокинов, антител и трансдукторов сигналов.
Вышеупомянутые лекарственные средства могут содержаться вместе с магнитными частицами в патентоспособном медицинском продукте или наноситься на его поверхность. В том случае, когда лекарственное средство за счет ковалентных или ионных связей соединено с магнитными частицами или медицинским продуктом или биоразрушаемым медицинским продуктом, связывание лекарственного средства происходит, например, с участием гидроксигрупп, аминогрупп, карбонильных групп, тиоловых групп, или карбоксильных групп, в зависимости от того, какие функциональные группы несет соответствующее лекарственное средство.
С участием гидроксигрупп предпочтительно образуются сложные эфиры, ацетали или кетали, с участием тиоловых групп предпочтительно образуются тиоловые эфиры, тиоловые ацетали или тиоловые кетали, с участием аминогрупп предпочтительно образуются амиды и отчасти имины (шиффовы основания), с участием карбоксильных групп предпочтительно образуются сложные эфиры или амиды, а с участием карбонильных групп предпочтительно образуются кетали.
Кроме того, предпочтительно, чтобы лекарственное средство или лекарственные средства были связаны с наночастицами или с медицинским продуктом или биоразрушаемым медицинским продуктом не напрямую, а в иммобилизованном виде с помощью линкерной молекулы. Кроме того, известны способы функционализации поверхности наночастицы, так что аминогруппы, гидроксигруппы, карбоксильные группы или карбонильные группы могут быть образованы на поверхности наночастиц известными способами.
Терапевтически активные вещества связаны с наночастицами и/или с медицинским продуктом или с биоразрушаемым медицинским продуктом непосредственно или через линкерную молекулу, предпочтительно через амидную связь или эфирную связь.
Предпочтительны линкеры, которые содержат pH-расщепляемый ацеталь, эфир, гидразоновые или иминовые группы и могут быть расщеплены посредством реакции в кислой среде или ферментативной реакции.
Амидная группа должна быть названа в качестве ферментативно расщепляемой группы в линкерной молекуле или около нее. Группы, расщепляемые под действием температуры или кислоты, содержат, например, фосфатные группы, тиофосфатные группы, сульфатные группы, фосфамидные группы, карбаматные группы или иминогруппы.
Нет необходимости в том, чтобы лекарственное средство было ковалентно связано с линкером или с биоразрушаемым медицинским продуктом, оно может быть связано с помощью ионных или водородных связей или может присутствовать в интеркалированной или координатной форме.
Как описано выше, в патентоспособных медицинских продуктах можно использовать любые магнитные частицы. Примеры таких магнитных частиц описаны в WO 2005 070471 А2, WO 02/43708 A2, US 5411730 A1, WO 2005 042142 A2, WO 03/026618 A1, WO 2005 065282 A2, WO 2006 108405 A2 и WO 2007 019845 A2.
Биоразрушаемые медицинские продукты
После операции на раковой опухоли хирург оставляет внутри организма пациента патентоспособные биоразрушаемые медицинские продукты в форме имплантатов, гелей, тканей, материи, покрытий для ран или пленкообразующих препаратов, а затем закрывает рану.
Патентоспособные биоразрушаемые медицинские продукты служат, в частности, для последующего лечения операционной области с помощью тепла, образующегося при термотерапии, чтобы уничтожить оставшиеся опухолевые клетки и чтобы предотвратить рецидивирование.
Таким образом, патентоспособные биоразрушаемые медицинские продукты состоят из физиологически приемлемых материалов и/или расщепляются на физиологически приемлемые продукты распада и компоненты.
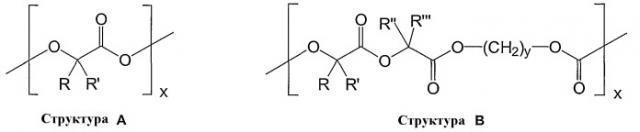
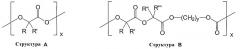
Материалы для патентоспособных медицинских продуктов выбраны из группы, содержащей или состоящей из: полиакриловая кислота, полиакрилат, полиметилметакрилат, полибутилметакрилат, полиизобутилметакрилат, полиакриламид, полиакрилонитрил, полиамид, полиэфирамид, полиэтиленамин, полиимид, поликарбонат, поликарбоуретан, поливинилкетон, поливинилгалогенид, поливинилиденгалогенид, простой поливиниловый эфир, поливиниловые ароматические соединения, сложный поливиниловый эфир, поливинилпирролидон, полиоксиметилен, полиэтилен, полипропилен, политетрафторэтилен, полиуретан, полиолефиновый эластомер, полиизобутилен, EPDM смолы, фторсиликон, карбоксиметилхитозан, полиэтилентерефталат, поливалерат, карбоксиметилцеллюлоза, целлюлоза, вискоза триацетат, вискозы, нитрат целлюлозы, ацетат целлюлозы, гидроксиэтилцеллюлоза, бутират целлюлозы, ацетат-бутират целлюлозы, этилвинилацетатный сополимер, полисульфон, полиэфирсульфон, эпоксидная смола, ABS смолы, EPDM смолы, силиконовый предполимер, силикон, полисилоксан, поливинилгалоген, простой эфир целлюлозы, целлюлозы триацетат, хитозан, производные хитозана, полимеризуемые масла, поливалеролактоны, поли-ε-декалактон, полилактид, полигликолид, сополимеры полилактида и полигликолида, поли-ε-капролактон, полигидроксимасляная кислота, полигидроксибутират, полигидроксивалерат, полигидроксибутират-со-валерат, поли(1,4-диоксан-2,3-дион), поли(1,3-диоксан-2-он), поли-пара-диоксанон, полиангидрид, ангидрид полималеиновой кислоты, полигидроксиметакрилат, полицианоакрилат, поликапролактондиметилакрилат, поли-β-малеиновая кислота, поликапролактонбутилакрилат, многоблочные сополимеры, полученные из олигокапролактондиола и олигодиоксанондиола, полиэфирэфирные многоблочные сополимеры, полученные из ПЭГ и поли(бутилентерефталата), полипивотолактон, триметилкарбонат полигликолевой кислоты, поликапролактон-гликолид, поли(γ-этилглутамат), поли(DTH-иминокарбонат), поли(DTE-со-DT-карбонат), поли(бисфенол A-иминокарбонат), полиортоэфир, триметилкарбонат полигликолевой кислоты, политриметилкарбонат, полииминокарбонат, поливиниловые спирты, полиэфирамиды, гликолидизированные полиэфиры, полифосфоэфиры, полифосфазены, поли[p-карбоксифенокси)пропан], полигидроксивалериановая кислота, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с остатками аминокислот в остове, полиэфирэфиры, полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, каррагинаны, крахмал, коллаген, полимеры на белковой основе, полиаминокислоты, синтетические полиаминокислоты, цеин, модифицированный цеин, полигидроксиалканоаты, пектиновая кислота, актиновая кислота, фибрин, модифицированный фибрин, казеин, модифицированный казеин, карбоксиметилсульфат, альбумин, гиалуроновая кислота, гепарансульфат, гепарин, хондроитина сульфат, декстран, циклодекстрин, сополимеры, полученные из ПЭГ и полипропиленгликоля, аравийская камедь, гуаровая или другие камеде-смолы, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, липоиды, полимеризуемые масла и их модификации, сополимеры и смеси выше указанных веществ.
Вышеуказанные полимеры являются биоразрушаемыми и их можно получать с такими степенью полимеризации и с поперечными связями, которые поддаются биоразрушению.
Под термином «биоразрушаемый» или «биорассасывающийся» понимают, что эти материалы разрушились или будут разрушены на 90 процентов по массе в течение периода от 1 месяца до 12 месяцев, предпочтительно до 6 месяцев, при физиологических условиях.
Предпочтительными биоразрушаемыми полимерами являются полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, полигидроксибутират, полигидроксиметакрилат, полиортоэфиры, гликолированные полиэфиры, поливиниловые спирты, поливинилпирролидон, со