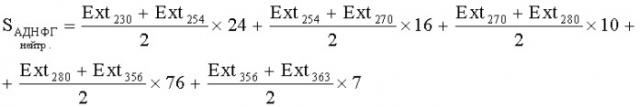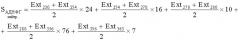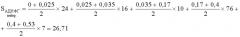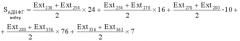Способ комплексной оценки содержания продуктов окислительной модификации белков в тканях и биологических жидкостях
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к биологической химии, и предназначено для более полной оценки окислительной модификации белков (ОМБ) и анализа соотношения альдегид-динитрофенилгидразонов (АДНФГ) и кетон-динитрофенилгидразонов (КДНФГ) основного и нейтрального характера в плазме и клетках крови, а также в тканях животных с целью определения степени выраженности и стадии окислительного стресса. Способ основывается на том, что спектр ОМБ делится на отдельные геометрические фигуры, представляющие собой прямоугольные трапеции. Площадь под кривой спектра окислительной модификации белков складывается из площадей под кривой АДНФГ и КДНФГ основного и нейтрального характера и определяется по формуле. Предложенный способ позволяет не только оценить общее значение ОМБ, определить количество АДНФГ и КДНФГ основного и нейтрального характера, но и сопоставить первичные и вторичные маркеры ОМБ и в результате этого выявить путь нарушения нативной конформации белков. 3 ил., 2 пр.
Реферат
Изобретение относится к медицине, в частности, к биологической химии, и предназначено для более полной оценки окислительной модификации белков (ОМБ) и анализа соотношения альдегид-динитрофенилгидразонов (АДНФГ) и кетон-динитрофенилгидразонов (КДНФГ) основного и нейтрального характера в плазме и клетках крови, а также в тканях животных с целью определения степени выраженности и стадии окислительного стресса.
На сегодняшний день окислительная модификация белков признана одним из наиболее ранних показателей поражения различных тканей организма при свободнорадикальной патологии [1, 4]. Следует отметить, что окислительная деструкция белков рассматривается как один из ранних и стабильных признаков окислительного стресса (ОС). В ранних стадиях окислительного стресса преобладают альдегид-динитрофенилгидразоны (АДНФГ), в поздних стадиях - кетон-динитрофенилгидразоны (КДНФГ) [6].
Определение окисленных групп белков как маркеров ОС имеет ряд преимуществ. Так, карбонильные группы являются химически стабильными соединениями и циркулируют в крови более продолжительный промежуток времени, чем конечные продукты свободнорадикального окисления липидов, например малоновый диальдегид. Окисленные белки подвергаются разрушению в течение часов и дней, в то время как продукты окисления липидов нейтрализуются за считанные минуты [7, 8].
Одним из перспективных направлений в науке стало практическое исследование ОМБ в биологическом материале при патологических состояниях. Результатом окислительной деструкции белков является нарушение нативной структуры белков [4]. Под действием АФК могут происходить два процесса - фрагментация белков, маркерами которой являются АДНФГ, и агрегация белков, маркерами которой являются КДНФГ [5, 6].
Для определения продуктов ОМБ обычно используется метод R.L.Levine в модификации Е.Е.Дубининой, основанный на регистрации 2,4-динитрофенилгидразонов основного и нейтрального характера. Содержание окисленных белков определяют не только в плазме и клетках крови, но и в тканях.
Из данных литературы известно, что для алифатических альдегид-динитрофенилгидразонов нейтрального характера спектр поглощения зарегистрирован в диапазоне 230-558 нм, основного характера - в диапазоне 258-264 и 428-520 нм. Для алифатических кетон-динитрофенилгидразонов нейтрального характера спектр поглощения 363-367 нм, основного характера - 430-434 и 524-535 нм [3].
Анализ ОМБ производится путем сравнения отдельных значений на соответствующих длинах волн. В результате такой оценки накапливается большой фактический материал, демонстрирующий изменение карбонильных производных. Однако полученный материал перегружен числовыми значениями, что затрудняет оценку и анализ полученного материала. Известно, что одним из способов комплексной оценки может быть подсчет площади под кривой, так например, Малаховой М.Я. оценивались результаты содержания в плазме и эритроцитах крови веществ низкой и средней молекулярной массы (ВНиСММ) [2].
Из всего вышеперечисленного следует, что для корректной интерпретации полученных результатов ОМБ требуется разработка метода, позволяющего комплексно оценить и проанализировать значения ОМБ, учитывая стадию окислительного стресса и нарушения конформации белков.
Сущность изобретения заключается в том, что график спектра ОМБ делится на УФ-спектр (100-400 нм) и область видимого света (380-790 нм). В свою очередь, в УФ-спектре регистрируются АДНФГ и КДНФГ нейтрального характера. Следовательно, длины волн 230, 254, 270, 280, 356 нм характеризуют АДНФГ нейтрального характера, а λ=363 нм и λ=370 нм характеризуют КДНФГ также нейтрального характера. Немаловажно отметить, что в области видимого света регистрируются АДНФГ (428 и 430 нм) и КДНФГ (430, 434 нм и 524, 535 нм) основного характера («Характеристика регистрации динитрофенилгидразонов в световом спектре», рис.1).
Поставленная цель достигается тем, что график спектра ОМБ разделяется на сегменты, одни из которых характеризуют первичные маркеры ОС - АДНФГ, а другие характеризуют вторичные маркеры ОС - КДНФГ.
Результат, который может быть получен при осуществлении изобретения, состоит в более полном анализе фактического материала, используя комплексную оценку содержания окисленных продуктов белка.
Это достигается тем, что оценка осуществляется при подсчете площади под кривой спектра окислительной модификации белков.
Учитывая, что «шаг» между длинами волн является величиной непостоянной, то вычислить площадь плоской фигуры с помощью определенного интеграла не представляется возможным. В результате этого возникает необходимость разбить площадь под кривой на отдельные фигуры, которые представляют собой прямоугольные трапеции (рис 1), высота которых будет равна разнице между длинами волн (h=λ2-λ1), а основания равны значениям экстинкции на определенной длине волны, например Extλ1 и Extλ2, выраженные в единицах оптической плотности. Далее полученное значение можно выразить в е.о.п. на мл плазмы, ед.опт.пл. на грамм ткани, ед.опт.пл. на грамм белка для плазмы и тканей органов.
Таким образом, площадь под кривой спектра окислительной модификации белков, которая складывается из площадей под кривой АДНФГ и КДНФГ основного и нейтрального характера, определяется формулой:
S о б м = S А Д Н Ф Г н е й т р . + S А Д Н Ф Г о с н . + S К Д Н Ф Г н е й т р . + S К Д Н Ф Г о с н .
где
S А Д Н Ф Г н е й т р . = E x t 230 + E x t 254 2 × 24 + E x t 254 + E x t 270 2 × 16 + E x t 270 + E x t 280 2 × 10 + + E x t 280 + E x t 356 2 × 76 + E x t 356 + E x t 363 2 × 7
S А Д Н Ф Г о с н . = E x t 428 + E x t 520 2 × 92
S К Д Н Ф Г н е й т р . = E x t 363 + E x t 370 2 × 7 + E x t 370 + E x t 428 2 × 58
S К Д Н Ф Г о с н . = E x t 430 + E x t 434 2 × 4 + E x t 520 + E x t 535 2 × 15
Таким образом, предложенный метод позволяет не только оценить общее значение ОМБ, определить количество АДНФГ и КДНФГ основного и нейтрального характера, но и сопоставить первичные и вторичные маркеры ОМБ и в результате этого выявить путь нарушения нативной конформации белков.
Пример 1
Исследование проводилось на крысе линии Wistar массой 350 г. Животному в течение 10 дней перорально вводили L-аргинин в дозе 500 мг/кг. Содержание и выведение животных из эксперимента осуществляли в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приказ Минздрава СССР №755 от 12.08.1977 г.). После выведения животного из эксперимента из навески ткани почки готовили гомогенат лизосомальной и внелизосомальной фракции. Окислительную модификацию белков определяли во внелизосомальной фракции по методу R.L.Levine в модификации Е.Е.Дубининой.
По полученным значениям экстинкции строится график («Спектр ОМБ под действием L-аргинина в почке крыс», рис.2), далее рассчитывается площадь под полученной кривой.
S А Д Н Ф Г н е й т р . = 0 + 0 2 × 24 + 0 + 0 2 × 24 + 0 + 0 2 × 16 + 0 + 0,015 2 × 76 + 0,015 + 0,02 2 × 7 = 0,6925 S А Д Н Ф Г о с н . = 0,005 + 0,002 2 × 92 = 0,322
S К Д Н Ф Г н е й т р . = 0,02 + 0,02 2 × 7 + 0,02 + 0,005 2 × 58 = 0,865
S К Д Н Ф Г о с н . = 0,01 + 0,015 2 × 4 + 0,006 + 0,01 2 × 15 = 0,125
Sомб=0,6925+0,322+0,865+0,125=2,0045
Полученное значение площади под кривой делится на содержание белка (3,7044 г/л) и окончательное значение выражается в е.о.п./грамм белка.
Общая площадь под кривой ОМБ почки составила 2,0045/3,7044=0,541 е.о.п./грамм белка, из них площадь АДНФГнейтр.=0,187, АДНФГосн=0,087, КДНФГнейтр=0,234, КДНФГосн=0,034 е.о.п./грамм белка.
Содержание первичных маркеров окислительного стресса составило 50,3%, из них на долю АДНФГнеитр приходится 68%, а на долю АДНФГосн - 32%. Из общего количества ОМБ содержание вторичных маркеров составило 49,7%, из них на долю КДНФГнейтр приходится 86%, а на долю КДНФГосн - 14%.
Таким образом, под действием L-аргинина в дозе 500 мг/кг содержание вторичных и первичных маркеров окислительного стресса почти равны.
Пример 2.
Пациентке С.Т.И., 64 года, поставлен диагноз тромбофлебит вен нижних конечностей. Забор крови у пациентки производился утром из локтевой вены натощак в количестве 10 мл. В качестве антикоагулянта использовали ЭДТА. Кровь центрифугировали, плазму снимали и использовали для проведения определения ОМБ по методике Levine R. в модификации Дубининой Е.Е. По полученным значениям экстинкции строится график («Спектр ОМБ в плазме пациента с диагнозом тромбофлебит нижних конечностей», рис.3), далее рассчитывается площадь под полученной кривой.
S А Д Н Ф Г н е й т р . = 0 + 0,025 2 × 24 + 0,025 + 0,035 2 × 16 + 0,035 + 0,17 2 × 10 + 0,17 + 0,4 2 × 76 + + 0,4 + 0,53 2 × 7 = 26,71 S А Д Н Ф Г о с н . = 0,2 + 0,27 2 × 92 = 21,62
S К Д Н Ф Г н е й т р . = 0,53 + 0,195 2 × 7 + 0,195 + 0,2 2 × 58 = 13,9925
S К Д Н Ф Г о с н . = 0,26 + 0,20 2 × 4 + 0,25 + 0,28 2 × 15 = 3,975
Sомб=26,71+21,62+13,9925+3,975=66,2975
Полученное значение площади под кривой ОМБ рассчитано на 0,1 мл плазмы, соответственно на 1 мл плазмы составит 662,975 е.о.п./мл плазмы, из них S А Д Н Ф Г н е й т р . = 267,1 ; S А Д Н Ф Г о с н . = 216,2 ; S К Д Н Ф Г н е й т р . = 139,925 ; S К Д Н Ф Г о с н . = 39,75 е .о .п ./мл плазмы .
Содержание первичных маркеров окислительного стресса плазмы пациентки с диагнозом тромбофлебит нижних конечностей составило 73%, из них на долю АДНФГнейтр приходится 55%, а на долю АДНФГосн - 45%. Из общего количества ОМБ содержание вторичных маркеров составило 27%, из них на долю КДНФГнейтр приходится 78%, а на долю КДНФГосн - 22%.
Таким образом, в плазме пациентки с диагнозом тромбофлебит нижних конечностей значительно преобладают первичные маркеры окислительного стресса, что свидетельствует о фрагментации белковых молекул.
Источники информации
1. Зенков Н.К. Окислительный стресс: биохимический и патофизиологический аспекты / Н.К.Зенков, В.З.Ланкин, Е.Б.Меньшикова. - М.: МАИК, 2001. - 343 с.
2. Малахова М.Я. Эндогенная интоксикация. Методы биохимической регистрации эндогенной интоксикации / М.Я.Малахова // Эфферентная терапия. - Т. 1, №1. - 1995. - С.61-64
3. Окислительная модификация белков сыворотки крови человека. Метод ее определения / Е.Е.Дубинина [и др.] // Вопросы мед. химии, т.41, №1. - 1995. - с.24-26.
4. Окислительная модификация белков: проблемы и перспективы исследования / Л.Е.Муравлева [и др.] // Фундаментальные исследования - 2010. - №1. - С.74-78.
5. Токсикологические последствия окислительной модификации белков при различных патологических состояниях / Ю.И.Губский [и др.] // Современные проблемы токсикологии, т.8, №3. - 2005. - с.20-27.
6. Толочко З.С. Окислительная модификация белков в крови крыс при повреждении капсаицин-чувствительных нервов и изменении уровня оксида азота / 3.С.Толочко, В.К.Спиридонов // Российский физиологический журнал им. И.М. Сеченова. - Т.96, №1. - 2010. - с.77-84.
7. Protein carbonyl groups as biomarkers of oxidative stress / I. Dalle - Donne [et al.] // Pubmed - 2003. - URL:
http://www.ncbi.nlm.nih.gov/pubmed/12589963.
8. Stadtman E.R. Protein oxidation / E.R.Stadtman, R.L.Levine // Annals of N.Y.Academy of Sciences. - Vol.899. - 2000. - P.191-208.
Способ комплексной оценки содержания продуктов окислительной модификации белков в тканях и биологических жидкостях, включающий определение количества карбонильных продуктов, отличающийся тем, что оценку степени окислительной модификации белков (ОМБ) в биологическом материале осуществляют при расчете площади под кривой спектра ОМБ, которая равна сумме площадей альдегид-динитрофенилгидразонов (АДНФГ) и кетон-динитрофенилгидразонов (КДНФГ) нейтрального и основного характера: S омб = S АДНФГ нейтр . + S АДНФГ осн . + S КДНФГ нейтр . + S КДНФГ осн . где S А Д Н Ф Г н е й т р . = E x t 230 + E x t 254 2 × 24 + E x t 254 + E x t 270 2 × 16 + E x t 270 + E x t 280 2 ⋅ 10 + + E x t 280 + E x t 356 2 × 76 + E x t 356 + E x t 363 2 × 7 S А Д Н Ф Г о с н . = E x t 428 + E x t 520 2 × 92 S К Д Н Ф Г н е й т р . = E x t 363 + E x t 370 2 × 7 + E x t 370 + E x t 428 2 × 58 S К Д Н Ф Г о с н . = E x t 430 + E x t 434 2 × 4 + E x t 520 + E x t 535 2 × 15