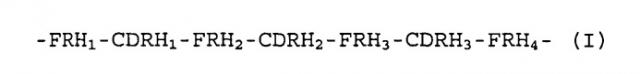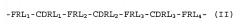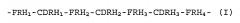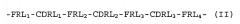Антитело к epha2
Иллюстрации
Показать всеИзобретение относится к области иммунологии, медицины и биотехнологии. Предложены варианты анти-EPHA2 антител. Предложенные антитела связываются с полипептидом, состоящим из аминокислот 426-534 в SEQ ID NO:8. Также описаны гибридомы, продуцирующие такие антитела, и фармацевтические композиции и способы применения таких антител и композиций. Изобретение может быть использовано в медицине. 31 н. и 43 з.п. ф-лы, 14 ил., 14 пр., 1 табл.
Реферат
Область техники
Настоящее изобретение относится к антителу, которое обладает ингибирующим действием по отношению к злокачественной трансформации клеток и/или росту опухолевых клеток. Более конкретно, настоящее изобретение относится к антителу к EPHA2 и фармацевтической композиции, содержащей это антитело.
Предшествующий уровень техники
EPHA2 представляет собой рецепторную тирозинкиназу c молекулярной массой 130 кДа и один трансмембранный домен (Molecular and Cellular Biology, 1990, vol. 10, p. 6316-6324). EPHA2 содержит лигад-связывающий домен и два фибронектиновых домена 3 типа, располагающиеся в N-концевой внеклеточной области, и тирозинкиназный домен, и домен α-мотива стерильности (SAM), располагающиеся в C-концевой внутриклеточной области.
В качестве лигандов EPHA2 известны белки эфрины, от эфрина-A1 до эфрина-А5, заякоренные на плазматической мембране посредством GPI (Annual Review of Neuroscience, 1998, vol. 21, p. 309-345). Связывание лиганда с EPHA2 приводит к активированию тирозинкиназного домена и фосфорилированию остатков тирозина, присутствующих во внутриклеточной области EPHA2, что обеспечивает передачу сигнала внутрь клетки. Также описано, что EPHA2, связанный с лигандом, интернализируется внутрь клетки посредством эндоцитоза и с течением времени расщепляется протеосомой (Molecular Cancer Research, 2002, vol. 1, p. 79-87).
Было описано, что высокая экспрессия EPHA2 клинически проявляется множеством злокачественных опухолей, в частности, раком молочной железы, злокачественной опухолью пищевода, злокачественной опухолью предстательной железы, злокачественной опухолью желудка, немелкоклеточным раком легких, злокачественной опухолью толстого кишечника и мультиформной глиобластомой (Cancer Research, 2001, vol. 61, p. 2301-2306; International Journal of Cancer, 2003, vol. 103, p. 657-663; The Prostate, 1999, vol. 41, p. 275-280; American Journal of Pathology, 2003, vol. 163, p. 2271-2276; Cancer Science, 2005, vol. 96, p. 42-47; Clinical Cancer Research, 2003, vol. 9, p. 613-618; Oncology Reports, 2004, vol. 11, p. 605-611; и Molecular Cancer Research, 2005, vol. 3, p. 541-551). Также описано, что: для злокачественной опухоли пищевода у пациентов с экспрессией EPHA2 существует тенденция к метастазированию опухоли с высокой частотой в региональные лимфоузлы, к большому количеству метастазов в лимфоузлах и к низкой степени дифференцировки опухоли, и к низкому показателю выживаемости в течение пяти лет (International Journal of Cancer, 2003, vol. 103, p. 657-663); в случае немелкоклеточного рака легких у пациентов с повышенной экспрессией EPHA2 имеется тенденция к низким показателям безрецидивной выживаемости и к подверженности рецидивам, в частности, метастазам в головной мозг (Clinical Cancer Research, 2003, vol. 9, p. 613-618); а в случае злокачественной опухоли толстого кишечника, у пациентов с экспрессией EPHA2 существует тенденция к появлению метастазов в печени, к инвазии опухоли в лимфатические сосуды и к метастазированию в лимфоузлы, и многие пациенты с поздней клинической стадией злокачественной опухоли являются положительными по экспрессии EPHA2 (Oncology Reports, 2004, vol. 11, p. 605-611).
Кроме того, описано, что при введении генов EPHA2 в клетки, незлокачественные клетки приобретают фенотип злокачественных опухолей, такой как способность к свободному росту клеток, способность к образованию тубулярных структур в матриксе и способность к росту клеток in vivo (Cancer Research, 2001, vol. 61, p. 2301-2306), и злокачественные клетки обладают повышенной инвазивностью во внеклеточном матриксе (Biochemical and Biophysical Research Communications, 2004, vol. 320, p. 1096-1102; и Oncogene, 2004, vol. 23, p. 1448-1456). Кроме того, описано, что: инвазивность или свободный рост клеток злокачественной опухоли и рост опухоли in vivo ингибируются посредством выключения экспрессии EPHA2, используя миРНК (Oncogene, 2004, vol. 23, p. 1448-1456; и Cancer Research, 2002, vol. 62, p. 2840-2847); а инвазивность, свободный рост и способность злокачественных клеток к образованию тубулярных структур ингибируются посредством активирования EPHA2, используя в виде слитых белков его лиганд эфрин-A1 и Fc-область IgG человека и таким образом, вызывая деградацию EPHA2 посредством эндоцитоза (Cancer Research, 2001, vol. 61, p. 2301-2306; Molecular Cancer Research, 2005, vol. 3, p. 541-551; и Biochemical and Biophysical Research Communications, 2004, vol. 320, p. 1096-1102).
С другой стороны, описано, что EPHA2 экспрессируется не только в злокачественных клетках, но также в пределах опухолей или в окружающих их кровеносных сосудах (Oncogene, 2000, vol. 19, p. 6043-6052). Описано, что у мышей сигналы EPHA2 участвуют в ангиогенезе, индуцированном эфрином-A1 и, в частности, EPHA2, экспрессирующийся в сосудистых эндотелиальных клетках, необходим для образования сосуда или выживания сосудистых эндотелиальных клеток (Journal of Cell Science, 2004, vol. 117, p. 2037-2049). Также описано, что слитые белки внеклеточной области EPHA2 и Fc-области IgG человека ингибируют ангиогенез in vivo и демонстрируют противоопухолевый эффект (Oncogene, 2002, vol. 21, p. 7011-7026).
Моноклональные антитела пригодны не только в качестве диагностических лекарственных средств, но также в виде терапевтических лекарственных средств. Моноклональные антитела, активно используют, в частности, при лечении злокачественных опухолей, и моноклональные антитела к рецепторным тирозинкиназам, таким как HER2 и EGFR или к внеклеточным областям CD20, используют при лечении злокачественных опухолей и они демонстрируют превосходный эффект (The New England Journal of Medicine, 2007, vol. 357, p. 39-51; Oncogene, 2007, vol. 26, p. 3661-3678; и Oncogene, 2007, vol. 26, p. 3603-3613). Механизм действия моноклональных антител, используемых при лечении злокачественных опухолей, включает индукцию апоптоза и ингибирование сигналов роста. Кроме того, считается, что очень важную роль также играет их действие, опосредованное через иммунный ответ, такой как ADCC или CDC. Действительно, описано, что при введении антител к HER2 (трастузумаб) или антител к CD20 (ритуксимаб), они оказывают более слабое противоопухолевое действие на ксенотрансплантаты голых мышей (nude), которые дефектны по FcγR, необходимому для индукции ADCC, по сравнению с голыми мышами без дефекта по FcγR (Nature Medicine, 2000, vol. 6, p. 443-446). Так же описано, что антитела к CD20 (ритуксимаб), при введении антител, оказывают более слабое противоопухолевое действие на мышей с недостаточностью комплемента, которая вызвана введением яда кобры, по сравнению с мышами без недостаточности комплемента (Blood, 2004, vol. 103, p. 2738-2743).
Для EPHA2 описано, что агонистические моноклональные антитела к EPHA2 с активностью индукции фосфорилирования остатков тирозина EPHA2 и активностью индукции деградации EPHA2 также как и лиганды ингибируют способность к свободному росту клеток линии рака молочных желез и способность клеток формировать тубулярные структуры во внеклеточном матриксе (Cancer Research, 2002, vol. 62, p. 2840-2847). Также описано, что агонистические моноклональные антитела к EPHA2, которые распознают эпитоп на EPHA2, выявляемый чаще в злокачественных клетках, чем в незлокачественных клетках, и обладают активностью индукции фосфорилирования остатков тирозина EPHA2 и активностью индукции деградации EPHA2, проявляют противоопухолевое действие in vivo (Cancer Research, 2003, vol. 63, p. 7907-7912; и заявка WO 03/094859). С другой стороны, у Kiewlich et al. описано, что их моноклональные антитела к EPHA2 обладали активностью индукции фосфорилирования остатков тирозина EPHA2 и активностью индукции деградации EPHA2, но не имели противоопухолевого действия in vivo (Neoplasia, 2006, vol. 8, p. 18-30).
Кроме того, в заявке WO 2006/084226 описаны моноклональные антитела к EPHA2 LUCA19, SG5, LUCA40 и SPL1, полученные посредством иммунизации мышей злокачественными клетками и описано, что среди этих антител: LUCA19 и SG5 не влияют на фосфорилирование остатков тирозина EPHA2; LUCA40 ингибирует рост злокачественных клеток in vitro; а LUCA19, SG5, и LUCA40 интернализируются внутрь злокачественных клеток в присутствие антитела к антителам мыши, меченого токсином (сапорином). В документе также описано, что LUCA40 и SPL1 проявляют противоопухолевое действие in vivo. Однако остается невыясненным обладают ли эти антитела агонистической активностью или нет.
Несмотря на эти исследования, все еще неизвестным является эпитоп для антитела к EPHA2, которое проявляет противоопухолевое действие in vivo. Ранее не было нигде описано, что определенная аминокислотная последовательность во внеклеточной области EPHA2 пригодна в качестве эпитопа для моноклонального антитела, предназначенного для противораковой терапии.
Даже антитела к одним и тем же антигенам отличаются по своим свойствам, в зависимости от различий в эпитопах или в своих последовательностях. Кроме того, вследствие этого различия в своих свойствах, антитела, при введении людям, будут вызывать различный клинический ответ относительно эффективности действия лекарственного средства, частоте терапевтического ответа, побочных эффектов, частоте проявления устойчивости к лекарственному средству и т.д.
Таким образом, лекарственное средство с лучшими клиническими свойствами также может отличаться в зависимости от пациента. Во многих случаях, такие свойства являются неизвестными до фактического введения лекарственного средства. Таким образом, крайне необходимо разработать лекарственное средство с новым механизмом действия. Также крайне необходимо разработать антитело к EPHA2, обладающее свойствами, отличающимися от свойств традиционных антител.
Описание изобретения
Задачи, подлежащие решению посредством изобретения
Целью настоящего изобретения является разработка антитела к EPHA2.
Дополнительной целью настоящего изобретения является разработка фармацевтической композиции и т.п., содержащей антитело к EPHA2, обладающее терапевтическим действием на злокачественную опухоль.
Дополнительной целью настоящего изобретения является разработка способа получения антитела.
Дополнительной целью настоящего изобретения является разработка способа ингибирования роста опухоли, с использованием антитела и т.д.
Средства решения задач
Авторы настоящего изобретения провели необходимые исследования для достижения целей и таким образом успешно получили новое моноклональное антитело к EPHA2, которое не обладает активностью индуцирования фосфорилирования остатков тирозина EPHA2 и обладает активностью ADCC и активностью CDC по отношению к злокачественным клеткам, экспрессирующим EPHA2. Кроме того, авторы настоящего изобретения исследовали эпитоп для этого антитела и в результате впервые обнаружили, что антитело, которое связывается с областью, включающей два домена фибронектина 3 типа, представленные в EPHA2, С-концевой домен, обладает превосходной противоопухолевой активностью in vivo. Настоящее изобретение выполнено на основе этих открытий.
Конкретно настоящее изобретение включает:
(1) антитело, распознающее эпитоп, который распознается антителом, продуцируемым гибридомой SH348-1 (FERM BP-10836);
(2) антитело по (1), где антитело обладает следующими свойствами a)-d):
a) не обладает способностью к фосфорилированию остатков тирозина EPHA2;
b) обладает активностью ADCC по отношению к клеткам, экспрессирующим EPHA2;
c) обладает активностью CDC по отношению к клеткам, экспрессирующим EPHA2; и
d) обладает противоопухолевой активностью in vivo;
(3) антитело по (1), где антитело обладает следующими свойствами a)-e):
a) не обладает способностью к фосфорилированию остатков тирозина EPHA2;
b) демонстрирует эффект снижения уровня белка EPHA2;
c) обладает активностью ADCC по отношению к клеткам, экспрессирующим EPHA2;
d) обладает активностью CDC по отношению к клеткам, экспрессирующим EPHA2; и
e) обладает противоопухолевой активностью in vivo;
(4) антитело, которое специфично связывается с полипептидом, состоящим из последовательности аминокислот, соответствующей аминокислотам с No. от 426 до 534 в SEQ ID NO: 8 в списке последовательностей;
(5) антитело, которое специфично связывается с полипептидом, состоящим из последовательности аминокислот, соответствующей аминокислотам с No. от 426 до 534 в SEQ ID NO: 8 в списке последовательностей и обладает следующими свойствами, от a) до d):
a) не обладает способностью к фосфорилированию остатков тирозина EPHA2;
b) обладает активностью ADCC по отношению к клеткам, экспрессирующим EPHA2;
c) обладает активностью CDC по отношению к клеткам, экспрессирующим EPHA2; и
d) обладает противоопухолевой активностью in vivo;
(6) антитело, которое специфическим образом связывается с пептидом, состоящим из последовательности аминокислот, соответствующей аминокислотам с No. от 426 до 534 в SEQ ID NO: 8 в списке последовательностей и обладает следующими свойствами, от a) до е):
a) не обладает способностью к фосфорилированию остатков тирозина EPHA2;
b) демонстрирует эффект снижения уровня белка EPHA2;
c) обладает активностью ADCC по отношению к клеткам, экспрессирующим EPHA2;
d) обладает активностью CDC по отношению к клеткам, экспрессирующим EPHA2; и
e) обладает противоопухолевой активностью in vivo;
(7) антитело по любому из (1)-(6), где антитело специфическим образом связывается с пептидом, состоящим из последовательности аминокислот, соответствующей аминокислотам с No. 439 до 534 в SEQ ID NO: 8 в списке последовательностей;
(8) антитело по любому из (1)-(7), где антитело ингибирует фосфорилирование остатков тирозина EPHA2, индуцированное лигандом EPHA2;
(9) антитело по любому из (1)-(7), где антитело не ингибирует связывание лиганда EPHA2 с EPHA2, но ингибирует фосфорилирование остатков тирозина EPHA2, индуцированное лигандом EPHA2;
(10) антитело, которое специфично связывается с полипептидом, состоящем из аминокислотной последовательности, соответствующей SEQ ID NO: 8 в списке последовательностей, где антитело имеет аминокислотные последовательности, соответствующие SEQ ID No: 59, 61 и 63 в списке последовательностей или аминокислотные последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотных последовательностях в качестве участков, определяющих комплементарность в вариабельной области тяжелой цепи и антитело имеет аминокислотные последовательности, соответствующие SEQ ID No: 65, 67 и 69 в списке последовательностей, или аминокислотные последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотных последовательностях, в качестве участков, определяющих комплементарность в вариабельной области легкой цепи;
(11) антитело, которое специфично связывается с полипептидом, состоящим из последовательности аминокислот, представленных в SEQ ID NO: 8 в списке последовательностей, характеризующееся следующим 1) и 2):
1) имеющее пептид тяжелой цепи, содержащий последовательность аминокислот, представленную общей формулой (I):
-FRH1-CDRH1-FRH2-CDRH2-FRH3-CDRH3-FRH4-(I)
где FRH1 обозначает произвольно выбранную аминокислотную последовательность, содержащую от 18 до 30 аминокислот; CDRH1 обозначает аминокислотную последовательность, соответствующую SEQ ID NO: 59 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; FRH2 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 14 аминокислот; CDRH2 обозначает аминокислотную последовательность, соответствующую SEQ ID NO: 61 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; FRH3 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 32 аминокислот; CDRH3 обозначает аминокислотную последовательность, соответствующую SEQ ID NO: 63 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; и FRH4 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 11 аминокислот, где эти аминокислоты связаны друг с другом пептидными связями; и
2) имеющее полипептид легкой цепи, содержащий аминокислотную последовательность, представленную общей формулой (II):
-FRL1-CDRL1-FRL2-CDRL2-FRL3-CDRL3-FRL4-(II)
где FRL1 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 23 аминокислот; CDRL1 обозначает аминокислотную последовательность, соответствующую SEQ ID NO: 65 в списке последовательностей, или аминокислотную последовательность с делеций, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; FRL2 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 15 аминокислот; CDRL2 обозначает аминокислотную последовательность, соответствующую SEQ ID NO: 67 в списке последовательностей; FRL3 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 32 аминокислот; CDRL3 обозначает аминокислотную последовательность, соответствующую SEQ ID NO: 69 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; и FRL4 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 10 аминокислот, где эти аминокислоты связаны друг с другом посредством пептидных связей;
(12) антитело, которое распознает эпитоп, распознаваемый антителом, продуцируемым гибридомой SH357-1 (FERM BP-10837);
(13) антитело по (12), где антитело обладает следующими свойствами, представленными от a) до d):
a) не обладает способностью к фосфорилированию остатков тирозина EPHA2;
b) обладает активностью ADCC по отношению к клеткам, экспрессирующим EPHA2;
c) обладает активностью CDC по отношению к клеткам, экспрессирующим EPHA2; и
d) обладает противоопухолевой активностью in vivo;
(14) антитело, которое специфическим образом связывается с пептидом, состоящим из последовательности аминокислот, соответствующей аминокислотам с No. 426 до 534 в SEQ ID NO: 8 в списке последовательностей и обладающее следующими свойствами, от a) до e):
a) не обладает способностью к фосфорилированию остатков тирозина EPHA2;
b) не демонстрирует эффект снижения уровня белка EPHA2;
c) обладает активностью ADCC по отношению к клеткам, экспрессирующим EPHA2;
d) обладает активностью CDC по отношению к клеткам, экспрессирующим EPHA2; и
e) обладает противоопухолевой активностью in vivo;
(15) антитело по любому из (12)-(14), где антитело специфическим образом связывается с пептидом, состоящим из последовательности аминокислот, соответствующей аминокислотам с No. от 439 до 534 в SEQ ID NO: 8 в списке последовательностей;
(16) антитело по любому из (12)-(15), где антитело ингибирует фосфорилирование остатков тирозина EPHA2, индуцированное лигандом EPHA2;
(17) антитело по любому из (12)-(15), где антитело не ингибирует связывание лиганда EPHA2 с EPHA2, но ингибирует фосфорилирование остатков тирозина EPHA2, индуцированное лигандом EPHA2;
(18) антитело, которое специфическим образом связывается с полипептидом, состоящим из аминокислотной последовательности, представленной в SEQ ID NO: 8 в списке последовательностей, где антитело имеет аминокислотные последовательности, соответствующие SEQ ID No: 71, 73 и 75 в списке последовательностей, или аминокислотные последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотных последовательностях, в виде участков, определяющих комплементарность в вариабельной области тяжелой цепи и где антитело имеет аминокислотные последовательности, соответствующие SEQ ID No: 77, 79 и 81 в списке последовательностей, или аминокислотные последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотных последовательностях, в виде участков, определяющих комплементарность в вариабельной области легкой цепи;
(19) антитело, которое специфично связывается с полипептидом, состоящим из последовательности аминокислот, соответствующим SEQ ID NO: 8 в списке последовательностей, характеризующееся следующим 1) и 2):
1) имеющее пептид тяжелой цепи, содержащий последовательность аминокислот, представленную общей формулой (I):
-FRH1-CDRH1-FRH2-CDRH2-FRH3-CDRH3-FRH4-(I)
где FRH1 обозначает произвольно выбранную аминокислотную последовательность, содержащую от 18 до 30 аминокислот; CDRH1 обозначает аминокислотную последовательность, соответствующую SEQ ID NO: 71 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; FRH2 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 14 аминокислот; CDRH2 обозначает аминокислотную последовательность представленную в SEQ ID NO: 73 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; FRH3 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 32 аминокислот; CDRH3 обозначает аминокислотную последовательность представленную в SEQ ID NO: 75 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; и FRH4 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 11 аминокислоты, где эти аминокислоты связаны друг с другом посредством пептидных связей; и
2) имеющее полипептид легкой цепи, содержащий аминокислотную последовательность, представленную общей формулой (II):
-FRL1-CDRL1-FRL2-CDRL2-FRL3-CDRL3-FRL4-(II)
где FRL1 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 23 аминокислоты; CDRL1 обозначает аминокислотную последовательность, соответствующую SEQ ID NO: 77 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; FRL2 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 15 аминокислот; CDRL2 обозначает аминокислотную последовательность представленную в SEQ ID NO: 79 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; FRL3 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 32 аминокислот; CDRL3 обозначает аминокислотную последовательность представленную в SEQ ID NO: 81 в списке последовательностей или аминокислотную последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотной последовательности; и FRL4 обозначает произвольно выбранную аминокислотную последовательность, состоящую из 10 аминокислот, где эти аминокислоты связаны друг с другом посредством пептидных связей;
(20) антитело по любому из (1)-(19), характеризующееся тем, что антитело представляет собой гуманизированное антитело;
(21) антитело по любому из (1)-(19), характеризующееся тем, что антитело представляет собой антитело человека;
(22) антитело по любому из (1)-(19), характеризующееся тем, что антитело представляет собой антитело IgG;
(23) антитело по любому из (1)-(9) и (12)-(17), характеризующееся тем, что антитело представляет собой любое, выбранное из Fab, F(ab')2, Fv, scFv, диатела, линейного антитела и полиспецифического антитела;
(24) антитело, продуцируемое гибридомой SH348-1 (FERM BP-10836);
(25) антитело, продуцируемое гибридомой SH357-1 (FERM BP-10837);
(26) антитело, содержащее следующее 1) и 2):
1) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 119 в SEQ ID NO: 35 в списке последовательностей или полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 119 в SEQ ID NO: 39 в списке последовательностей; и
2) полипептид легкой цепи, содержащий последовательность аминокислот, соответствующую аминокислотам с No. от 1 до 112 в SEQ ID NO: 37 в списке последовательностей или полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 112 в SEQ ID NO: 41 в списке последовательностей;
(27) антитело, содержащее следующие 1) или 2):
1) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 119 в SEQ ID NO: 35 в списке последовательностей и полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 112 в SEQ ID NO: 37 в списке последовательностей; и
2) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 119 в SEQ ID NO: 39 в списке последовательностей и полипептид легкой цепи, содержащий аминокислотную последовательность соответствующую аминокислотам с No. от 1 до 112 в SEQ ID NO: 41 в списке последовательностей;
(28) антитело, содержащее следующие 1) и 2):
1) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую SEQ ID NO: 35 в списке последовательностей или полипептид тяжелой цепи, содержащий аминокислотная последовательность, соответствующую SEQ ID NO: 39 в списке последовательностей; и
2) полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую SEQ ID NO: 37 в списке последовательностей или полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую SEQ ID NO: 41 в списке последовательностей;
(29) антитело, содержащее следующие 1) или 2):
1) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую SEQ ID NO: 35 в списке последовательностей и полипептид легкой цепи, содержащий аминокислотную последовательность представленную в SEQ ID NO: 37 в списке последовательностей; и
2) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую SEQ ID NO: 39 в списке последовательностей и полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую SEQ ID NO: 41 в списке последовательностей;
(30) антитело, полученное посредством гуманизации антитела по любому из (24)-(29);
(31) антитело, содержащее следующие 1) и 2):
1) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 107 в списке последовательностей или полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 115 в списке последовательностей; и
2) полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 91 в списке последовательностей или полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 99 в списке последовательностей;
(32) антитело, содержащее следующие 1) или 2):
1) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 107 в списке последовательностей и полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 91 в списке последовательностей; и
2) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 115 в списке последовательностей и полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 99 в списке последовательностей;
(33) антитело, содержащее следующие 1) и 2):
1) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 139 в списке последовательностей или полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 147 в списке последовательностей; и
2) полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 123 в списке последовательностей или полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 131 в списке последовательностей;
(34) антитело, содержащее следующие 1) или 2):
1) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 139 в списке последовательностей и полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 123 в списке последовательностей; и
2) полипептид тяжелой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 147 в списке последовательностей и полипептид легкой цепи, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 131 в списке последовательностей;
(35) A Fab, F(ab')2, Fv, scFv, диатело, линейное антитело или полиспецифическое антитело, полученные из антител по любому из (24)-(34);
(36) любой один полипептид, выбранный из группы, состоящей из следующих 1)-20):
1) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 119 в SEQ ID NO: 35 в списке последовательностей;
2) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 119 в SEQ ID NO: 39 в списке последовательностей;
3) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 112 в SEQ ID NO: 37 в списке последовательностей;
4) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 1 до 112 в SEQ ID NO: 41 в списке последовательностей;
5) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 107 в списке последовательностей;
6) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 115 в списке последовательностей;
7) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 138 в SEQ ID NO: 107 в списке последовательностей;
8) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 138 в SEQ ID NO: 115 в списке последовательностей;
9) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 91 в списке последовательностей;
10) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 99 в списке последовательностей;
11) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 134 в SEQ ID NO: 91 в списке последовательностей;
12) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 134 в SEQ ID NO: 99 в списке последовательностей;
13) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 139 в списке последовательностей;
14) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 468 в SEQ ID NO: 147 в списке последовательностей;
15) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 138 в SEQ ID NO: 139 в списке последовательностей;
16) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 20 до 138 в SEQ ID NO: 147 в списке последовательностей;
17) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 123 в списке последовательностей;
18) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 239 в SEQ ID NO: 131 в списке последовательностей;
19) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 134 в SEQ ID NO: 123 в списке последовательностей; и
20) полипептид, содержащий аминокислотную последовательность, соответствующую аминокислотам с No. от 21 до 134 в SEQ ID NO: 131 в списке последовательностей;
(37) мышиная гибридома SH348-1 (FERM BP-10836);
(38) мышиная гибридома SH357-1 (FERM BP-10837);
(39) Фармацевтическая композиция, характеризующаяся тем, что она содержит по меньшей мере одно антитело, выбранное из антител по (1)-(35);
(40) Фармацевтическая композиция для лечения злокачественных опухолей, характеризующаяся тем, что она содержит по меньшей мере одно антитело, выбранное из антител по (1)-(35);
(41) Способ ингибирования роста опухоли у млекопитающего, где способ включает введение любого антитела, выбранного из группы, состоящей из антител по (1)-(35), (39) и (40);
(42) Способ ингибирования роста опухоли по (41), характеризующийся тем, что опухоль представляет собой опухоль, экспрессирующую EPHA2;
(43) Полинуклеотид, кодирующий антитело или полипептид по любому из (1)-(36);
(44) Клетка-хозяин, трансформированная полинуклеотидом по (43); и
(45) Способ получения антитела с использованием клетки-хозяина по (44).
Преимущества изобретения
В настоящем изобретении успешно получено новое моноклональное антитело к EPHA2, которое не обладает активностью индукции фосфорилирования остатков тирозина EPHA2 и обладает активностью ADCC и активностью CDC по отношению к злокачественным клеткам, экспрессирующим EPHA2. Кроме того, обнаружено, что антитело обладает великолепной противоопухолевой активностью in vivo.
Кроме того, разработана фармацевтическая композиция для лечения злокачественных опухолей, содержащая это антитело.
Краткое описание рисунков
Фиг.1 представляет собой рисунок, демонстрирующий результаты Вестерн-блоттинга, демонстрирующие наличие или отсутствие активности индукции посредством антитела к EPHA2 фосфорилирования остатков тирозина EPHA2. Фиг.1A) представляет собой рисунок, демонстрирующий результаты, полученные в отсутствие перекрестно-связывающего антитела, где в верхней части показаны результаты для антитела 4G10, а в нижней части показаны результаты для антитела к EPHA2 (D7). На фиг.1B) представлен рисунок, на котором показаны результаты, полученные в присутствие перекрестно-связывающего антитела, где в верхней части представлены результаты для антитела 4G10, а в нижней части показаны результаты для антитела к EPHA2 (D7);
На фиг.2 представлен рисунок, на котором показаны результаты Вестерн-блоттинга, показывающие наличие или отсутствие активности индукции снижения уровня белка EPHA2 посредством антитела к EPHA2. На фиг.2A) представлен рисунок, на котором показаны результаты, полученные в отсутствие перекрестно-связывающего антитела, где в верхней части показаны результаты для антитела к EPHA2 (D7), а в нижней части показаны результаты для антитела к β-актину. На фиг.2B) представлен рисунок, на котором показаны результаты, полученные в присутствие перекрестно-связывающего антитела, где в верхней части представлены результаты для антитела к EPHA2 (D7), а в нижней части показаны результаты для антитела к β-актину;
На фиг.3 представлены графики, показывающие наличие или отсутствие у антитела к EPHA2 активности ADCC по отношению к различным клеточным линиям. На графике "**" обозначает значение P<0,01, а "***" обозначает значение P<0,001. На фиг.3A) представлен график, на котором показана активность ADCC по отношению к клеткам MDA-MB-231. На фиг.3B) представлен график, на котором показана активность ADCC по отношению к клеткам A549. На фиг.3С) представлен график, на котором показана активность ADCC по отношению к клеткам PC-3;
На фиг.4 представлены графики, на которых показано наличие или отсутствие CDC активности антитела к EPHA2 по отношению к различным клеткам. На графике "***" обозначает значение P<0,001. На фиг.4A) представлен график, на котором показана активность CDC SH348-1 по отношению к клеткам MDA-MB-231. На фиг.4B) представлен график, на котором показана активность CDC SH348-1 по отношению к клеткам A549. На фиг.4С) представлен график, на котором показана активность CDC SH348-1 по отношению к клеткам PC-3. На фиг.4D) представлен график, на котором показана активность CDC SH357-1 по отношению к клеткам MDA-MB-231. На фиг.4E) представлен график, на котором показана активность CDC SH357-1 по отношению к клеткам A549. На фиг.4F) представлен график, на котором показана активность CDC SH357-1 по отношению к клеткам PC-3;
На фиг.5A) представлен рисунок, на котором показан расчет доменной структуры EPHA2 и положений EPHA2-ECD, FNIII-NC, FNIII-N и FNIII-C в EPHA2, которые представ