Способ экспансии мононуклеарных клеток пуповинной крови (пкмнк) ex vivo в присутствии мультипотентных стромальных мезенхимальных клеток (ммск)
Иллюстрации
Показать всеИзобретение относится к биотехнологии и медицине. Предложен способ экспансии мононуклеарных клеток пуповинной крови (пкМНК) ex vivo в присутствии мультипатентных мезенхимальных клеток (ММСК), включающий культивирование ММСК из стромально-васкулярной фракции жировой ткани до достижения монослоя при концентрации O2 в среде 5%, добавление суспензии пкМНК к монослою ММСК, культивирование в течение 72 часов при концентрации O2 в среде 5%, отбор неприкрепленных пкМНК и замену среды, продолжение культивирования ММСК с прикрепившимися к ним пкМНК в течение 7 дней при концентрации O2 в среде 5%. Изобретение может быть использовано при получении культур стволовых клеток для нужд регенеративной медицины. 3 ил., 3 табл., 1 пр.
Реферат
Изобретение относится к биотехнологии, медицине и может быть использовано при получении культур гемопоэтических стволовых клеток для различных целей.
В настоящее время перспективность использования гемопоэтических стволовых и прогениторных клеток (ГСК), экспансия которых проведена ex vivo, для нужд медицины, в первую очередь, для пациентов с онкогематологическими заболеваниями, ни у кого не вызывает сомнения. Однако получение таких клеток из костного мозга является сложной и травматичной процедурой, что делает поиск адекватной замены ГСК весьма актуальным.
Одним из перспективных источников ГСК является пуповинная кровь, в которой мульти- и бипотентных гемопоэтических предшественников больше, чем в костном мозге взрослого человека (.Mayani et al., 1998). На сегодняшний день в мире сделано уже более 20000 трансплантаций мононуклеарных клеток пуповинной (пкМНК) крови пациентам с различными видами гематологических и генетических заболеваний, большая часть из которых дети. Среди преимуществ пкМНК следует отметить легкость и безопасность сбора, доступность при хранении в криобанках и относительно низкая реакция трансплантата против хозяина. Хотя фракция мононуклеаров пуповинной крови содержит большее количество гемопоэтических клеток с большей пролиферативной способностью, ее применение ограничено недостаточным объемом клеток. Для успешного приживления необходимо не менее 3*107 ядросодержащих клеток или 1*105 CD34+ ранних недифференцированных предшественников на килограмм веса реципиента (Rocha et al., 2001; Wagner et al., 2002; van Heeckeren et al., 2007). Недостаточное количество трансплантата угрожает увеличением времени приживления, возможностью появления осложнений и даже летальным исходом. Используют различные клинические и доклинические способы преодоления этого недостатка: введение 2 единиц пуповинной крови (Barker et al., 2003), совместное введение с CD34+ клетками мононуклеаров периферической крови (Fernandez et al., 2003), экспансия гемопоэтических клеток ex vivo до введения. Для культивирования используются как исходные мононуклеарные клетки (костного мозга или пуповинной крови), так и обогащенная CD34+ клетками популяция. Экспансия может проводиться суспензионной культуре с добавлением гемопоэтиновых коктейлей (содержащих цитокины, стимулирующие гемопоэз), обеспечивающих самообновление и пролиферацию примитивных гемопоэтических предшественников в статическом режиме или в проточных биореакторах. В качестве гемопоэтинов обычно используют SCF, IL-3, IL-6, ТРО, G-CSF, Flt-3 (ligand). Второй вариант - это сокультура с стромальными компонентами, в частности с мультипотентными мезенхимальными клетками (ММСК), что позволяет моделировать условия гемопоэтического микроокружения. В среду культивирования при этом также добавляются экзогенные гемопоэтиновые коктейли (Robinson et al., 2007).
Показано, что при использовании фракции, обогащенной CD34+ клетками, удается добиться лучшего результата при дальнейшей ex vivo экспансии гемопоэтических клеток (Briddell et al., 1997; Петевка и др., 2012), однако, при проведении предварительных процедур, в частности иммуноселекции, часть и так немногочисленных гемопоэтических клеток пуповинной крови теряется (Koller et al., 1995).
Таким образом, задача разработки подходов для более эффективной и физиологически обоснованной экспансии гемопоэтических клеток по-прежнему остается одной из наиболее значимых в области клеточной терапии и регенеративной медицины. Важно отметить, что условия культивирования, позволяющие оптимальным образом моделировать условия гемопоэтического микроокружения, являются весьма существенными для проведения качественной экспансии ex vivo.
Большая часть такого рода исследований до недавнего времени проводилась на стромальных и гемопоэтических предшественниках, выделенных из костного мозга (Arai & Suda, 2007; Valtieri & Sorrentino, 2008). Именно на костномозговых клетках были изучены основные закономерности ex vivo взаимодействия ГСК и основного клеточного компонента их микроокружения - ММСК (см. обзор Valtieri & Sorrentino, 2008).
В качестве стромальных подслоев, кроме ММСК из костного мозга, используются в настоящее время как первичные культуры ММСК (из жировой ткани, пуповинной крови, мобилизованной крови взрослого человека) (Wagner et al., 2005), так и линейные стромальные клетки различного происхождения, например AFT024 (Wagner et al., 2005), MS-5 (Berardi et al., 1997). Среди альтернативных источников ММСК наиболее привлекательными являются клетки стромально-васкулярной фракции жировой ткани, т.к. они могут быть легко и в достаточном количестве извлечены из ткани пациента.
Одним из важнейших факторов, регулирующих метаболизм кроветворного микроокружения и самих гемопоэтических стволовых и прогениторных клеток в костном мозге, является концентрация O2. В нескольких работах, посвященных изучению влияния пониженного содержания кислорода на экспансию ГСК в средах без фидера, показано, что гипоксия вызывает существенные изменения в популяции ГСК (Cipolleschi et al., 1993). Преимущественное поддержание жизнеспособности и пролиферации недифференцированных ГСК в условиях гипоксии, по сравнению с коммитированными предшественниками, было также показано и в других исследованиях (Koller et al., 1992; Danet et al., 2003; Ivanovic et al., 2002; 2004).
Что касается ММСК, то для них значения 20% O2 в среде культивирования также значительно превышают значения O2 в их физиологическом окружении. В ряде исследований, в том числе проведенных и в нашей лаборатории, показано, что культивирование при пониженном содержании кислорода существенным образом меняет свойства стромальных клеток. В частности, культивирование ММСК, выделенных из костного мозга, в условиях пониженного O2, приводило к увеличению их пролиферативной активности и жизнеспособности и модификации их дифференцировочных потенций (Буравкова и Анохина, 2007; Жамбалова и др., 2009; Lennon et al., 2001; Bosch et al., 2006; Salim et al., 2006; Ren et al., 2006; Fehrer et al., 2007). В нашей лаборатории также было показано, что ММСК из жировой ткани человека, культивируемые при пониженном до 5% O2 в среде, обладали более выраженным мезенхимальным фенотипом и более высокой пролиферативной активностью по сравнению с ММСК, культивируемыми в среде со стандартным содержанием O2 (20%), и не отличались от последних по жизнеспособности и иммунофенотипу. Кроме того, при 5% О2 замедлялась дифференцировка лМСК в остеогенном и адипогенном направлении (Буравкова и др., 2009). Замедление дифференцировки лМСК при понижении концентрации O2 показано также и другими исследователями (Lee et al., 2006; Malladi et al., 2006).
Исследования, в которых предпринимаются попытки более детально смоделировать особенности микроокружения гемопоэтической ниши с использованием не только стромальных клеток, но и гипоксических значений O2, к настоящему времени единичны (Жамбалова и др., 2009; Song et al., 2009; Hammoud et al., 2012; Jing et al., 2012; Андреева и др., 2012).
Оценка эффективности экспансии гемопоэтических предшественников пуповинной крови (общего числа пкМНК, КОЕ и CD34+клеток) в присутствии микроинкапсулированных остеобластов выявила преимущественное увеличение перечисленных параметров в условиях 5% O2 (Song et al., 2009).
В работе Hammoud et al., 2012 была исследована экспансия CD34+ клеток из пуповинной крови на ММСК из костного мозга человека при 20, 5 и 1,5% O2. Авторы анализировали только клетки, находящиеся в суспензии. В популяции К1 (культура 1) после 10 дней сокультивирования чем меньше была концентрация O2, тем меньше был прирост общего числа и CD34+ клеток, а также КОЕ. При этом анализ способности K1 клеток к репопуляции костного мозга у имммунодефицитных мышей, показал, что именно гипоксические клетки в системе in vivo были наиболее эффективны. Авторы предположили, что сочетание стромального фидера и низких значений O2 при экспансии ex vivo позволяет полностью сохранить и даже улучшить функциональную активность гемопоэтических стволовых клеток. Это, по мнению авторов, подтверждается и данными по анализу популяции К2 (культура 2), в которой после 14 дней сокультивирования именно среди «гипоксических» клеток было выявлено больше всего КОЕ.
Jing et al., 2012, исследовали влияние концентрации O2 на взаимодействие CD34+клеток из мобилизованной периферической крови и ММСК из костного мозга человека при 0,5% O2. Ранее, в этой лаборатории (Jing et al., 2010) было подробно описано формирование трех различных компартментов CD34+ клеток относительно ММСК в течение 7 дней сокультивирования: (1) неадгезированная фракция, (2) клетки, прикрепленные к ММСК, которые при фазовоконтрастной микроскопии были яркими («светящимися»), авторы назвали их phase-bright cells, и (3) клетки под ММСК, темные в фазовом контрасте (phase-dim cells). Авторы показали, что CD34+ клетки в этих компартментах находятся в разном функциональном состоянии. Среди прикрепленных клеток больше всего пролиферирующих, а под ММСК - покоящихся (CD34+/CD38-). После деления CD34+клетки откреплялись от ММСК и формировали неадгезивную фракцию.
Цель данного изобретения - отработка метода обогащения популяции мононуклеаров из пуповинной крови ранними недифференцированными CD34+ и коммитированными гемопоэтическими предшественниками с использованием фидерного слоя из ММСК жировой ткани человека.
Подробное описание изобретения.
Из жировой ткани человека мультипотентные мезенхимальные стромальные клетки (ММСК) были выделены с использованием стандартной методики (Zuk et. al., 2001) с модификациями (Buravkova et. al., 2009). Сразу после выделения ММСК в среде а-МЕМ с 10% фетальной телячьей сыворотки (ФТС) (Hyclone, США) 100 ед/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ глютамина (все компоненты ПанЭко, Россия) помещали в чашки Петри, часть из которых культивировали в стандартном CO2-инкубаторе (5% CO2+95% воздуха (20% O2), 37°C, 100% влажности), другую часть - в мультигазовом инкубаторе Sanyo (Япония), где поддерживалась концентрация кислорода 5%. Клетки пассировали при достижении 70%-80% конфлуентности. Для проведения экспериментов использовали клетки 2-4-го пассажа.
Мононуклеарные клетки пуповинной крови (пкМНК), включающие гемопоэтические стволовые и потомки стволовых клеток, были предоставлены Банком стволовых клеток «КриоЦентр» (г. Москва). Перед инициализацией культур криоконсервированные образцы пкМНК, полученные методом седиментации (Denning-Kendall, Donaldson, Nicol et al., 1996), размораживали на водяной бане при температуре +37°C и отмывали от криопротектора в полной среде роста с 10% ФТС. После осаждения центрифугированием клетки ресуспендировали в среде RPMI 1640 (Gibco, Великобритания), 10% ФТС 100 ед/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ глютамина и доводили их концентрацию до 10x6 клеток/мл.
Для создания метода обогащения популяции мононуклеаров из пуповинной крови ранними недифференцированными CD34+ и коммитированными гемопоэтическими предшественниками с использованием фидерного слоя из ММСК жировой ткани человека была разработана модель сокультивирования ММСК и пкМНК при 5% O2 - как более близкая к физиологической концентрации в микроокружении стволовых и прогениторных клеток in vivo. В качестве сравнения была взята концентрация кислорода 20%, как стандартная для лабораторной практики.
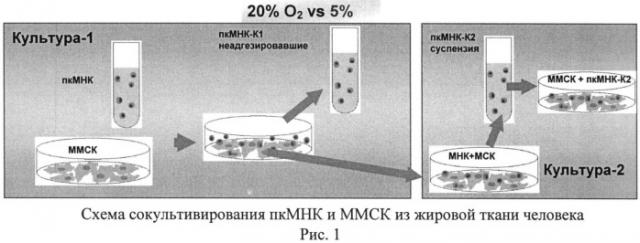
Схема осуществления изобретения представлена на рис.1.
ММСК культивировали до достижения 70-80% монослоя при 20% и 5% O2. Суспензию пкМНК (10×6/мл) в полной среде RPMI 1640 добавляли к монослою стромальных клеток и культивировали 72 часа. После этого отбирали неприкрепленные пкМНК и проводили замену среды без возвращения пкМНК. ММСК с прикрепившимися к ним пкМНК продолжали культивировать до 7-го дня от начала эксперимента. Таким образом, взаимодействие стромальных и гемопоэтических клеток было разделено на два основных этапа.
- На первом этапе ММСК сокультивировали с исходными пкМНК (культура-1) (K1), в результате чего часть гемопоэтических предшественников прикреплялась к монослою ММСК, а часть оставалась в суспензии исходных пкМНК и была удалена из сокультуры.
- На втором этапе сокультивировали ММСК с пкМНК, образующимися из ранее прикрепившихся - культура-2 (К2).
На каждом из этапов были охарактеризованы пкМНК в суспензии, и пкМНК, прикрепившиеся к ММСК.
Жизнеспособность клеток оценивали на проточном цитофлюориметре Epics XL (Beckman Coulter, США), используя набор Annexin V-FITC/PI (Immunotech, Франция), согласно инструкции производителя.
Суспензию пкМНК и пкМНК-К2 иммунофенотипировали, используя антитела к CD45, CD34 и CD133 на проточном цитофлюориметре.
Способность гемопоэтических предшественников к дифференцировке оценивали по числу клеток (колониеобразующие единицы, КОЕ), формирующих колонии различных гемопоэтических ростков, в полужидкой среде с цитокинами MethoCult Н4034 (STEMCELL Technologies, Канада). Клетки вносили в среду в соответствии с инструкцией производителя в конечной концентрации 3×103-5×103 клеток в 35-миллиметровую чашку Петри. Через 14 суток определяли общее количество колоний (КОЕ), а также БОЕ-Э, КОЕ-Г, КОЕ-М и КОЕ-ГМ.
Формирование колоний гемопоэтических предшественников на поверхности ММСК выявляли визуально с помощью фазово-контрастной микроскопии живых клеток и
после фиксации 4% параформальдегидом и окраски кристаллическим фиолетовым.
Способность стромальных клеток поддерживать жизнеспособность и самообновление малодифференцированных пкМНК при 20% и 5% O2 была охарактеризована по наличию среди этой фракции клеток, способных прикрепиться к ММСК, мигрировать по ним и образовать «области булыжной мостовой» (КООБ).
Статистический анализ проводили с помощью пакета программ «Microsoft Excel 2000» и «Statistica 7.0», используя непараметрический критерий Манна-Уитни.
Примеры осуществления изобретения.
1. Сокультивирование мононуклеаров пуповинной крови (пкМНК) и ММСК при различном содержании O2 в среде культивирования (культура 1 (пкМНК-К1)).
Морфологическая характеристика и оценка динамики и эффективности прикрепления nkMHK-K1 к ММСК при сокультивировании.
К предмонослою ММСК (60-70% конфлюэнтности), экспансия которых была проведена при 20% и 5% O2, вносили суспензию пкМНК и продолжали культивировать при тех же концентрациях О2. Известно, что пуповинная кровь человека содержит, помимо гемопоэтических клеток-предшественников, находящиеся на разных этапах дифференцировки, зрелые форменные элементы, которые составляют основную часть популяции пкМНК. В течение 72 часов происходила адгезия незначительной части мононуклеаров из пуповинной крови к ММСК, а большая часть пкМНК оставалась в суспензии. Известно, что к стромальному слою прикрепляются, в первую очередь, недифференцированные и малодифференцированные гемопоэтические клетки (Wagner et al., 2007). Для того чтобы неадгезированные зрелые мононуклеары крови, которые постепенно подвергались апоптотической гибели, не мешали дальнейшему росту прикрепившихся недифференцированных предшественников, через 72 часа суспензию этих клеток удаляли и добавляли свежую среду RPMI 1640.
Морфологию, количество и жизнеспособность прикрепившихся к подслою ММСК клеток из пуповинной крови (пкМНК-К1) оценивали через 24 и 72 часа от начала сокультивирования.
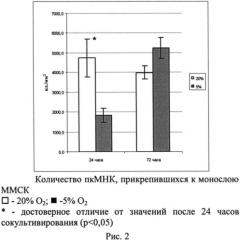
На поверхности ММСК были обнаружены единичные клетки, которые по морфологии соответствовали зрелым форменным элементам периферической крови: лимфоциты, моноциты, эритроциты. Кроме того, были выявлены гемопоэтические предшественники разной степени дифференцированности, относящиеся к различным гемопоэтическим росткам. Также были обнаружены зрелые лимфоциты периферической крови. Количество прикрепившихся через 24 часа пкМНК-К1 значительно варьировало в зависимости от донора пкМНК и было существенно большим при 20% O2 (рис.2). Через 72 часа количество прикрепленных пкМНК-К1 было несколько меньше при 20% O2 и достоверно больше при 5% O2 (р<0,05) (рис.1).
Для того чтобы оценить количество живых пкМНК-К1 среди всей популяции прикрепленных клеток, мы использовали тест на жизнеспособность и пути клеточной гибели (Аннексин V-FITC/PI).
Для анализа на проточном цитофлюориметре клетки трипсинизировали и полученную суспензию окрашивали Аннексин V-FITC/PI. Для того чтобы провести анализ отдельных популяций, клетки в суспензии предварительно были окрашены антителами против CD90 для идентификации ММСК и против CD45 - для выявления лейкоцитов. Данные по жизнеспособности были получены для пкМНК в гейте, содержавшем только CD45-положительные клетки.
Через 24 часа доля живых пкМНК-К1 составила, в среднем, 78% при 20% и 5% O2; некротических 1 и 2%; апоптотических 22 и 20%, причем 2/3 клеток были в фазе раннего апоптоза при 20% и 5% O2, соответственно. Через 72 часа сокультивирования доля живых прикрепившихся пкМНК-К1 была 83 и 85%, некротических 1 и 1%, а доля апоптотических уменьшилась до апоптотических 16 и 15% при 20% и 5% О2, соответственно (см. табл.1).
| Таблица 1. | ||||
| Жизнеспособность пкМНК-К1, адгезированных на ММСК | ||||
| Адгезированные nkMHK-K1, сокулътура с ММСК | ||||
| 24 ч | 72 ч | |||
| O2,% | 20 | 5 | 20 | 5 |
| некроз, % | 1±0 | 2±1 | 1±0 | 1±0 |
| ранний апоптоз, % | 16±7 | 13±4 | 9±3 | 10±2 |
| поздний апоптоз, % | 6±2 | 7±1 | 7±1 | 5±0 |
| живые, % | 78±7 | 78±7 | 83±3 | 85±2 |
Данные представлены как М+m 4 независимых экспериментов
Таким образом, после того, как произошло прикрепление и распластывание пкМНК, их жизнеспособность оставалась высокой, а клеточная гибель одиночных клеток происходила, в основном, за счет апоптоза. Если сопоставить эти данные с описанными выше для исходной суспензий пкМНК и неприкрепившимися пкМНК-К1, то можно отметить, что после адгезии к ММСК жизнеспособность пкМНК не только не снизилась, а, напротив, даже несколько улучшилась после 72 часов сокультивирования.
2. Влияние ММСК и различной концентрации кислорода в среде культивирования на гемопоэтические клетки - (производные) потомки исходных пкМНК (культура 2 (пкМНК-К2)).
Характеристика пкМНК-К2, прикрепившихся к подслою ММСК
После 72 часов суспензия пкМНК-К1 была удалена, и далее наблюдение проводили за теми клетками, которые остались прикрепленными к ММСК - пкМНК-К2. После 7 дней от начала культивирования на поверхности ММСК можно было видеть малодифференцированные клетки-предшественники, среди которых обнаруживались описанные ранее клетки миелоидного и эритроидного ростков. Кроме того, были выявлены клетки, отвечающие критериям бластных: базофильная цитоплазма, крупное светлое ядро с 1-2 ядрышками. Такие клетки встречались в большом количестве при 20%, а при 5% O2 были обнаружены только единичные клетки.
На этом сроке культивирования на поверхности ММСК были выявлены также колонии недифференцированных клеток-предшественников. Часть этих клеток проникала в пространство под ММСК, формируя там так называемые «области булыжной мостовой», площадь которых увеличивалась в ходе последующего культивирования.
Оценка с помощью проточной цитофлюориметрии после окраски Аннексин V-FITC/PI показала, что 80-90% прикрепленных мононуклеаров были живыми (табл.2).
| Таблица 2. | ||
| Жизнеспособность пкМНК-К2, прикрепленных к ММСК, после 7 суток сокультивирования (An-V-FITC/PI) | ||
| Адгезированные nkMHK-K2, | ||
| сокультура с ММСК | ||
| O2,% | 20 | 5 |
| некроз, % | 1±0 | 1±0 |
| ранний апоптоз, % | 12±5 | 6±2 |
| поздний апоптоз, % | 2±1 | 15±13 |
| живые, % | 86±6 | 78±15 |
Данные представлены как M+m 4 независимых экспериментов
Таким образом, в популяции адгезированных пкМНК-К2 описаны малодифференцированные клетки-предшественники, среди которых обнаруживались выявленные ранее клетки миелоидного и эритроидного ростков, а также бласты, которых было существенно больше при 20% O2. При 20% O2 выявлены одиночные клетки гранулоцитарного ряда, при 5% O2 их было существенно больше. Доля живых клеток среди всех адгезированных пкМНК-К2 была высокой (более 80%), причем при 20% O2 таких клеток было на 10% больше, чем при 5% O2.
Идентификация ранних гемопоэтических предшественников среди пкМНК-К2 на монослое ММСК.
Недифференцированные CD34+ и CD133+ клетки среди адгезированных пкМНК-К2 выявляли иммуноцитохимически через 7 и 14 суток сокультивирования с ММСК при различном содержании кислорода и определяли их количество на 1 см2. Через 7 дней культивирования клетки, положительные по указанным маркерам были обнаружены на ММСК как при 20%, так и при 5% O2. Число CD34+ клеток при разной концентрации O2 отличалось незначительно и составило 1170+60 и 1050+60, a CD133+ клеток - 1160+40 и 900+50 при 20% и 5% O2 соответственно. Через 14 суток совместного культивирования количество малодифференцированных пкМНК-К2 при 5% O2 достоверно увеличилось по сравнению с 7-дневной культурой и составило 1250+70 (CD34+ в 1,2 раза) и 1320+65 (CD133+ в 1,5 раза). Напротив, при 20% О2 количество недифференцированных гемопоэтических предшественников уменьшилось в 1,5 раза в случае CD34+ и в 1,3 раза для CD133+ клеток.
Полученные данные показывают, что недифференцированные гемопоэтические клетки одинаково эффективно адгезируют к ММСК, предварительное культивирование которых проведено при разном содержании O2 в среде. Последующая экспансия на стромальном фидере идет более эффективно при пониженном содержании О2.
Характеристика вновь образованной неадгезированной фракции nkMHK-K2
На 7-е сутки после начала сокультивирования над прикрепленными к подложке пкМНК-К2 появлялась суспензионная фракция клеток.
Эти клетки были собраны и проанализированы. Количество их было сходно при 20% и 5% O2 и составило 132±57 и 111±35 тыс/мл соответственно. Живых клеток в обеих популяциях было около 90%. Доля неадгезированных пкМНК-К2, несущих маркеры ранних гемопоэтических предшественников CD34 и CD133, приведена в табл.3. Среди пкМНК-К2 CD34+ клеток было на 40% больше при 5%, чем при 20% O2 (р<0,05), а процент CD133+ клеток был примерно одинаковым.
| Таблица 3 | |||
| Доля ранних гемопоэтических предшественников среди популяции пкМНК-К2 | |||
| CD34+, % | CD133+, % | ||
| 20% O2 | 5% O2 | 20% O2 | 5% O2 |
| 37±8 | 62±5* | 20±9 | 26±15 |
Приведены усредненные данные 4 независимых экспериментов (M+m),
* - р<0,05, достоверное отличие от значений при 20% O2
С учетом того, что исходная суспензия пкМНК содержала, в среднем, 0,3+0,1% CD34+пкМНК, обогащение суспензии пкМНК-К2 недифференцированными предшественниками в результате экспансии на ММСК составило 100 и 200 раз при 20% и 5% O2 соответственно.
Кроме цитофлюориметрического анализа для идентификации ранних гемопоэтических предшественников был использован тест по выявлению клеток, способных формировать «области булыжной мостовой» (КООБ). Считается, что КООБ при введении in vivo способны длительно поддерживать кроветворение, т.е. обладают свойствами ближайших потомков стволовых клеток. Суспензию пкМНК-К2 пересеивали на новый подслой ММСК, обработанных митомицином для остановки клеточного деления. Уже через 72 часа на поверхности ММСК как при 20%, так и 5% O2 можно было видеть отдельные адгезировавшие пкМНК-К2 и вновь сформированные колонии, аналогичные тем, что были описаны нами для пкМНК-К1. Кроме того, над прикрепившимися пкМНК-К2 вновь образовывалась суспензионная фракция клеток. После 2-х недель сокультивирования как при 20%, так и при 5% O2 можно было видеть крупные области, занятые КООБ.
Для того чтобы выявить присутствие КОЕ среди неприкрепленных пкМНК-К2, использовали метод получения колоний в полужидкой среде MethoCult Н4034.
Среди пкМНК-К2, полученных при 20% O2, общее число КОЕ было почти 1,6 раза меньше по сравнению с 5% O2. Более половины всех КОЕ представляли собой БОЕ-Э, которых при 5% O2 было более чем в 2 раза больше, чем при 20% O2. Кроме того, при 5% O2 было больше КОЕ-Г и меньше КОЕ-М (рис.3.а-в).
Проведенные эксперименты продемонстрировали, что в суспензии пкМНК-К2, образующейся при экспансии на ММСК гемопоэтических предшественников из пуповинной крови при 20% и 5% O2, можно выявить КООБ, способные к формированию «зон булыжной мостовой», и КОЕ различных гемопоэтических ростков. Это свидетельствует о наличии среди пкМНК-К2 как клеток, дающих начало коммитированным предшественникам, так и малодифференцированных клеток, способных обеспечить длительное кроветворение in vivo.
Таким образом, ММСК из жировой ткани человека могут эффективно поддерживать жизнеспособность гемопоэтических предшественников из пуповинной крови различной степени коммитированности, причем при низкой концентрации O2 происходит значительное обогащение популяции недифференцированными предшественниками и преимущественное развитие определенных гемопоэтических ростков. Полученные результаты представляются важными как с точки зрения фундаментальных физиологических механизмов гемоэпоза, так и в связи с тем, что направленная экспансия предшественников гемопоэтических клеток ex vivo может иметь важное значение для нужд регенеративной медицины.
Способ экспансии мононуклеарных клеток пуповинной крови (пкМНК) ex vivo в присутствии мультипотентных мезенхимальных стромальных клеток (ММСК) человека, включающий культивирование ММСК из стромально-васкулярной фракции жировой ткани до достижения монослоя при концентрации O2 в среде 5%, добавление суспензии пкМНК к монослою ММСК, культивирование в течение 72 часов при концентрации O2 в среде 5%, отбор неприкрепленных пкМНК и замену среды, продолжение культивирования ММСК с прикрепившимися к ним пкМНК в течение 7 дней при концентрации O2 в среде 5%.