Пестицидные композиции
Иллюстрации
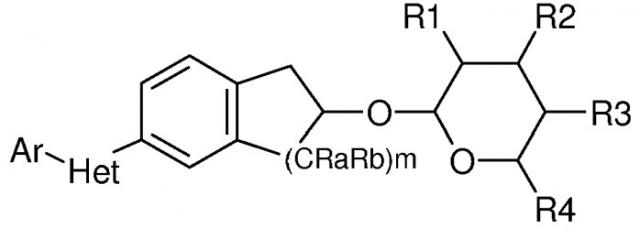
Показать всеИзобретение относится к соединениям общей формулы I
(I)
где
именуется как Ar2,
где (a) Ar представляет собой (1) фенил, пиридил или тиадиазолил, или (2) замещенный фенил, замещенный пиридил или замещенный тиадиазолил, где указанные замещенный фенил, замещенный пиридил и замещенный тиадиазолил имеют один или несколько заместителей, независимо выбранных из H, F, Cl, Br, I, C1-C6 галогеналкила, C1-C6 алкокси или C1-C6 галогеналкокси; (b) Het является пяти- или шестичленным, незамещенным гетероциклическим кольцом, содержащим один гетероатом азота, и где Ar и Ar2 не находятся в орто-положении по отношению друг к другу (но могут быть в мета-положении, так как, например, в пятичленном кольце они находятся в положениях 1,3 и в шестичленном кольце - в положениях 1,3 или 1,4); (c) R1 представляет собой C1-C6 алкокси; (d) R2 представляет собой C1-C6 алкокси; (e) R3 представляет собой C1-C6 алкокси; (f) R4 представляет собой C1-C6 алкил; (g) m равно 1; и (i) Ra и Rb представляют собой Н, обладающий пестицидной активностью, и к способам борьбы с вредителями. 6 н. и 1 з.п. ф-лы, 2 табл., 14 пр.
Реферат
Область техники, к которой относится изобретение
По данной заявке испрашивается приоритет по предварительной заявке США № 61/151543, поданной 11 февраля 2009, полное раскрытие содержания которой включено в настоящий документ путем ссылки. Раскрытое в данном документе изобретение относится к области пестицидов и к их применению для борьбы с вредителями.
Уровень техники
Вредители вызывают каждый год миллионы человеческих смертей по всему миру. Кроме того, существует более десяти тысяч видов вредителей, которые вызывают потери сельскохозяйственной культуры. Эти сельскохозяйственные потери составляют миллиарды долларов США каждый год. Термиты вызывают разрушение различных структур, таких как дома. Эти термитные потери составляют миллиарды долларов США каждый год. В качестве заключительного примечания, многие пищевые вредители в складских помещениях поедают и загрязняют примесями хранящиеся пищевые продукты. Эти потери хранящихся пищевых продуктов составляют миллиарды долларов США каждый год, но что более важно, лишают людей необходимой пищи.
Существует острая необходимость в новых пестицидах. Насекомые развивают устойчивость к пестицидам, находящимся в использовании. Сотни видов насекомых устойчивы к одному или нескольким пестицидам. Хорошо известно повышение устойчивости к некоторым более старым пестицидам, таким как ДДТ, карбаматы и органофосфаты. Но устойчивость повысилась даже к некоторым более новым пестицидам. В связи с этим существует необходимость в новых пестицидах и, особенно, в пестицидах, которые обладают новыми способами действия.
Заместители (неисчерпывающий список)
Примеры, данные для заместителей, являются (за исключением галогена) неисчерпывающими и не должны быть истолкованы как ограничивающие изобретение, изложенное в этом документе.
«Алкенил» означает ациклический, ненасыщенный (по меньшей мере по одной двойной связи углерод-углерод), разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил.
«Алкенилокси» означает алкенил, состоящий дополнительно из одинарной связи углерод-кислород, например аллилокси, бутенилокси, пентенилокси, гексенилокси, гептенилокси, октенилокси, ноненилокси и деценилокси.
«Алкокси» означает алкил, состоящий дополнительно из одинарной связи углерод-кислород, например метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изобутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси и децокси.
«Алкил» означает ациклический, насыщенный, разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, октил, нонил и децил.
«Алкинил» означает ациклический, ненасыщенный (по меньшей мере по одной тройной связи углерод-углерод и каким-либо двойным связям), разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например этинил, пропаргил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил.
«Галоген» означает фтор, хлор, бром и йод.
«Галогеналкокси» означает галогеналкил, состоящий дополнительно из одинарной связи углерод-кислород, например фторметокси, дифторметокси и трифторметокси, 2-фторэтокси, 1,1,2,2,2-пентафторэтокси, 1,1,2,2-тетрафтор-2-бромэтокси и 1,1,2,2-тетрафторэтокси.
«Галогеналкил» означает алкил, состоящий дополнительно из одинаковых или различных галогенов в количестве от одного до максимально возможного количества, например фторметил, дифторметил, трифторметил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
«Галогенфенилокси» означает фенилоксигруппу, имеющую один или несколько одинаковых или различных галогенов.
«Гидроксиалкил» означает алкил, имеющий одну или несколько гидроксигрупп.
Подробное описание изобретения
Соединения по настоящему изобретению имеют следующую формулу:
,
где именуется как Ar2,
где
(a) Ar представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиадиазолил, тиенил
или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, замещенный тиадиазолил или замещенный тиенил,
где указанные замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, замещенный тиадиазолил и замещенный тиенил имеют один или несколько заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 гидроксиалкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, С3-С6 гидроксициклоалкила, С3-С6 циклоалкокси, С3-С6 галогенциклоалкокси, С3-С6 гидроксициклоалкокси, С1-С6 алкокси, C1-C6 галогеналкокси, С2-С6 алкенила, С2-С6 алкинила, S(=O)n(C1-C6 алкила), S(=O)n(C1-C6 галогеналкила), OSO2(C1-C6 алкила), OSO2 (C1 -C6 галогеналкила), C(=O)H, C(=O)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкила), C(=O)O(C1-C6 алкила), C(=O)(C1-C6 галогеналкила), C(=O)O(C1-C6 галогеналкила), C(=O)(C3-C6 циклоалкила), C(=O)O(C3-C6 циклоалкила), C(=O)(C2-C6 алкенила), C(=O)O(C2-C6 алкенила), (C1-C6 алкил)O(C1-C6 алкила), (C1-C6 алкил)S(C1-C6 алкила), C(=O)(C1-C6 алкил)C(=O)O(C1-C6 алкила), фенила, фенокси, замещенного фенила и замещенного фенокси (где такой замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, С1-С6 алкила, С1-С6 галогеналкила, C1-C6 гидроксиалкила, С3-С6 циклоалкила, С3-С6 галогенциклоалкила, С3-С6 гидроксициклоалкила, С3-С6 циклоалкокси, С3-С6 галогенциклоалкокси, С3-С6 гидроксициклоалкокси, C1-C6 алкокси, C1-C6 галогеналкокси, С2-С6 алкенила, С2-С6 алкинила, S(=O)n(C1-C6 алкила), S(=O)n(C1-C6 галогеналкила), OSO2(C1-C6 алкила), OSO2(C1-C6 галогеналкила), C(=O)H, C(=O)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкила), C(=O)O(C1-C6 алкила), C(=O)(C1-C6 галогеналкила), C(=O)O(C1-C6 галогеналкила), C(=O)(C3-C6 циклоалкила), C(=O)O(C3-C6 циклоалкила), C(=O)(C2-C6 алкенила), C(=O)O(C2-C6 алкенила), (C1-C6 алкил)O(C1-C6 алкила), (C1-C6 алкил)S(C1-C6 алкила), C(=O)(C1-C6 алкил)C(=O)O(C1-C6 алкила), фенила и фенокси);
(b) Het является пяти- или шестичленным, насыщенным или ненасыщенным, гетероциклическим кольцом, содержащим один или несколько гетероатомов, независимо выбранных из азота, серы или кислорода, и где Ar и Ar2 не находятся в орто-положении по отношению друг к другу (но могут быть в мета- или пара-положении, так как, например, в пятичленном кольце они могут находиться в положениях 1,3 и в шестичленном кольце в положениях 1,3 или 1,4), и где указанное гетероциклическое кольцо может быть также замещено одним или несколькими заместителями, независимо выбранными из H, F, Cl, Br, I, CN, NO2, оксо, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 гидроксиалкила, С3-С6 циклоалкила, С3-С6 галогенциклоалкила, С3-С6 гидроксициклоалкила, С3-С6 циклоалкокси, С3-С6 галогенциклоалкокси, С3-С6 гидроксициклоалкокси, C1-C6 алкокси, C1-C6 галогеналкокси, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкила), S(=O)n(C1-C6 галогеналкила), OSO2(C1-C6 алкила), OSO2(C1-C6 галогеналкила), C(=O)H, C(=O)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкила), C(=O)O(C1-C6 алкила), C(=O)(C1-C6 галогеналкила), C(=O)O(C1-C6 галогеналкила), C(=O)(C3-C6 циклоалкила), C(=O)O(C3-C6 циклоалкила), C(=O)(C2-C6 алкенила), C(=O)O(C2-C6 алкенила), (C1-C6 алкил)O(C1-C6 алкила), (C1-C6 алкил)S(C1-C6 алкила), С(=O)(С1-С6 алкил)C(=O)O(C1-C6 алкила), фенила, фенокси, замещенного фенила и замещенного фенокси (где такие замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 гидроксиалкила, C3-C6 циклоалкила, С3-С6 галогенциклоалкила, С3-С6 гидроксициклоалкила, C3-C6 циклоалкокси, С3-С6 галогенциклоалкокси, C3-C6 гидроксициклоалкокси, C1-С6 алкокси, C1-C6 галогеналкокси, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкила), S(=O)n(C1-C6 галогеналкила), OSO2(C1-C6 алкила), OSO2(C1-C6 галогеналкила), C(=O)H, C(=O)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкила), C(=O)O(C1-C6 алкила), С(=O)(C1-C6 галогеналкила), C(=O)O(C1-C6 галогеналкила), C(=O)(C3-C6 циклоалкила), C(=O)O(C3-C6 циклоалкила), C(=O)(C2-C6 алкенила), C(=O)O(C2-C6 алкенила), (C1-C6 алкил)O(C1-C6 алкила), (C1-C6 алкил)S(C1-C6 алкила), C(=O)(C1-C6 алкил)C(=O)O(C1-C6 алкила), фенила и фенокси);
(c) R1 представляет собой H, OH, F, Cl, Br, I, оксо, C1-C6 алкил, С1-С6 галогеналкил, C1-C6 алкокси, C3-C6 циклоалкокси, C1-C6 галогеналкокси, C2-C6 алкенилокси, (C1-C6 алкил)O(C1-C6 алкил), (C1-C6 алкил)O(C1-C6 алкокси), OC(=O)(С1-С6 алкил), OC(=O)(C3-C6 циклоалкил), OC(=O)(C1-C6 галогеналкил), OC(=O)(C2-C6 алкенил) или NRxRy;
(d) R2 представляет собой H, F, Cl, Br, I, оксо, C1-C6 алкил, C1-C6 галогеналкил, C1-C6 алкокси, C3-C6 циклоалкокси, С1-С6 галогеналкокси, C2-C6 алкенилокси, (C1-C6 алкил)O(C1-С6 алкил), (C1-C6 алкил)O(C1-C6 алкокси), OC(=O)(C1-C6 алкил), OC(=O)(C3-C6 циклоалкил), OC(=O)(C1-C6 галогеналкил), OC(=O)(C2-C6 алкенил) или NRxRy;
(e) R3 представляет собой H, OH, F, C1, Br, I, оксо, C1-C6 алкил, C1-C6 галогеналкил, C1-C6 алкокси, C3-C6 циклоалкокси, C1-C6 галогеналкокси, C2-C6 алкенилокси, (C1-C6 алкил)O(C1-C6 алкил), (C1-C6 алкил)O(С1-С6 алкокси), OC(=O)(C1-C6 алкил), OC(=O)(C3-C6 циклоалкил), OC(=O)(C1-C6 галогеналкил), OC(=O)(C2-C6 алкенил) или NRxRy;
(f) R4 представляет собой H, C1-C6 алкил, C1-C6 галогеналкил, C1-C6 алкокси, C1-C6 галогеналкокси, C2-C6 алкенилокси, (C1-C6 алкил)O(C1-C6 алкил);
(g) m равно 1 или 2;
(h) Rx и Ry независимо выбраны из H, C1-C6 алкила, C1-C6 галогеналкила, C1-С6 гидроксиалкила, С3-С6 циклоалкила, С3-С6 галогенциклоалкила, С3-С6 гидроксициклоалкила, С3-С6 циклоалкокси, С3-С6 галогенциклоалкокси, С3-С6 гидроксициклоалкокси, C1-C6 алкокси, C1-С6 галогеналкокси, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкила), S(=O)n(C1-C6 галогеналкила), OSO2(C1-C6 алкила), OSO2(C1-C6 галогеналкила), C(=O)H, C(=O)OH, C(=O)(C1-C6 алкила), C(=O)O(C1-C6 алкила), C(=O)(C1-C6 галогеналкила), C(=O)O(C1-C6 галогеналкила), С(=O)(С3-С6 циклоалкила), C(=O)O(C3-C6 циклоалкила), C(=O)(C2-C6 алкенила), C(=O)O(C2-C6 алкенила), (C1-C6 алкил)O(C1-C6 алкила), (C1-C6 алкил)S(C1-C6 алкила), C(=O)(C1-C6 алкил)C(=O)O(C1-C6 алкила), фенила и фенокси; и
(i) Ra и Rb независимо выбраны из H, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 гидроксиалкила, C1-C6 алкокси, и C1-C6 галогеналкокси.
В другом варианте осуществления настоящего изобретения:
(a) Ar представляет собой фенил, пиридазинил, пиридил, тиенил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный тиадиазолил или замещенный тиенил, где указанные замещенный фенил, замещенный пиридазинил, замещенный пиридил и замещенный тиенил имеют один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 гидроксиалкила, C1-C6 галогеналкокси, C2-C6 алкенила, S(=O)n(C1-C6 алкила), S(=O)n(C1-C6 галогеналкила), OSO2(C1-C6 галогеналкила), C(=O)(C1-C6 алкила), (C1-C6 алкил)S(C1-C6 алкила) и феноксигруппы (где такая замещенная феноксигруппа имеет один или несколько заместителей, независимо выбранных из F, Cl, Br или I).
В еще одном варианте осуществления изобретения:
(a) Ar представляет собой замещенный фенил, замещенный пиридил или замещенный тиадиазолил, где указанные замещенный фенил, замещенный пиридил и замещенный тиадиазолил имеют один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 гидроксиалкила, C1-C6 галогеналкокси, C2-C6 алкенила, S(=O)n(C1-C6 алкила), S(=O)n(C1-C6 галогеналкила), OSO2(C1-C6 галогеналкила), C(=O)(C1-C6 алкила), (C1-C6 алкил)S(C1-C6 алкила) и феноксигруппы (где такая замещенная феноксигруппа имеет один или несколько заместителей, независимо выбранных из F, Cl, Br или I).
В еще одном варианте осуществления изобретения:
(a) Ar представляет собой замещенный фенил, где указанный замещенный фенил имеет один или несколько заместителей, независимо выбранных из F, Cl, Br, I, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 алкокси и C1-C6 галогеналкокси.
В еще одном варианте осуществления настоящего изобретения Ar означает фенил или пиридил.
В еще одном варианте осуществления настоящего изобретения:
(b) Het представляет собой имидазолил, изотиазолил, изоксазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, оксазолинил, оксазолил, пиперазинил, пиперидинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, 1,2,3,4-тетразолил, тиадиазолил, тиазолинил, тиазолил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил, 1,2,4-триазолил, замещенный имидазолил, замещенный изотиазолил, замещенный изоксазолил, замещенный 1,2,4-оксадиазолил, замещенный 1,3,4-оксадиазолил, замещенный оксазолинил, замещенный оксазолил, замещенный пиперазинил, замещенный пиперидинил, замещенный пиразинил, замещенный пиразолинил, замещенный пиразолил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, замещенный пирролил, замещенный тетразолил, замещенный тиадиазолил, замещенный тиазолинил, замещенный тиазолил, замещенный 1,2,3-триазинил, замещенный 1,2,4-триазинил, замещенный 1,3,5-триазинил, замещенный 1,2,3-триазолил и замещенный 1,2,4-триазолил, где указанные замещенные группы имеют один или несколько заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, оксо, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 гидроксиалкила, С3-С6 циклоалкила, С3-С6 галогенциклоалкила, С3-С6 гидроксициклоалкила, С3-С6 циклоалкокси, С3-С6 галогенциклоалкокси, С3-С6 гидроксициклоалкокси, С1-С6 алкокси, С1-С6 галогеналкокси, С2-С6 алкенила, С2-С6 алкинила, S(=O)n(С1-С6 алкила), S(=O)n(С1-С6 галогеналкила), OSO2(С1-С6 алкила), OSO2(С1-С6 галогеналкила), C(=O)H, C(=O)NRxRy, (С1-С6 алкил)NRxRy, C(=O)(С1-С6 алкила), C(=O)O(С1-С6 алкила), C(=O)(C1-C6 галогеналкила), C(=O)(C3-C6 циклоалкила), C(=O)O(C3-C6 циклоалкила), C(=O)(C1-C6 галогеналкила), C(=O)(C2-C6 алкенила), C(=O)O(C2-C6 алкенила), (C1-C6 алкил)O(C1-C6 алкила), (С1-C6 алкил)S(C2-C6 алкила), C(=O)(С1-С6 алкил)C(=O)O(C1-C6 алкила), фенила, фенокси, замещенного фенила и замещенного фенокси (где такие замещенный фенил и замещенный фенокси имеют один или несколько заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, оксо, C1-C6 алкила, С1-С6 галогеналкила, С1-С6 гидроксиалкила, С3-С6 циклоалкила, С3-С6 галогенциклоалкила, С3-С6 гидроксициклоалкила, С3-С6 циклоалкокси, С3-С6 галогенциклоалкокси, С3-С6 гидроксициклоалкокси, С1-С6 алкокси, C1-С6 галогеналкокси, С2-С6 алкенила, С2-С6 алкинила, S(=O)n(C1-C6 алкила), S(=O)n(C1-C6 галогеналкила), OSO2(C1-C6 алкила), OSO2(C1-C6 галогеналкила), C(=O)H, C(=O)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкила), C(=O)O(C1-C6 алкила), C(=O)(C1-C6 галогеналкила), C(=O)(C3-C6 циклоалкила), C(=O)O(C3-C6 циклоалкила), C(=O)(C1-C6 галогеналкила), C(=O)(C2-C6 алкенила), C(=O)O(C2-C6 алкенила), (C1-C6 алкил)O(C1-C6 алкила), (C1-C6 алкил)S(C1-C6 алкила), C(=O)(C1-C6 алкил)C(=O)O(C1-C6 алкила), фенила и фенокси).
В еще одном варианте осуществления настоящего изобретения:
(b) Het представляет собой имидазолил, изоксазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, оксазолил, пиперазинил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, 1,2,3,4-тетразолил, тиадиазолил, тиазолил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил, 1,2,4-триазолил, замещенный имидазолил, замещенный 1,3,4-оксадиазолил, замещенный пиперазинил, замещенный пиразолил, замещенный пиримидинил и замещенный 1,2,4-триазолил, где указанные замещенные группы имеют один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, оксо, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 гидроксиалкила, С1-С6 алкокси, С1-С6 галогеналкокси, С2-С6 алкенила, S(=O)n(С1-С6 алкила), S(=O)n(С1-С6 галогеналкила), OSO2(С1-С6 галогеналкила), C(=O)O(С1-С6 алкила) и (С1-C6 алкил)S(C1-C6 алкила).
В еще одном варианте осуществления настоящего изобретения: (b) Het означает пиримидинил и пиразолил.
В еще одном варианте осуществления настоящего изобретения: (c) R1 означает C1-C6 алкокси.
В еще одном варианте осуществления настоящего изобретения: (d) R2 означает C1-C6 алкокси.
В еще одном варианте осуществления настоящего изобретения: (e) R3 означает C1-C6 алкокси.
В еще одном варианте осуществления настоящего изобретения: (f) R4 означает C1-C6 алкил.
Несмотря на то что были представлены эти варианты осуществления, возможны другие варианты осуществления и сочетания представленных вариантов осуществления и других вариантов осуществления.
Получение пиранозных промежуточных соединений
Большое разнообразие пираноз (в различных структурных формах, например в D- и L-) может быть использовано для получения соединений по настоящему изобретению. Например, может быть использован следующий неисчерпывающий перечень пираноз: рибоза, арабиноза, ксилоза, ликсоза, рибулоза, ксилулоза, аллоза, альтроза, глюкоза, манноза, гулоза, идоза, галактоза, талоза, псикоза, фруктоза, сорбоза, тагатоза, фукоза, микароза, хиновоза, олеандроза, рамноза и паратоза. В большинстве нижеследующих примеров для получения пиранозного промежуточного соединения была использована L-рамноза.
Как правило, пиранозные промежуточные соединения могут быть получены следующим образом (с использованием L-рамнозы в качестве примера). O-алкилированные производные рамнозы можно получить из коммерчески доступной L-рамнозы или гидрата L-рамнозы, используя алкилйодид и порошкообразный гидроксид калия (KOH) в безводном диметилсульфоксиде (ДМСО), при температуре от 5°C до 15°C. Затем полностью алкилированный продукт выделяют экстракцией из раствора ДМСО гексанами, после чего концентрируют гексановый слой в вакууме. Этот промежуточный алкилпиранозид затем сразу обрабатывают водным раствором хлористоводородной кислоты (HCl) или другой водной кислотой, которая образует свободный гидроксисахар, обычно в виде смеси α- и β-аномеров.
В качестве альтернативы, пералкилированная L-рамноза может быть выделена гидролизом спиносада или другого три-(O-алкил)рамнозилированного природного продукта с использованием условий, аналогичных условиям, описанным для выделения метилолеандрозида из авермектина B2 (Loewe et al., J. Org. Chem. 1994, 59, 7870). Таким образом, обработка технического спиносада избытком концентрированной серной кислоты в безводном метиловом спирте (MeOH) приводит к гидролизу сахара рамнозы и преобразованию в метилпиранозид. Чистый метилпиранозид может быть после этого удален из реакционной среды путем исчерпывающей экстракции гексанами или другим углеводородным растворителем. Чистый рамнопиранозид может быть после этого выделен с общим выходом около 65-75% дистилляцией неочищенной жидкости в вакууме.
3-O-этил 2,4-ди-O-метилрамноза может быть получена подобным образом, исходя из спинеторама. Другие алкилированные производные могут быть получены аналогично, исходя из соответственно функционализированных производных спиносоида, которые получены из какого-либо спиносин фактора, который имеет одну или несколько свободных гидроксильных групп, прикрепленных к рамнозе (например, спиносин J), с использованием условий, описанных в публикации DeAmics et al., патент США 6001981, 1999.
Иллюстрации получения таких пиранозных промежуточных соединений даны в примерах.
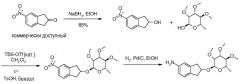
Линкер 2-гидрокси-инданил получают из 5-нитроиндан-2-она путем восстановления боргидридом натрия (NaBH4). Этот спирт гликозилируют с использованием 2-(трет-бутилдиметилсилилокси)три-O-алкилрамнозы и катализатора кислоты Льюиса, такой как трет-бутилдиметилсилилтрифторометансульфонат (TBS-OTf) в дихлорметане (CH2Cl2), при температуре от -30 до 30°C. Альтернативно, гликозилирование может быть выполнено нагреванием инданола с пералкилированным сахаром в присутствии катализатора, такого как п-толуолсульфоновая кислота (TsOH), при кипячении с обратным холодильником, с использованием ловушки Дина-Старка для удаления воды. Затем выполняют восстановление нитрогруппы с использованием водорода и катализатора, такого как палладий на углероде (Pd/C), в этиловом спирте (EtOH) или другом подходящем растворителе.
Очевидно, что продукты этих реакций имеют дополнительный оптический центр и что поэтому продукты состоят из диастереомерной смеси.
Другие промежуточные соединения инданил-три-O-метилрамнозы и целевые соединения могут быть получены, как показано ниже. 2-Инданол О-ацетилируют, как описано в литературе (Inamato, Can. J. Chem. 1967, 45, 1185). Ацетилирование по Фриделю-Крафтсу, за которым следует щелочной гидролиз, приводит к ацетилированному 2-инданолу, который конденсируют с трет-бутилдиметилсилиловым (TBDMS) эфиром ацеталя три-O-метилрамнозы с использованием триметилсилилтрифлата (TMSOTf) в качестве катализатора.
Преобразование ацетильной группы в пиримидин или пиразол выполняют в две стадии. На первой стадии образуют 2-(диметиламино)акрилоильную группу путем обработки ацетильного производного диметилформамид-диметилацеталем (ДМФА-DMA). Затем энаминон преобразуют или в пиримидин путем обработки соответственно замещенным бензамидином, или в пиразол путем обработки гидразином в спиртовом растворителе, таком как EtOH или MeOH. Далее можно выполнить N-арилирование пиразола галогенароматической группой с использованием основания, такого как KOH, карбонат калия (K2CO3), карбонат цезия (CS2CO3), гидрид натрия (NaH) или гексаметилдисилазид лития (LiHMDS), в полярном апротонном растворителе (например, Liu et al., J. Org. Chem. 2005, 70, 10135).
2-Инданолы, замещенные различными альтернативными гетероциклами, также входят в объем настоящего изобретения. Это может быть выполнено конденсированием галогензамещенного индола с аминогетероциклом. Широкий диапазон NH-замещенных гетероциклов (имидазолы, триазолы, пиразолы и т.д.) и широкий диапазон взаимосвязанных условий описаны в современной литературе.
Кроме того, производные 2-гидрокси-тетрагидронафтила также служат в качестве предшественников для соединений по настоящему изобретению. Коммерчески доступный 6-бром-2-тетралон может быть преобразован в соответствующее 2-O-гликозилированное производное, которое затем сочетают с подходящим гетероциклическим фрагментом любым из разнообразных способов, имеющихся в литературе, включая, но ими не ограничиваясь, сочетание по Ульману (если гетероцикл содержит свободную -NH-группу) или сочетание по Сузуки (если гетероцикл содержит бороновую кислоту или сложноэфирную группу).
ПРИМЕРЫ
Эти примеры служат для иллюстративных целей и не должны истолковываться как ограничивающие раскрытое в настоящем документе изобретение только раскрытыми вариантами осуществления.
Пример 1: Получение (3R,4R,5S,6S)-2,3,4,5-тетраметокси-6-метилтетрагидропирана (соединение E-1)
Раствор гидрата L-рамнозы (40 грамм (г), 0,22 моля (моль)) в безводном диметилсульфоксиде (ДМСО; 450 миллилитров (мл)) помещали в 2-литровую (л) трехгорлую круглодонную колбу и перемешивали механически, в то же время добавляя одной порцией порошкообразный гидроксид калия (KOH; 75 г, 1,34 моль). Йодметан (187 г, 1.32 моль) добавляли в этот раствор с такой скоростью, чтобы температура держалась ниже 30°C. Для поддержания этой температуры периодически использовали баню со смесью сухой лед-ацетон. После завершения добавления (примерно 2 часа (ч)) раствор перемешивали в течение дополнительных 3 ч, после чего ему давали отстояться при комнатной температуре в течение ночи. Затем этот чистый раствор экстрагировали гексанами (4×500 мл) и промывали объединенный гексановый раствор насыщенным раствором соли, затем сушили и выпаривали растворитель с получением раствора светло-оранжевого цвета (44 г, 92%). В результате дистилляции получали 40 г бесцветного масла, т.кип. 150°C (0,5 мм рт.ст.).
Пример 2: Получение (3R,4R,5S,6S)-3,4,5-триметоки-6-метилтетрагидропиран-2-ола (соединение E-2)
Раствор соединения E-1 (35,7 г, 0,162 моль) в 2 N хлористоводородной кислоте (HCl; 300 мл) нагревали при 98°C в течение 5 ч, затем охлаждали до комнатной температуры и экстрагировали дихлорметаном (CH2Cl2; 4×170 мл). Объединенные экстракты сушили над сульфатом магния (MgSO4) и обесцвечивали древесным углем. Концентрирование давало указанное в заголовке соединение (24,7 г, 74%) в виде вязкого масла. Часть необработанного продукта (960 миллиграмм (мг)) подвергали дистилляции в вакууме с использованием аппарата Кугельрора, собирая 890 мг при 145-155°C (1-2 мм).
Пример 3: Получение (3R,4R,5S,6S)-4-этокси-2,3,5-триметокси-6-метилтетрагидропирана (соединение E-3)
Серную кислоту (H2SO4, 98%; 300 мл, 5,6 моль) медленно добавляли к перемешиваемому раствору метилового спирта (2,5 л) в 4-литровой колбе Эрленмейера. Когда раствор был охлажден до комнатной температуры, добавляли 3'-OEt спиносин J/L (350 г, 0,47 моль, приготовленный, как в патенте США 6001981, 1999, DeAmics et al.) и полученный раствор нагревали при кипении с обратным холодильником в течение 6 ч. Охлажденный раствор переносили в 4-литровую разделительную воронку и экстрагировали гексанами (3×1 л). Объединенный органический раствор сушили, концентрировали в вакууме, а затем подвергали дистилляции с использованием аппарата Кугельрора, получая бесцветное масло (65 г, 60%), т.кип. 165°C (10 мТорр).
Соединения с E-3 по E-22 получали в соответствии с методиками, описанными выше и проиллюстрированными в примерах 1-3. Эти соединения приведены в таблице 1.
Пример 4: Получение трет-бутилдиметил-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)силана (соединение E-23)
Три-O-метилрамнозу (20,0 г, 97,0 ммоль) растворяли в CH2Cl2 (400 мл) и обрабатывали имидазолом (10,0 г, 147 ммоль) и хлор-трет-бутилдиметилсиланом (TBSCl; 20,0 г, 132 ммоль). Через 3 дня (д) реакционную смесь распределяли между водой (H2O) и CH2Cl2, органический слой промывали насыщенным раствором соли, сушили над сульфатом натрия (Na2SO4) и концентрировали. Неочищенный остаток дополнительно очищали с помощью хроматографии на силикагеле (10-20% этилацетат (EtOAc) в петролейном эфире в качестве элюента) с получением указанного в заголовке соединения (12,8 г, 82%) в виде чистого сиропа с соотношением α:β 20:80. Физические свойства главного β-эпимера: 1H-ЯМР (CDCl3) δ 4,55 (с, 1H), 3,58 (с, 3H), 3,48 (м, 1H), 3,45 (с, 3H), 3,40 (с, 3H) 3,00 (м, 3H), 1,24 (д, J=6,2Гц, 3H), 0,80 (с, 9H), 0,05 (с, 6H); EIMS m/z 263 ([M-tBu]+, 1), 88 (100).
Пример 5: Получение 5-ацетилиндан-2-илового эфира уксусной кислоты (соединение E-24)
При 5-10°C к смеси хлорида алюминия (AlCl3; 30,6 г, 0,229 моль) в дисульфиде углерода (CS2; 160 мл) добавляли ацетилхлорид (12 мл, 13,2 г, 0,169 моль). К этой смеси добавляли раствор индан-2-илового эфира уксусной кислоты (19,9 г, 0,113 моль, получен в соответствии со способом, описанным в Can. J. Chem. 1967, 45, 1185) в ацетилхлориде (12 мл), поддерживая температуру ниже 11°C. Содержимое перемешивали при 5°C в течение 3 ч и затем осторожно добавляли в ледяную воду (350 мл), содержащую концентрированную HCl (60 мл). Смесь экстрагировали CH2Cl2 (2×), объединенные экстракты промывали H2O и сушили над Na2SO4. Концентрирование давало указанное в заголовке соединение (23,8 г, 97%) в виде твердого вещества: 1H-ЯМР δ 7,84 (с, 1H), 7,82 (м, 1H), 7,32 (д, J=7,0Гц, 1H), 5,55 (м, 1H), 3,40-3,32 (м, 2H), 3,10-3,05 (м, 2H), 2,60 (с, 3Н), 2,04 (с, 3H); EIMS m/z 158 ([M-AcOH]+, 42), 143 (100)
Пример 6: Получение 1-(2-гидрокси-индан-5-ил)этанона (соединение E-25)
Раствор 5-ацетилиндан-2-илового эфира уксусной кислоты (соединение E-24; 1,50 г, 6,87 ммоль) в диоксане (7 мл) обрабатывали 1,0 N гидроксидом натрия (NaOH; 7,7 мл) и перемешивали раствор при комнатной температуре в течение ночи. Раствор разбавляли H2O (25 мл) и экстрагировали CH2Cl2 (2×). Объединенные экстракты сушили (MgSO4) и концентрировали с получением указанного в заголовке соединения (1,06 г, 88%): 1H-ЯМР δ 7,85 (с, 1H), 7,79 (м, 1H), 7,33 (д, J=7,7Гц, 1H), 4,76 (м, 1H), 3,29-3,21 (м, 2H), 3,00-2,94 (м, 2H), 2,59 (с, 3H), 1,73 (д, J=5,3Гц, 1H); EIMS m/z 176 (M+, 76), 161 (100).
Пример 7: Получение 1-[2-((2R,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)индан-5-ил]этанона (соединение E-26)
При 0-5°C к раствору 1-(2-гидроксииндан-5-ил)этанона (соединение E-25; 440 мг, 2,50 ммоль) и 92% масс./масс. трет-бутилдиметил-(3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)силана (соединение E-23; 1,00 г, 2,87 ммоль) в CH2C12 (6 мл) через шприц добавляли триметилсилилтрифлат (0,12 мл, 146 мг, 0,66 ммоль). Содержимому давали постепенно нагреться до комнатной температуры и перемешивали в течение ночи. Раствор разбавляли CH2Cl2 и промывали один раз насыщенным бикарбонатом натрия (NaHCO3). Водную фазу экстрагировали один раз CH2Cl2 и сушили объединенные органические фазы (MgSO4). Концентрирование давало масло бледно-зеленого цвета (783 мг, 86%): 1H-ЯМР (CDCl3) δ 7,79 (м, 2H), 7,29 (д, J=7,6Гц, 1H), 4,97 (с, 1H), 4,64 (м, 1H), 3,67-3,40 (м, 3H), 3,55 (с, 3H), 3,50 (с, 3H), 3,45 (с, 3H), 3,21-2,97 (м, 5H), 2,59 (с, 3H), 1,30 (д, J=6,3Гц, 1H); ИК (чистый) 1683 см-1.
Пример 8: Получение 3-диметиламино-1-[2-((2R,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)индан-5-ил]пропенона (соединение E-27)
Раствор 1-[2-(3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)индан-5-ил]этанона (соединение E-26; 2,02 г, 5,54 ммоль) и незначительного количества 2,4,6-три-трет-бутилфенола в диметилформамид-диметилацетале (ДМФА-DMA; 12 мл) нагревали при 90-100°C в течение 48 ч. При охлаждении раствор концентрировали с получением масла (2,4 г), которое очищали методом хроматографии на силикагеле с использованием EtOAc в качестве элюента, удаляя 620 мг непрореагировавшего исходного вещества. Требуемый продукт элюировали EtOAc, содержащим 3% триэтиламина (Et3N), с получением указанного в заголовке соединения (1,5 г, 64%): т.пл. 118-123,5°C; 1H-ЯМР (CDCl3) δ 7,80 (д, J=12,6Гц, 1H), 7,72 (м, 2H), 7,24 (д, J=7,6Гц, 1H), 5,70 (д, J=12,6Гц, 1H), 4,98 (с, 1H), 4,64 (м, 1H), 3,62-3,42 (м, 3H), 3,55 (с, 3H), 3,50 (с, 3H), 3,46 (с, 3H), 3,26-2,95 (м, 5H), 1,32 (д, J=6,3Гц, 1Н); ИК (чистый) 1644 см-1; ESIMS m/z 420 ([M+H]+); Анал. вычислено для C23H33NO6: C, 65,84; H, 7,93; N, 3,34. Найдено: C, 65,36; H, 7,80; N, 3,27.
Пример 9: Общая методика получения пиримидинов
Реакционные пробирки заполняли 0,714 ммоль гидрогалогенида бензамидина, 3 мл EtOH, 0,76 мл (0,71 ммоль) 0,93 М раствора этоксида натрия в EtOH и 1,35 мл (0,24 ммоль) 0,18 М раствора соединения E-27 в тетрагидрофуране (ТГФ). Смеси перемешивали при 75°C в течение 42 ч, а затем выпаривали в вакууме досуха. Остатки разбавляли этиловым эфиром (Et2O) и насыщенным хлоридом натрия (NaCl). Нерастворимое вещество отфильтровывали, органические фазы промывали насыщенным NaCl и сушили (MgSO4). Концентрирование давало неочищенные вещества, которые очищали методом хроматографии. Следующие соединения получали с использованием условий, изложенных в примере 9.
2-(4-Хлорфенил)-4-[2-((2R,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)индан-5-ил]пиримидин (соединение 1С)
Хроматография на силикагеле (CH2Cl2, затем 30% EtOAc в CH2Cl2) дает указанное в заголовке соединение (45 мг, 37%): 1H-ЯМР (CDCl3) δ 8,8 (д, 1H), 8,5 (д, 2H), 8,1 (д, 1H), 8,0 (м, 1H), 7,6 (д, 1H), 7,5 (д, 2H), 7,4 (д, 1H), 5,0 (с, 1H), 4,7 (м, 1H), 3,6-3,4 (м, 3H), 3,6 (с, 3H), 3,5 (с, 3H), 3,4 (с, 3H), 3,3-3,0 (м, 5H), 1,3 (д, 3H); ESIMS m/z 513 ([M+H+2]+, 40), 511 ([M+H]+, 100), 545 ([M+H]+, 100).
2-(2,4-Дихлорфенил)-4-[2-((2R,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)индан-5-ил]пиримидин (соединение 2C)
Хроматография на силикагеле (3:2 CH2Cl2/EtOAc) дает указанное в заголовке соединение (55 мг, 27%): 1H-ЯМР (CDCl3) δ 8,86 (д, J=5,3Гц, 1H), 8,06 (д, J=7,6Гц, 1H,), 7,97 (м, 1H), 7,84 (дд, J=8,2, 1,3Гц, 1H), 7,66 (д, J=5,3Гц, 1H), 7,56 (д, J=2,0Гц, 1H), 7,40-7,35 (м, 2H), 5,00 (с, 1H), 4,67 (м, 1H), 3,62-3,42 (м, 3H), 3,55 (с, 3H), 3,51 (с, 3H), 3,45 (с, 3H), 3,30-3,05 (м, 5H), 1,32 (д, J=6,3Гц, 3H); ESIMS m/z 549 ([M+H+4]+, 15), 547 ([M+H+2]+, 71), 545 ([M+H]+, 100); Анал. вычислено для C28H30Cl2N2O5: C, 61,65; H, 5,54; N, 5,14. Найдено: C, 61,37; H, 5,38; N, 5,12.
2-(3-Трифторметилфенил)-4-[2-((2R,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)индан-5-ил]пиримидин (Соединение 3C)
С помощью обращенно-фазовой жидкостной хроматографии (диоксид кремния, модифицированный C18 амидным линкером; градиентный метод, проходящий с использованием смеси от 3:2 H2O/CH3CN до 95:5 CH3CN/H2O, содержащей 0,1% уксусной кислоты) получали указанное в заголовке соединение (20 мг, 15%): 1H-ЯМ