Носитель для лекарственных средств и биологически активных веществ для лечения и диагностики и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины и фармацевтики, а именно к носителю для лекарственных средств и биологически активных веществ для лечения и диагностики, представляющему наночастицу, имеющую ядро из диоксида циркония, покрытое оболочкой из оксидов железа, форму, близкую к сферической, и размер в пределах 15-100 нм, и способу получения носителя, при котором в раствор, содержащий катионы железа II, железа III и циркония IV, имеющий рН=7,5, добавляют аммонийную смесь до значения рН=8-9 со скоростью, обеспечивающей получение наночастиц заданного размера в пределах 15-100 нм, продукт отделяют центрифугированием, промывают и подвергают лиофильной сушке. Изобретение обеспечивает создание нового носителя для лекарственных средств и биологически активных веществ. 2 н. и 2 з.п. ф-лы, 2 пр., 1 табл., 3 ил.
Реферат
Группа изобретений относится к медицине, фармацевтической промышленности и биотехнологии, а именно к носителю для лекарственных средств и биологически активных веществ для лечения и диагностики и способу его получения. Носитель может быть использован для доставки лекарственных или других биологически активных веществ в организм человека или животного и регулируемого их высвобождения при диагностике и лечении. Способ получения носителя может быть использован при его производстве.
Известен препарат жидкофазных композиций, содержащих наноструктурные металлсодержащие частицы с высокой бактерицидной, каталитической, антикоррозионной и магнитной активностью, и способ его получения (RU 2322327, опубл. 20.04.2008). Наноструктурные металлические и биметаллические частицы, а также наноструктурные частицы оксидов и сульфидов получают путем восстановления ионов металлов сольватированными электронами и радикалами в системе обратных мицелл в отсутствие кислорода воздуха. Способ получения мицеллярного раствора стабильных металлсодержащих наноструктурных частиц включает приготовление обратно-мицеллярной дисперсии на основе раствора поверхностно-активного вещества в неполярном растворителе, введение водного или водно-спиртового раствора ионов солей металлов, проведение перед началом процесса восстановления перемешивания или ультразвуковой обработки дисперсии, деаэрирование и проведение восстановления сольватированными электронами и радикалами, генерируемыми при воздействии на дисперсию ионизирующего излучения. Изобретение обеспечивает контролируемое получение в жидкой фазе стабильных наноразмерных металлических, биметаллических частиц и наноструктур оксидов и сульфидов металлов.
К недостаткам указанных жидкофазных композиций и способа их получения следует отнести сложность процесса синтеза, заключающуюся в необходимости обеспечения инертной атмосферы, не содержащей кислорода (деаэрирование), предварительном приготовлении обратно-мицеллярной дисперсии на основе раствора поверхностно-активного вещества в неполярном растворителе, применении источника ионизирующего излучения для генерирования сольватированных электронов и радикалов.
Известен носитель, представляющий собой наночастицу, состоящую из суперпарамагнитных оксидов железа или из чистого железа, имеющего оксидный слой, и связанную с, по меньшей мере, одним терапевтически активным веществом посредством линкера (RU 2007141588/15, заявл. 12.04.06; опубл. 20.05.09). Магнитные наночастицы (МНЧ) из оксидов железа обладают низкой токсичностью и стабильностью физических характеристик, что обусловило их применение в биомедицине. Известный носитель является наиболее близким по технической сущности к заявленному носителю для лекарственных средств и биологически активных веществ для лечения и диагностики.
Однако МНЧ из магнетита имеют сложную, угловатую форму, отличную от сферической, и широкое полидисперсное распределение по размерам. Для их использования необходимо применять специальные режимы обработки, поверхностно-активные вещества (ПАВ) и способы их введения в раствор. Для медикаментозного и препаративного контроля доставки биологически активных веществ на носитель, помимо целевого компонента, необходимо наносить маркер (флуоресцеин или подобные соединения).
Известен способ получения наночастиц оксида металла, включающий обработку исходной неорганической соли соответствующего металла в среде реакционного газа при высоких температурах, в котором порошок исходной соли обрабатывают в токе водяного пара при скорости подачи 20-30 мл/мин и температуре 500-900°C (RU 2384522, опубл. 20.03.2010). Способ основан на реакции термогидролиза, при котором происходит реакция химического обмена с образованием оксида соответствующего металла и газообразного оксида. Способ позволяет получать порошкообразный продукт наночастиц оксидов металлов с размером частиц 3-10 нм. Данный способ принят авторами в качестве ближайшего аналога заявленного способа.
К недостаткам способа следует отнести его сложность, необходимость использования специального оборудования и высоких температур. Кроме того, наночастицы оксидов металлов с размером 3-10 нм не могут быть использованы в качестве носителя для лекарственных средств, так как очень быстро выводятся из организма. Для этих целей требуются частицы с размером 15-100 нм.
Технический результат, достигаемый группой изобретений, заключается в создании носителя для лекарственных средств и биологически активных веществ для лечения и диагностики с формой наночастиц, близкой к сферической, и заданным размером, примерно от 15 до 100 нм.
Заявленный технический результат достигается в носителе для лекарственных средств и биологически активных веществ для лечения и диагностики, представляющем наночастицу, содержащую оксиды железа, в котором наночастица имеет ядро из диоксида циркония, покрытое оболочкой из оксидов железа, форму, близкую к сферической, и размер в пределах 15-100 нм.
Предпочтительно, чтобы наночастица имела размер 15-20 нм с ядром из диоксида циркония размером 5-10 нм.
Заявленный технический результат достигается также в способе получения носителя для лекарственных средств и биологически активных веществ для лечения и диагностики, включающем обработку исходной неорганической соли, в котором в раствор, содержащий катионы железа II и железа III и циркония IV, имеющий pH=7,5, добавляют аммонийную смесь до значения pH=8-9 со скоростью, обеспечивающей получение наночастиц заданного размера в пределах 15-100 нм, продукт отделяют центрифугированием, промывают и подвергают лиофильной сушке.
Для получения наночастиц размером 15-20 нм с ядром из диоксида циркония размером 5-10 нм катионы железа II, железа III и циркония IV в растворе берут в мольном соотношении 2:1:1 и добавляют водную аммонийную смесь, содержащую 25% гидроксида аммония и 1% ацетата аммония, со скоростью 4 мл/мин.
За счет использования диоксид циркониевого ядра форма наночастиц близка к сферической. Такой носитель можно использовать без дополнительной обработки для сорбции действующих веществ. Форма наночастицы, близкая к сферической, обеспечивает равномерное покрытие ее лекарственным препаратом при использовании ее в качестве носителя, а также наибольшую устойчивость получаемого коллоидного раствора к оседанию и расслоению.
Наличие циркониевого ядра может являться маркером для определения количественного содержания наночастиц в тканях при проведении лабораторных исследований на токсичность, биосовместимость и биораспределение. Для этого достаточно вести контроль за содержанием в тканях Zr рядом физико-химических методов анализа, например атомно-эмиссионной спектроскопией тканей.
Поскольку произведение растворимости гидроксида циркония (ПР=2·10-24) ниже произведения растворимости оксида железа II (ПР=5·10-10) и гидроксида железа III (ПР=3,2·10-17), при добавлении аммонийной смеси с определенной скоростью на первой стадии образуются наночастицы гидроксида циркония, имеющие форму, близкую к сферической. Затем на ядро из гидроксида циркония начинает наслаиваться магнетит - смесь оксидов железа II и железа III.
В водных растворах ионы циркония и железа гидролизуются, последующее взаимодействие с ОН-группами приводит к образованию гидроокисей.
Переход от гидроокисей к оксидам металлов происходит на стадии лиофильного высушивания.
Заявленный способ обеспечивает форму ядра и окончательную форму наночастицы, близкую к сферической, и размер наночастиц примерно от 15 до 100 нм без использования сложных технологий и высоких температур. Наночастицы размером менее 10 нм быстро вымываются из организма путем фильтрации через почечный фильтр. Наночастицы размером более 100 нм быстро элиминируются из кровотока элементами ретикуло-эндотелиальной системы.
Назначение аммонийной смеси обусловлено следующим.
Раствор аммиака, с одной стороны, является источником ОН-групп, необходимых для образования гидроокисей. С другой стороны, аммиак связывает ионы железа, препятствуя преждевременному выпадению гидроокисей железа. Исходя из этого, кроме раствора аммиака, другие щелочи не подойдут для получения такого рода наночастиц, так как гидроокиси железа и циркония будут выпадать беспорядочно.
При добавлении аммонийной смеси образуется гидроокись циркония, на частицах которой ацетат аммония адсорбируется, так как находится в виде СН3СОО-, следовательно, поверхность частиц приобретает отрицательный заряд и притягивает ионы железа II и железа III из раствора согласно законам электростатики, при этом происходит последующее формирование оболочки из гидроокиси железа именно на поверхности гидроокиси циркония, а не хаотично в объеме раствора. Ацетат аммония - это хороший ПАВ, и его не требуется большое количество.
Варьируя соотношение катионов, скорость подачи аммонийной смеси и конечное значение рН, можно варьировать размер циркониевого ядра и окончательный размер наночастиц в пределах примерно 15-100 нм.
В качестве водорастворимых солей, содержащих катионы железа (II), железа (III) и циркония (IV), могут быть использованы сульфаты, нитраты, хлориды, бромиды.
Для получения наночастиц размером 15-20 нм с ядром из диоксида циркония размером 5-10 нм аммонийная смесь содержит 25% гидроксида аммония и 1% ацетата аммония. Мольное соотношение катионов железа II, железа III и циркония IV подобрано экспериментально и составляет 2:1:1. Скорость подачи аммонийной смеси также подобрана экспериментально и составляет 4 мл/мин. Оба этих параметра, а именно соотношение реагентов и скорость подачи аммонийной смеси, обеспечивают образование в растворе наночастиц оксида циркония размером 5-10 нм. Затем на эти частицы начинает наслаиваться магнетит, вплоть до установления значения рН=8-9, что обеспечивает окончательный размер наночастиц 15-20 нм.
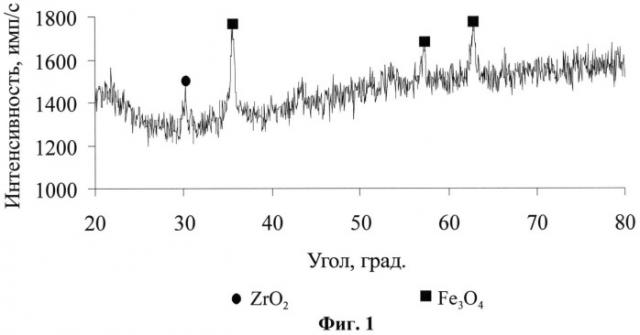
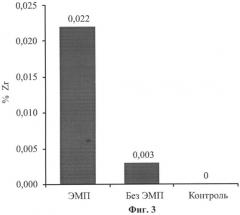
На фиг. 1 представлены результаты рентгенодифракционного анализа наночастиц с ядром ZrO2 и оболочкой Fe3O4; на фиг. 2 - микрофотографии наночастиц: а - наночастицы Fe3O4; б - наночастицы с ядром ZrO2 и оболочкой Fe3O4; на фиг. 3 - содержание циркония в образцах тканей.
Способ осуществляют, например, следующим образом.
В раствор, содержащий соли катионов железа II, железа III и циркония IV, при постоянном перемешивании и стандартной температуре (25 град. С) с заданной скоростью добавляют аммонийную смесь, состоящую из раствора гидроксида аммония и раствора ацетата аммония. Синтез проводят до фиксации насыщенно черной окраски и установления значения рН = 8-9. Полученный коллоидный продукт отделяют центрифугированием и промывают 4 раза дистиллированной водой. Для подготовки сухой пробы полученные наночастицы отфильтровывают и подвергают лиофильной сушке при температуре -48 град.С в течение 48 часов.
Группа изобретений иллюстрируется следующими примерами.
1. К раствору, содержащему смесь сульфатов железа II, железа III и нитрат циркония в мольном соотношении 2:1:1 и объемом 700 мл, при постоянном перемешивании добавляли смесь 25% раствора гидроксида аммония и 1% раствора ацетата аммония со скоростью 4 мл/мин.. Таким образом, отношение железа и ацетата аммония составляло 2:1:0.1. Синтез проводили до фиксации насыщенно черной окраски и установления значения рН=8-9. На следующий день полученный коллоидный продукт отделяли центрифугированием и промывали 4 раза дистиллированной водой. Для подготовки сухой пробы полученные наночастицы отфильтровывали и подвергали лиофильной сушке при температуре -48°С в течение 48 часов.
Для подтверждения химического состава полученных наночастиц проводили рентгенодифракционный анализ. Результаты рентгенодифракционного анализа (фиг.1) подтверждают химический состав наночастиц.
Удельную поверхность наночастиц определяли по упрощенному методу БЭТ на установке Клячко-Гурвича. Удельная поверхность составила около 100 м2/г, что говорит о хорошей адсорбционной емкости наночастиц.
Для определения размеров наночастиц использовали метод сканирующей электронной растровой микроскопии.
Для сравнения были получены наночастицы чистого магнетита. Микрофотографии наночастиц чистого магнетита и заявленного носителя представлены на фиг.2.
Наночастицы чистого магнетита (фиг.2.а) имеют сложную, угловатую форму и широкое полидисперсное распределение по размерам. Наночастицы заявленного носителя, напротив, имеют форму, близкую к сферической, и размеры 15-20 нм при размере ядра 5-10 нм (фиг.2.б). Такой наноматериал можно использовать без дополнительной обработки для сорбции действующих веществ.
Для реализации адресной доставки наночастиц в ткани опытных животных был использован соленоид с параметрами, указанными в таблице 1.
| Таблица 1 | ||
| №п/п | Параметр | Значение |
| 1 | Диаметр соленоида (D), мм | 35.0 |
| 2 | Длина рабочей части соленоида (l), мм | 40.0 |
| 3 | Число витков (N) | 800 |
| 4 | Диаметр провода (d), мм | 0,22 |
| 5 | Сопротивление (R), Ом | 40 |
| 6 | Напряжение питания (U), В | 20.0 |
| 7 | Сила тока (I), А | 0.5 |
Наиболее эффективное расстояние от центра соленоида до объекта доставки определили математически, и оно составило 7 мм.
Эксперименты выполняли на крысах самцах линии Wistar, массой 250-300 грамм. Животные были разделены на следующие группы:
1. Контроль, в течение 10 минут производили внутривенное введение 0,9% раствора NaCl в объеме 1 мл, n = 5.
2. Внутривенное введение наночастиц в дозировке 1 мг/мл без воздействия электромагнитного поля, n = 5.
3. Введение наночастиц в дозировке 1 мг/мл с воздействием электромагнитного поля на бедро крысы в течение 10 минут, n = 5.
Через 20 минут после начала введения физиологического раствора или суспензии наночастиц осуществляли выведение животного из эксперимента и забирали мышцы бедра для анализа. Забранные образцы тканей сушили в сухожаровом шкафу при температуре 90°С в течение 24 часов, затем измельчали до порошкообразного состояния и растворяли в серной кислоте. Анализ полученного сернокислого раствора на содержание циркония проводили атомно-эмиссионным методом с индуктивно связанной плазмой (АЭСИСП) по стандартной методике.
Анализ результатов (фиг.3) показал, что в контроле циркония не обнаружено. В эксперименте с введением наночастиц и воздействием электромагнитного поля наблюдается максимальный уровень циркония, что свидетельствует о накоплении наночастиц и возможности таргетной доставки лекарственных препаратов в ткани нижней конечности.
2. Синтез наночастиц осуществляли, так же как в примере 1, при мольном соотношении катионов железа II, железа III и циркония IV 3:1:2. Скорость подачи аммонийной смеси была 10 мл/мин. Полученные наночастицы имели размер 40-50 нм и размер ядра 18-20 нм.
Использование заявленной группы изобретений позволяет получить носитель для лекарственных средств и биологически активных веществ для лечения и диагностики с формой наночастиц, близкой к сферической, и заданным размером примерно от 15 до 100 нм.
1. Носитель для лекарственных средств и биологически активных веществ для лечения и диагностики, представляющий наночастицу, содержащую оксиды железа, отличающийся тем, что наночастица имеет ядро из диоксида циркония, покрытое оболочкой из оксидов железа, форму, близкую к сферической, и размер в пределах 15-100 нм.
2. Носитель по п.1, отличающийся тем, что наночастица имеет размер 15-20 нм с ядром из диоксида циркония размером 5-10 нм.
3. Способ получения носителя для лекарственных средств и биологически активных веществ для лечения и диагностики, включающий обработку исходной неорганической соли, отличающийся тем, что в раствор, содержащий катионы железа II, железа III и циркония IV, имеющий pH=7,5, добавляют аммонийную смесь до значения pH=8-9 со скоростью, обеспечивающей получение наночастиц заданного размера в пределах 15-100 нм, продукт отделяют центрифугированием, промывают и подвергают лиофильной сушке.
4. Способ по п.3, отличающийся тем, что катионы железа II, железа III и циркония IV берут в мольном соотношении 2:1:1 и добавляют водную аммонийную смесь, содержащую 25% гидроксида аммония и 1% ацетата аммония, со скоростью 4 мл/мин.