Способ управления биохимическими реакциями
Иллюстрации
Показать всеИзобретение относится к биохимии и может быть использовано для управления биохимическими реакциями in vitro и in vivo. Управление осуществляется посредством воздействия на магнитную наносуспензию, содержащую биоактивную макромолекулу, прикрепленную непосредственно или через лиганд к однодоменным магнитным наночастицам, внешним низкоинтенсивным низкочастотным переменным магнитным полем, обеспечивающим деформацию и/или изменение конформации участвующих в реакции биоактивных макромолекул. Изобретение позволяет дозированно воздействовать на конкретное звено метаболизма, отвечающее за патологическое состояние. 12 з.п. ф-лы, 11 ил.
Реферат
Изобретение относится к медицине, биологии и ветеринарии и может быть использовано для ранней диагностики болезней и адресной доставки лекарственных препаратов в заданную область организма.
Однодоменные магнитные и суперпарамагнитные наночастицы (МНЧ) широко используются в биомедицинских исследованиях, диагностике и терапии тяжелых заболеваний (Arruebo М., Fernandez-Pacheco R., Ibarra M.R., Santamaria J. II Nano Today. 2007. V. 2. No. 6. P. 22-32 [1], Mahmoudi M., Sant S., Wang В., Laurent S., Sen Т. 11 Advanced Drug Delivery Reviews. 2011. V. 63. P. 24-46 [2]). Наиболее освоенные области применения МНЧ в наномедицине - селективное повышение контрастности изображения при магнитно-резонансной томографии (Veiseh О., Gunn I.W., Zhang М. // Advanced Drug Delivery Reviews. 2010. V. 62. P. 284-304 [3], Lacroix L.-M., Ho D., Sun S. // Current Topics in Medical Chemistry. 2010. V. 10, No. 12, P. 1184-1197 [4]), адресная доставка лекарств [1-4], контролируемое освобождение лекарств из наноконтейнеров и гелей (Ноаге Т., Timko В.Р., Santamaria J., Goya G.F., Irusta S., Lau S., Stefanescu C.F., Lin D., Langer R., Kohane D.S. // Nano Letters, 2011, V. 11, P. 1395-1400 [5], Derfus A.M., Maltzahn G. von, Harris T.J., Duza Т., Vecchio K.S., Ruoslahti E., Bhatia S.N. // Adv. Mater. 2007. V. 19. P. 3932-3936 [6], Thomas C.R., Ferris D.P., Lee J.-H., Choi E., Cho M.H., Kim E.S., Stoddart J. F., Shin J.-S., Cheon J., Zink J.I. // J. Am. Chem. Soc. 2010. V. 32. P. 10623-10625 [7]) и абляция раковых опухолей методом гипертермии в радиочастотном магнитном поле (Jeyadevan В. II Ceramic Society of Japan. 2010. V. 118. No. 6. P. 391-401. [8] Hergt R., Dutz S., Muller R., Zeisberger M. II J. Phys.: Condens. Matter. 2006. V. 18. P. S2919-S2934 [9], [Gazeau F., M. Levy, Wilhem С.II Nanomedicine. 2008. V. 3. No. 6. P. 831-844 [10], Cherukuri P., Glazer E.S., Curley S.A. II Advanced Drug Delivery Reviews. 2010. V.62. P. 339-345 [11]).
Методами одномолекулярной силовой спектроскопии с помощью оптических и магнитных ловушек (пинцетов) получен большой объем экспериментальных данных о влиянии сил в диапазоне от единиц до сотен pN на конформацию и химические свойства различных макромолекул (ММ) - белков, сахаридов, ДНК, РНК и др. [12, 13], а также на каталитическую активность ферментов (Conroy R. // In Handbook of Molecular Force Spectroscopy. Ed. A. Noy. Springer. 2008. P. 23-96 [14]). Следует отметить, что в упомянутых источниках информации происходит деформация единичной ММ, а в предлагаемом подходе - ансамбля ММ, что позволяет управлять макрокинетикой биохимических реакций in vitro и in vivo в макроскопических объемах.
Известен также способ управления функциональным состоянием биологического объекта, включающий воздействие на биологический объект постоянным магнитным полем (патент США N 3890953, А 61 N 1/42, 1975). Данное воздействие осуществляет коррекцию биохимических процессов в зоне действия магнитного поля, причем указанная коррекция способствует росту костей и других тканей тела, а также позволяет стимулировать восстановительные процессы.
Недостатками указанного способа является то, что воздействие осуществляется не дозированно и недостаточно локализовано, невозможно осуществить избирательное действие поля на молекулярном уровне, т.е. воздействовать на конкретное звено метаболизма, отвечающее за данное патологическое состояние.
Также известен способ коррекции функционального состояния биологического объекта, включающий создание магнитного поля с постоянной и переменной составляющей вектора напряженности (патент США N 4932591, МПК A61N 1/40, 1990). Данный способ позволяет осуществлять воздействие на обменные процессы в клетках и управлять биохимическими реакциями при данном метаболизме, однако малая избирательность и степень воздействия на клеточном уровне не позволяют считать данную систему достаточно эффективной.
Задачей настоящего изобретения является разработка способа управления биохимическими реакциями in vitro и in vivo на молекулярном уровне посредством дозированного механического деформирования макромолекул (биоактивных молекул или низкомолекулярных органических молекул). В изобретении обеспечивается деформация ансамбля макромолекул, что позволяет управлять макрокинетикой биохимических реакций in vitro и in vivo в макроскопических объемах. Управление биохимическими реакциями осуществляется посредством изменения скорости биохимических реакций (выпуска лекарств и/или биоактивных веществ) на молекулярном уровне через наномеханическое воздействие на активные макромолекулы (ферменты, ингибиторы, ДНК, РНК и др.). Выпуск лекарств и/или биоактивных веществ может, например, происходить в результате биохимических реакций, протекающих в поверхностном слое наноконтейнера, в котором разрыв химических связей может привести к частичному или полному разрушению слоя и выходу биоактивных веществ наружу.
Поставленная задача решается тем, что способ управления скоростью биохимических реакций или высвобождения лекарственных средств из наноагрегатов осуществляют в магнитных наносуспензиях, содержащих агрегаты из магнитных однодоменных наночастиц с химически пришитыми к ним биологическими макромолекулами посредством наложения внешнего низкоинтенсивного низкочастотного негреющего неионизирующего переменного магнитного поля.
Под низкоинтенсивными в настоящем изобретении понимаются магнитные поля, сами по себе не приводящие к изменению констант скоростей и равновесия реагирующих веществ (обычно значительно меньше 106 А/м), а под негреющими - не вызывающими нагрева ни магнитных наночастиц, ни растворителя (обычно это низкочастотные магнитные поля с частотой менее нескольких десятков кГц). Для того чтобы переменное магнитное поле оказывало эффективное механическое действие на магнитные наночастицы, приводя их в колебательно-вращательное движение и передавая деформацию прикрепленным к ним макромолекулам, размеры магнитных наночастиц должны быть меньше, чем это необходимо для перехода в однодоменное состояние, но больше критического, при котором происходит переход в суперпарамагнитное состояние. Кроме того, частота переменного магнитного поля должна быть ниже некоторой критической величины, равной обратному времени Брауновской релаксации магнитных моментов наночастиц.
Под управлением биохимическими реакциями понимается изменение константы равновесия или скорости реакции в большую или меньшую сторону относительно их значений без магнитного поля.
В качестве магнитных наносуспензий могут быть использованы растворы однодоменных частиц ферромагнитных или ферримагнитных материалов в воде, физиологическом растворе или других биосовместимых жидкостях. В качестве биоактивных макромолекул могут быть использованы ферменты, ингибиторы, ДНК, РНК и др. В качестве магнитных наночастиц могут быть использованы оксиды железа (Fe304, Fe203, различные железосодержащие ферриты, соединения редкоземельных элементов (Gd, Dy, Eu) и др.
Макромолекулы могут быть прикреплены химически или за счет кулоновских сил к двум или более магнитным наночастицам непосредственно или через промежуточные лиганды так, чтобы при вращении наночастиц в переменном магнитном поле их окружные перемещения вызывали растяжение, скручивание или сдвиг в структуре прикрепленных макромолекул. Для этого химическую реакцию пришивания макромолекулы к наночастице проводят так, чтобы активная биомолекула прикреплялась двумя или большим числом связей к соседним магнитным наночастицам в агрегате или к двум соседним складкам на молекуле-лиганде, чтобы передача перемещения на поверхности наночастиц на прикрепленные к ним макромолекулы вызывали наибольшие деформации в структуре макромолекулы.
В качестве лиганда могут использоваться полимерные молекулы регулируемой длины и жесткости.
Управление кинетикой ферментативной реакции может осуществляться в водном растворе, содержащем взвешенные МНЧ магнетита (FeO·Fe2O3) и пришитые к ним через полимерные мостики белки (например, молекулы фермента химотрипсина), магнитным полем напряженностью Н от 5 до 500 kA/m и частотой 20-5000 Hz, в частности 30-1000Hz.
Изменение конформации и разрушение слабых связей в белковой макромолекуле фермента может осуществляться прикладыванием к ней сил растяжения, сжатия, сдвига или скручивания в процессе ориентации магнитных моментов МНЧ по полю.
Новизна предлагаемого направления использования МНЧ заключается в создании с их помощью контролируемых деформаций химических связей для наномеханического управления топологией и каталитическими свойствами биоактивных макромолекул (ММ), например, специфических белков, катализаторов биохимических процессов - ферментов. Деформирующая сила прикладывается к ММ в результате поворотов МНЧ под действием переменного низкочастотного (негреющего) внешнего магнитного поля (МП). В отсутствие МП в ансамбле изолированных МНЧ устанавливается хаотическая ориентация магнитных моментов. Характерное время ориентационной релаксации (упорядочения магнитных моментов МНЧ в МП или их хаотизации при его отключении) определяется гидродинамическим радиусом частицы Rhd, вязкостью η и температурой Т окружающей среды:
τ r = ( 4 η π R h d 3 ) / ( 3 k B T ) ( 1 )
здесь kB - постоянная Больцмана.
Для водных суспензий МНЧ с Rhd=10…20 nm при Т=300 К величина
τr составляет 1…10 µs. Внешнее МП стремится сориентировать вектора намагниченности МНЧ в одном направлении, что приводит к повороту последних на угол от 0 до 180°. Смещение конца ММ, прикрепленной к МНЧ, достигает максимума Δl=πRhd при µ0 Н mi >> kB T и τf >> τr, где µ0 - магнитная постоянная, τf - характерное время изменения МП (для гармонического поля частотой f величина τf=1/2πf). Данные условия накладывают ограничения на минимальный и максимальный диаметр частиц, а также параметры переменных магнитных полей, с помощью которых можно осуществлять наномеханическое управление кинетикой биохимических реакций в магнитных наносуспензиях с наименьшими затратами энергии.
Заявляемое изобретение поясняется чертежами.
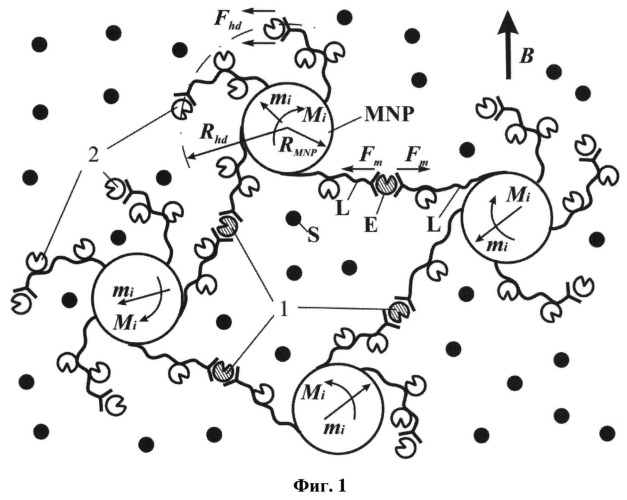
На фиг.1 представлена структурная схема, поясняющая архитектуру комплексов, содержащих однодоменные магнитные частицы (MNP), молекулы белка - фермента (Е), молекулы линкеры (L) (ПЕГ-полиметакриловая кислота, или ПЕГ-полиакриловая кислота, или ПЕГ-полиаспарагиновая кислота) и субстрата (S). mi - магнитный момент MNP, Mi - действующий на нее механический момент, Fhd и Fm - гидродинамическая и контактная силы, приложенные к молекуле фермента, соответственно.
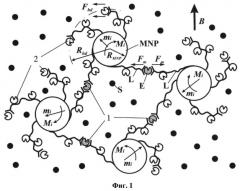
На фиг.2 представлен диапазон сил и деформаций, которые приводят к различным наномеханическим эффектам в макромолекулах (по данным Single Molecular Spectroscopy).
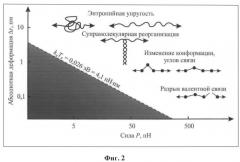
На фиг.3 представлена блок-схема экспериментального комплекса для воздействия НЧ МП на магнитные наносуспензии. Источник переменного тока, регулируемый по частоте и амплитуде, потребляемой мощностью до 2 kVA. Индуктор, состоящий из электромагнитов для создания в зазоре магнитопровода переменного МП, содержит индукционный датчик МП и датчик температуры.
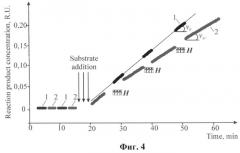
На фиг.4 представлена кинетика реакции E+S в МП Н=100 kA/m, f=50 Hz на фоне контрольного эксперимента в отсутствие МП. 1 - контрольный образец без обработки МП; 2 - образец суспензии, обработанный МП; v0 - скорость реакции в контрольном эксперименте без обработки реагентов в МП; vM - скорость реакции после обработки реагентов в МП.
На фиг.5 представлена зависимость эффекта торможения реакции E+S вследствие магнитной обработки суспензии с предварительно введенным субстратом: а) от числа экспозиций в МП; б) от напряженности МП. Напряженность МП: 1-0; 2-34; 3-66; 4-110; 5-152; 6-220 kA/m.
На фиг.6 представлена кинетика реакции, контролируемая абсорбцией света продуктом реакции в спектрфотометре (СФ) на длине волны 380 нм. Условия реакции: 2 ml Tris рН8.2+3ul ChT+3ul BTNA. Частота МП 5000 Hz, напряженность МП Н ~ 13 кА/m, экспозиция 3 min.
На фиг.7 представлена кинетика реакции, контролируемая абсорбцией света продуктом реакции в СФ на 380 нм. Условия реакции: 2ml Tris рН8.2+3ul ChT+20ul IT13+2min+3ul BTNA. Частота МП 5000 Hz, напряженность МП H ~ 13 кА/min, экспозиция 3 min.
На фиг.8 представлена кинетика реакции, контролируемая абсорбцией света продуктом реакции в СФ на 380 нм. Условия реакции: 2ml Tris рН8.2+4ul ChT+40ul IT13+2min+3ul BTNA. Частота МП 1000 Hz, напряженность МП H ~ 70 кА/m, экспозиция 3 min.
На фиг.9 представлена кинетика реакции, контролируемая абсорбцией света продуктом реакции в СФ на 380 нм. Условия реакции: 2ml Tris рН8.2+4ul ChT+60ul IT13+2min+3ul BTNA. Частота МП 1000 Hz, напряженность МП H ~ 13 кА/m, экспозиция 3 min, МП+МП - после повторной экспозиции в тех же условиях.
На фиг.10 представлена полевая зависимость эффекта замедления реакции с участием фермента ChTPAA5.
На фиг.11 представлена полевая зависимость эффекта замедления реакции с участием фермента ChTPMA5.
В зависимости от того, прикреплена ли ММ к одной или двум/нескольким МНЧ (что определяется концентрацией МНЧ в суспензии, а также физико-химическими свойствами оболочки из полимерных молекул на МНЧ) могут реализоваться два различных механизма действия МП на ММ - гидродинамический и контактный (фиг.1). Первый аналогичен гидродинамическому вытягиванию ММ в потоке жидкости (например, ДНК перед секвенированием). Приложенная к ММ сила при этом пропорциональна f, η и Rhd. В модели сферической глобулы радиусом Rhd, прикрепленной полимерным линкером к МНЧ, сила Fhd по закону Стокса равна
F h d = 6 π η R h d v = 12 π 2 η R h d 2 f ( 2 )
Здесь v=2πfRhd - линейная скорость движения центра глобулы ММ фермента относительно неподвижной жидкости.
Вторая ситуация аналогична возникающей при деформировании ММ с помощью магнитных пинцетов (Stigter D., Bustamante С.// Biophysical J. 1998. V. 75. P. 1197-1210 [12], Neuman K.E., Nagy A. // Review. Nature Methods. 2008. V.5. No. 6. P. 491-505 [13]).
При этом максимальная деформирующая сила Fc обратно пропорциональна Rhd и не зависит от η и f (при условии, что τf >> τr):
F m ≈ ( m μ 0 H ) / R h d = 4 / 3 ( π R m 3 ρ I μ 0 H ) / R h d ( 3 )
здесь m=(4/3) π R m 3 ρ I μ 0 - магнитный момент сферической частицы магнетита радиусом Rm, удельной намагниченностью I и плотностью ρ.
Диапазон сил от единиц до сотен пиконьютон, создаваемый таким способом, достаточен для проведения любых манипуляций с макромолекулами (фиг.2). Легко заметить, что схематически ситуация, которая возникает при наложении переменного МП на магнитную наносуспензию с белками, прикрепленными к магнитным наночастицам, физически близка той, что реализуется в магнитных ловушках для единичных молекул. Это дает возможность сверить оценочные данные относительно сил, развиваемых в магнитной суспензии наночастицами, с реально измеренными в опытах с магнитными пинцетами.
В магнитных суспензиях, содержащих однодоменные частицы магнитоупорядоченных материалов с диаметром не менее 12-14 nm, в отличие от единичных ММ наномеханическому воздействию подвергается большой ансамбль ММ одновременно. Это приводит к более сложной, но статистически определенной ситуации. Кроме того, в однородном МП (или близком к таковому при больших объемах образцов) можно рассчитывать только на повороты магнитных наночастиц в МП и, следовательно, окружные перемещения в единицы-десятки нм, а не на поступательное движение наночастиц на сотни нм, как в магнитных пинцетах, оперирующих сильно неоднородными МП.
При увеличении напряженности поля могут меняться межатомные расстояния, затем конформация ММ и затем разрушаться сначала слабые связи (водородные, ван-дер-ваальсовы), а при дальнейшем росте поля - и ковалентные. Любое из этих событий, а тем более их совокупность способны внести сильные изменения в динамику элементарных актов, их продолжительность, частоту успешных попыток различных перестроек в структуре, а следовательно - и в микро- и макрокинетику процесса.
Изменение длины и углов межатомных связей, конформации и разрушение слабых связей в белковой макромолекуле фермента возникает в процессе прикладывания к ней при ориентации магнитных моментов МНЧ вдоль вектора внешнего магнитного поля.
Указанная совокупность существенных признаков позволила получить новый эффект влияния слабого низкочастотного МП на кинетику ферментативной реакции в магнитной наносуспензии и выявить зависимость эффекта как уменьшения, так и увеличения скорости реакции от напряженности и частоты магнитного поля (при различной напряженности Н в диапазоне от 5 до 500 kA/m и частоте 20-5000 Hz), то есть тот эффект, который не был получен всеми известными ранее средствами.
Была осуществлена проверка работы макета системы, реализующей указанные материальные воздействия, и оценка эффекта изменения скорости нескольких ферментативных реакций под действием внешнего низкочастотного магнитного поля.
Для проведения экспериментов был разработан экспериментальный комплекс, который состоит из сменных источников переменного тока, электромагнитов (ЭМ) с различными техническими параметрами и характеристиками, датчиков МП, температуры и измерительной аппаратуры (осциллограф, мультиметры). На фиг.3 показана блок-схема такого комплекса для воздействия НЧ МП на магнитные наносуспензии.
В качестве источника переменного тока в одной из серий экспериментов использовали лабораторный автотрансформатор (ЛАТР) мощностью 2000 ВА, с диапазоном регулирования напряжения 0-250 В, частотой 50 Гц, а в другой - функциональный генератор стандартных сигналов (Lab-2, Velleman) вместе с усилителем звуковых частот пиковой мощностью 100 Вт в полосе от 20 Hz до 20 kHz.
Сменные электромагниты состоят из магнитопровода (ферромагнитного сердечника) и катушек с различным количеством витков и промежуточных выводов для дискретного изменения индуктивности индуктора с целью использования их в широком диапазоне частот (от 20 Hz до 20 kHz) и создания различного по величине МП.
Между полюсами ЭМ помещается ячейка (приемник) для стандартной кюветы спектрофотометра (СФ), в которой находится исследуемая суспензия с МНЧ для воздействия на нее переменным МП. Ячейка снабжена индукционным датчиком для измерения магнитного поля и полупроводниковым датчиком для измерения температуры.
Осциллографом или мультиметром определяли величину эдс электромагнитной индукции, наведенной МП в индукционном датчике, а затем пересчитывали в амплитуду и среднеквадратическое значение напряженности МП. Пересчет производили по формуле, вытекающей из закона электромагнитной индукции М. Фарадея:
ε = ω × S × N × μ 0 H ( 4 )
Поверх обмоток ЭМ имеется охладительный водяной контур с регулируемым потоком для охлаждения самих обмоток и стабилизации температуры в кювете с помощью внешнего термостата. В процессе опыта температура устанавливалась в пределах 20…27°C. Такая же температура задавалась и в рабочем отсеке спектрофотометра с помощью внутреннего пельтье-термостата.
Влияние низкочастотного магнитного поля на ферментативную реакцию.
Методика исследования химических реакций в суспензиях с биосовместимыми магнитными наночастицами в низкочастотных магнитных полях состоит в следующем. Приготавливают суспензию с реагентами, затем ее делят на две части, одну из которых оставляют в контрольной кювете, а вторую - подвергают воздействию низкочастотного МП умеренной напряженности в разработанном экспериментальном комплексе. Наблюдаемый эффект состоит в изменении скорости протекания каталитической реакции расщепления молекул субстрата в суспензии, которую контролируют по поглощению оптического излучения на длине волны 380 нм в спектрофотометре. Создаваемые внешним МП силы, действующие на магнитные наночастицы, деформируют макромолекулы ферментов, пришитые через молекулы-линкеры к магнитным наночастицам. Это приводит к изменению скорости химической реакции в суспензии, что легко обнаружить по изменению тангенса наклона кинетической кривой (зависимости константы скорости реакции от времени), регистрируемой в спектрофотометре.
Результаты экспериментов
Были проведены эксперименты по выявлению возможного влияния МП на реакцию E+S (здесь Е - молекула фермента - химотрипсина, S - молекула субстрата - п-нитроанилида N-бензоил-L-тирозина (БТНА)) в магнитной суспензии (наночастицы магнетита Fe3O4, со средним радиусом от 8 до 12 nm (по данным электронной микроскопии). ММ фермента прикрепляли к МНЧ через промежуточную молекулу -линкер (блок-иономер полиметакриловая кислота - полиэтиленгликоль (ПМА-ПЕГ) длиной 10…20 nm). Гидродинамический радиус наночастиц с шубой из разных блок-иономеров варьировался от 20 до 28 nm (по данным динамического светорассеяния). Затем в магнитную суспензию вводили субстрат и помещали образец в переменное МП частотой f от 50 до 5000 Hz и напряженностью H от 0 до 220 kA/m. Наблюдение за кинетикой реакции осуществляли с помощью спектрфотометра (СФ) Beckman с термостатируемым кюветным отделением, который регистрировал наработку продукта реакции гидролиза БТНА, катализируемой ферментом химотрипсином, по абсорбции света на длине волны 380 nm (ей соответствует резонансное поглощение света в конечном продукте - п-нитроанилине).
Для контроля в каждом эксперименте следили за кинетикой реакции в двух одинаковых светопрозрачных кюветах с одним и тем же раствором исходных реагентов, попеременно помещая их в измерительную ячейку СФ. Одна из кювет подвергалась экспозиции в МП в течение 2.5 -3 минут несколько раз (до 4) с перерывами, необходимыми для регистрации отклика в СФ, другая - в это время находилась в термостатированном кюветном отделении СФ и устанавливалась в канал измерения на время экспозиции в МП первой кюветы. При не слишком высокой концентрации (не приводящей к коагуляции наноагрегатов в более крупные кластер и выпадению последних в осадок) исходных реагентов и нарабатываемого продукта концентрация последнего росла линейно во времени в течение десятков минут, т.е. скорость реакции была неизменной фиг.4, на котором показана кинетика реакции, контролируемая в СФ по абсорбции продуктом света на длине волны 380 нм.
В образцах, подвергавшихся действию МП, наблюдалось замедление реакции после каждой экспозиции в поле (фиг.5а). Наибольший эффект замедления реакции давала первая экспозиция в МП. Из полевой зависимости видно, что до Н ~ 100 kA/m эффект растет с полем, а при экспозиции в более сильных МП - начинает падать (фиг.56). Это свидетельствует о наличии конкурентных процессов, возникающих под действием МП.
В следующих сериях экспериментов исследовали кинетику реакции при различных частотах МП и вариациях исходных реактивов. На фиг.6 показана кинетика реакции, контролируемая абсорбцией света продуктом в СФ на 380 нм. Условия реакции: 2 ml Tris рН8.2+3ul ChT+3ul BTNA. Частота МП 5000 Hz, напряженность МП H ~ 13 kA/m, экспозиция 3 min.
На фиг.7 показана кинетика реакции, контролируемая по абсорбции света продуктами реакции в СФ на длине волны 380 nm. Условия реакции: 2ml Tris рН8.2+3ul ChT+20ul IT13+2min+3ul BTNA. Частота МП 5000 Hz, напряженность МП H ~ 13 kA/m, экспозиция 3 min.
На фиг.8 показана кинетика реакции, контролируемая по абсорбции света продуктами реакции в СФ на длине волны 380 nm. Условия реакции: 2ml Tris рН8.2+4ul ChT+40ul IT13+2min+3ul BTNA. Частота МП 1000 Hz, напряженность МП H ~ 70 kA/m, экспозиция 3 min.
На фиг.9 показана кинетика реакции, контролируемая по абсорбции света продуктами реакции в СФ на длине волны 380 nm. Условия реакции: 2ml Tris рН8.2+4ul ChT+60ul IT13+2min+3ul BTNA. Частота МП 1000 Hz, напряженность МП H ~ 13 kA/m, экспозиция 3 min, МП+МП - после повторной экспозиции в тех же условиях.
Полевые зависимости эффекта замедления реакции E+S в магнитных наносуспензиях, содержащих агрегаты из молекул фермента химотрипсина, прикрепленных к МНЧ с помощью различных лигандов (ChTPAA5 и ChTPMA5), показаны на фиг.10 и 11 соответственно. Их качественный анализ позволяет сделать следующие выводы:
1. Обе серии зависимостей имеют максимум в поле H около 120 kA/m и 75 kA/m соответственно. Максимальное замедление скорости реакции и в том, и в другом случае составило 30±5%.
2. Наличие максимумов на полевых зависимостях может быть объяснено конкуренцией двух процессов, инициируемых полем, и противоположно влияющих на кинетику. В частности, рост эффекта при увеличении поля может быть обусловлен более сильными деформациями белковой молекулы и ее активных центров в более интенсивных полях. Падение эффекта с ростом поля (после достижения максимума затормаживания реакции) может быть вызвано обрывом связей, обеспечивающих прикрепление молекулы фермента к МНЧ и передачу деформирующей силы при повороте последней в осциллирующем магнитном поле.
3. Для обоих видов агрегатов вклад в эффект первой экспозиции в МП всегда больше, чем последующих. В области максимума эффекта эта особенность проявляется наиболее ярко. Это может происходить по нескольким причинам: а) напряженности приложенного поля не хватает для приведения системы в насыщение; b) недостаточно время экспозиции в поле, чтобы успели произойти все перестройки в структуре белка (время релаксации больше продолжительности экспозиции); с) за время паузы в экспозиции образца в магнитном поле в системе успевает произойти некоторая релаксация состояний, индуцированных полем (время релаксации наведенного полем состояния сопоставимо с длительностью пауз между экспозициями в МП).
Таким образом, разработаны и экспериментально апробированы методики управления биохимическими реакциями в суспензиях с биосовместимыми магнитными наночастицами, например, оксида железа в низкочастотных магнитных полях (НЧ МП) умеренной напряженности.
С практической точки зрения способ управления биохимическими реакциями может быть реализован в организме, а также при адресной доставке лекарств нового поколения и дистанционного дозирования их активности и выпуска из транспортных наноагрегатов.
Изобретение может найти применение в клинике для диагностики и терапии различных заболеваний, в т.ч. злокачественных новообразований.
1. Способ управления биохимическими реакциями in vitro и in vivo посредством воздействия на магнитную наносуспензию, содержащую биоактивную макромолекулу, прикрепленную непосредственно или через лиганды к однодоменным магнитным наночастицам, внешним низкоинтенсивным низкочастотным переменным магнитным полем, обеспечивающим деформацию и/или изменение конформации участвующих в реакции биоактивных макромолекул.
2. Способ по п.1, характеризующийся тем, что биоактивная макромолекула в магнитной наносуспензии прикреплена к двум или большему числу магнитных наночастиц.
3. Способ по п.1, характеризующийся тем, что частоту магнитного поля выбирают ниже критической величины, равной обратному времени Брауновской релаксации магнитных моментов наночастиц в жидкости, обеспечивающей колебательно-вращательное движение магнитных наночастиц, вызывающих деформацию и/или конформацию биоактивных макромолекул.
4. Способ по п.1, характеризующийся тем, что в качестве магнитных наночастиц используют однодоменные частицы магнетита (FeO·Fe2O3) или других ферро- или ферримагнетиков.
5. Способ по п.1, характеризующийся тем, что магнитные наночастицы используют с размерами, меньше необходимых для перехода в однодоменное состояние, но больше критического, при котором происходит их переход в суперпарамагнитное состояние.
6. Способ по п.1, характеризующийся тем, что в качестве растворителя для суспензии используют воду, или физиологический раствор, или любую биосовместимую жидкость.
7. Способ по п.1, характеризующийся тем, что в качестве лиганда используют полимерные молекулы регулируемой длины и жесткости.
8. Способ по п.1, характеризующийся тем, что в качестве биоактивной макромолекулы используют молекулы фермента, ингибитора, ДНК, РНК.
9. Способ по п.1, характеризующийся тем, что магнитное поле используют напряженностью от 5 до 500 kA/m и частотой 20-5000 Hz.
10. Способ по п.1, характеризующийся тем, что управление биохимическими реакциями осуществляют через изменение скорости биохимических реакций (выпуск лекарств и/или биоактивных веществ) на молекулярном уровне.
11. Способ по п.1, характеризующийся тем, что управление биохимическими реакциями осуществляют посредством изменения межатомного расстояния, валентных углов, конформации или разрушения слабых связей в белковой макромолекуле.
12. Способ по п.1, характеризующийся тем, что белковая макромолекула прикреплена к магнитным наночастицам с возможностью обеспечения при воздействии магнитным полем передачи на макромолекулу сил растяжения, сжатия, сдвига или скручивания, вызванных посредством ориентации магнитных моментов наночастиц вдоль вектора приложенного магнитного поля.
13. Способ по п.1, характеризующийся тем, что биоактивная макромолекула прикреплена к соседним магнитным наночастицам двумя или большим числом связей или к двум соседним складкам на молекуле-лиганде.