Способ создания трансгенных животных со стабильным и высоким уровнем экспрессии целевого белка в молоке
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к методам производства в биореакторах, основанных на трансгенных млекопитающих-продуцентах, лекарственных препаратов и биологических добавок нового поколения. Способ получения трансгенных животных, продуцирующих в молоко белок со стабильным и высоким уровнем экспрессии, включает получение трансгенных млекопитающих с помощью вектора, содержащего репортерный ген, кодирующий целевой белок, промотор бета-казеинового гена коз, терминатор ростового фактора быка и эффективные двусторонние терминаторы транскрипции. Терминаторы окружают экспрессионную кассету и обладают способностью эффективно обрывать геномные транскринты в геноме млекопитающих, эффективно защищая экспрессию трансгена в геноме млекопитающего от последующей репрессии. При этом эффективные двусторонние терминаторы представляют собой любой геномный участок млекопитающего, удовлетворяющий следующим условиям: 3'-области двух одновременно экспрессирующихся и противоположно направленных генов, содержащих в своем составе участок предпоследнего экзона, последний интрон, последний экзон и сигнал полиаденилирования, расстояние между двумя сигналами полиаденилирования, расположенными на разных тяжах ДНК, не превышает 100 п.н. Способ может быть использован для получения трансгенных млекопитающих с высоким и стабильным уровнем наработки в молоке целевого белка для медицинских и исследовательских целей. 4 ил., 4 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии, в частности к методам производства в молоке трансгенных животных лекарственных препаратов и биологических добавок нового поколения, таких как антитела и сложные белковые молекулы.
Уровень техники
В биотехнологической промышленности все больше лекарственных препаратов и биологических добавок производятся в биореакторах, основанных на культурах клеток высших эукариот. Биореакторами для производства белков могут быть любые живые организмы - бактерии, грибы, растения, животные и клеточные культуры. В современном производстве наиболее широко используются бактерии и дрожжи, которые можно эффективно и экономично размножать в промышленных биотехнологических установках. Однако для нормального функционирования многих белков человека очень важны те изменения, которые происходят на посттрансляционном уровне: гликозилирование, ацетилирование, фосфорилирование, карбоксилирование и некоторые другие преобразования. В настоящее время многие антитела к белкам, нарушающим правильное развитие клеток, используются для лечения болезней, связанных с такими нарушениями. Большая часть антител производится в культурах клеток. Поэтому для производства многих белков используют культуры клеток млекопитающих, в которых происходят правильные модификации белков. Однако невысокий уровень продуктивности, сложности в организации промышленного производства и высокая цена производства определяют высокий уровень цен на лекарственные препараты, сделанные в культурах клеток млекопитающих.
Себестоимость производства рекомбинантых белков в молоке трансгенных животных намного ниже. В трансгенных животных целевой ген может экспрессироваться только в молочной железе и только во время лактации, не оказывая побочных воздействий на организм трансгенного животного. Кроме этого, в молочной железе трансгенных животных выполняется большинство посттрансляционных модификаций рекомбинантных белков и происходит правильная укладка белков, необходимая для проявления их биологической активности. В настоящее время дано разрешение на производство первых двух продуктов, синтезируемых в молочной железе: человеческий антитромбин III, полученный из трансгенных коз (фирма GTC Biotherapeutics), и рекомбинантный C1-ингибитор (Pharming Group NV), продуцируемый трансгенными кроликами.
В векторах для экспрессии рекомбинантных белков в молоке используют регуляторные области генов, белковые продукты которых составляют мажорную фракцию в молоке. Наиболее популярными являются регуляторные области лактоглобулинового гена овцы, гена кислых белков сыворотки грызунов (мышь, крыса и кролик), генов альфа-лактальбумина и альфа-S1-казеина коровы и гена бета-казеина козы [3]. Обычно в экспрессионный вектор включают протяженную 5'-область (1-7 т.п.н.), которая состоит из промотора, тканеспецифичных энхансеров, усиливающих экспрессию в молочной железе, и первых некодирующих экзонов и расположенных между ними интронов. В первых интронах генов с высокой долей вероятности могут находиться регуляторные элементы, способные усиливать транскрипцию гена. В экспрессионный вектор также включают 3'-нетранслируемую область (НТО) гена, размеры которой могут варьировать от 0.5 т.п.н. до 10 и более т.п.н. Обычно в состав 3'-НТО включают последние некодирующие экзоны и интроны гена, сайт полиаденилирования и прилежащие последовательности, которые потенциально могут усиливать терминацию транскрипции. В векторной конструкции 5'- и 3'-НТО генов могут принадлежать как одному, так и разным генам.
Среди промоторов, используемых для экспрессии в молочных железах, бета-казеиновый является одним из наиболее эффективных для экспрессии целевых белков в молочных железах трансгенных животных. На основе этого промотора создан единственный существующий коммерческий вектор для экспрессии РБ в молоке трансгенных животных - pBC1. С использованием этого вектора было получено большинство трансгенных высокоэкспрессирующих линий коз. В этом векторе используется регуляторная область бета-казеинового гена размером 6.2 т.п.н., состоящая из промотора и гормон-зависимого энхансера, который стимулирует промотор только в молочных железах. В состав вектора также входит 7.8 т.п.н. 3'-области бета-казеинового гена, которая обеспечивает эффективную терминацию транскрипции, что является необходимым условием для образования стабильной мРНК, кодирующей целевой белок. Для накопления целевого белка в молоке кодирующая часть гена должна содержать в своем составе последовательность сигнального пептида, необходимого для секреции. Такую последовательность можно взять из любого гена, кодирующего секретируемый белок.
Значительную роль в обеспечении эффективности экспрессии трансгена играет район интеграции конструкции в геном. Инъецированная ДНК обычно встраивается в области, бедные генами, в которых чаще происходят разрывы ДНК [7]. В таких районах хроматин обычно негативно влияет на экспрессию встроенного поблизости трансгена.
Для защиты экспрессии трансгена от репрессии и поддержания прямой зависимости между количеством копий и уровнем экспрессии трансгена в культурах клеток млекопитающих используется ряд регуляторных элементов: А/Т богатые последовательности ДНК, которые связываются с фракцией ядерного матрикса, названные MAR/SAR-элементами [5, 6, патент US 2005/0176099 A1, опубликован 11.08.2005; патент US 2011/0061117 A1, опубликован 10.03.2011]; регуляторные элементы (UCOE), активирующие промоторы генов «домашнего хозяйства» [1, патент US 2010/0112640 A1, опубликован 06.05.2010; патент US 7442787 B2, опубликован 28.10.2008]; STAR-элементы, обладающие способностью блокировать распространение гетерохроматина [9, патент US 2007/0037256 A1, опубликован 15.02.2007]; инсуляторы [10, 12, патент US 2006/0179500 A1, опубликован 10.08.2006].
Из всех вышеперечисленных регуляторных элементов в векторных конструкциях для получения трансгенных животных используют только инсуляторы. Инсуляторами называют регуляторные элементы, которые блокируют взаимодействие между энхансером и промотором, если находятся между ними [8]. Кроме того, часть инсуляторов способна являться границей между транскрипционно активным хроматином и гетерохроматином. Одним из наиболее хорошо изученных инсуляторов позвоночных является куриный β-глобиновый инсулятор (HS4-инсулятор), размером 1200 п.н., расположенный на 5'-конце β-глобинового локуса [2]. Созданный компанией Invitrogen вектор для получения трансгенных животных pBC1 содержит две копии куриного HS4-инсулятора длиной 1.2 т.п.н. на 5' конце вектора. Детальный анализ влияния HS4-инсулятора на транскрипционную активность нескольких промоторов, в том числе бета-казеинового промотора коз и WAP-промотора кроликов, показал, что инсулятор значительно повышает уровень экспрессии трансгена и количество трансгенных линий, в которых наблюдается значимая экспрессия целевого белка [4, 11, 13]. В то же время HS4-инсулятор не влияет на вариабельность экспрессии трансгена, эктопическую экспрессию трансгена в других тканях организма и не обеспечивает прямую корреляцию между количеством копий трансгена и уровнем экспрессии. Таким образом, HS4-инсулятор выполняет роль универсального усилителя транскрипции, который можно использовать для увеличения активности слабых промоторов.
При получении трансгенных животных с помощью линейной ДНК происходят многокопийные тандемные интеграции конструкций в геном, что приводит к формированию районов, содержащих множественные повторы конструкции. Такие повторяющиеся последовательности ДНК активно транскрибируются в обоих направлениях, что приводит к запуску репрессии по механизму РНК интерференции. В результате через несколько генераций после получения трансгенной линии клеток может происходить затухание экспрессии трансгенов. Инсуляторы и активаторные регуляторные элементы не способны останавливать транскрипцию через трансгены [14]. Поэтому только эффективные терминаторы транскрипции могут защитить экспрессию трансгенов от РНК интерференции. Ранее нами было показано, что терминаторы транскрипции эффективно поддерживают стабильно высокий уровень экспрессии репортерного гена eGFP в культуре клеток млекопитающих (Патент №2425882).
Сущность изобретения
В настоящем изобретении предлагается использование терминаторов транскрипции в экспрессионном векторе для получения трансгенных животных. Задачей настоящего изобретения является создание экспрессирующих векторов для получения трансгенных млекопитающих, в молоке которых будет обеспечена наработка целевого белка на стабильном и высоком уровне. В разрабатываемых экспрессионных векторах будут использованы терминатороы транскрипции, окружающие экспрессионную кассету и обрывающие геномные транскрипты в местах встройки трансгена в геном.
Поставленная задача решается путем создания трансгенных животных, продуцирующих белок со стабильным и высоким уровнем экспрессии, включающий микроинъекцию яйцеклеток млекопитающего экспрессирующим вектором, содержащим целевой ген, экспрессируемый под β-казеиновым промотором, и двусторонние терминаторы транскрипции, окружающие экспрессионную кассету, которые обладают способностью эффективно обрывать геномные транскрипты в геноме млекопитающих, эффективно защищая экспрессию трансгена в геноме млекопитающего от последующей репрессии, при этом эффективные двусторонние терминаторы представляют собой любой геномный участок млекопитающего, удовлетворяющий следующим условиям: 3'-области двух одновременно экспрессирующихся и противоположно направленных генов, содержащих в своем составе участок предпоследнего экзона, последний интрон, последний экзон и сигнал полиаденилирования, расстояние между двумя сигналами полиаденилирования, расположенными на разных тяжах ДНК, не превышает 100 п.н.
Предлагаемое изобретение может быть использовано для получения трансгенных животных, содержащих эффективно работающие в молочных железах конструкты, продуцирующие рекомбинантные белки, которые могут быть использованы в медицинских и исследовательских целях.
Сущность описываемого изобретения поясняется чертежом (фиг.1), на котором представлены схемы конструкций для тестирования разрабатываемого подхода в молоке трансгенных животных, где
А - контрольная Luc, в которой тестируемые ДНК-элементы отсутствуют;
Б - контрольная 2xIns_Luc, в которой выше β-казеинового промотора встроены две копии инсулятора из β-глобинового локуса кур;
В - конструкция 2xT1_Luc_2xT2 с ДНК-элементами - двусторонними терминаторами транскрипции, окружающими экспрессионную кассету, состоящую из промотора, целевого гена, сигналов нолиаденилирования.
Пример 1. Отбор эффективных двусторонних терминаторов транскрипции
В настоящее время не существует базы с коллекцией эффективно работающих терминаторов транскрипции. В то же время часто негативные эффекты при внедрении трансгенной конструкции в геном связаны с геномной транскрипцией, идущей через трансген, с одной стороны, и с транскрипцией, протекающей из конструкции в геном, - с другой. Поэтому для преодоления такого эффекта необходимо окружать конструкцию эффективно работающими терминаторами транскрипции. И для максимальной изоляции конструкции желательно, чтобы встраиваемые терминаторы были двусторонними. Однако все известные используемые в трансгенезе терминаторы являются полярными, для того чтобы они были двусторонними, необходимо чтобы на обеих цепях ДНК содержались сигналы полиаденилирования со всеми необходимыми регуляторными модулями, запускающими работу терминатора. Для отбора таких двусторонних элементов нами были отобраны участки генома на стыках противоположно направленных генов. Именно в этих зонах и должны содержаться терминирующие сигналы для каждого из генов. Однако в геноме человека присутствует порядка 20000 генов, поэтому нами был проведен автоматизированный поиск. Предполагается, что наиболее сильными являются терминаторы сильно экспрессирующихся генов. При недостаточной эффективности работы в данном случае транскрипция может распространяться далее за границы гена и приводить к сбою в работе промотора следующего гена, если гены расположены на одном тяже ДНК, или приводить к образованию комплементарной РНК с последующей РНК интерференцией, при расположении генов на разных тяжах. Исходя из этого, можно предположить, что максимальной эффективностью должны обладать терминаторы сильных генов, расположенных на разных тяжах, направленных друг на друга на небольшом расстоянии друг от друга.
Поиск таких генов можно проводить программными средствами, используя имеющуюся в открытом доступе информацию. Сначала необходимо создать базу данных, достаточно компактную, но содержащую всю необходимую информацию о положении генов на хромосоме. Затем написать программу, позволяющую по полученной базе производить поиск пар генов предположительно обладающими сильными терминаторами.
Построение базы данных, содержащей информацию о генах человека.
За основу были взяты данные, опубликованные на сайте NCBI, представляющие собой объединение результатов работы HumanGenomeProject и других проектов. Для обработки полученной информации была написана программа, позволяющая отобрать необходимые данные. В результате была получена база данных с необходимым минимумом элементов. База включала информацию обо всех аннотированных генах человеческого генома и включала следующую информацию: ID таксона, название хромосомы, на которой расположен ген, координата начала и окончания гена на хромосоме, расположение на прямом или обратном тяже ДНК, название контига, начало и конец контига на хромосоме, его ориентация, имя гена, ID гена, тип записи (gene), идентификатор проекта, в рамках которого внесена аннотация, тип транскрипта, синтезируемого с гена, код достоверности аннотации.
Общий объем базы составил 4,44 мб. Количество записей - 40283.
Программа для поиска противоположно направленных генов.
На начальном этапе вводится значение расстояния между двумя противоположно направленными генами, ниже которого программа будет отбирать пары генов.
После запуска с введенными значениями программа читает данные из базы данных и создает из них массив. Время работы O(n). Затем сравнивает каждую запись с каждой, проводя, таким образом, n(n-1)/2 операций сравнения (где n - число записей) за работу. Первую запись сравнивает с n-1, вторую с n-2 и т.д, n-1 запись - с 1. Проверяется принадлежность обоих генов одной хромосоме, расположены ли они на разных тяжах ДНК. При соблюдении этих условий проверяется расстояние между ними. Отбираются те, расстояние между которыми меньше заданного пользователем. При этом программа запоминает найденные гены. Результаты работы выводятся в файл. Время поиска - O(n2). Общее время работы программы лимитируется временем поиска - O(n2).
Первичный поиск подходящих участков генома.
После создания программы был проведен поиск подходящих участков генома человека. Было задано следующее условие: должны быть отобраны пары генов, расстояние между которыми не превышает 100 п.н. В таких генах на достаточно небольшом расстоянии должны содержаться эффективно работающие терминаторы транскрипции, защищающие транскрипты от РНК-интерференции.
Программой был найден 141 участок, удовлетворяющий данному условию. Так как в геноме аннотировано много генов, для которых методами молекулярной биологии не показано наличие транскрипта и белкового продукта, участки, соответствующие таким генам, были выведены из анализа, и в результате осталось 80 участков. Далее из этих 80 необходимо выбрать те, на базе которых будут созданы трансгенные конструкции. На пути оптимизации конструкций для получения трансгенных животных важно создаваемую конструкцию окружать эффективно работающими в молочных железах терминаторами транскрипции. Поэтому необходимо отобрать элементы, способные терминировать транскрипцию в молочных железах. В результате была собрана коллекция элементов, которые потенциально могут работать как эффективные терминаторы транскрипции в молочных железах. При выборе участков генома мы руководствовались несколькими условиями:
- Для того чтобы терминация транскрипции эффективно осуществлялась на двух цепях ДНК, выбирались зоны с противоположно направленными генами.
- Так как необходимо, чтобы терминация транскрипции эффективно проходила в клетках молочной железы, выбирались терминаторы преимущественно в конце генов домашнего хозяйства.
- Так как известно, что 3'-концевые интроны часто усиливают эффективность терминации транскрипции, выбирались гены с интронами.
- Так как важным условием создания экспрессирующего вектора является его компактность, то участок, содержащий 2 терминатора, а также область с последним интроном и окружающими его экзонами, не должен был превышать 2 т.п.н.
В результате были выбраны 6 участков генома, включающих в себя 3'-участки противоположно направленных генов с последним интроном (2хТ1-6) (см. Приложение). Для амплификации всех выбранных участков генома были подобраны праймеры. С геномной ДНК, выделенной из культуры клеток НЕК293, были амплифицированы фрагменты ДНК.
Тестирование регуляторных элементов генома на терминирующую активность.
Для оценки функциональной активности терминаторов транскрипции была выбрана бицистронная система. При помощи методов молекулярного клонирования была разработана бицистронная репортерная система и на ее основе созданы тестовые конструкции (фиг.2). Эффективность данной модели была проверена па культуре клеток рака молочной железы MCF-7.
В созданной бицистронной системе в одном векторе под общим CMV промотором (работающим во всех типах клеток млекопитающих) были объединены открытые рамки считывания генов зеленого (eGFP) и красного (neo-RFP) флуоресцентных белков таким образом, чтобы между этими генами рамка считывания была сбита. При этом ген neo-RFP может нормально экспрессироваться и транслироваться по кэп-зависимому пути, а продукт eGFP при этом не нарабатывается. Стоит отметить, что такая система рассчитана на транзиентный анализ, но в некоторых случаях для возможной селекции клонов и их анализа при длительном культивировании ген neo-RFP представлен слитым продуктом красного флуоресцентного белка и белка устойчивости к неомицину. Между генами neo-RFP и eGFP встроен элемент УВПР (участок внутренней посадки рибосомы), с которого запускается кэп-независимая трансляция eGFP. Выше УВПР предусмотрен уникальный сайт рестрикции, по которому встраиваются тестируемые на терминирующую активность элементы. Общая стратегия данной системы заключается в том, что, если элемент препятствует прохождению РНК-полимеразного комплекса, образуется молекула мРНК, содержащая только первый цистрон (neo-RFP), а второй цистрон (eGFP) перестает экспрессироваться за счет того, что соответствующая РНК отсутствует (фиг.3).
Результаты измерений контрольных конструкций показали, что созданной бицистронной моделью можно успешно пользоваться в культуре клеток (табл.1). Так, моноцистронные системы показали, что уровень флуоресценции eGFP в транзиентных экспериментах успешно детектируется уже через 48 часов после трансфекции (конструкт eGFP) и превышает пороговое значение аутофлуоресценции приблизительно в 6 раз (клетки MCF7) (табл.1). В то же время моноцистрон с красным флуоресцентным белком (neo-RFP) в канале FL1 не детектируется и не вносит никакого вклада в фоновое значение.
Для доказательства того, что второй цистрон не способен экспрессироваться за счет реинициации рибосомой за стоп-кодоном первого цистрона, был тестирован конструкт (neo-RFP_eGFP), и он продемонстрировал практически недектируемый сдвиг относительно порогового значения интенсивности флуоресценции. Таким образом, контрольные конструкты показали правомерность использования данной модели. Была подготовлена серия конструктов, в которых после первого цистрона выше УВПР в прямой (dir) и обратной (rev) ориентациях был встроен тестируемый элемент. Также для тестирования эффективности используемой модели был тестирован. В качестве положительного контроля на терминацию был использован элемент, соответствующий терминатору транскрипции из 3'нетранслируемой области β-глобиновового гена человека, который только в прямой ориентации содержит в своем составе функциональные терминаторные последовательности. Как контрольные, так и опытные конструкции были трансфецированы в культуру клеток MCF7. На третий день после трансфекции были проведены измерения уровня флуоресценции клеточных культур и получены результаты, представленные в табл.1.
| Таблица 1 | ||
| Значения флуоресценции в канале eGFP для конструкций | ||
| Клетки, экспрессирующие GFP, % | Значение медианы в области M1 | |
| MCF7 | 0,1 | 11,1 |
| Neo-RFP | 0,24 | 11,04 |
| eGFP | 39,93 | 44,51 |
| Neo-RFP_eGFP | 0,9 | 11,8 |
| K | 62,7 | 52,52 |
| β_dir | 6,9 | 16,4 |
| β_rev | 53,6 | 28,1 |
| 1_dir | 2,6 | 14,5 |
| 1_rev | 10,7 | 18,9 |
| 2_dir | 13,8 | 20,3 |
| 2_rev | 7,4 | 18,1 |
| 3_dir | 9,11 | 18,7 |
| 3_rev | 11,1 | 18,9 |
| 4_dir | 13,8 | 19,4 |
| 4_rcv | 21,4 | 19,9 |
| 5_dir | 11,7 | 17,8 |
| 5_rcv | 9,8 | 17,6 |
| 6_dir | 12,3 | 18,1 |
| 6_rev | 56,3 | 46,7 |
Для всех конструкций был детектирован разный процент светящихся клеток, во всех случаях превышающий пороговое значение автофлуоресценции (нетрансфецированные клетки MCF7). Контрольная конструкция К демонстрирует высокий уровень флуоресценции, свидетельствующий об отсутствии обрыва транскрипта перед цистроном eGFP. В то же время конструкции с тестируемыми на терминирующую активность последовательностями демонстрируют пониженный уровень флуоресценции.
Основным показателем терминирующей активности тестируемых элементов в данной системе служило соотношение между процентным содержанием клеток, экспрессирующих eGFP, в пулах клеток, трансфецированных плазмидой, содержащей УВПР, но не содержащей терминирующий элемент (K) к процентному содержанию экспрессирующих eGFP клеток в пулах, трансфецированных конструкцией с тестируемым элементом (табл.2).
Действительно, тестируемый известный терминатор из β-глобиновового гена человека продемонстировал свою терминирующую активность, при этом он, как и полагается, работал только в одной ориентации (dir), в то время как другая была функционально неактивной. Полученные результаты с отобранными ранее потенциально двусторонними терминаторами свидетельствуют о том, что элементы 1-6 являются эффективными терминаторами транскрипции, причем все элементы, кроме элемента №6, являются двусторонними (способны эффективно обрывать транскрипты на разных тяжах ДНК).
| Таблица 2 | |
| Оценка способности тестируемых элементов препятствовать прохождению транскрипции | |
| Терминирующая активность по отношению к конструкции K | |
| K | |
| β_dir | 9,1 |
| β_rev | 1,2 |
| 1_dir | 24,1 |
| 1_rev | 5,9 |
| 2_dir | 4,5 |
| 2_rev | 8,5 |
| 3_dir | 6,9 |
| 3_rev | 5,6 |
| 4_dir | 4,5 |
| 4_rev | 2,9 |
| 5_dir | 5,4 |
| 5_rev | 6,4 |
| 6_dir | 5,1 |
| 6_rev | 1,1 |
Таким образом, данные элементы можно использовать в экспрессионных векторах, предназначенных для экспрессии целевых белков в молочных железах в тех случаях, когда необходимо обеспечить обрыв транскрипта как в прямом, так и в обратном направлении.
Пример 2. Подготовка трансгенных конструктов для последующего получения трансгенных млекопитающих
Для тестирования эффективности использования двусторонних терминаторов транскрипции в конструктах, предназначенных для получения трансгенных млеопитающих-продуцентов целевых белков, была подготовлена серия тестовых трансгенных конструктов (фиг.1).
В настоящее время существует стандартный экспрессионный вектор для получения трансгенных животных, экспрессирующих целевые белки в молоко. Этот вектор, pBC1 производства Invitrogen, содержит в своем составе промотор, 5'-НТО, 3'-НТО и терминатор гена бета-казеина, а также две копии инсулятора из бета-глобинового локуса кур выше промотора. Считается, что инсулятор способствует стабилизации уровня экспрессии трансгена, защищая его от зон репрессионного хроматина. Однако работы на культурах клеток демонстрируют, что защитный эффект инсулятора не обладает пролонгированностью действия. Так, трансгены, защищенные инсулятором, эффективно экспрессируются только в первые 6 месяцев культивирования клеток, а затем происходит постепенный спад уровня экспрессии трансгена. Известно, что большая часть генома транскрибируется, образуя длинные некодирующие молекулы РНК, которые могут оказывать репрессирующее действие на многие гены, в том числе и на введенный в геном трансген. В связи с этим подход в совершенствовании экспрессирующих векторов, связанный с использованием в качестве защитных элементов терминаторов транскрипции, может быть применим для создания трансгенных животных-продуцентов.
Для проверки эффективности разрабатываемого подхода была создана серия трансгенных конструкций. В качестве репортерного гена использовался ген люциферазы светлячка, находящийся под контролем β-казеинового промотора коз. Известно, что данный промотор обеспечивает высокий уровень транскрипции целевого гена в клетках молочных желез.
Для оценки эффективности применения терминаторов транскрипции в экспрессионных векторах для наработки целевого белка в молочных железах млекопитающих для поддержания стабильного и высокого уровня наработки целевого белка использовались следующие плазмиды (фиг.1):
А) В качестве отрицательного контроля использовался вектор Luc, содержащий ген люциферазы, слитый с сигнальной последовательностью β-казеина для выведения белка из клеток молочных желез непосредственно в молоко. Ген люциферазы был размещен под контролем промотора β-казеина коз. В качестве 3'-НТО в данном векторе использовалась 854 п.н. - область из гена ростового фактора быка, в состав которой входит функциональный в клетках молочных желез сигнал полиаденилирования. Данная плазмида содержит ген устойчивости к ампициллину для наработки плазмиды в клетках Е.coli.
Б) Для сравнения эффективности использования терминаторов транскрипции с известными на данный момент элементами, способными поддерживать транскрипцию трансгена в клетках молочных желез па высоком уровне, была сконструирована плазмида 2xIns_Luc. Для получения данной плазмиды в вектор Luc выше β-казеинового промотора встраивалась последовательность длиной 2427 п.н., содержащая две тандемные копии инсулятора из бета-глобинового локуса курицы. Данная последовательность была получена из коммерческой плазмиды pBC 1 (Invitrogen). Этот элемент в настоящее время широко используется для повышения уровня экспрессии целевого гена, так как считается, что он обладает способностью изолировать трансген от влияния окружающих цис-регуляторных последовательностей.
В) Плазмида 2xT1_Luc_2xT2, содержащая последовательности отобранных двусторонних терминаторов транскрипции, которые являются функционально активными в клетках молочных желез. Последовательности терминаторов в данной конструкции окружают экспрессионную кассету, состоящую из гена люциферазы, промотора β-казеина коз и 3'-НТО из гена ростового фактора быка.
Пример 3. Получение и анализ трансгенных животных
С помощью набора для минипрепаративного выделения были получены восокоочищенные плазмиды, содержащие требуемые конструкции. ДНК для микроинъекций переводили в линеаризованную форму, обрабатывая препарат эндонуклеазами рестрикции, фланкирующими экспрессионную кассету, и избавлялись от тела плазмиды, содержащего в своем составе ген устойчивости к ампициллину и бактериальный ориджин репликации. Обработанная рестриктазами ДНК подвергалась электрофорезу в агарозном геле. Требуемый фрагмент вырезался из геля (в условиях его наблюдения с помощью длинноволнового ультрафиолета) и очищался от примесей. ДНК в линеаризованной форме получали в концентрации от 50 до 160 нг/мкл, разводили буфером ТЕ до концентрации 1-5 нг/мкл.
Культивирование яйцеклеток осуществлялось в СO2-инкубаторе при содержании углекислого газа в воздухе 5%- и 100%-ной влажности. Культивирование проходило в чашках Петри диаметром 35 мм в каплях размером 50-60 мкл. Сверху капли покрывались легким минеральным маслом категории «embryo tested».
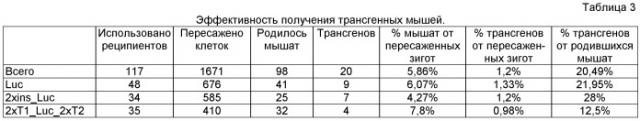
Инъекция линейных фрагментов ДНК (1 мкг/мл) проводилась в мужские пронуклеусы мышиных зигот на стадии двух пронуклеусов. После микроинъекции зиготы культивировали в течение 2-3 часов в CO2-инкубаторе. После культивирования клетки визуально оценивались, и те из них, что находились в удовлетворительном состоянии, пересаживались в яйцеводы ложнобеременных самок-реципиентов. Пересадка проводилась хирургически под наркозом. В рамках эксперимента по получению трансгенных по конструкциям Luc, 2xins_Luc, 2xT1_Luc_2xT2 мышей 1671 микроинъецированная зигота была пересажена 117 реципиентам, всего получено 98 мышат, среди них 20 трансгенов (табл.3).
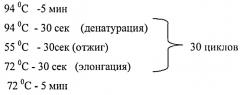
Для идентификации трансгенных мышей ДНК выделяли из хвостов солевым методом и анализировали с помощью ПЦР с помощью праймеров Luc_d 5'-gctatgaagagatacgccctggttcc-3' и Luc_r 5'-gcgaaatgcccatactgtt-3'.
Состав реакционной смеси:
50 мМ KCl, 2.0 мМ MgCl2, 25 мМ Трис-HCl, pH 9.0, 2 мМ dNTP, 0.5 ед. акт. Taq-полимеразы (Invitrogene) и 10 мкМ каждого праймера. На 10 мкл реакционной смеси добавляли 1 мкл раствора геномной ДНК, выделенной солевым методом (концентрация примерно 100 нг/мкл).
Параметры температурного цикла:
Так как родившиеся после микроинъекций мыши (фаундеры) могут оказаться мозаиками, т.е. могут содержать трансген не во всех клетках, то они могут не быть генетически однородными животными, т.е. они не являются линейными животными. Для установления линий трансгенных мышей требуется получить потомство от фаундеров. В случае, если у такого потомка будет детектирован трансген, можно будет считать, что этот трансген содержится во всех клетках организма, т.е. трансгенные потомки фаундера можно (с некоторыми оговорками) считать линией. Поэтому от 12 первичных трансгенных мышей были получены линии потомков.
Пробы молока у трансгенных мышей берутся на 2-20 день после родов не чаще 2 раз за лактацию. Взятие молока проводится у наркотизированной внутрибрюшинной инъекцией раствора Avertin (0,25%) мыши из расчета 10 мкл/г; для увеличения молокоотдачи мыши внутрибрюшинно вводится окситоцин (10 ед/мл) из расчета 10 мкл/г. В экспериментах по изучению уровня экспрессии репортерного гена люциферазы в молоке трансгенных мышей были взяты пробы молока из разных трансгенных линий мышей. Данные пробы были обезжирены. Затем по 20 мкл из каждого образца были использованы для анализа содержания люциферазы в образце молока. Результаты анализа проб молока, полученных от трансгенных мышей, представлены в табл. 4 и на фиг.4.
| Таблица 4 | |||
| Результат анализа проб молока | |||
| Конструкция | Средний уровень продукции | Доверительный интервал (α=0,1) | Количество проб молока |
| Luc | <0,1 | - | 12 |
| 2xins_Luc | 3,80 | 2,2 | 26 |
| 2xT1_Luc_2xT2 | 6,30 | 2,35 | 6 |
Крайне низкие уровни экспрессии люциферазы с молоком животных с конструкцией Luc можно объяснить тем, что из-за неспецифичного встраивания трансгена в геном возможна ситуация, когда генетическое окружение (например, участки гетерохроматина) препятствует экспрессии гена. В то же время трансгенные мыши с конструкциями 2xins_Luc и 2xT1_Luc_2xT2 продемонстрировали гораздо более высокий уровень наработки рекомбинантного белка. При этом разработанный нами вариант экспрессионного вектора с двусторонними терминаторами в качестве защитных регуляторных элементов трансгена оказался примерно в 2 раза более эффективным по сравнению с используемым коммерческим вариантом, представленным двумя копиями инсулятора из β-глобинового локуса кур. В результате можно сделать вывод, что конструкция 2xT1_Luc_2xT2 является более эффективной для продукции целевого белка в молочных железах трансгенного животного по сравнению с конструкцией 2xins_Luc.
Приложение.
>2xT1
>2xT2
>2xT3
>2xT4
>2xT5
>2xT6
Список цитированной литературы
1. Benton T., Chen T., McEntee M., Fox B., King D., Crombie R., Thomas T.C., Bebbington C. // Cytotechnology. 2002. V.38. P.43-46.
2. Chung J.H., Bell A.C., Felsenfeld G. // Proc. Natl. Acad. Sci. USA. 1997. V.94. P.575-580.
3. Echelard Y. // Curr. Opin. Biotechnol. 1996. V.7. P.536-540.
4. Giraldo P., Rival-Gervier S., Houdebine L.-M., Montoliu L. // Transgenic Res. 2003. V.12. P.751-755.
5. Girod P.A., Zahn-Zabal M., Mermod N. // Biotech Bioeng. 2005. V.91. P.1-11.
6. Girod P.A., Nguyen D.Q., Calabrese D., Puttini S., Grandjean M., Martinet D., Regamey A., Saugy D., Beckmann J.S., Bucher P., et al. // Nature methods. 2007. V.4. P.747-753.
7. Goldman I.L., Kadullin S.G., Razin S.V. // Med. Sci. Monit. 2004. V.10. P.RA274-285.
8. Herold M., Bartkuhn M., Renkawitz R. // Development. 2012. V.139. P.1045-1057.
9. Kwaks T.H.J., Barnett P., Hemrika W., Siersma T., Sewalt R.G., Satijn D.P., Brons J.F., van Blokland R., Kwakman P., Kruckeberg A.L., et al. // Nature Biotech. 2003. V.21. P.553-558.
10. Kwaks T.H.J., Otte A.P. // Trends in Biotech. V.24. P.137-142.
11. Potts W., Tucker D., Wood H., Martin C. // Biochem. Biophys. Res. Commun. 2000. V.273. P.1015-1018.
12. Recillas-Targa F., Valadez-Graham V., Farrell C.M. // BioEssays. 2004. V.26. P.796-807.
13. Rival-Gervier S., Pantano T., Viglietta C.. Maeder C., Prince S., Attal J., Jolivet G., Houdebine L.-M. // Transgenic Res. 2003. V.12. P.723-730.
14. Silicheva M, Golovnin A, Pomerantseva K, Parshikov A, Georgiev P, Maksimenko O. // Nucleic Acids Res. 2010. V.38. P.39-47.
Способ создания трансгенных животных, продуцирующих в молоко белок со стабильным и высоким уровнем экспрессии, включающий получение трансгенных млекопитающих с помощью вектора, содержащего репортерный ген, кодирующий целевой белок, промотор бета-казеинового гена коз, терминатор ростового фактора быка и эффективные двусторонние терминаторы транскрипции, которые окружают экспрессионную кассету и обладают способностью эффективно обрывать геномные транскрипты в геноме млекопитающих, эффективно защищая экспрессию трансгена в геноме млекопитающего от последующей репрессии, при этом эффективные двусторонние терминаторы представляют собой любой геномный участок млекопитающего, удовлетворяющий следующим условиям: 3'-области двух одновременно экспрессирующихся и противоположно направленных генов, содержащих в своем составе участок предпоследнего экзона, последний интрон, последний экзон и сигнал полиаденилирования, расстояние между двумя сигналами полиаденилирования, расположенными на разных тяжах ДНК, не превышает 100 п.н.