Способ пластики пищеводного отверстия диафрагмы
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургии. Пластику пищеводного отверстия диафрагмы осуществляют стенкой мобилизованного дна желудка. Прошивают наивысшие точки дна желудка, прилежащие порции левой ножки диафрагмы и стенки пищевода, с захватом пищеводно-диафрагмальной связки. Прошивают нижние порции левой ножки диафрагмы и прилежащую часть фундального отдела желудка. Прошивают нижнюю часть правой ножки диафрагмы и прилежащую часть дна желудка. Аналогичный шов накладывают на верхнюю часть правой ножки диафрагмы. Способ обеспечивает малотравматичную, прецизионную лапароскопическую коррекцию пищеводно-желудочного перехода при отсутствии укорочения пищевода за счет широкой мобилизации кардии, дна желудка, дистального отдела пищевода, предупреждающую натяжение тканей при выполнении фундопликации. 8 ил., 1 пр.
Реферат
Предлагаемое изобретение относится к медицине, а именно к хирургии, и может быть использовано в хирургической практике при лечении пациентов с грыжей пищеводного отверстия диафрагмы.
Проблема лечения больных с грыжей пищеводного отверстия диафрагмы и его осложнениями, основной причиной развития которых является заброс кислого желудочного содержимого в пищевод при недостаточности пищеводно-желудочного перехода, остается одной из самых актуальных в современной хирургической гастроэнтерологии. Число больных, нуждающихся в подобных операциях, продолжает увеличиваться, что обусловлено прежде всего улучшением диагностики и переосмыслением врачебной позиции в лечении грыжи пищеводного отверстия диафрагмы, рефлюкс-эзофагита и его осложнений.
С 1991 года, в эпоху бурного развития эндоскопической хирургии, получили развитие и с течением времени завоевали широкое признание способы лапароскопической коррекции недостаточности пищеводно-желудочного перехода. Наиболее часто применяемыми являются способы «полной» фундопликации по Nissen, Nissen-Rosetti, «неполной» фундопликации по Belsey, Dor и Toupet [Пучков К.В., Филимонов В.Б. Грыжи пищеводного отверстия диафрагмы. «Медпрактика-М», М., 2003].
Многообразие используемых способов говорит о недостаточной удовлетворенности хирургов результатами оперативного лечения данной категории пациентов и отсутствии единой, универсальной методики, «золотого стандарта», отвечающего всем предъявляемым требованиям.
Одним из видов пластики пищеводного отверстия диафрагмы с использованием синтетических пластических материалов является операция, предложенная J. Angelchik [Angelchik J.P., Cohen R. A new surgical procedure for the treatment of gastroesophageal reflux and hiatal hernia. Surg Gynecol Obstet 1979; 148:246]. Суть ее заключается в установлении вокруг пищевода кольцевидного силиконового протеза, дозирующего просвет пищеводного отверстия диафрагмы.
Клиническое использование этой операции выявило следующие существенные недостатки: частая послеоперационная дисфагия, миграция протеза в просвет желудочно-кишечного тракта, в брюшную и плевральную полость.
За ближайший аналог предлагаемого способа принят вариант лапароскопической фундопликации с использованием синтетического материала при пластике пищеводного отверстия диафрагмы (О.В. Галимов и соавт. Способ хирургического лечения грыж пищеводного отверстия диафрагмы. Заявка на изобретение 20.07.2006 г. РФ №2005103256). Способ заключается в следующем: под интубационным наркозом накладывают пневмоперитонеум. Используя стандартные точки установки троакаров, вводят видеолапароскоп и манипуляторы. Оценивают состояние кардии, пищеводного отверстия диафрагмы. В желудок вводят толстый зонд. Желудок оттягивают в каудальном направлении и надсекают брюшину над абдоминальным участком пищевода, осуществляют его мобилизацию. Обойдя пищевод, продевают вокруг него резиновую держалку и оттягивают ее в вентрокаудальном направлении. Затем подготавливают синтетический имплантат из политетрафторэтилена (PTFE) размером 8×8 см, в центре имплантата вырезают круг диаметром 2,5 см, сообщающийся благодаря радиальному разрезу с внешней границей. Имплантат скручивают в трубочку для проведения его в брюшную полость через 10-мм троакар. В брюшной полости манипуляторами захватывают имплантат, расправляют и устанавливают таким образом, что края разреза имплантата обхватывают пищевод, в результате пищевод оказывается в вырезанном отверстии имплантата. Края разреза политетрафторэтиленовой сетки сшивают в виде дупликатуры, при этом в шов захватывают правую ножку диафрагмы и отдельными ручными или аппаратными швами в количестве 4-6 имплантат фиксируют к диафрагме. После этого фундопликационную манжету формируют, проводя заднюю стенку дна желудка позади пищевода, с фиксацией в нижней точке к медиальной поверхности пищевода одним-двумя швами, на 2 см выше анатомической кардии. Затем выше этой точки на протяжении не менее 4 см переднюю стенку дна желудка сшивают с проведенной позади пищевода задней стенкой дна желудка 2-3 швами. На этом операцию завершают.
К недостаткам ближайшего аналога можно отнести:
- фиброзирование синтетического импантата с развитием локального спаечного процесса со сдавлением пищевода и возникновением дисфагии в послеоперационном периоде;
- миграция синтетического имплантата в просвет пищевода или желудка либо в брюшную полость;
- частичное или полное пересечение или сдавление блуждающих нервов вследствие захвата их в циркулярную манжетку либо при фиброзировании импантата осложняется послеоперационным гастростазом и/или парезом кишечника.
Задачи:
1) повышение безопасности и доступности способа пластики пищеводного отверстия диафрагмы, предупреждение повреждения вагусной иннервации желудка;
2) воссоздание всех элементов, составляющих арефлюксный механизм кардии (острый угол Гиса, клапан Губарева, абдоминальный отрезок пищевода);
3) предупреждение рецидивов ГПОД в послеоперационном периоде;
4) сокращение сроков медико-социальной реабилитации.
Сущность изобретения заключается в том, что пластику пищеводного отверстия диафрагмы из лапароскопического доступа, включающую мобилизацию дна желудка, абдоминального отдела пищевода, фундопликацию, отличающуюся тем, что пластику пищеводного отверстия диафрагмы осуществляют стенкой мобилизованного дна желудка путем прошивания наивысшей точки мобилизованного дна желудка, прилежащей верхней порции левой ножки диафрагмы и стенки пищевода с захватом остатков пищеводно-диафрагмальной связки, затем формируют следующий шов-связку путем прошивания нижней порции левой ножки диафрагмы и прилежащей к ней части фундального отдела желудка, после чего формируют следующий шов-связку путем прошивания нижней части правой ножки диафрагмы и прилежащей к ней части дна желудка, затем аналогичный шов накладывают на верхнюю часть правой ножки диафрагмы.
Технический результат
Способ позволяет малотравматично и прецизионно производить хирургическую коррекцию пищеводно-желудочного перехода при ГПОД и отсутствии укорочения пищевода. Способ обеспечивает доступную в техническом отношении широкую мобилизацию кардии, дна желудка, дистального отдела пищевода, предупреждающую натяжение тканей при выполнении фундопликации, создание функциональной арефлюксной манжетки, надежное закрытие пищеводного отверстия диафрагмы. Способ обеспечивает хорошие результаты в послеоперационном периоде за счет надежного закрытия пищеводного отверстия диафрагмы дном желудка, что предотвращает миграцию фундопликационной манжеты в заднее средостение и таким образом препятствует рецидиву ГПОД, улучшает функциональный результат.
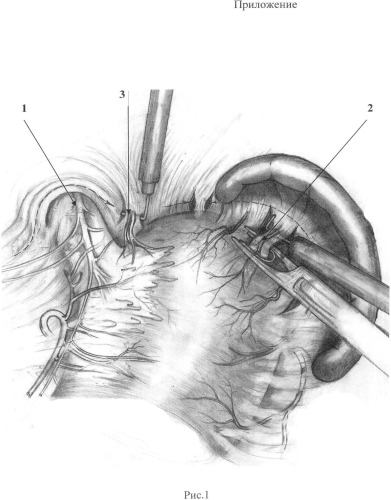
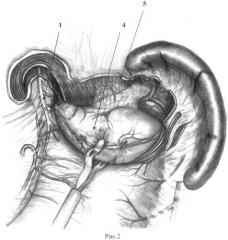
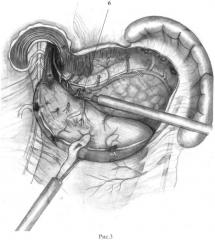
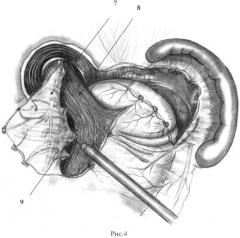
Выполнение способа продемонстрировано на рис.1-8, где рис.1 -мобилизация кардиального отдела и дна желудка, начинающаяся с пересечения верхней части желудочно-селезеночной связки; рис.2 - этап мобилизации (выделение дна желудка); рис.3 - выделение левой диафрагмальной ножки; рис.4 - мобилизация желудка по малой кривизне по типу суперселективной проксимальной ваготомии; рис.5 - начало формирования арефлюксной манжеты - наложение шва, восстанавливающего угол Гиса; рис.6 - формирование шва, захватывающего нижнюю порцию левой диафрагмальной ножки и прилежащую часть дна желудка; рис.7 - наложение шва, фиксирующего правую часть манжеты и верхнюю часть правой ножки диафрагмы; рис.8 - фиксация обеих полуокружностей манжеты между собой и к диафрагме и создание циркулярной арефлюксной конструкции вокруг пищевода, где: пп.1 - передний n.vagus; 2 - выделение и клипирование короткого желудочного сосуда; 3 - ветвь нижней диафрагмальной артерии; 4 - отвернутое зажимом дно желудка; 5 - линия рассечения париетальной брюшины; 6 - ветвь задней желудочной артерии; 7 - отведенный вправо и вверх брюшинно-жировой лоскут с передним n.vagus; 8 - абдоминальный отдел пищевода; 9 - первая поперечная желудочная артерия; 10 - задний n.vagus; 11 - шов-связка, восстанавливающий угол Гиса; 12 - шов-связка, захватывающий нижнюю порцию левой диафрагмальной ножки и прилежащую часть дна желудка; 13 - шов, фиксирующий правую часть дна желудка и нижнюю часть правой ножки диафрагмы; 14 - шов-связка, фиксирующий дно желудка и верхнюю часть правой ножки диафрагмы.
Предлагаемый способ осуществляют следующим образом. Оперативное вмешательство начинают с инсуффляции углекислого газа в брюшную полость. Выполняют установку троакаров в точках: 1) 10 мм- троакар на 1-2 см выше пупка по срединной линии (вводят первым) - для 30" оптики; 2) 10 мм- троакар в правой подреберной области по средне-ключичной линии - для введения ретрактора и отведения левой доли печени; 3) 10 мм- троакар в левой мезогастральной области по среднеключичной линии на 3-4 см ниже и 1-2 см левее мечевидного отростка - для введения мягкого зажима типа «Бебкокк»; 4) 10 мм- троакар в левой подреберной области по среднеключичной линии - для введения основных инструментов (диссектора, ножниц, клипсаппликатора; 5) 10 мм- троакар в левой мезогастральной области по передней подмышечной линии - для введения зажима типа «Бебкокк» и мини-ретрактора для пищевода. Операционный стол переводят в положение Фовлера (30-35 градусов), в желудок вводят зонд (диаметр 14 мм). Отводят левую долю печени печеночным ретрактором вверх и вправо.
Вскрывают по краю пищеводного отверстия диафрагмы брюшину, затем скелетируют ПОД и ее левую ножку, пересекая пищеводно-диафрагмальные, диафрагмально-кардиальные и диафрагмально-фундальные связки. Пересечение пищеводно-диафрагмальной связки осуществляют после скелетирования левой ножки диафрагмы у ее левого края (безопасная зона для переднего-левого ствола n.Vagus п.1, 3, рис.1). Низводят кардию и абдоминальный отдел пищевода вместе с клетчаткой, связочным аппаратом, стволами блуждающих нервов и их основными ветвями, что значительно удлиняет абдоминальный пищевод и облегчает работу на пищеводно-желудочном переходе. Затем пристеночно в проксимальном направлении (п.5, рис.2) мобилизуют дно желудка, пересекают верхнюю часть желудочно-селезеночной связки, клипируют и пересекают 1-2 проксимальных коротких желудочных сосуда (п.2, рис.1) - только при этом условии объем мобилизации будет достаточным для дальнейшего использования дна желудка в качестве пластического материала и формирования арефлюксной конструкции без натяжения (рис.1). Мобилизованное дно желудка отворачивают кпереди и вниз, открывая заднюю стенку дна желудка (п.4, рис.2), что предоставляет широкий доступ к левой и правой ножкам диафрагмы, задней желудочной артерии (п.6, рис.3), заднему (правому) стволу блуждающего нерва (п.10, рис.5), исключая его повреждение при диссекции пищевода сзади. Сзади мобилизуют кардию и проксимальный участок тела желудка, пересекают первую заднюю поперечную сосудистую ветвь (п.6, рис.3). Мобилизованное дно желудка опускают на место и приступают к диссекции передней стенки кардии и малой кривизны сверху вниз. Из мобилизованной клетчатки у вершины угла Гиса формируют лоскут, отделяя от стенки желудка вершину малого сальника. Подтягивая за нее, добиваются контурирования основного ствола переднего вагуса и его веточек, идущих к желудку (п.7, рис.4).
Сосудисто-нервные пучки пересекают пристеночно. После пересечения кардиальных веточек n. vagus подвижность лоскута малого сальника увеличивалась. Основной ствол вагуса с малым сальником свободно отводится и хорошо открывается угол малой кривизны и пищеводно-желудочный переход.
На протяжении 3-4 см мобилизуют абдоминальный отдел пищевода (п.8, рис.4), при этом рассекают соединительно-тканные перемычки, располагающиеся между блуждающими нервами и пищеводом. Поэтапно отворачивают малый сальник и прецизионно денервируют и скелетируют малую кривизну желудка до уровня первой - второй поперечной сосудистой ветви (п.9, рис.4). В малом сальнике оставляют отсеченные от стенки желудка веточки вагуса и сосуды (рис.4). На этом мобилизацию завершают. Мобилизованный пищевод подтягивают ретрактором. Наивысшую точку мобилизованного дна желудка (на уровне последнего пересеченного короткого желудочного сосуда) прошивают серозно-мышечным швом нитью «Ethibond» 2-0 на атравматической игле, прошивают стенку пищевода на расстоянии около 3 см проксимальнее пищеводно-желудочного перехода, с захватом остатков пищеводно-диафрагмальной связки и прилежащей верхней порцией левой ножки диафрагмы (п.11, рис.5). Нить затягивают без натяжения фиксируемых тканей, узлы завязываются интракорпорально. Первым швом реализуют как восстановление физиологического острого угла Гиса, так и абдоминизацию нижнего отдела пищевода. Пищевод приподнимают, позади него на переднюю поверхность проводят заднюю стенку фундального отдела желудка. Следующий шов формируют на 2-2,5 см ниже предыдущего, в него захватывают нижнюю порцию левой ножки диафрагмы и прилежащую часть фундального отдела желудка (п.12, рис.6). В следующий шов захватывают правую часть дна желудка и нижнюю часть правой ножки диафрагмы (п.13, рис.7), затем аналогичный шов накладывают на верхнюю часть правой ножки диафрагмы (п.14, рис. 8). Таким образом завершается пластика пищеводного отверстия диафрагмы, после чего формируется фундопликационная манжета.
Клинический пример: Больная Н-ва Л.Б., 50 лет, поступила в ХО №4 МУЗ ГБ №2 «КМЛДО» 09.03.09 с диагнозом: Аксиальная кардио-фундальная нефиксированная грыжа пищеводного отверстия диафрагмы. ГЭРБ: дистальный катаральный рефлюкс-эзофагит 1 ст. по Савари-Миллер.
Диагноз подтвержден данными фиброэзофагогастродуоденоскопии, полипозиционного рентгенологического исследования пищевода и желудка, 24-часовой pH-метрией.
Под комбинированным наркозом 13.03.10 выполнена операция: лапароскопическое устранение ГПОД, формирование арефлюксной кардии.
Выполнено наложение пневмоперитонеума и введение троакаров. Пересечена левая треугольная связка печени, левая доля печени отведена вверх и вправо. Мобилизация верхней части желудочно-селезеночной связки с выделением, клипированием и пересечением двух проксимальных коротких желудочных сосудов. Выполнена мобилизация дна и кардиального отдела желудка по большой кривизне до левой стенки пищевода с визуализацией левой диафрагмальной ножки. Произведена мобилизация по малой кривизне желудка по типу суперселективной проксимальной ваготомии с пересечением проксимального поперечного сосуда. Брюшинно-жировой лоскут малого сальника, содержащий передний блуждающий нерв, отведен вверх и вправо. Пищевод приподнят, выполнена диссекция тканей в позадипищеводном пространстве, визуализирован и смещен дорсальнее задний блуждающий нерв, выделены диафрагмальные ножки. Произведена мобилизация 4 см нижней трети грудного отдела пищевода. Затем наивысшая точка мобилизованного дна желудка- на 5 см дистальнее левой стенки пищевода по большой кривизне, прошита серозно-мышечным швом нитью - «Ethibond» 2-0 на атравматической игле, с последующим захватом левой стенки пищевода на 5 см выше уровня кардии, остатков пищеводно-диафрагмальной связки и прилежащей порцией сухожильной части диафрагмы - указанным швом восстановлен угол Гиса и абдоминальная позиция нижней части пищевода.
Пищевод приподнят, позади него на переднюю поверхность проведена задняя стенка фундального отдела желудка. Наложен шов, захватывающий дно желудка и нижнюю часть левой ножки диафрагмы.
В следующий шов захвачены правая часть дна желудка и нижняя часть правой ножки диафрагмы, затем аналогичный шов наложен на верхнюю часть правой ножки диафрагмы, таким образом завершена пластика пищеводного отверстия диафрагмы.
После этого сшиты между собой передняя и задняя стенки дна желудка в проксимальных точках с захватом стенки пищевода и остатков пищеводно-диафрагмальной связки и правой ножки диафрагмы. Дистальнее на протяжении 5 см сшиты правая и левая стороны формируемой манжеты с включением стенки пищевода, с интервалом швов 1 см.
Послеоперационный период протекал без осложнений.
Назогастральный зонд удален к исходу 1-х суток.
Переведена из анестезиологически-реанимационного отделения в палату отделения на 2-е сутки, тогда же начато энтеральное питание через рот.
На 3-е сутки после операции выполнена контрастная полипозиционная ренгеноскопия пищевода и желудка: удовлетворительная функция манжеты, гастроэзофагеального рефлюкса не отмечено, затеков контраста не выявлено.
Больная была выписана на 4-е сутки после операции.
При контрольном обследовании через 6 месяцев после операции:
Эзофагогастроскопия: признаков воспаления слизистой оболочки пищевода не выявлено, кардия сомкнута, признаков гастроэзофагеального рефлюкса не отмечено.
Полипозиционная рентгеноскопия пищевода и желудка: удовлетворительная функция арефлюксной манжетки, признаков ГПОД и ГЭР не отмечено.
В настоящее время состояние удовлетворительное, жалобы, типичные при грыже пищеводного отверстия диафрагмы и гастроэзофагеальной рефлюксной болезни, отсутствуют.
Способ пластики пищеводного отверстия диафрагмы из лапароскопического доступа, включающий мобилизацию дна желудка, абдоминального отдела пищевода, фундопликацию, отличающийся тем, что пластику пищеводного отверстия диафрагмы осуществляют стенкой мобилизованного дна желудка путем прошивания наивысшей точки мобилизованного дна желудка, прилежащей верхней порции левой ножки диафрагмы и стенки пищевода с захватом остатков пищеводно-диафрагмальной связки, затем формируют следующий шов-связку путем прошивания нижней порции левой ножки диафрагмы и прилежащей к ней части фундального отдела желудка, после чего формируют следующий шов-связку путем прошивания нижней части правой ножки диафрагмы и прилежащей к ней части дна желудка, затем аналогичный шов накладывают на верхнюю часть правой ножки диафрагмы.