Способ видовой дифференциации жизнеспособных родококков, иммобилизованных в гелевом носителе
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано для дифференцированного определения числа жизнеспособных актинобактерий рода Rhodococcus, иммобилизованных в нерастворимом гелевом носителе. Способ предусматривает следующее. Гранулу биокатализатора с заключенными в ней клетками одного или нескольких видов родококков помещают в лунку 96-луночного планшета, добавляют краситель иодонитротетразолий (INT). После появления специфического фиолетового окрашивания формазана измеряют оптическую плотность гранулы с помощью планшетного фотометра. В случае окрашенного субстрата или предварительного нахождения иммобилизованного биокатализатора в почве проводят экстракцию формазана 96% этанолом и измеряют оптическую плотность экстракта. Число жизнеспособных родококков в грануле геля определяют с помощью калибровочного графика зависимости оптической плотности от числа живых клеток в суспензии, определенного традиционным методом высева на плотную питательную среду. Затем из окрашенной красителем гранулы биокатализатора или из гранулы после экстракции красителя выделяют ДНК и проводят ПЦР с использованием наборов видоспецифических праймеров. Определяют видовое положение иммобилизованных родококков. Изобретение позволяет сократить время дифференциации родококков и повысить точность способа. 1 з.п. ф-лы, 3 табл., 4 ил., 4 пр.
Реферат
Изобретение относится к промышленной микробиологии и биотехнологии, в частности к способам детекции микроорганизмов в биотехнологических препаратах и объектах окружающей среды, и предназначено для дифференцированного определения числа жизнеспособных актинобактерий рода Rhodococcus, иммобилизованных в нерастворимом в воде гелевом носителе. Родококки, характеризующиеся высокой активностью оксигеназного ферментного комплекса и доминирующие в загрязненных почвенных микробиоценозах, являются одной из наиболее разрабатываемых бактериальных групп в современной биотехнологии, перспективной для создания биокатализаторов процессов деструкции и трансформации органических соединений всех известных классов [Ившина И.Б. Состояние и проблемы развития специализированных центров микробиологических ресурсов в России // Микробиология. - 2012. - Т.81. №5, - С.551-560]. В связи с возрастающим применением иммобилизованных биокатализаторов в биотехнологии, в частности ферментационных процессах и при очистке загрязненной воды и почвы, актуальной проблемой является контроль жизнеспособности микроорганизмов, заключенных в матрицу носителей.
Известны культуральные способы определения численности живых микроорганизмов в биопрепаратах и объектах окружающей среды, основанные на высеве исследуемого образца на подходящую питательную среду, но они не предназначены для детекции иммобилизованных в водонерастворимых гелях микроорганизмов, что связано с трудностями их выделения из гелевого носителя. Используется также прямой подсчет количества микроорганизмов под микроскопом, однако его применение ограничено для непрозрачных образцов, в частности гелей с заключенными в них микробными клетками. Поэтому при изучении жизнеспособности иммобилизованных в геле клеток в основном используют косвенные биохимические методы, например люциферин-люциферазный метод определения количества АТФ [Ефременко Е.Н., Татаринова Н.Ю. Влияние длительного хранения клеток микроорганизмов, иммобилизованных в криогель поливинилового спирта, на их выживаемость и биосинтез целевых метаболитов // Микробиология. - 2007. - Т.76, №3. - С.383-389].
Суть метода заключается в проведении катализируемой ферментом люциферазой реакции АТФ с белком люциферином и кислородом. Гранулы биокатализатора помещают в ДМСО для экстракции внутриклеточного АТФ, затем к полученному экстракту добавляют люциферин-люциферазный реагент и определяют интенсивность свечения с помощью люминометра. Точную концентрацию АТФ определяют по калибровочному графику при использовании стандартных растворов АТФ известной концентрации. Далее рассчитывают количество жизнеспособных иммобилизованных микроорганизмов с помощью калибровочной зависимости концентрации АТФ от числа живых клеток микроорганизма в суспензии, определенного традиционным методом высева на плотную питательную среду. Преимуществами данного способа являются (1) универсальность в отношении различных носителей и микроорганизмов разных систематических групп, (2) отсутствие зависимости внутриклеточной концентрации АТФ от физиологического состояния клеток и (3) высокая чувствительность метода.
Однако данным способом невозможно осуществлять детекцию микроорганизмов, то есть определение их видового положения. К недостаткам способа также можно отнести его длительность и трудоемкость, связанную с получением калибровочных зависимостей, а также необходимость использования дорогостоящего оборудования и набора реагентов. Кроме того, недостатком способа является невозможность контролировать эффективность экстракции внутриклеточного АТФ с помощью ДМСО, которая может существенно различаться у разных микроорганизмов в зависимости от строения их клеточной стенки.
Известен способ детектирования живых, поврежденных и мертвых клеток микроорганизмов с помощью проточной цитометрии [Патент №2384624], который позволяет детектировать окрашенные флуоресцентным красителем микроорганизмы на уровне одной клетки. Однако данный способ непригоден для микроорганизмов, иммобилизованных в водонерастворимых гелях, так как требует выделения микроорганизмов в жидкую среду и пропускания потока жидкости в проточной кювете цитофлуориметра. Кроме того, с помощью данного способа невозможно проводить определение видового положения микроорганизма.
Ранее нами описан метод определения числа жизнеспособных родококков, иммобилизованных в криогеле поливинилового спирта, основанный на витальном окрашивании гранул геля иодонитротетразолием (INT) в 96-луночном планшете и определении интенсивности фиолетовой окраски гранул, появляющейся вследствие восстановления бесцветного INT до красно-фиолетового формазана в присутствии живых активно респирирующих микроорганизмов, с помощью планшетного фотометра [Kuyukina M.S., Ivshina I.В., Gavrin A.Yu., Podorozhko E.A., Lozinsky V.I., Jeffree C.E., Philp J.С.Immobilization of hydrocarbon-oxidizing bacteria in polyvinyl alchohol) cryogels hydrophobized using a biosurfactant // J. Microbiol. Methods. - 2006. - V.65. - P.596-603]. Образующийся формазан экстрагировали из гранул геля с помощью этилацетата, а затем определяли оптическую плотность экстракта. Однако данным методом невозможно определять видовое положение иммобилизованных бактерий.
Существуют способы дифференцированного определения иммобилизованных в геле микроорганизмов с помощью иммунологических методов, в частности применения антител, высокоспецифичных по отношению к микроорганизмам определенного типа. Так, известен иммунофлуоресцентный способ селективного определения количества клеток лактококков и бревибактерий, иммобилизованных в гранулах каррагинанового геля [Prioult G., Lacroix С., Turcotte С., Fliss I. Simultaneous immunofluorescent detection of coentrapped cells in gel beads // Appl. Environ. Microbiol. - 2000. V.66 (5). - P.2216-2219; Doleyres Y., Fliss I., Lacroix C. Quantitative determination of the spatial distribution of pure-and mixed-strain immobilized cells in gel beads by immunofluorescence // Appl. Microbiol. Biotechnol. - 2002. - V.59 (2-3). - P.297-302]. Способ основан на использовании поликлональных антител к данным видам бактерий. Согласно способу гранулу геля с заключенными в нем микроорганизмами разрезали пополам, отмывали буферным раствором и инкубировали в течение 2 часов с поликлональными антителами меченными флуоресцентными красителями ALEXA (568 для лактококков и 488 для бревибактерий). После 4-кратного промывания буфером гранулу анализировали с помощью конфокального лазерного сканирующего микроскопа при соответствующей эмиссии. Иммунофлуоресцентные сигналы обрабатывали с помощью специального программного обеспечения, позволяющего осуществить дифференцированное определение количества и распределения микроорганизмов в грануле геля.
Данный способ имеет несколько существенных недостатков, главным из которых является неуниверсальность метода и необходимость предварительного получения специфичных поликлональных антител для каждого определяемого типа микроорганизмов, что делает сам метод очень дорогими, а область его возможного применения очень узкой. Кроме того, конфокальный лазерный сканирующий микроскоп является очень дорогостоящим оборудованием. Существенный недостаток метода также в том, что количественный анализ микроорганизмов затруднен сильной зависимостью флуоресцентного сигнала от физиологического состояния клетки, химического состава геля и жидкой среды, а также глубины нахождения клеток в толще геля, что делает получение воспроизводимых результатов практически невозможным.
Известны способы детекции живых микроорганизмов в различных средах с помощью полимеразной цепной реакции (ПЦР). Описан способ детекции живых клеток микроорганизма путем дифференцирования живых клеток от мертвых клеток или поврежденных клеток в тестируемом образце [Патент №2395583]. Способ предусматривает стадию обработки тестируемого образца ядом топоизомеразы или ядом ДНК-гиразы, стадию экстракции ДНК из тестируемого образца и амплификацию мишеневого участка экстрагированной ДНК методом ПЦР, где длина мишеневого участка составляет от 900 до 3000 нуклеотидов, и стадию анализа продукта амплификации с помощью гель-электрофореза. Изобретение позволяет определять наличие живых организмов в исследуемом образце.
Недостатком этого метода является невозможность количественного определения жизнеспособных микроорганизмов.
Наиболее близким к заявляемому способу является способ детектирования живой клетки микроорганизма в тест-пробе [Патент №2410440], предусматривающий добавление к этой тест-пробе сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм; облучение светом, имеющим длину волны 350 нм-700 нм; удаление сшивающего агента; добавление среды и дальнейшее инкубирование; добавление опять сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к инкубируемой тест-пробе; повторное облучение светом, имеющим длину волны 350 нм-700 нм; экстракцию ДНК из этой тест-пробы и амплификацию района-мишени экстрагированной ДНК; и анализ амплифицированного продукта.
Однако количественная оценка живых микроорганизмов данным способом невозможна при постановке простой ПЦР, а требует проведения ПРЦ реального времени (real-time PCR), для чего необходимо использование дорогостоящего оборудования, программного обеспечения и реактивов, более сложный дизайн зондов и праймеров. Кроме того, данный способ не апробирован для микроорганизмов, иммобилизованных в водонерастворимых гелевых носителях.
Цель настоящего изобретения - разработка простого и экспрессного метода количественной детекции живых иммобилизованных клеток родококков разных видов и контроля функциональной стабильности биокатализаторов на основе водонерастворимых полимерных гелей. Техническим результатом является возможность постоянного контроля жизнеспособности одного или нескольких штаммов родококков, заключенных в гранулы биокатализатора, быстрой селекции наиболее эффективных биокатализаторов, а также мониторинга выживаемости иммобилизованных бактерий в биопрепаратах при их хранении, использовании в биореакторах или объектах окружающей среды. При этом в одной и той же грануле биокатализатора последовательно определяется число жизнеспособных клеток и видовая принадлежность иммобилизованных бактерий, что сокращает время анализа, уменьшает расход образца биокатализатора и позволяет селективно оценивать эффективность моновидовых (однокомпонентных) и поливидовых (многокомпонентных) биокатализаторов на основе родококков. Предлагаемая в настоящем способе комбинация окрашивания INT и обычной ПЦР является более простым и надежным способом детекции жизнеспособных бактерий определенного вида. Предлагаемый способ предполагает одновременную оценку жизнеспособности иммобилизованных в геле родококков с помощью витального окрашивания иодонитротетразолием (INT) и их видовую детекцию с помощью видоспецифической ПЦР. Это необходимо, например, когда в биореакторе, либо в загрязненной воде или почве используется сразу несколько видов родококков, и представители разных видов иммобилизованы в одинаковые гранулы гелевого носителя. Метод состоит в том, что сначала определяют число живых клеток родококков в образце геля путем окрашивания INT и измерения оптической плотности геля, а затем в этом же образце геля определяют, к какому виду принадлежат данные бактерии путем постановки ПЦР с видоспецифическими праймерами. Если в ранее опубликованном способе [Kuyukina M.S., Ivshina I.В., Gavrin A.Yu., Podorozhko E.A., Lozinsky V.I., Jeffree C.E., Philp J.C. Immobilization of hydrocarbon-oxidizing bacteria in poly(vinyl alchohol) cryogels hydrophobized using a biosurfactant // J. Microbiol. Methods. - 2006. - V.65. - P.596-603] образовавшийся формазан экстрагировали этилацетатом, то в настоящем изобретении используется менее токсичный и общедоступный растворитель - этанол, обладающий более высокой экстракционной способностью в отношении формазана.
Существенным отличием заявляемого изобретения является новое сочетание последовательно выполняемых действий и применяемых методов анализа (а именно спектрофотометрического и генетического, т.е. специфическое окрашивание гранул геля, экстракция красителя и определение оптической плотности, выделение ДНК и проведение видоспецифической ПЦР) для количественного определения жизнеспособности иммобилизованных бактерий разных таксономических групп. Суть способа заключается в возможности выделения бактериальной ДНК из одной гранулы геля, предварительно окрашенной INT, или гранулы, из которой предварительно экстрагировали формазан 96%-ным этанолом, и получении достоверных результатов видовой детекции родококков с помощью ПЦР.
Описание способа. Одну гранулу геля размером 5-125 мм3 с заключенными в ней клетками одного или нескольких видов родококков в концентрации 103-109 клеток/мл помещают в лунку 96-луночного планшета, добавляют 200 мкл INT (5 г/л) и после появления специфического фиолетового окрашивания (в течение 1-2 ч) измеряют оптическую плотность гранулы с помощью планшетного фотометра при 600-630 нм. В случае, когда гранула с иммобилизованными родококками окрашена вследствие цветного материала геля, нахождения иммобилизованного биокатализатора в окрашенной жидкой среде или в почве, из лунки планшета удаляют жидкость, проводят экстракцию формазана из гранулы путем добавления 200 мкл 96% этанола, после инкубации в течение 1 ч удаляют гранулу и измеряют оптическую плотность экстракта при 460-500 нм. Число жизнеспособных родококков в грануле геля рассчитывают с помощью калибровочного графика зависимости оптической плотности от числа живых клеток в суспензии, определенного традиционным методом высева на плотную питательную среду.
Затем из предварительно разрезанной на несколько частей скальпелем окрашенной красителем гранулы или из этой же гранулы после экстракции красителя выделяют ДНК методом, обеспечивающим выделение максимального количества бактериальной ДНК из геля, предпочтительно модифицированным методом [Amita J., Vandana Т., Guleria R.S., Verma R.K. Qualitative evaluation of mycobacterial DNA extraction protocols for polymerase chain reaction // Mol. Biol. Today. - 2002. - V.3. - P.43-50], сочетающим термический и энзиматический лизис клеток родококков, либо с помощью коммерческого набора ZR ВАС DNA Miniprep Kit (Zymo Research) в соответствии с инструкцией фирмы-производителя. В случае предварительного нахождения гранул иммобилизованного биокатализатора в почве выделение бактериальной ДНК проводят модифицированным методом [Dong D. Removal of humic substances from soil DNA using aluminium sulfate // J. Microbiol. Methods. - 2006. - V. 66. - P. 217-222] либо с помощью коммерческого набора ZR ВАС Soil DNA Miniprep Kit (Zymo Research) в соответствии с инструкцией фирмы-производителя.
Выделенную ДНК используют для проведения ПЦР с использованием наборов специфических праймеров для соответствующих видов родококков. При этом соблюдают условия постановки ПЦР для конкретного набора праймеров. Продукты ПЦР анализируют при помощи электрофореза в 1,5%-ном агарозном геле, после окрашивания геля раствором (0,5 мкг/мл) бромистого этидия и появления соответствующих полосок в УФ-свете определяют видовое положение иммобилизованных бактерий.
Конкретные примеры осуществления изобретения.
Пример 1. Готовили два образца иммобилизованного биокатализатора на основе гранул криогеля поливинилового спирта (ПВС) размером 10 мм3 с заключенными в каждом из них углеводородокисляющими родококками (106 кл/мл) - либо Rhodococcus ruber ИЭГМ 615, либо Rhodococcus opacus ИЭГМ 249 по описанной методике [Kuyukina M.S., Ivshina I.В., Gavrin A.Yu., Podorozhko E.A., Lozinsky V.I., Jeffree C.E., Philp J.C. Immobilization of hydrocarbon-oxidizing bacteria in polyvinyl alchohol) cryogels hydrophobized using a biosurfactant // J. Microbiol. Methods. - 2006. - V.65. - P.596-603]. В биореактор с загрязненной нефтяными углеводородами (2 об.%) водой помещали 50 гранул биокатализатора (25 гранул с R. ruber и 25 гранул с R. opacus) и инкубировали в течение 48 ч. После этого проводили сравнительную оценку эффективности данных штаммов по их жизнеспособности в присутствии загрязненной углеводородами воды. Для анализа отбирали 10 гранул, отмывали их от остаточного углеводорода с помощью буферного раствора и помещали в лунки 96-луночного планшета. Гранулы окрашивали с помощью INT в течение 1 ч и определяли интенсивность фиолетового окрашивания на планшетном фотометре при 630 нм. Затем отбирали 5 окрашенных гранул, экстрагировали из них формазан 96% этанолом в течение 1 ч и определяли интенсивность окрашивания экстрактов на планшетном фотометре при 490 нм. Полученные результаты пересчитывали на число жизнеспособных клеток в грануле по калибровочному графику зависимости оптической плотности от числа клеток для данных штаммов родококков. Далее каждую гранулу разрезали на 4 части стерильным скальпелем, помещали в пластиковую микропробирку и проводили выделение бактериальной ДНК модифицированным методом [Amita J., Vandana Т., Guleria R.S., Verma R.K. Qualitative evaluation of mycobacterial DNA extraction protocols for polymerase chain reaction // Mol. Biol. Today. - 2002. - V.3. - P.43-50]. Для этого в микропробирку добавляли 0,2 мл лизисного буфера (10 мМ Tris, 1 мМ ЭДТА, pH 8.0), нагревали до 85°C в течение 10 мин и немедленно замораживали при -20°C в течение 15 мин. Смесь оттаивали, добавляли лизоцим (20 мг/мл), перемешивали и инкубировали при 37°C в течение 2 ч. Далее повышали температуру смеси до 65°C, добавляли протеиназу К (0,25 мг/мл) и додецилсульфат натрия (1%) и инкубировали на шейкере в течение 30 мин. К смеси добавляли СТАВ (10%) и NaCl 0.7 М до концентрации 1%. Экстрагировали ДНК смесью хлороформ/изоамиловый спирт (24:1) при осторожном встряхивании в течение 5 мин. Далее смесь центрифугировали при 10 тыс.об/мин в течение 1 мин и отбирали верхнюю фракцию супернатанта. Осаждение бактериальной ДНК проводили путем добавления 7,5 М ацетата аммония и изопропанола в соотношении 1:2 при +4°C в течение 15 мин, смесь центрифугировали при 12 тыс.об/мин в течение 10 мин. Надосадочную жидкость сливали, а осадок 3 раза промывали 70%-ным этанолом. Полученный осадок ДНК растворяли в 0,5 мл 0,01 М Tris-HCl, pH 7,6.
Выделенную из одной гранулы геля ДНК использовали для ПЦР с наборами праймеров для R. ruber и R. opacus, описанными [Bell K.S., Kuyukina M.S., Heidbrink S., Philp J.C., Aw D.W.J., Ivshina I.B., Christofi N. Identification and environmental detection of Rhodococcus species by 16S rDNA-targeted PCR // J. Appl. Microbiol. - 1999. - V.87. - P.472- 480], синтезированными компанией «Синтол», Москва.
Использовали наборы праймеров следующего состава:
1) специфичные для R. ruber (ожидаемая длина амплифицированного продукта 302 пн)
а) Rul 5′GTCTAATACCGGATAGGACCTCGGGA3′,
б) Ru2 5′TACCGTCACTTGCGCTTCGTCGGTAC3′;
2) специфичные для R. opacus (ожидаемая длина амплифицированного продукта 447 пн)
а) Rol 5′TATGACCTTCGGCTGCATGGCTGAG3′,
б) Ro2 5′ CCGTATCGCCTGGAAGCTCGAG3′.
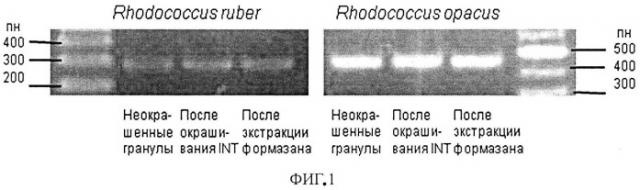
Реакционная смесь объемом 25 мкл имела следующий состав: 10 мМ ПЦР-буфер; 2,5 мМ MgCl2 (для праймеров к R. ruber) и 1,5 мМ MgCl2 (для праймеров к R. opacus); 0,2 мМ смесь четырех дезоксинуклеозидтрифосфатов (дНТФ); по 0,2 мкМ прямого и обратного праймера; 0,4 ед. Taq-ДНК полимеразы; 1 мкл ДНК, деионизировання вода. Режимы амплификации для данных праймеров следующие: 5 мин при 95°C и 35 циклов по 30 сек при 95°C, 30 сек при 64°C (для R. opacus) или 60°C (для R. ruber), 30 сек при 72°C, затем 10 мин при 72°C. Продукты ПЦР визуализировали с помощью агарозного гель-электрофореза. Штаммы R. ruber и R. opacus четко детектировались по результатам ПЦР в гранулах геля без окрашивания, после окрашивания INT и после экстракции формазана этанолом (фиг.1). Среднее число иммобилизованных живых клеток R. ruber составляло 2,7×106 кл/мл, a R. opacus - 1,7×106 кл/мл (табл.1). Таким образом, выживаемость клеток R. ruber после контакта с нефтезагрязненной водой в 1,6 раз превышала таковую клеток R. opacus. Время проведения всего анализа составило 6-8 ч.
Пример 2. Готовили два образца иммобилизованного биокатализатора на основе гранул криогеля ПВС размером 125 мм3 с заключенными в каждом из них углеводородокисляющими бактериями (106 кл/мл) либо Rhodococcus ruber ИЭГМ 615, либо Rhodococcus erythropolis ИЭГМ 275, как описано в примере 1. В почву, загрязненную нефтью (10 вес.%), вносили 200 гранул биокатализатора (100 гранул с R. ruber и 100 гранул с R. erythropolis) и инкубировали в течение 1-3-х недель. После этого отбирали 10 гранул и проводили сравнительную оценку эффективности данных штаммов по их выживаемости в нефтезагрязненной почве, как описано в примере 1. Поскольку гранулы окрашивались в темный цвет после инкубирования в нефтезагрязненной почве, проводили количественное определение формазана после его экстракции этанолом по интенсивности окрашивания экстрактов на планшетном фотометре при 490 нм. В качестве контроля использовали пустые (без микроорганизмов) гранулы после их инкубирования в нефтезагрязненной почве. Полученные результаты пересчитывали на число жизнеспособных клеток в грануле по калибровочному графику зависимости оптической плотности от числа клеток для данных штаммов бактерий. Далее каждую гранулу использовали для выделения ДНК с помощью коммерческого набора ZR Soil DNA Miniprep Kit (Zymo Research) в соответствии с инструкцией фирмы-производителя. Выделенную из 1 гранулы ДНК использовали для ПЦР с наборами праймеров для R. ruber и R. erythropolis, описанными [Bell K.S., Kuyukina M.S., Heidbrink S., Philp J.C., Aw D.W.J., Ivshina I.В., Christofi N. Identification and environmental detection of Rhodococcus species by 16S rDNA-targeted PCR // J. Appl. Microbiol. - 1999. - V.87. - P.472-480], синтезированными компанией «Синтол», Москва. Использовали наборы праймеров следующего состава:
1) специфичные для R. ruber - как в примере 1;
2) специфичные для R. erythropolis (ожидаемая длина амплифицированного продукта 449 пн)
а) Rel 5′CGTCTAATACCGGATATGACCTCCTATC3′,
б) Re2 5′GCAAGCTAGCAGTTGAGCTGCTGGT 3′.
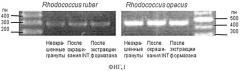
Реакционная смесь объемом 25 мкл имела следующий состав: 10 мМ ПЦР-буфер; 2,5 мМ MgCl2 (для праймеров к R. ruber) и 1,5 мМ MgCl2 (для праймеров к R. erythropolis); 0,2 мМ смесь четырех дезоксинуклеозидтрифосфатов (дНТФ); по 0,2 мкМ прямого и обратного праймера; 0,4 ед. Taq-ДНК полимеразы; 1 мкл ДНК, деионизировання вода. Режимы амплификации для данных праймеров следующие: 5 мин при 95°C и 35 циклов по 30 сек при 95°C, 30 сек при 64°C (для R. erythropolis) или 60°C (для R. ruber), 30 сек при 72°С, затем 10 мин при 72°C. Продукты ПЦР визуализировали с помощью агарозного гель-электрофореза. Штаммы R. ruber и R. erythropolis четко детектировались по результатам ПЦР в гранулах геля после продолжительного пребывания в нефтезагрязненной почве (фиг.2). Среднее число живых клеток R. ruber составляло 3,2×105 кл/мл, a R. erythropolis - 2,8×105 кл/мл (табл.2). Таким образом, данные виды родококков успешно детектировались с помощью предложенного способа после длительного пребывания иммобилизованного биокатализатора в нефтезагрязненной почве. Время проведения всего анализа составило 6-8 ч.
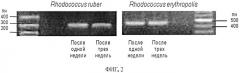
Пример 3. Готовили образец поливидового биокатализатора на основе гранул криогеля ПВС размером 100 мм3 с заключенными в них углеводородокисляющими бактериями (106 кл/мл) R. ruber ИЭГМ 615 и R. opacus ИЭГМ 245, взятыми в равных соотношениях, как описано в примере 1. После хранения биокатализатора в холодильнике (при 5°C) в течение 2-х месяцев определяли жизнеспособность иммобилизованных родококков. Для анализа отбирали 10 гранул и помещали их в лунки 96-луночного планшета. Гранулы окрашивали с помощью INT в течение 1 ч и определяли интенсивность фиолетового окрашивания на планшетном фотометре при 630 нм. Полученные результаты пересчитывали на число жизнеспособных клеток в грануле по калибровочному графику зависимости оптической плотности от числа клеток для данных штаммов родококков. Далее из каждой гранулы выделяли ДНК с помощью коммерческого набора ZR DNA Miniprep Kit (Zymo Research) в соответствии с инструкцией фирмы-производителя и проводили видоспецифическую ПЦР, как показано в примере 1. Оба штамма R. ruber и R. opacus, заключенные совместно в 1 грануле геля, четко детектировались по результатам ПЦР (фиг.3). Среднее число живых клеток данных штаммов микроорганизмов составляло 5,7×106 кл/мл (табл.3). Таким образом, видовая дифференциация и определение жизнеспособности иммобилизованных родококков успешно проводились с помощью предложенного способа после продолжительного хранения биокатализатора. Время проведения всего анализа составило 6 ч.
Пример 4. Готовили 4 образца моновидового биокатализатора на основе гранул криогеля ПВС размером 100 мм3 с заключенными в них углеводородокисляющими бактериями R. opacus ИЭГМ 245, взятыми в различных концентрациях (103, 104, 106 и 108 кл/мл), как описано в примере 1. Для анализа отбирали по 5 гранул каждого образца и помещали их в лунки 96-луночного планшета. Гранулы окрашивали с помощью INT в течение 1 ч и определяли интенсивность фиолетового окрашивания на планшетном фотометре при 630 нм. Полученные результаты пересчитывали на число жизнеспособных клеток в грануле по калибровочному графику зависимости оптической плотности от числа клеток для данных штаммов микроорганизмов. Далее из каждой гранулы выделяли ДНК как в примере 3 и проводили видоспецифическую ПЦР, как показано в примере 1. Клетки R. opacus четко детектировались по результатам ПЦР во всех гранулах даже при низкой (103 кл/мл) концентрации (фиг.4). Время проведения всего анализа составило 6 ч.
Таким образом, заявляемый способ видовой дифференциации жизнеспособных родококков, иммобилизованных в водонерастворимых гелевых носителях, по сравнению с аналогами имеет ряд существенных преимуществ, поскольку позволяет определять число живых бактериальных клеток определенного вида в одном образце (грануле) биокатализатора даже при их низкой (от 103 кл/мл) концентрации, в короткое (6-8 ч) время, без необходимости выделения клеток из гелевого носителя и культивирования бактерий и без использования дорогостоящего оборудования.
Описание фигур и таблиц
Фиг.1. Результаты ПЦР-амплификации ДНК, выделенной из гранул геля с иммобилизованными клетками Rhodococcus ruber и Rhodococcus opacus после инкубирования биокатализатора в присутствии загрязненной углеводородами воды.
Фиг.2. Результаты ПЦР-амплификации ДНК, выделенной из гранул геля с иммобилизованными клетками Rhodococcus ruber и Rhodococcus erythropolis после инкубирования биокатализатора в нефтезагрязненной почве в течение 1 и 3 недель.
Фиг.3. Результаты ПЦР-амплификации ДНК, выделенной из гранул геля с совместно иммобилизованными клетками Rhodococcus ruber и Rhodococcus opacus после хранения биокатализатора.
Фиг.4. Результаты ПЦР-амплификации ДНК, выделенной из гранул геля с иммобилизованными в различных концентрациях клетками Rhodococcus ruber.
Табл.1. Результаты определения жизнеспособности иммобилизованных в геле клеток Rhodococcus ruber и Rhodococcus opacus после инкубирования биокатализатора в присутствии загрязненной углеводородами воды.
Табл.2. Результаты определения жизнеспособности иммобилизованных в геле клеток Rhodococcus ruber и Rhodococcus erythropolis после инкубирования биокатализатора в нефтезагрязненной почве в течение 1 и 3 недель.
Табл.3. Результаты определения жизнеспособности иммобилизованных в геле клеток Rhodococcus ruber и Rhodococcus opacus после хранения биокатализатора.
| Таблица 1 | ||
| Виды родококков | Rhodococcus ruber | Rhodococcus opacus |
| Значения ОП630 нм окрашенных INT гранул геля с иммобилизованными родококками | 1,53±0,12 | 1,18±0,09 |
| Значения ОП490 н.м экстрактов формазана из окрашенных INT гранул геля с иммобилизованными родококками | 0,42±0,02 | 0,28±0,03 |
| Среднее число иммобилизованных живых клеток родококков, кл/мл | (2,7±0,16)×106 | (1,7±0,08)×106 |
| Таблица 2 | ||
| Виды микроорганизмов | Rhodococcus ruber | Rhodococcus erythropolis |
| Значения ОП490 нм экстрактов формазана из окрашенных INT гранул геля с иммобилизованными родококками (после 1 недели в почве) | 1,08±0,02 | 1,00±0,04 |
| Среднее число иммобилизованных живых клеток родококков (после 1 недели в почве), кл/мл | (6,0±0,21)×105 | (4,7±0,36)×105 |
| Значения ОП490 нм экстрактов формазана из окрашенных INT гранул геля с иммобилизованными родококками (после 3 недель в почве) | 0,87±0,05 | 0,73±0,09 |
| Среднее число иммобилизованных живых клеток родококков (после 3 недель в почве), кл/мл | (3,2±0,18)×105 | (2,8±0,14)×105 |
| Таблица 3 | |
| Виды микроорганизмов | R. ruber+R. Opacus |
| Значения ОП630 нм окрашенных INT гранул геля с иммобилизованными родококками | 1,90±0,13 |
| Среднее число иммобилизованных живых клеток родококков, кл/мл | (5,7±0,42)×106 |
1. Способ видовой дифференциации жизнеспособных родококков, иммобилизованных в гранулах водонерастворимого геля, заключающийся в спектрофотометрическом определении числа живых клеток в окрашенном иодонитротетразолием (INT) образце геля, экстракции ДНК из данного образца и проведении ПЦР с использованием наборов видоспецифических праймеров.
2. Способ по п.1, отличающийся тем, что после окрашивания образца геля INT проводят экстракцию образовавшегося формазана этанолом, а затем экстрагируют ДНК из данного образца геля для постановки видоспецифической ПЦР.