Способ оценки in vitro индивидуальной реакции организма пациента на действие фармакологического препарата
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано для in vitro оценки индивидуальной иммунной реакции организма на действие фармацевтического препарата. Для этого проводят исследование отдельных лимфоцитов периферической крови пациента методом интерференционной микроскопии. Из суспензии лимфоцитов крови донора до действия внешнего фактора выделяют первую пробу, микроскопируют в интерференционном микроскопе, для получения изображения лимфоцита в виде зон оптической плотности в проекции отдельных органелл и измеряют последовательно: цитоплазматический индекс, а также значения фазовой толщины, площади, эквивалентных диаметров, фазового объема, рефрактерности у следующих органелл лимфоцита: внешняя граница периферийной части цитоплазмы, плотная часть цитоплазмы, хондриом, ядро и ядрышко. Затем у этого же донора из суспензии лимфоцитов выделяют вторую пробу и после действия на лимфоциты фармакологического препарата их повторно микроскопируют в интерференционном микроскопе, измеряют вышеуказанные параметры указанных органелл лимфоцита, после чего образуют второй набор значений фазовой толщины. При этом оценку индивидуальной иммунной реакции организма на действие фармацевтического препарата осуществляют по количественным изменениям указанных параметров во втором наборе параметров. Изобретение обеспечивает снижение вероятности непредсказуемых последствий лекарственной терапии и побочных явлений. 1 з.п. ф-лы, 2 табл., 12 ил.
Реферат
Изобретение относится к медицине и может быть использовано при лабораторных исследованиях in vitro действия лекарственных препаратов и других внешних факторов.
В последние годы стали более заметны недостатки ряда методов традиционной медицинской диагностики. В перечне многих актуальных проблем современной медицины значительная часть связана с диагностикой заболеваний иммунной системы, с аллергическими реакциями, с непредсказуемостью действия фармакологических препаратов на организм человека, побочными эффектами, проблемами трансплантологии и т.п. Это привело к формированию нового направления персонализированной медицины. О его зрелости свидетельствуют организационные структуры, периодические издания, сайты, регулярные конференции и т.д. В статьях и докладах уделяется большое внимание новым методам in vitro диагностики как более безопасным для пациента.
Для определения иммунного статуса пациента широко используются методы in vitro диагноза, основанные на анализе изображений, определении параметров клеток крови и тканей методами и приборами микроскопии, проточной цитометрии, биохимии и другими средствами.
Новые методы микроскопии (конфокальной, флуоресцентной, нелинейной, интерференционной, комбинационной и др.) позволяют получить в функциональных изображениях значительно большую информацию о морфологии клетки. Однако их общим недостатком является большое время анализа, трудоемкость и большой расход материалов. Кроме того, эти методы дают ограниченную информацию о параметрах органелл клетки в изображении окрашенной клетки, и параметры представляются в относительных, а не в абсолютных значениях.
Известно, что интерференционные или фазовые изображения обладают рядом необычных свойств. На экране монитора они представлены в виде двумерного распределения оптической разности хода лучей, нормированного на длину волны света. Это свойство фазовых изображений позволяет сравнивать морфологические параметры, полученные в различных условиях и приборах на неокрашенных клетках и использовать их в медицине, например, для иммунной диагностики и исследования механизма действия препаратов на эритроциты и другие клетки.
В работе Yonng Keun Park, выполненной в лаборатории G Popescu, MIT, США и опубликованной в PNAS, 2008, приведены результаты измерений рефрактерности и флуктуации мембраны отдельных эритроцитов. Эритроциты были выделены из крови пациента, инфицированного паразитом Plasmodium falciparum. Измерения на оригинальном дифракционном фазовом микроскопе показали корреляцию между средним по объему показателем преломления (или рефрактерностью) эритроцита и температурой пациента на различных стадиях лихорадки. Для вычисления показателя преломления здоровых доноров и больных использовались абсолютные значения фазовой толщины. В качестве дополнительных параметров приведены значения концентрации гемоглобина. Благоприятным обстоятельством являлась их оптическая однородность и отсутствие ядер. Поэтому средние по объему значения показателя преломления, приведенные в указанной выше и во многих других работах, не могут быть использованы в качестве единственного значимого параметра морфологии, характеризующего состояние отдельного мононуклеара.
Ближе к заявляемому изобретению является in vitro способ оценки влияния глюкокортикостероидов на моноциты периферической крови по изменению их морфометрических показателей методом компьютерной фазово-интерференционной микроскопии (Терпигорев С.А., Ильченко В.А., Василенко И.А. и др. «Соотношение результатов лечения глюкокортикостероидами с их влиянием на моноциты in vitro при бронхиальной астме». Бюл. Эксп. биол. и мед., 2003, Т.135-6, стр.683-687). Этот способ основан на определении изменений морфометрических показателей моноцитов (диаметра, периметра, высоты, площади, объема) после их инкубации с преднизолоном в концентрации 10-7 и 10-4 ммоль/л в течение 60 минут при комнатной температуре. При снижении показателей (диаметра, периметра и площади) клеток на 10% и более по сравнению с контролем (с необработанными клетками) прогнозируется эффективность глюкокортикостероидной терапии.
Недостатками этого способа являются ограниченная достоверность анализа, связанная с использованием в качестве критерия эффективности терапии фиксированного уровня (10% и более) снижения значимых параметров, большое время измерений и тестирования одного типа препаратов.
Наиболее близким к заявляемому изобретению является описанный в RU 2382364 и опубликованный 20.02.2010 способ прогнозирования эффективности лечения глюкокортикостероидами, включающими исследование in vitro методом фазово-интерференционной микроскопии моноцитов периферической крови, определение морфометрических параметров клеток и анализ полученных результатов. Отличительной чертой способа является активация моноцитов больного в течение 15 минут излучением гелий-неонового лазера. В качестве критерия эффективности лечения используется оптическая толщина ядер.
Этот способ прогнозирования методом фазово-интерференционной микроскопии эффективности лечения глюкокортикостероидами включает в себя исследование in vitro моноцитов периферической крови, обработанных преднизолоном, определение морфометрических параметров моноцитов, анализ полученных результатов, при этом перед обработкой преднизолоном моноциты активируют в течение 10-20 мин гелий-неоновым лазером при мощности (0,5-1,0)103 Вт/см2, регистрируют оптическую толщину ядер моноцитов, затем обрабатывают преднизолоном и повторно регистрируют оптическую толщину ядер моноцитов и при увеличении этого показателя на 30% и более прогнозируют эффективность лечения глюкокортикостероидами.
Основным недостатком этого способа, который ограничивает возможность его более широкого применения, является использование в качестве активирующего фактора излучения гелий-неонового лазера без указания дозировки. В качестве значимого параметра используется фазовая толщина, в которую дают вклад кроме ядра также другие органеллы.
Заявляемое изобретение направлено на достижение технического результата, заключающегося в повышении точности прогнозирования иммунного отклика пациента на действие фармакологического препарата, на снижение вероятности нежелательных побочных эффектов и на сокращение времени исследования и стоимости диагноза.
Указанный результат достигается тем, что способ оценки in vitro индивидуальной реакции организма пациента на действие фармакологического препарата, отличающийся тем, что из суспензии лимфоцитов донора до применения испытуемого фармакологического препарата в среде выделяют первую пробу, микроскопируют в интерференционном микроскопе для получения изображения мононуклеара в виде зон оптической плотности в проекций отдельных органелл и измеряют значимые параметры одиночных лимфоцитов в зонах оптической плотности для установления уровня нормы для этих параметров, затем у этого же донора из суспензии лимфоцитов выделяют вторую пробу с испытуемым фармакологическим препаратом в среде, повторно микроскопируют в интерференционном микроскопе и измеряют значимые параметры в указанных зонах, а оценку in vitro индивидуальной реакции организма пациента на действие фармакологического препарата осуществляют по количественным изменениям в совокупности значимых параметров зонах изображения мононуклеара в реальном времени по отношению к значимым параметрам, полученным до действия фармакологического препарата. Указанные признаки являются существенными и взаимосвязаны с образованием устойчивой совокупности существенных признаков, достаточной для получения требуемого технического результата.
Настоящее изобретение поясняется конкретным примером исполнения, который, однако, не является единственно возможным, но наглядно демонстрирует возможность достижения требуемого технического результата.
На фиг.1 схематически показано положение клетки в измерительной камере: В клетке оптически более плотная часть структуры находится в центре и менее плотная цитоплазма - на периферии. Форма клетки (Т-лимфоцита) предполагается близкой к сфере; схематически изображена оптически неоднородная клетка на полированной кремниевой подложке в измерительной камере на предметном столе микроскопа;
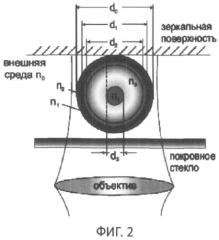
фиг.2 - топограмма - проекция лимфоцита и его органелл: цитоплазмы, разветвленной митохондрии (хондриома), ядра и ядрышка в виде двумерного распределения фазовой толщины. В окружающей лимфоцит среде обозначены окружностями различных диаметров внешняя (d0) и границы (di) других органелл;
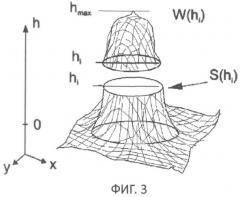
фиг.3 - схематически показаны площадь S(hi) и фазовый объем W(hi) в сечении 3-мерного изображения h(x,y) горизонтальной плоскостью hi=const. Максимальное значение фазовой толщины hmax. Наибольшие значения W(hi) и S(h) соответствуют hi=0;
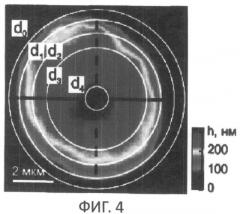
фиг.4 - условное деление на окружности - зоны;
фиг.5 - профили фазовой толщины h(x) и h(y) в ортогональных сечениях топограммы h(x,y). Диаметры di и фазовые толщины hi (i=0-4) соответствуют предполагаемому положению границ «зон»;
фиг.6 - s-гистограмма и график функции S(h), на которых обозначены значения фазовой толщины, площади и диаметров, которые отождествлялись с указанными границами «зон»: s-гистограмма отображает зависимость s(h) площади пикселей от фазовой толщины и является статистической характеристикой фазового изображения h(x,y). Показаны значения площади Si на границах «зон» (hi);
фиг.7 - различие в профилях рефрактерности ΔnA-D(r) вдоль радиусов, отличающихся поворотом на 90°, объясняется асимметрией структурных элементов клетки. Максимумы на участке (r2-r3≈2,8-2 мкм) в профилях рефрактерности ΔnA-D(r) связаны с пространственной неоднородностью хондриома. Сравнительно плоские части профиля с рефрактерностью Δn34≈0.03 в интервале радиусов r3-r4≈2-1.25 мкм соответствует ядру, а более высокие значения (Δn45≈0.05-0,06) в ближней к центру зоне (r≤1.25 мкм) - ядрышку;
фиг.8 - w-гистограмма отображает зависимость плотности фазового объема w(h) клетки от фазовой толщины. Малые (w≈0,01 мкм3/нм) плотности при h≤135 нм соответствуют малой рефрактерности цитоплазмы. Значения Wi обозначают фазовый объем на границах (hi) «зон»;
фиг.9 - из сравнения профилей фазовой толщины видно изменение формы, отсутствие характерных «плеч» и снижение толщины при ФГА-активации лимфоцита;
фиг.10 - из графика функции S(h) видно значительное увеличение площади клетки до S0=75 мкм2 и периферийной цитоплазмы (до 32 мкм2) при сохранение площади (S2) ее плотной части. Характерный для хондриома крутой участок отсутствует и граница между хондриомом и ядром не видна;
фиг.11 - при ФГА-активации Т-лимфоцит стал оптически более однородным, характерные максимумы, которые идентифицировались с вкладом хондриома, сместились в периферийную часть цитоплазмы;
фиг.12 - в графике функции W(h) видно 4-кратное увеличение фазового объема периферийной цитоплазмы (W0-W1=1,3 мкм3) и снижение фазового объема плотной части до W2=5,2 мкм3.
Показанные на фиг.5-12 изменения оптических параметров объясняются влиянием происходящих в клетке процессов и внешних факторов на физические параметры ее органелл. Поэтому изменения морфологии, регистрируемые методами оптической микроскопии, традиционно используются в биофизике клетки и для in vitro диагностики в медицине. Мы предлагаем новый метод определения функционального состояния отдельной клетки, основанный на уникальных свойствах фазовых изображений. В фазовом изображении клетки, полученном на интерференционном микроскопе, применение оригинальных алгоритмов позволяет получить набор значимых биофизических параметров. Эти параметры (фазовая толщина, площади и поперечные размеры органелл, фазовые объемы, показатель преломления и др.) являются физическими параметрами и количественно характеризуют морфологию клетки. Они определяются в абсолютных единицах и могут быть получены на различных типах интерференционных микроскопов.
В основе заявленного способа лежит общая последовательность действий, заключающаяся в следующем.
1. Из суспензии мононуклеаров (в т.ч. лимфоцитов) в нормальной среде выделяют первую пробу, микроскопируют в интерференционном микроскопе (в т.ч. в когерентном фазовом микроскопе) для получения изображения мононуклеара в виде топограммы - двумерного распределения фазовой толщины, отображающей проекцию отдельных органелл клетки, отличающихся по показателю преломления. Клетка представляет собой сложную структуру из функционально связанных между собой органелл. В проекции клетки при ее сканировании с высоким разрешением можно получить «зоны» - области, отличающиеся по фазовой толщине. В трехмерном изображении клетки ее участкам с более высокими значениями показателя преломления, например ядра, соответствуют большие фазовые толщины.
Набор параметров физических параметров (площадь, диаметр, рефрактерность, фазовый объем и др.) на границах «зон» мы используем в качестве характеристики функционального состояния. Мы обозначаем здесь термином «значимые» такие параметры, изменениям которых можно дать биофизическую или медицинскую интерпретацию. В фазовую толщину каждой «зоны» дают вклад органеллы клетки. На этом основано определение «нормы», в виде набора параметров в базе (банке) данных нормально функционирующей клетки здорового (не больного и не подверженного внешнему воздействию или воздействию лекарственных препаратов) человека. Формирование банка наборов параметров для клеток доноров разного пола, возраста и т.д. людей позволит количественно сравнивать его набор с наборами, характерными для «нормы» и для различных патологий, и затем по данным корреляционного анализа предлагать диагноз с численной вероятностной оценкой.
В перспективе такой подход может быть использован в проблеме т.н. персонализированной медицины, для индивидуальной оценки аллергенного и фармакологического действия препаратов, трансплантатов и других факторов на конкретного человека. Формирование личного (персонифицированного) банка наборов значимых параметров позволит анализировать динамику изменений, проследить тенденции изменения этих параметров и прогнозировать начало отклонений.
2. Фазовое изображение оптически неоднородной клетки представляет собой двумерное распределение оптической разности хода, которое характеризует локальное значение оптической плотности клетки или т.н. локальную фазовую толщину. Более плотным органеллам, например ядру, соответствуют большие значения фазовой толщины. Границы «зон» в фазовом изображении клетки соответствуют границам органелл и распознаются по заметному изменению фазовой толщины. В сечении горизонтальной плоскостью фазового изображения можно определить площадь органеллы и т.н. фазовый объем отсеченного фрагмента. Под фазовым объемом мы понимаем произведение физического объема на рефрактерность. По значениям фазовой толщины на границах «зон» с помощью гистограмм фазовой толщины и фазового объема и других алгоритмов можно определить значимые параметры в изображении клетки и использовать их набор для характеристики ее функционального состояния.
3. Наборы значимых параметров одиночных мононуклеаров используют для установления уровня нормы и для характеристики изменений функционального состояния мононуклеаров при действии различных факторов и формирования базы (банка) данных.
4. В зависимости от поставленной задачи способ может дополняться другими существенными действиями.
Например, для проведения доклинического тестирования какого-либо фармакологического препарата получают значимые параметры клетки здорового донора, соответствующие норме, а затем у этого же донора из суспензии мононуклеаров выделяют вторую пробу с испытуемым фармакологическим препаратом в среде, повторно микроскопируют в интерференционном микроскопе для получения второго набора значимых параметров и тестирование на эффективность испытуемого фармакологического препарата осуществляют по количественным изменениям значимых параметров во втором наборе после действия фармакологического препарата. При сравнении используют величины параметров в характерных точках гистограмм фазовой толщины, а значимые параметры определяют из функций площади, фазового объема и профиля рефрактерности.
Для прогнозирования иммунного ответа пациента на действие внешних факторов так же получают первый набор значимых параметров до внешнего воздействия, затем после действия внешнего фактора на пациента из суспензии его мононуклеаров выделяют вторую пробу, повторно микроскопируют в интерференционном микроскопе, получают второй набор значимых параметров. Прогнозирование иммунного ответа пациента на действие внешнего фактора осуществляют по количественным изменениям значимых параметров второго набора значимых параметров, полученных после действия внешнего фактора. При этом для характеристики мононуклеара в числе набора значимых параметров фазового изображения используют рефрактерность и фазовый объем мононуклеара и его органелл.
Возможно прогнозирование индивидуального иммунного ответа на действие аллергена путем сравнения набора значимых параметров пациента со статистически достоверными наборами значимых параметров в базе данных для характерных патологий, и диагноз производят по количественной оценке коэффициента корреляции.
Аналогичным образом по отношению к способу прогнозирования производят оценку in vitro индивидуальной реакции на действие фармакологического препарата на организм пациента и прогнозирование реакции отторжения трансплантата. Оценку in vitro индивидуальной реакции на действие фармакологического препарата осуществляют по количественным изменениям во втором наборе значимых параметров по сравнению со значимыми параметрами, полученными до действия фармакологического препарата.
Аналогичным образом по отношению к способу прогнозирования производят оценку вероятности отторжения трансплантата. Второй набор значимых параметров получают после введения в среду иммунно-компетентных клеток реципиента белков и экстрактов ткани донора.
Результаты предварительных исследований Т-лимфоцитов человека показали перспективность ее применения для экспресс-диагностики in vitro состояния отдельной клетки. Для биофизической интерпретации результатов измерений разработана оптическая модель клетки. Зависимость оптических параметров органелл от их функционального состояния объясняется "вариабельной компонентой рефрактерности", обнаруженной ранее на митохондриях и других клетках.
Количественную оценку морфофункционального состояния клеток производят по результатам анализа фазового изображения, полученного с помощью указанных выше или других типов интерференционного микроскопа. Для определения набора значимых параметров изображения клетки используют различные известные алгоритмы и программное обеспечение. При необходимости, вычисляют статистические данные, в т.ч. средние по ансамблю клеток величины значимых параметров.
Новые оптические методы, в частности интерференционная микроскопия, начали использоваться в последние годы в биофизике и медицине для исследования структуры клеток и происходящих в них процессов (G. Popescu, Quantitative phase imaging of nanoscale cell structure and dynamics, in: Methods in cell biology, Elsevier Inc. Ed. B. Jena, 2008, V.90, Ch.5, P.87-115; V.P. Tychinsky, N. Tikhonov, Interference Microscopy in Cell Biophysics. Principles and methodological aspects of Coherent Phase Microscopy, Cell Biochemistry and Biophysics, V.2010, 58(3). P.107-1016; V.P. Tychinsky, A.N. Tikhonov, Visualization of individual cells and energy-transducing organelles. Cell Biochemistry and Biophysics, 2010. 58(3). P.117-128; Y. Park, M. Diez-Silva, G. Popescu, G. Lykotrafitis, W. Choi, M. Feld. S. Suresh, Refractive index maps and membrane dynamics of human red blood cells parasitized by Plasmodium falciparum, PNAS. 2008. V.105(37), P.13730-13735; Z. Yaqoob, T. Yamauchi, W. Choi, Dan Fu, R. Dasari, M. Feld, Single-shot full-field reflection phase microscopy. Optics Express. 2011. V.19. P.7587-7595; В.П. Тычинский, «Динамическая фазовая микроскопия: возможен ли “диалог” с клеткой?», УФН, 2007, Т.177(5), стр.535-552). Выше отмечались уникальные свойства интерференционных методов, которые состоят в представлении фазового изображения объекта в виде двухмерного распределения оптической разности хода (ОРХ) h(x,y) в плоскости (x,y) и в высокой чувствительности к изменениям ОРХ. Принципиальное значение имеет измерение ОРХ в абсолютных значениях (в долях длины волны). Оцифрованные значения ОРХ обычно интерпретируются как локальные значения фазовой толщины клетки и используются для вычисления показателя преломления n(x,y) (Y. Park, M. Diez-Silva, G. Popescu, G. Lykotrafitis, W. Choi, M. Feld, S. Suresh, Refractive index maps and membrane dynamics of human red blood cells parasitized by Plasmodium falciparum, PNAS. 2008. V.105(37), P.13730-13735; Y. Hiramoto, Shumei Shimoda, Yoko Shoji, Refractive index of the protoplasm in sea urchin eggs. Develop. Growth and Differ., 1979), T.1(2), С.141-153) или среднего по объему всей клетки значения <n(x,y)>. Из этих и других (V. Manteifel, L. Bakeeva, T. Karu, Ultrastructural changes in chondriome of human lymphocytes after irradiation with He-Ne laser: appearance of giant mitochondria, J. of Photochemistry and Photobiology, 1997. V.38. P.25-30) работ следовал вывод о принципиальной возможности использования параметров фазового изображения для количественной оценки in vitro функционального состояния живых клеток. Однако отсутствие адекватной методологии, методов и алгоритмов ограничивало число значимых параметров и информативность фазового изображения отдельной живой клетки.
В настоящем изобретении заявляется возможность получения набора значимых параметров. Мы предполагаем, что использование набора значимых параметров позволит разработать новый, более информативный метод in vitro диагностики функционального состояния отдельной клетки.
В качестве экспериментальной модели для проверки метода использовались мононуклеары периферической крови здоровых доноров. Свежевыделенные клетки суспендировали в среде 199 и определяли ее параметры в "норме". Для характеристики "активированного" состояния клетки ее предварительно выдерживали в течение 1 ч при 37°C в среде с поликлональным митогеном-фитогемагглютинином (ФГА; 2 мкг/мл). Суспензию клеток наносили в виде капли на полированную кремниевую подложку и затем под покровным стеклом помещали на предметный стол когерентного фазового микроскопа "Эйрискан" (V.P. Tychinsky, N. Tikhonov, Interference Microscopy in Cell Biophysics. Principles and methodological aspects of Coherent Phase Microscopy, Cell Biochemistry and Biophysics, V.2010, 58(3). P.107-1016; В.П. Тычинский, «Динамическая фазовая микроскопия: возможен ли “диалог” с клеткой?», УФН, 2007, Т.177(5), стр.535-552). Спейсер толщиной 15 мкм между кремниевой подложкой и покровным стеклом препятствовал деформации клеток. Измерения проводили не более 30 мин с использованием предохранительной шторки для минимизации действия на клетки излучения гелий-неонового лазера (λ=633 нм, 1 мВт).
Положение клетки в измерительной камере схематически показано на фиг.1. Изображение на разработанном в МИРЭА микроскопе "Эйрискан" получали растровым методом (V.P. Tychinsky, N. Tikhonov, Interference Microscopy in Cell Biophysics. Principles and methodological aspects of Coherent Phase Microscopy, Cell Biochemistry and Biophysics, V.2010, 58(3). P.107-1016), в котором значения ОРХ определялись последовательно в каждом пикселе изображения компенсационным методом (В.П. Тычинский, «Динамическая фазовая микроскопия: возможен ли “диалог” с клеткой?», УФН, 2007, Т. 177(5), стр.535-552). В этом методе фаза опорной волны изменялась по линейно-периодическому закону движением зеркала в опорном плече интерферометра. Растровое сканирование изображения и регистрация интерференционного сигнала производились координатно-чувствительным фотоприемником-диссектором ЛИ-620. Этот метод позволил получить сверхдифракционное пространственное разрешение и регистрировать в клетках динамические процессы в реальном времени. Ограниченная шумами чувствительность к изменениям ОРХ была около 1 нм. Авторы считают, что параметры интерференционного микроскопа в данном случае не имели решающего влияния на результаты.
Авторы исходили из предположения, что в фазовом изображении клетки можно выделить "зоны" с различной фазовой толщиной, границы которых соответствуют границам органелл и различаются по показателю преломления. В отдельных случаях преобладающий вклад в фазовую толщину дает только одна органелла. Например, известно, что ядро и окружающая его разветвленная митохондрия (хондриом) являются наиболее плотной частью структуры клетки (см. фиг.2, 3 и 4), и наименее плотная - периферийная часть цитоплазмы (см. фиг.3 и фиг.4). Разработанные авторами алгоритмы обеспечивали получение в фазовых изображениях следующих функций и параметров: а - профиля фазовой толщины h(x)-зависимости фазовой толщины в поперечном сечении клетки; б - зависимости рефрактерности Δn(r) от радиуса в изображении клетки и численных значений рефрактерности органелл Δn(ri) на границах «зон»; в - гистограмм s(h)-зависимости плотности площади пикселей от фазовой толщины (h) в топограмме h(x,y); г - функции S(h)-зависимости площади в сечении изображения клетки от фазовой толщины; д - гистограммы w(h)-зависимости плотности фазового объема структурного элемента изображения от фазовой толщины; е - функции W(h)-зависимости фазового объема элементов клетки в интервале значений фазовой толщины (0-h). В гистограммах, в профилях фазовой толщины, графиках S(h) и s(h) были определены значения фазовой толщины (hi), которые являются границами "зон". Из оптической модели клетки следовало, что в отдельных «зонах» можно было выделить преобладающий вклад конкретных органелл (периферийной и плотной цитоплазмы, хондриома, ядра и ядрышка). Численные значения функций S(hi) и W(hi) позволили определить площадь частей изображения внутри контура с фиксированной фазовой толщиной (hi) и вычислить диаметры (di) окружностей, равных им по площади (см. фиг.4). Было показано, что при некоторых условиях диаметры di можно отождествить с границами органелл и дать адекватную биофизическую интерпретацию параметрам «зон».
На изображении (голограмме) Т-лимфоцита на фиг.2 границы "зон" показаны в виде окружностей соответствующих диаметров (di). Диаметр d0 мы отождествляем с внешней границей клетки, d1 - с границей периферийной и плотной частей цитоплазмы, d2 - с границей плотной части цитоплазмы с хондриомом (разветвленной гигантской митохондрией), d3 - с границей хондриома с ядром, d4 - с границей ядра и ядрышка. На площадь кольца ΔSij=Si-Sj, ограниченную диаметрами di и dj, проецируется часть клетки, которой соответствует фазовый объем ΔWij. На фиг.3 схематически показаны площадь S(h) в сечении 3-мерного изображения h(x,y) горизонтальной плоскостью hi=const и часть фазового объема W(hi). Под фазовым объемом части клетки мы понимаем произведение W(hi)=Δn0iV(hi) ее геометрического объема V(hi) и рефрактерности (Δn0i=n1-n0), где ni - показатель преломления органеллы.
Параметры соответствующих "зон", площадь которых ограничена диаметрами di и dj (j=i+1), мы обозначаем двумя индексами границ. Из фиг.2, 3 и 4 следует, что на площадь «зон» (за исключением 1-2) проецируется и дает вклад в фазовую толщину нескольких органелл. Одним из наиболее значимых параметров являются значения рефрактерности (Δn0i) на i-й границе. Для их вычисления было использовано представление фазовой толщины суммой вкладов (V.P. Tychinsky, N. Tikhonov, Interference Microscopy in Cell Biophysics. Principles and methodological aspects of Coherent Phase Microscopy, Cell Biochemistry and Biophysics, V.2010, 58(3). P.107-1016):
h ( x , y ) = ∑ h i ( x , y ) ( 1 ) ,
где hi(x,y)=Hi(x,y)Δn0i, Hi(x,y) - геометрическая толщина i-й границе и оптической модели клетки в виде системы концентрических сферических слоев.
В профилях фазовой толщины h(x) и h(y) на фиг.5, полученных в диаметральных сечениях топограммы Т-лимфоцита (фиг.2), обозначены диаметры (di) и значения толщины (hi), которые соответствуют границам "зон". Видно, что профили h(x) и h(y) несколько отличаются по форме. Внешнему диаметру клетки (d0) на профиле h(x) соответствует нижнее значение фазовой толщины (h0=0). В фазовую толщину (h0≤h≤h1) первой "зоны" (0-1) дает вклад только периферийная часть цитоплазмы, почти лишенная крупных органелл. С приближением к центру клетки фазовая толщина растет. Это связано с последовательно возрастающими вкладами: плотной части цитоплазмы с ретикулом в интервале высот и диаметров в области (1-2), хондриома (2-3), ядра (3-4) и ядрышка (h≤h≤hmax) (4-5). Морфология клетки, размеры и рефрактерность органелл влияют на долю точек в заданном интервале фазовой толщины (h,Δh) и, соответственно, на форму s-гистограммы. Проекции пологих участков h(x,y) соответствует большое число точек и максимум в s-гистограмме для этого интервала фазовых толщин.
Выше отмечалось, что функция S(h), полученная интегрированием s-гистограммы, отображает зависимость площади в сечении клетки от положения плоскости h=const. Часть левого максимума в s-гистограмме на фиг.6 соответствует сравнительно большой площади подложки и не имеет отношения к клетке. Правый его склон отражает вклад рефрактерности (Δn01) периферийной части цитоплазмы. Известно, что ее показатель преломления мало отличается от n0=1,333 для воды. Максимальный вклад периферийной цитоплазмы в фазовую толщину на границе с плотной цитоплазмой не превышает h1=25 нм. Широкий правый максимум s-гистограммы в интервале 115≤h≤165 нм соответствует вкладу в фазовую толщину более плотной части клетки (хондриома, ядра и ядрышка). Монотонный рост функции S(h) (фиг.6) от нуля в центре (при hmax≈220 нм) до максимального значения S0=40 мкм2 соответствует увеличению площади сечения у основания (h=0). Значения функции S(hi) в характерных точках (hi) были использованы для определения диаметров (di) эквивалентных по площади окружностей, которые условно отождествлялись с границей i-й «зоны». Увеличение S(h) при отрицательных значениях (h≤0) соответствует площади подложки и не связано с клеткой. В фазовую толщину 1-й "зоны", площадь которой ΔS01=S0-S1=8 мкм2 ограничена внешней (d0≈7,14 мкм, h0=0) и внутренней d1≈6.4 мкм, h1=35 нм) окружностями, проецируется и дает вклад только периферийная часть цитоплазмы клетки. На фиг.6 обозначены значения фазовой толщины, площади и диаметров, которые условно отождествлялись с указанными границами органелл: S2=24 мкм2, h2=115 нм (d2≈5.5 мкм); S3=10 мкм2, h3=165 нм (d3≈3.6 мкм); S4≈2 мкм2, h4=200 нм, (d4≈1,6 мкм). Площади колец ("зон") соответственно были равны, мкм2: ΔS01=8; ΔS12=8; ΔS23=14; ΔS34=6; ΔS45=S4≈2 мкм2. В некоторых случаях граница между хондриомом и ядром (h3) была трудноразличима. Из приведенных выше величин следует, что на цитоплазму (ΔS01+ΔS12)=16 мкм2 в топограмме Т-лимфоцита в норме приходится 40% площади всей клетки (S0).
w-гистограмма и функция W(h) (фиг.8) позволили получить дополнительные сведения о морфологии Т-лимфоцита. Понятие фазового объема, по-видимому, не часто используется в биофизике клетки, и мы здесь на конкретных примерах покажем возможность его использования для характеристики состояния Т-лимфоцита. Малые значения (w≈0,01 мкм3/нм) плотности фазового объема в интервале 0≤h≤135 нм отображают малую рефрактерность периферийной цитоплазмы и ретикулума. Увеличение плотности до w≈0,04 мкм3/нм и сохранение высокого уровня в интервале 115≤h≤165 нм объясняется более высокой рефрактерностью и большими геометрическими объемами хондриома и ядра. Снижение плотности в интервале 165≤h≤200 нм связано с малым геометрическим объемом ядрышка, несмотря на его высокую рефрактерность. Функция W(h) позволяет получить численные значения фазового объема W(hi) на границах "зон", мкм3: W0=10; W1=9,7; W2=7,6; W3=3,6; W4=0,8; Соответственно, разность этих значений позволяет оценить фазовые объемы структур, которые проецируются в эти «зоны», мкм3: ΔW01=0,3; ΔW12=2,1; ΔW23=4,0; ΔW34≈2,8; ΔW45=W4≈0,8. В данном случае на цитоплазму Т-лимфоцита в норме приходится (ΔW01+ΔW12)=2,4 мкм3 или ≈24% от всего фазового объема. Остальные 76% приходятся на оптически более плотные структуры клетки (ядро и хондриом). Ниже будет показано, что функциональное состояние клетки оказывает заметное влияние на фазовые объемы органелл.
Заметим, что отношение площади цитоплазмы к окрашенной площади ядра ("цитоплазматический индекс") традиционно используется для количественной характеристики ее морфологии. Функции S(h) и W(h) позволяют определить аналогичные "индексы" в фазовых изображениях клетки. По аналогии мы их представляем здесь в виде отношения площадей Is=(ΔS01+ΔS12)/S2 и фазовых объемов (Iw=(ΔW01+ΔW12)/W2. Для Т-лимфоцита в норме эти "индексы" имели значения: Is=0,66 и Iw=0,316.
Следующими значимыми параметрами «фазового портрета» являются рефрактерности органелл. Для их вычисления были использованы оптическая модель и алгоритм, подобный приведенному в (Y. Hiramoto, Shumei Shimoda, Yoko Shoji, Refractive index of the protoplasm in sea urchin eggs. Develop.Growth and Differ., 1979), Т.1(2), С.141-153). На фиг.7 показаны результаты вычисления профиля рефрактерности Δn(r)A-D в виде ее зависимости от радиуса r. Четыре профиля были получены в сечениях (A-D), отличающихся поворотом на 90°. Различие в форме и в положении максимумов свидетельствует о заметной асимметрии распределения оптической плотности в T-лимфоците, несмотря на его близкую к сфере форму. Там же обозначены радиусы ri=di/2, соответствующие границам органелл. Следует обратить внимание на максимумы рефрактерности (Δn23≈0.035-0,05) в интервале радиусов r2-r3≈2,8-2 мкм, которые мы отождествляем с границами 3-й «зоны» с преобладающим вкладом хондриома. Из приведенных в статье Т. Кару изображений на электронном микроскопе следует, что пространственная структура хондриома весьма неоднородна. С этим обстоятельством, по-видимому, связано различие в форме профилей в сечениях А-D. Эта асимметрия становилась менее заметна при деэнергизации Т-лимфоцита. Расположенные ближе к центру участки профиля мы отождествляем с вкладом ядра (Δn34≈0.03), которому по нашим оценкам соответствует внешняя граница r3≈2,0 мкм, и ядрышку (Δn45≈0.05-0,06) в пределах r4≤1,25 мкм. Эти значения рефрактерности на границах «зон» входят в набор значимых параметров.
Перечисленные выше параметры с разной степенью адекватности количественно отображают морфологию клетки. Важно отметить, что в предлагаемом здесь подходе число значимых параметров в наборе не ограничено указанными здесь алгоритмами и не связано с конкретной оптической моделью клетки. В зависимости от природы объекта, его морфологии и специфических особенностей функционального изображения набор может быть дополнен другими значимыми параметрами. Для сравнения результатов измерений в различных условиях и их интерпретации необходимо, чтобы параметры набора измерялись в стандартных, нормированных физических величинах.
В заявляемых способах регистрируют изменения в значимых параметрах наборов (фазовой толщины (hi), площадей (Si), фазовых объемов (Wi) и рефрактерности органелл (<Δn>)). Первый набор определяют для ансамбля из небольшого числа (10-15) мононуклеаров. Затем действуют на мононуклеары испытуемым препаратом и через определенное время регистрируют фазовые изображения второго ансамбля мононуклеаров. Определяют значимые параметры в наборах отдельных клеток, при необходимости их усредняют, затем их сравнивают и оценивают их изменения. По численным значениям разности усредненных по ансамблям значимых параметров наборов прогнозируют действие на организм пациента испытуемого препарата.
Для проведения исследований забор крови (4-5 мл) производят из локтевой вены и стабилизируют ее в пробирке гепарином в концентрации 25 ЕД на 1 мл крови. Мононуклеары выделяют стандартным методом на градиенте плотности для лимфоцитов Ficoll-Paque (p=1,077 г/см3) произв