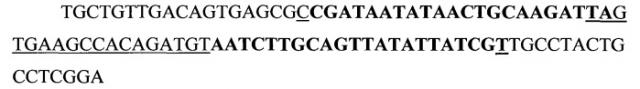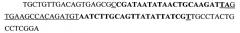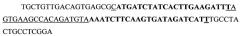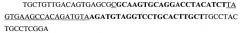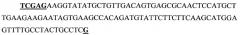Способ профилактики и лечения бронхиальной астмы, осложняющих ее респираторных вирусных инфекций и других воспалительных заболеваний дыхательных путей
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к терапии и инфекционным болезням, и может быть использовано для профилактики и лечения бронхиальной астмы, осложняющих ее респираторных вирусных инфекций и других воспалительных заболеваний дыхательных путей. Для этого одновременно подавляют ген p респираторно-синцитиального вируса (далее - РСВ) и провоспалительный ген il-4 мыши, при этом для подавления гена p РСВ, необходимого для его репликации в клетке, используют создаваемую молекулу малой интерферирующей РНК (миРНК) - SEQ ID NO 1 (siP1), а для подавления провоспалительного гена il-4 мыши используют создаваемую молекулу миРНК - SEQ ID NO 15 (siIL4-408). На их основе создают препараты, содержащие терапевтически эффективное их количество, после чего вводят интраназально. Способ позволяет ослабить признаки аллергического воспаления и тяжесть течения РСВ-инфекции за счет подавления провоспалительного гена il-4 мыши и подавления репликации вируса РСВ. 1 з.п. ф-лы, 17 ил., 2 табл.
Реферат
Изобретение относится к области медицины.
За последние годы была разработана эффективная противовирусная терапия для многих вирусных инфекций, однако количество заболевших остается высоким. Наиболее частыми, до 90% всех случаев инфекционных заболеваний, являются острые респираторные вирусные инфекции (ОРВИ). Ведущую роль в структуре заболеваемости ОРВИ занимает респираторно-синцитиальный вирус (далее - РСВ). РСВ (англ. RSV, Human respiratory syncytial virus) - вирус, вызывающий инфекции дыхательных путей.
Несмотря на десятилетия исследований РСВ, эффективных и широкодоступных терапевтических средств против данной инфекции в настоящее время не существует. В 60 гг. были разработаны первые вакцины для профилактики РСВ-инфекции, в том числе живая, на основе температуро-чувствительных штаммов РСВ, а также инактивированная формалином вакцина. Эти препараты не обеспечивали достаточного протективного эффекта. Более того, у привитых детей, в поствакцинальном периоде развивались более тяжелые формы естественной РСВ-инфекции, чем в контрольной группе. Печальный опыт формалин-инактивированной РСВ-вакцины показал, что на фоне естественной РСВ-инфекции у вакцинированных развивались более тяжелые поражения нижнего дыхательного тракта, чем в контрольной группе. Предполагают, что причиной этого явилась иммунологическая сенсибилизация, связанная с клеточно-опосредованными иммунными механизмами, что наблюдается при многих аллергических состояниях, в частности при бронхиальной астме (далее - БА). Предполагается при этом, что у привитых при последующей естественной инфекции происходит высвобождение воспалительных факторов и других молекул, увеличивающих локальный воспалительный процесс. Вакцины, созданные спустя 30 лет, не показали эффективности. Разработка терапевтических средств, направленных против РСВ, также не принесла ожидаемых результатов. В настоящее время для лечения РСВ-инфекции применяется рибавирин - простейший нуклеозидный аналог, вызывающий многочисленные побочные эффекты. Накапливается опыт применения средств против РСВ на основе нейтрализующих поликлональных и моноклональных антител - RSV-IGIV (Respigam), palivizumab (Synagis), MEDI-524 (Numab), однако очевидно, что их применение будет ограничено из-за очень высокой стоимости.
Респираторные вирусные инфекции зачастую связаны с развитием обострений у больных бронхиальной астмой (БА), в частности вирусы поражают эпителий дыхательных путей, клетки которого выделяют большое количество провоспалительных цитокинов и медиаторов, усиливающих воспалительный процесс. К таковым относятся цитокины, продуцируемые Th2 клетками: ИЛ-4, ИЛ-5, ИЛ-13 и ИЛ-10. Они связаны с аллергическими заболеваниями и дисфункцией респираторного тракта.
Вышеупомянутые цитокины относятся к типичным Th2-цитокинам, их эффекты сильно перекрываются, однако между ними есть и определенное «разделение труда». Считается, что именно ИЛ-4 играет ключевую роль в подготовке аллергических процессов. Он имеет широкий спектр биологической активности, в частности усиливает пролиферацию B-лимфоцитов после распознавания антигена, а также регулирует синтез определенных классов антител (у человека - IgE и IgG4), участвующих преимущественно в развитии аллергии. В частности известно, что ИЛ-4 связан с переключением синтеза тяжелых цепей молекул иммуноглобулинов от IgM в направлении IgE либо IgG4. Благодаря множеству биологических функций IL-4 может считаться одним из главных регуляторов развития аллергических реакций и аллергического воспаления в тканях, так как помимо индукции синтеза указанных классов антител этот цитокин является ростовым фактором для базофилов, тучных клеток и эозинофилов и усиливает экспрессию в этих клетках рецепторов. Был выявлен гаплотип гена ИЛ-4, ассоциированный с тяжелой респираторно-вирусной инфекцией. В других исследованиях также показана связь вариантов ИЛ-4 с более тяжелым течением РС-вирусной инфекции. В связи с этим ген ИЛ-4 представляет собой перспективную мишень для разработки новых терапевтических средств.
Осуществлялись попытки подавить активность ИЛ-4 с помощью моноклональных антител, хотя доклинические исследования с использованием лабораторных мышей были успешными, однако последующее фазы испытаний с участием пациентов, страдающих БА, не подтвердили этих обнадеживающих результатов. Все вышеперечисленное указывает на то, что к настоящему времени появилась необходимость разработать принципиально новый подход к разработке широкодоступных лечебно-профилактических средств против аллергической БА и осложняющих ее респираторных вирусных инфекций.
Недавнее открытие интерференции рибонуклеиновой кислоты (далее - РНК) (далее - РНКи) - одного из основных механизмов посттранскрипционной регуляции генов - дало возможность использовать данный феномен для разработки новых средств, способных эффективно и безопасно подавлять как репродукцию вирусных инфекций, так и провоспалительных генов. РНКи позволяет специфически «выключать» экспрессию, теоретически любых генов-мишеней при помощи молекул малых интерферирующих РНК (миРНК или siRNA). Главными преимуществами использования препаратов на основе РНКи являются их высокая специфичность и эффективность подавления экспрессии гена-мишени (до 90%). Кроме того, привлекательной является сравнительная дешевизна методики. Синтез олигонуклеотидов в настоящее время вполне доступен и прост. Этот факт дает препаратам, созданным на базе миРНК, важное конкурентное преимущество, например, по сравнению с моноклональными антителами.
Хотя препараты миРНК уже активно внедряются в медицинскую практику, все еще не описано эффективного совместного воздействия антивирусных и противовоспалительных препаратов миРНК на модели бронхиальной астмы, осложненной инфекцией вирусом РСВ.
Аналогов предлагаемого изобретения не выявлено.
Задачей данного изобретения является разработка способа лечения и профилактики бронхиальной астмы, осложненной инфекцией вирусом РСВ.
Для решения данной задачи были разработаны противовирусные и противовоспалительные препараты, работающие на основе механизма интерференции РНК (РНКи), а также разработан способ их совместного воздействия на мышиной модели БА, осложненной инфекцией вирусом РСВ.
Способ профилактики и лечения бронхиальной астмы, осложняющих ее респираторных вирусных инфекций и других воспалительных заболеваний дыхательных путей, заключающийся в одновременном подавлении гена р респираторно-синцитиального вируса (далее - РСВ) и провоспалительного гена il-4 мыши, при этом для подавления гена p РСВ, необходимого для его репликации в клетке, используют создаваемую молекулу малой интерферирующей РНК (миРНК) - siP1, а для подавления провоспалительного гена il-4 мыши используют создаваемую молекулу миРНК - siIL4-408, на их основе создают препараты, содержащие терапевтически эффективное их количество, после чего полученные препараты вводятся млекопитающим.
Преимущественно, в способе профилактики и лечения бронхиальной астмы, осложняющих ее респираторных вирусных инфекций и других воспалительных заболеваний полученные препараты миРНК вводят интраназально.
Предлагаемое изобретение поясняется следующими графическими материалами: приложение с перечнем последовательностей в виде SEQ ID NO, в таблице 1 представлены последовательности молекул миРНК, направленные против мРНК гена il-4 мыши и контрольные миРНК, в таблице 2 представлены способы введения и дозы препаратов, содержащих миРНК (siP1 и siIL4-408), при использовании препаратов siGFP и siRV в качестве неспецифического контроля, на рисунке 1 представлено изменение интенсивности флуоресценции GFP+-клеток 293T после ко-трансфекции молекул миРНК и рекомбинантной плазмиды pUCHR IL4 IRES GFP, на рисунке 2 - изменение экспрессии il-4 в клетках 293T после ко-трансфекции молекул миРНК и рекомбинантной плазмиды pUCHR IL4 IRES GFP, на рисунке 3 - изменение концентрации ИЛ-4 мыши в супернатантах клеток 293T после ко-трансфекции молекул миРНК и рекомбинантной плазмиды pUCHR IL4 IRES GFP, на рисунке 4 представлено изменение уровней сывороточных anti-OVA-IgE у животных при интраназальном введении препаратов миРНК, на рисунке 5 представлено изменение уровней сывороточных anti-OVA-IgG2a у животных при интраназальном введении препаратов миРНК, на рисунке 6 представлено изменение удельной сопротивляемости дыхательных путей у животных при интраназальном введении препаратов миРНК, на рисунке 7 представлено изменение количества копий мРНК-il-4 в ткани легких, на рисунке 8 представлено количество вирусной РНК в гомогенатах легких мышей, сенсибилизированных овальбумином и обработанных специфическими и неспецифическими миРНК, на рисунке 9 представлены изменения относительного количества эозинофилов в бронхо-альвеолярном лаваже мышей, обработанных препаратами миРНК.
Разработка способа лечения и профилактики РСВ-инфекции и связанных с ней заболеваний дыхательных путей, работающего на основе механизма РНК-интерференции, проводилась с использованием мышиных моделей.
Для проектирования молекул миРНК, обладающих противовирусной активностью, были проанализированы доступные в базе данных GeneBank нуклеотидные последовательности генома вируса РСВ. Было установлено, что перспективным является ген p вируса РСВ, который необходим для его репликации в клетке. Белок P, кодируемый геном p необходим для фермента РНК-зависимой РНК-полимеразы (RdRP), и отвечает за его отхождение промотора и формирование комплекса, ответственного за элонгацию. При инфицировании клетки вирусом новообразованная RdRP осуществляет первые этапы транксрипции, обозначаемые как первичная транксрипция. В «состоянии транскрипции» вирусная RdRP запускается и выключается в начале и в конце каждого вирусного гена, что приводит к синтезу отдельных мРНК. Трансляция этих мРНК приводит к синтезу вирусных белков de novo. Из вышеуказанного следует, что сайленсинг гена p должен приводить к подавлению репликации вируса РСВ. В базе данных GenBank обнаружено несколько геномных последовательностей РСВ: AF013254, AF035006, AY353550, AY911262, U39662, U50362, U50363, U63644, NC_001781. Они были выравнены с использованием программы Vector NTI Suite V6 с целью определить консервативные участки в геноме РСВ, в частности в интервале, кодирующем ген p.
Данный анализ позволил спроектировать и в дальнейшем синтезировать 6 молекул миРНК, направленных против различных участков мРНК данного гена (SEQ ID NOS 1-6):
(SEQ ID NO 1),
(SEQ ID NO 2),
(SEQ ID NO 3),
(SEQ ID NO 4),
(SEQ ID NO 5),
(SEQ ID NO 6).
Возможность успешного использования молекул миРНК в качестве высокоспецифичного средства «выключения» экспрессии вирусных генов была доказана экспериментально. В ходе экспериментов in vitro репликация РСВ была специфично подавлена молекулами миРНК.
Методом световой микроскопии установлено, что в клетках, обработанных неспецифическими миРНК и необработанных миРНК, через 48 часов после заражения на монослое клеток МА-104 наблюдалось выраженное цитопатическое действие (ЦПД), которое выражалось в формировании характерных крупных синцитиев в монослое. Через 72-96 часов после инфицирования в этих лунках оставалось около 50% прикрепленных клеток, из них примерно половина в составе обширных синцитиев, остальные клетки находились в составе всплывших синцитиев. Напротив, через 48, 72 и 96 часов после заражения в лунках, обработанных специфическими миРНК, визуально синцитии не определялись. В клетках, обработанных специфическими миРНК, признаков ЦПД не наблюдали до 7-10 суток.
Наибольшую активность проявила siP1. Так, методом титрования по Риду-Менчу показано, что через 48 часов после инфицирования в лунках, обработанных siP1 (SEQ ID NO 1), обнаружено снижение титра РСВ по сравнению с контролем в 54 раза. Через 72 часа величина разницы между титром вируса в лунках, обработанных siP1, и в контрольных лунках составила 280 раз. Через 96 часов титр вируса в лунках, обработанных siP1, был в среднем в 125 раз меньше титра в контрольных лунках.
Аналогичные результаты были получены методом количественной ПЦР. Через 48 часов после инфицирования в лунках, обработанных siP1, обнаружено снижение количества специфической вирусной РНК по сравнению с контролем в 7 раз. Через 72 часа эта разница между количеством специфической вирусной РНК в лунках, обработанных siP1, и в контрольных лунках составила 19 раз. Через 96 часов количество специфической вирусной РНК в лунках, обработанных siP1, было в 38 раз меньше, чем в контрольных лунках.
Помимо молекул миРНК к некоторым из выбранных участков внутри гена p вируса РСВ были спроектированы и сконструированы три молекулы кшРНК. Ниже приведены готовые последовательности сконструированных кшРНК в составе ДНК-кассеты shRNAmir3 (SEQ ID NOS 7-9).
shP1 (SEQ ID NOS 7):
shP2 (SEQ ID NOS 8):
shP4 (SEQ ID NOS 9):
Чтобы оценить способность этих молекул кшРНК (shP1, shP2, shP4) проявлять антивирусную активность против РСВ, проведены наблюдения за изменением вирусной нагрузки на клетки МА-104 в течение 96 часов после их заражения низкой (MOI=0,0004) и высокой дозами (MOI=0,01) вируса. Интенсивность нагрузки определялась, во-первых, путем титрования вирусного материала на монослое клеток МА-104 по методу Рида-Менча. Данный способ позволяет оценивать количество сформировавшихся вирионов, способных инфицировать клетки МА-104 и образовывать специфические синцитии, видимые в световой микроскоп. Во-вторых, методом количественной ПЦР.
После заражения клеток МА-104, постоянно экспрессирующих молекулы shP1, shP2, shP4, и контрольную shCD43 низкой и высокой дозами РСВ происходило увеличение вирусной нагрузки на все штаммы клеток в течение наблюдаемого периода. При этом абсолютные значения титра вируса были в 3,4-7,3 раза выше при инфицировании клеток высокой дозой РСВ, о чем свидетельствуют данные титрования по методу Рида-Менча. Однако вирусная нагрузка на клетки, экспрессирующие shP1, shP2 и shP4, была значительно ниже в сравнении с клетками, экспрессирующими контрольную shCD43. Противовирусный эффект shP1, shP2 и shP4 был заметен уже спустя 48 часов после заражения клеток вирусом и проявлялся на протяжении всего наблюдаемого срока как при высокой, так и при низкой инфекционных дозах. Это свидетельствует о том, что изучаемые молекулы кшРНК обеспечивают специфический сайленсинг вирусного гена p по механизму интерференции РНК и, как следствие, приводят к подавлению репликации РСВ. В то время как экспрессия shCD43, не имеющей гомологии с геном p, не оказывает противовирусного эффекта.
Проведенные эксперименты подтвердили, что ген p является удобной мишенью для разработки противовирусных как миРНК, так и кшРНК.
Для проектирования молекул миРНК, обладающих противовоспалительной активностью, были проанализированы доступные в базе данных GeneBank нуклеотидные последовательности гена il-4 мыши. Известно, что повышенная активность этого гена приводит к синтезу интерлейкина-4 (далее - ИЛ-4), одного из основных провоспалительных факторов, что в итоге приводит к более тяжелому течению РСВ-инфекции. Кроме того, сама РСВ-инфекция способна провоцировать формирование сильной воспалительной реакции в дыхательных путях и, таким образом, провоцировать развитие приступов бронхиальной астмы. Таким образом, у больных с бронхиальной астмой тяжесть течения РСВ-инфекции определяется не только болезнетворной активностью самого вируса, но и повышенной воспалительной реакцией самого макро-организма на РСВ, что многократно утяжеляет течение инфекционного процесса.
В ходе анализа было построено выравнивание на основе известных в базе данные GeneBank последовательностей гена il-4 мыши. Номера последовательностей: M13238.1, M25892.1, AB174765.1, AF352783.1, NM_021283.2, X03532.1, BC027514.1. На основе полученного выравнивания было выбрано 6 участков в гене il-4 мыши в качестве мишеней для молекул миРНК и, соответственно, было спроектировано и сконструировано 6 молекул миРНК против гена il-4 мыши (SEQ ID NOS 10-15). Последовательности миРНК, направленных против мРНК-il-4, представлены в таблице 1, в которой «*» обозначена последовательность миРНК, направленная против мРНК гена gfp (SEQ ID NO 16), используемая в качестве положительного контроля, а «**» - последовательность миРНК, направленная против мРНК гена p респираторно-синцитиального вируса (РСВ) (SEQ ID NO 17), используемая в качестве отрицательного контроля. В качестве положительного контроля использовали siGFP, которая по нашим данным подавляла экспрессию ИЛ-4 до 10 раз. В качестве положительного контроля использовали siP4, направленную против гена p респираторно-синцитиального вируса, последовательность данной миРНК не имеет 100% сходства ни с последовательностью il-4 мыши, ни с последовательностью gfp. Более того, для тестирования спроектированных молекул миРНК в экспериментах in vitro была создана экзогенная модель экспрессии этого гена в хорошо трансфецируемых клетках 293T.
Эффективность спроектированных молекул миРНК была оценена с использованием данной модели различными методами. Для этого 1×105 клеток 293T трансфецировали смесью, состоящей из 0,5 мкг плазмиды pUCHR IL4 IRES GFP, экспрессирующей ИЛ-4, и 1 мкг соответствующей миРНК. Сутки после ко-трансфекции методом проточной цитометрии было оценено количество GFP+-клеток, а также средняя интенсивность их флуоресценции. Как оказалось, вариант миРНК (siIL4-408) приводил к заметному снижению интенсивности флуоресценции CFP+-клеток в 5 раз, в сравнении с отрицательным контролем (рисунок 1). На рисунке 1 представлена средняя интенсивность флуоресценции клеток 293T в % относительно контроля (siP4). Интенсивность флуоресценции клеток при ко-трансфекции siP4 и pUCHR IL4 IRES GFP принято за 100%. Представлены средние результаты двух независимых экспериментов.
Результаты, полученные в ходе количественного ПЦР анализа и ИФА, показали сходную картину. В клетках, взятых через сутки после ко-трансфекции, наблюдается снижение количества копий мРНК-il-4. Наиболее эффективное снижение обеспечивала также siIL4-408 до 3 раз (рисунок 2). На рисунке представлено количество копий мРИК-il-4 относительно контроля (siP4). Количество мРНК-il-4 при ко-трансфекции siP4 и pUCHR IL4 IRES GFP принято за 100%. Представлены средние результаты двух независимых экспериментов.
В клеточных супернатантах в этот же период времени происходит снижение концентрации секретированного клетками ИЛ-4 до 10 раз (рисунок 3).
Помимо молекул миРНК к выбранным участкам в мРНК гена il-4 мыши были спроектированы 2 молекулы кшРНК, направленные против мРНК-il-4 (SEQ ID NOS 18-19). Их последовательности представлены ниже (shIL4-267 и shIL4-408). Молекула кшРНК (shIL4-OB2), доступная на сайте производителя «OpenBiosystems» (SEQ ID NO 20) и также направленная на подавление мРНК гена il-4 мыши, использовалась в качестве положительного контроля.
shIL4-267 (SEQ ID NO 18)
shIL4-408 (SEQ ID NO 19)
shIL4-OB2 (SEQ ID NO 20)
Эффективность подавления экспрессии мышиного il-4 с использованием полученных кшРНК была оценена в экспериментах in vitro. Для этого клетки эмбриональной почки человека 293T в количестве 100 тыс. клеток были трансфецированы смесью, состоящей из 0,5 мкг рекомбинантной плазмидой плазмиды pUCHR IRES IL4 GFP, способной экспрессировать ИЛ-4 мыши, и 1 мкг плазмиды, несущей спроектированную кшРНК. Трансфекция клеток осуществлялась с использованием коммерческого реагента Lipofectamine2000 (Invitrogen) в соответствии с рекомендациями производителя. В качестве контроля специфичности использовали shP4, направленную против мРНК гена p вируса РСВ и не имеющую сходства с последовательностью il-4 мыши. В качестве отрицательного контроля использовали клетки, не обработанные какими-либо плазмидами. Сутки после ко-трансфекции смесью плазмид была определена концентрация ИЛ-4 в клеточных супернатантах. Как оказалось, наибольшей эффективностью обладала shIL4-OB2, снижая экспрессию гена il-4 в 5 раз (до 20%) в сравнении с shP4. Вариант shIL4-267 также достоверно снижал уровень экспрессии гена-мишени, но снижение было менее значительным до 50%.
Таким образом, были спроектированы варианты молекул миРНК и кшРНК, способные эффективно подавлять экспрессию провоспалительного гена il-4 мыши.
Был разработан режим введения препаратов миРНК и кшРНК модельным животным (мыши самки линии BALB/c с признаками бронхиальной астмы, осложненной вирусом РСВ).
Для оценки противовирусной и противовоспалительной эффективности совместного воздействия siP1 и siIL4-408 экспериментальные животные были разделены на 5 групп, у первых 4-х групп проводилось моделирование экспериментальной бронхиальной астмы (БА). Группам №2, 3 и 4 интраназально (и/н) вводили вирус РСВ, при этом группе 3 вводили миРНК против гена И-4 и миРНК против гена p вируса РСВ. В то же время группа 4 получала контрольные неспецифичные миРНК против гена gfp и против риновируса siRV. Группа №5 никаким манипуляциям не подвергалась (интактные животные) (таблица 2).
После каждого этапа (сенсибилизации и ИНА) был осуществлен забор крови и оценены уровни сывороточных антител класса IgE и субклассов IgG2a и IgG1.
Как и ожидалось, после этапа сенсибилизации уровни анти-OVA IgE антител были незначительно выше у животных, получавших аллерген внутрибрюшинно, т.е. у животных, подвергавшихся моделированию БА, чем у интактных мышей. Однако после этапа ИНА уровни специфических IgE антител возрастали в 2 раза, причем рост происходит как у модельных животных, так и у животных, получавших интраназально препараты миРНК. Несмотря на то что группа №3 получала миРНК против гена il-4, вовлеченного в IgE антителообразование, какого-либо понижения уровня данного класса антител не наблюдалось (рисунок 4). На рисунке представлены средние концентрации сывороточных анти-AVA IgE антител и ошибки средних.
При этом на рисунке приняты следующие условные обозначения:
× - достоверно отличается от группы «БА»,
# - достоверно отличается от группы «БА+RSV»,
• - достоверно отличается от группы «siGFP+siRV»,
где отличия считаются достоверными при p≤0,05, N=8.
Вероятно, это связано с тем, что животным миРНК вводилась локально (интраназально в ткань легких), а не системно (в кровоток), поэтому препарат не оказал влияния на уровни IgE в сыворотке крови.
Изменения уровней сывороточных анти-OVA IgG2a антител имели иной характер. В отличие от IgE, после ИНА не происходило какого-либо существенного роста специфических IgG2a антител во всех экспериментальных группах. Этот факт хорошо согласуется с современными представлениями об аллергических процессах, которые связаны с продукцией специфичных IgE антител Th2-клетками при снижении или, по крайней мере, неизменной продукции IgG2a антител Th1-клетками. Также как и в случае IgE не наблюдается изменений уровней IgG2a у животных, получавших миРНК против il-4, что еще раз подтверждает невозможность регулирования антителообразования посредством локального введения препаратов миРНК (рисунок 5). На рисунке представлены средние концентрации сывороточных анти-AVA IgG2a антител и ошибки средних. При этом приняты условные обозначения:
× - достоверно отличается от группы «БА»,
# - достоверно отличается от группы «БА+RSV»,
• - достоверно отличается от группы «siGFP+siRV»,
где отличия считаются достоверными при p≤0,05, N=8.
О превалировании Th2-ответа над Th1 у всех животных, подвергшихся моделированию аллергической БА, свидетельствуют также изменения индекса IgE/IgG2a, который увеличивается у всех животных после ИНА. Данный индекс IgE/IgG2a показывает соотношение уровней аллерген-специфичных антител IgE и IgG2a в сыворотке крови. Известно, что при аллергических состояниях уровень IgE возрастает и, соответственно, этот индекс принимает значения больше единицы. Что касается изменений уровней anti-OVA-IgG1 антител, то наблюдается картина, сходная с таковой для anti-OVA-IgG2a антител.
Через сутки после заключительной интраназальной апликации OVA у животных была оценена удельная сопротивляемость дыхательных путей (sRaw). Как оказалось у модельных животных (группа «БА») и у модельных животных, инфицированных РСВ (группа «БА+RSV»), сопротивляемость дыхательных путей была значительно выше, чем у интактных при использовании всех концентраций метахолина (MX) (6,25, 12,5, 25 и 50 мг/мл). Животные, получавшие неспецифические миРНК (siGFP и siRV), имели сопротивляемость дыхательных путей, сходную с таковой у модельных животных, однако при интраназальном введении siIL4-408 и siP1 в суммарной дозе 100 мкг/мышь удельная сопротивляемость существенно снижалась и принимала значения ниже, чем в интактной группе (рисунок 6).
Животным группы №3 вводился препарат siIL4-408, который, согласно нашим предположениям, должен подавлять экспрессию ИЛ-4 в органе-мишени, т.е. в легких. Для проверки нашей гипотезы у экспериментальных животных в ткани легких был оценен уровень экспрессии гена il-4 методом количественной ПЦР. Согласно проведенным расчетам уровень экспрессии il-4 в ткани легких снижался в 3 раза в сравнении с модельными животными (группа «БА») и в 2 раза в сравнении с животными, получавшими неспецифические миРНК (группа «БА+RSV+siMock») (рисунок 7). На рисунке 7 представлено изменение количества копий мРНК-il-4 в ткани легких на грамм ткани легкого. При этом приняты условные обозначения, где:
× - достоверно отличается от группы «БА»,
# - достоверно отличается от группы «БА+RSV»,
* - достоверно отличается от группы «БА+RSV+siMock».
Отличия достоверны при p≤0,05; N=8.
Оценка изменения вирусной нагрузки в легких осуществлялась также методом количественной ПЦР. В группе мышей, обработанных молекулами миРНК, направленными против РСВ, наблюдалось снижение вирусной нагрузки в 6,3 раза по сравнению с группой «БА+RSV» и в 3 раза по сравнению с группой «БА+RSV+siMock». Вероятно, снижение количества вирусной РНК в группе, обработанной неспецифическими миРНК, может быть связано с неспецифическим иммунным ответом, вызванным обработкой мышей большими количествами миРНК (100 мкг/мышь) (рисунок 8). При этом указано количество вирусной РНК в гомогенах легких мышей, сенсибилизированных овальбумином и обработанных специфическими и неспецифическими миРНК, где
# - достоверно отличается от группы «БА+RSV»,
* - достоверно отличается от группы «siMock».
Отличия достоверны при p≤0,05 (N=8).
Более того, исследование бронхо-альвеолярного лаважа мышей, одновременно обработанных молекулами миРНК против гена il-4 и против гена p вируса РСВ, показало существенное уменьшение количества эозинофилов (до 5 раз), являющихся маркерами аллергического воспаления (рисунок 9). При этом изменения относительного количества эозинофилов в бронхо-альвеолярном лаваже мышей, обработанных препаратами миРНК, условно обозначены:
# - достоверно отличается от группы «БА+RSV»
* - достоверно отличается от группы «БА+RSV+siMock»
Отличия достоверны при p≤0,05, N=8.
Таким образом, результатом данного изобретения устанавливается успешное совместное использование двух препаратов миРНК, один из которых (siIL4-408) подавляет провоспалительный ген il-4, а второй препарат миРНК (siP1) подавляет репликацию вируса РСВ. Согласно полученным данным оба препарата способны одновременно оказывать свой эффект и приводить к ослаблению признаков аллергического воспаления и тяжести течения РСВ-инфекции у млекопитающих.
| Таблица 1 | |||
| № | SEQ ID NO | Название миРНК | Последовательности смысловых цепей миРНК (5′-3′) |
| 1 | SEQ ID NO 10 | siIL4-127 | |
| 2 | SEQ ID NO 11 | siIL4-174 | |
| 3 | SEQ ID NO 12 | siIL4-267 | |
| 4 | SEQ ID NO 13 | siIL4-280 | |
| 5 | SEQ ID NO 14 | siIL4-373 | |
| 6 | SEQ ID NO 15 | siIL4-408 | |
| 7 | SEQ ID NO 16 | siGFP* | |
| 8 | SEQ ID NO 17 | siP4** |
| Таблица 2 | |||
| Название группы | Препарат/доза | Режим введения | |
| 1 | БА | - | - |
| 2 | БА+RSV | - | - |
| 3 | БА+RSV+siRNA | siIL4-408; 100 мкг/мышь | siIL4-408 - три и/н введения: за 2 сут до 1-й ИНА, за 5 ч до 1-й ИНА, за 5 ч до 2-й ИНА. |
| siP1-1; 70 мкг/мышь | |||
| siRSV-1 - одно и/н введение за 3 ч до введения РСВ. | |||
| 4 | БА+RSV+siMock | siIGFP; 100 мкг/мышь | siIGFP - три и/н введения: за 2 сут до 1-й ИНА, за 5 ч до 1-й ИНА, за 5 ч до 2-й ИНА. |
| siRV; 70 мкг/мышь | |||
| siRV - одно и/н введение за 3 ч до введения РСВ. | |||
| 5 | Интактные | - | - |
1. Способ профилактики и лечения бронхиальной астмы, осложняющих ее респираторных вирусных инфекций и других воспалительных заболеваний дыхательных путей, заключающийся в одновременном подавлении гена p респираторно-синцитиального вируса (далее - РСВ) и провоспалительного гена il-4 мыши, при этом для подавления гена p РСВ, необходимого для его репликации в клетке, используют создаваемую молекулу малой интерферирующей РНК (миРНК) - SEQ ID NO 1 (siP1), а для подавления провоспалительного гена il-4 мыши используют создаваемую молекулу миРНК - SEQ ID NO 15 (siIL4-408), на их основе создают препараты, содержащие терапевтически эффективное их количество, после чего полученные препараты вводятся млекопитающим.
2. Способ профилактики и лечения бронхиальной астмы, осложняющих ее респираторных вирусных инфекций и других воспалительных заболеваний по п.1, отличающийся тем, что полученные препараты миРНК вводят интраназально.