Биоматериал и средство с биоматериалом, стимулирующие противоопухолевую активность
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к онкологии, и может быть использовано для биологической терапии опухолей. Описан биоматериал, стимулирующий противоопухолевую активность, который содержит лиофилизат постнатальных индуцированных лимфатических узлов (ПНИЛУ) больного раком. Описано средство, стимулирующее противоопухолевую активность, которое содержит в качестве действующего вещества лиофилизат ПНИЛУ больного раком, а в качестве растворителя воду для инъекций, кремофор RH-40, эмульгатор Т-2, масло персиковое, глицерин, коллидон CL-M и бензиловый спирт при определенном соотношении компонентов. Использование изобретения обеспечивает получение нового средства отечественного производства, содержащего биоматериал, стимулирующий противоопухолевую активность, обладающего выраженным пролонгированным действием, удобного в применении. 2 н. и 1 з.п. ф-лы, 5 ил., 3 пр.
Реферат
Предлагаемая группа изобретений относится к области медицины, а именно к онкологии, и может быть использована для биологической терапии опухолей.
Современные достижения клеточной и молекулярной биологии создали реальные предпосылки для активного влияния на противоопухолевый иммунитет. Предполагается, что иммунная система может эффективно противодействовать раковым клеткам, вплоть до полной их элиминации. Лимфатические узлы являются одним из важнейших компонентов противоопухолевой защиты.
Известен способ вакцинной иммунотерапии по принципу реверсивной иммуносупрессии [патент US 7731945, 2010 г.], который заключается в индукционном продуцировании наивных Т-клеток, воздействии на наивные Т-клетки эндогенных или экзогенных антигенов и восстановлении Т-клеточного иммунитета путем введения смеси натуральных цитокинов в качестве адъюванта для эндогенных или экзогенных антигенов рака. Предпочтительно вводить смесь натуральных цитокинов в сочетании с тимозином 61.
Известна вакцинотерапия пациентов с иммуносупрессией [патент US 6977072, 2005 г.]. Способ иммунизации предусматривает активацию региональных лимфатических узлов, который включает ряд этапов: (1) перилимфатическое введение смеси натуральных цитокинов. У некоторых пациентов имеется локальное скопление дендритных клеток, которые поглотили антиген или вступили во взаимодействие с ним, но не могут созреть. Перилимфатическое введение цитокинов способствует дифференцированию и созреванию дендритных клеток;
(2) введение пациенту циклофозамида и нестероидных противовоспалительных препаратов. Эти препараты уменьшают Т-клеточную супрессию.
Известен искусственный лимфатический узел [патент US 8101195, 2012 г.]. Способ получения искусственного лимфатического узла включает следующие стадии: (а) иммунизация животного, с использованием антигена рака и, по крайней мере, одного адъюванта из группы, состоящей из полного адъюванта Фрейнда, CpG-адъюванта, липосомы, БЦЖ, polyI:C, R848 и липополисахарида, (б) трансплантация материала искусственного лимфатического узла, состоящего из полимерного биоматериала, включающего цитокинопродуцирующие стромальные клетки и дендритные клетки для иммунизированного животного. Тем самым, получается искусственный лимфатический узел, который вызывает раковый антиген-специфический иммунный ответ и обогащает IFN производство CDS-положительных киллеров Т-клеток или НК-клеток с раковой цитотоксической активностью.
Известен способ лечения диссеминированного рака [патент US 8211425, 2012 г.]. Иммунотерапевтический способ лечения пациента, страдающего от диссеминированного рака, включает:
а) выявление у пациента одного или большего количества сторожевых лимфатических узлов и, как вариант, идентификацию всех или части метастазов распространенного рака; б) резекцию одного или более узлов и, как вариант, всех или часть метастазов; в) выделение метастазо-реактивных Т-лимфоцитов из упомянутых лимфатических узлов; г) in vitro размножение упомянутых метастазо-реактивных Т-лимфоцитов; д) введение полученных таким образом Т-лимфоцитов пациенту, у которого Т-лимфоциты являются CD4+хелперами или CD8+Т-лимфоцитами.
Недостатком такого способа является использование клеток пораженного злокачественной опухолью органа, что не исключает вероятность прогрессии и рецидива онкологического заболевания.
Наиболее близким аналогом предлагаемого биоматериала, стимулирующего противоопухолевую активность, является иммуномодулятор, содержащий полипептиды интактных лимфатических узлов животных, представляющий собой порошок желтовато-белого цвета. Способ получения иммуномодулятора включает гомогенизацию интактных лимфатических узлов животных в растворе хлористого натрия в соотношении 1:3, аутолиз, центрифугирование, нагревание надосадочной жидкости до 80°C, охлаждение, удаление осадка и высушивание супернатанта посредством замораживания и помещения в атмосферную сублимационную установку с последующим досушиванием с помощью ИК-сушки [патент RU 2257904, 2005 г.].
Недостатками данного иммуномодулятора являются:
В состав иммуномодулятора, изготовленного из интактных лимфатических узлов животных, не входят вещества, содержащиеся в постнатальных индуцированных лимфатических узлах (ПНИЛУ) или вновь образованных лимфатических узлах больных раком [Ганцев Ш.Х. Новые технологии диагностики и лечения рака молочной железы / Креативная хирургия и онкология, 2009. - №1. - С. 6-9]), которые обладают более высокой биологической активностью [Gantsev S.K., Umezawa К., Islamgulov D.V., Husnutdinova Е.К., Ishmuratova R.S., Frolova V.Y., Kzyrgalin S.R. The role of inflammatory chemokines in lymphoid neoorganogenesis in breast cancer / Biomedicine & Pharmacotherapy, 2013. -Vol. 67. - №5. - Р. 363-366]. При этом способе получения биоматериала используется раствор хлористого натрия в соотношении 1:3, аутолиз при 4-6°C в течение 14 ч, нагревание надосадочной жидкости до 80°C. За счет консистенции и физико-химических свойств композиции - 0,15 М NaCl полученный раствор слабо удерживается в тканях, вследствие чего он не оказывает пролонгированного действия. Кроме того, данный способ получения биоматериала длителен и трудоемок.
Задачей изобретения является создание нового биоматериала, стимулирующего противоопухолевую активность.
Технический результат - получение материала для биотерапии опухолей, обеспечивающего уменьшение вероятности прогрессии и рецидива онкологического заболевания, а также регресса опухоли при некоторых локализациях.
Указанный технический результат достигается тем, что биоматериал, стимулирующий противоопухолевую активность, содержащий лиофилизат лимфатических узлов млекопитающего, согласно изобретению содержит лиофилизат постнатальных индуцированных лимфатических узлов больного раком.
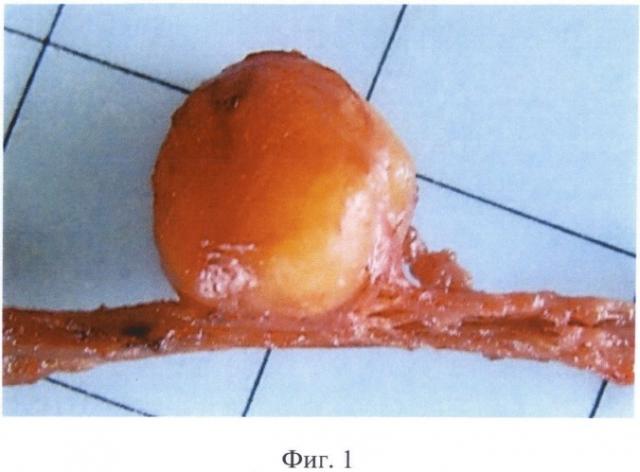
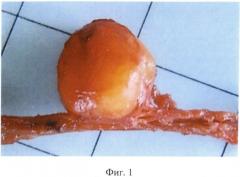
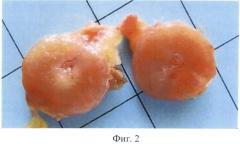
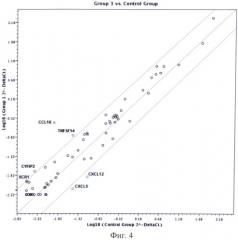
Изобретение иллюстрируется следующими фигурами: на фигуре 1 показан ПНИЛУ при раке молочной железы; на фигуре 2 - то же, поперечный разрез; на фигуре 3 - ПНИЛУ со сформированной стромой, окраска гематоксилином-эозином, ×60; на фигуре 4 - профиль экспрессии воспалительных хемокинов в ПНИЛУ относительно интактных лимфоузлов; на фигуре 5 - иерархический анализ профиля экспрессии воспалительных хемокинов в ПНИЛУ относительно интактных.
Мотивацией заявки служат новые данные, которые были получены нами в результате многолетних, мультидисциплинарных исследований процесса образования ПНИЛУ при раке.
Нами был открыт и детально изучен процесс формирования ПНИЛУ. Эти ткани напоминают исходные интактные лимфоидные органы (фигуры 1, 2, 3), развитие которых заканчивается после рождения, с сегрегацией в зоне Т и В клеток, дендритных клеток, фолликулярных дендрических клеток, лимфатических сосудов и больших эндотелиальных венул. При формировании ПНИЛУ активация стромальных клеток приводит к высвобождению молекул, которые контролируют процессы восстановления, распространения и выживания лейкоцитов. Одна из главных ролей в этом процессе принадлежит интерлейкину-7 (IL-7R).
Создание ниши для поступающих лейкоцитов происходит опосредованно через сотрудничество с внеклеточными компонентами матрицы молекул адгезии, цитокинами и хемокинами. Фактор некроза опухоли (ФНО) и лимфотоксин α (ЛТ-а) экспрессируются кроветворными клетками и играют важную роль в активации цитокинов и хемокинов в мезенхимальных, стромальных и эндотелиальных клетках, способствуя созданию лимфоидной ниши [Francesca A., Ricardo P. Lymphoid neogenesis in chronic inflammatory diseases / Nature Rev. Immunol., 2006. - Vol. 6. - Р. 205-217].
У трансгенных мышей, у которых наблюдается гиперэкспрессия лимфоидных хемокинов или ЛТ-а, происходит развитие органоспецифических лимфоидных органов (ЛО). Известно, что повышенная экспрессия ФНО-α у животных также приводит к образованию ЛО и развитию хронических воспалительных реакций [Alitalo К., Tammela Т., Petrova Т. Lymphangiogenesis in development and human disease / Nature, 2005. - Vol. 15. - P. 946-953; Bende R., van Maldegem F., van Noesel C. Chronic inflammatory disease, lymphoid tissue neogenesis and extranodal marginal zone B-cell lymphomas / Haematologica, 2009. - Vol. 94. - №8. - P. 1109-1123].
Исследования хемокинов и их рецепторов у мышей привело к пониманию молекулярных и межклеточных взаимодействий, которые лежат в основе лимфоидного органогенеза. При развитии лимфоидных органов и поддержании микроархитектуры лимфоидных тканей цитокины воспаления, семейства ФНО и ЛТ-а тесно взаимодействуют с гомеостатическими хемокинами CXCL13, CCL21, CCL19 и CXCL12. [Luther S., Bidgol A., Hargreaves D., Schmidt A., Xu Y., Paniyadi J., Paniyadi J., Matloubian M., Cyster J. Differing activities of homeostatic chemokines CCL19, CCL21, and CXCL12 in lymphocyte and dendritic cell recruitment and lymphoid neogenesis / J. Immunol., 2002. - Vol. 169. - P. 424-433].
Важен факт участия хемокинов в специфичном метастазировании раковых клеток (РК). Установлено, что клетки рака молочной железы (РМЖ) человека экспрессируют рецептор хемокинов CXCR4, тогда как его комплементарный лиганд CXCL12 продуцируется клетками тканей (костный мозг, легкое и лимфатические узлы), в которые чаще всего метастазируют РК [Muller A., Homey В., Soto Н., Ge N., Catron D., Buchanan М.Е., McClanahan Т., Murphy E., Yuan W., Wagner S.N., Barrera J.L., Mohar A., Verastegui E., Zlotnik A. Involvement of chemokine receptors in breast cancer metastasis / Nature, 2001. - Vol. 410. - Р. 50-56].
При этом в системе in vitro клетки РМЖ способны мигрировать по направлению к градиенту CXCL12, а антитела, нейтрализующие CXCR4, ингибируют образование метастазов в лимфатических узлах у экспериментальных животных. Клетки лимфатического эндотелия продуцируют и другие специфические хемокины (CCL21), привлекающие к ним РК из первичной опухоли, что коррелирует с наличием метастазов в «сторожевом» лимфатическом узле (СЛУ) [Takeuchi Н., Fujimoto А., Tanaka М., Yamano Т., Hsueh Е, Hoon D. CCL21 chemokine regulates chemokine receptor CCR7 bearing malignant melanoma cells / Clin. Cancer Res., 2004. - Vol. 10. - Р. 2351-2358].
Материалом для нашего исследования послужили образцы РНК, выделенные из ткани лимфоузлов 15 больных с клинически и цитологически установленным диагнозом РМЖ T2N1-3M0 стадии. Возраст больных РМЖ находился в пределах от 36 до 68 лет (медиана - 48 лет). Тотальную РНК выделяли из 200-300 мг ткани гистологически установленных нормальных лимфоузлов и из ПНИЛУ, реагентом Trizol (Invitrogen, США) по стандартному протоколу. Качество выделенной РНК определяли на спектрофотометре NanoDrop 1000 (Thermo FS) по соотношению оптических плотностей A260/A280 (использовались образцы только с коэффициентом 1,9-2,1). Выделенную РНК обрабатывали ДНКазой. Профиль экспрессии хемокинов и их рецепторов определяли методом флуоресцентной ПЦР в реальном времени с использованием набора Human Chemokines&Receptors PCR Array (Qiagen) в двух повторностях. Проведен анализ экспрессии следующих генов: хемокиновые (С-С мотив) лиганды: CCL1, CCL11, CCL13, CCL15, CCL16, CCL17, CCL18, CCL19, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8; хемокиновые (C-X-C мотив) лиганды: CXCL1, CXCL10, CXCL11, CXCL12, CXCL13, CXCL2, CXCL3, CXCL5, CXCL6, CXCL9; хемокиновые (С-С мотив) рецепторы: CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR10, CCRLl, CCRL2; хемокиновые (С-Х-С мотив) рецепторы: CXCR5, CXCR3, CXCR4, CXCR6, CYFIP2; другие хемокины и родственные гены: APLNR, BDNF, С5, C5AR1 GPR77), CCBP2, CKLF, CMTM1, CMTM2, CMTM3, CMTM4, CMKLR1, CSF3, CX3CL1, CX3CR1, TYMP, GDF5, GPR31, HCAR1, HIF1A, IL13, IL16, IL18, IL1A, IL4, IL8, CXCR1, LTB4R, MMP2, MMP7, MYD88, NFKB1, AIMP1, SDF2, SLIT2, ТСР10, TLR2, TLR4, TNF, TNFRSF1A, TNFSF14, TREM1, VHL, XCL1, XCR1.
Анализ результатов экспрессии генов, построение точечных диаграмм и кластерограмм проводились с использованием облачного приложения, основанного на анализе ΔΔCt, на сайте производителя тестового набора [http://www.sabiosciences.com].
Проведенный нами анализ экспрессии генов цитокинов и их рецепторов при образовании ПНИЛУ выявил повышение экспрессии генов CCL16, XCR1, CYFIP2, TNFSF14 и снижение экспрессии генов CXCL5 и CXCL12 (фиг.4).
В нашем исследовании экспрессия гена TNFRSF14 была повышена в 4,82 раза в ПНИЛУ. Белок, кодируемый геном TNFRSF14, является членом семейства лигандов рецепторов ФНО. Белок данного гена активирует два клеточных рецептора - рецептор клеточного проникновения вируса герпеса (HVEM, TNFRSF14) и рецептор лимфотоксина-β (РЛТ-б) [Marsters S.A., Ayres T.M., Skubatch M, Gray C.L., Rothe M, Ashkenazi A. Herpesvirus entry mediator, a member of the tumor necrosis factor receptor (TNFR) family, interacts with members of the TNFR-associated factor family and activates the transcription factors NF-kappaB and AP-1 / J.Biol. Chem., 1997. - Vol.272. -№22. - Р. 14029-14032]. Взаимодействие TNFRSF14-PЛT-б индуцирует каскад реакций, опосредованных транскрипционными факторами NF-кВ (Re1A и Re1B), индуцирующих экспрессию генов, участвующих в гомеостазе, таких как гены хемокинов организации ткани (CCL21, CXCL16 и др.) и межклеточных молекул адгезии (ICAM-1). TNFRSF14 совместно со своими лигандами-парологами, ФНО, ЛТ-а и ЛТ-б, иммуноглобулинами, аттенюатором В и Т лимфоцитов и CD160 формирует сложную мультисигнальную систему регуляции воспаления и гомеостаза иммунной системы [Soroosh P., Doherty Т., So Т. Herpesvirus entry mediator (TNFRSF14) regulates the persistence of T helper memory cell populations / J. Exp. Med., 2011. - Vol.208. - №4. - Р. 797-809].
При аутоиммунных заболеваниях, характеризующихся хроническим воспалением, в генезисе которого принимают участие цитокины семейства ФНО (TNFRSF14), происходят характерные события, которые заключаются в проникновении антигенспецифических Т-клеток в орган-мишень, привлечении других Т-клеток, В-клеток и макрофагов, а также активации клеток, находящихся в этом месте. Длительная продукция цитокинов ФНО приводит к формированию организованных лимфоидных структур [там же].
В ходе проведенного анализа выявлено 30-кратное повышение экспрессии гена хемокина CCL16 в ПНИЛУ. Хемокиновый (С-С мотив) лиганд 16 (CCL16) является представителем небольшого семейства СС хемокинов, который известен под разными именами, в том числе хемокин, экспрессирующийся в печени (LEC) и Monotactin-1 (MTN-1). Хемокин CCL16 экспрессируется в тимусе, печени, селезенке и стимулирует миграцию моноцитов и лимфоцитов. Клеточная экспрессия CCL16 в моноцитах в значительной степени индуцируется IL-10, ИФ-γ и бактериальными липополисахаридами. Ген CCL16 располагается на хромосоме 17, в кластере генов CC хемокинов. CCL16 запускает каскад реакций, взаимодействуя с хемокиновыми рецепторами на поверхности клетки, такими как CCR1, CCR2, CCR5 и CCR8 [Nomiyama Н., Hieshima К., Nakayama Т., Sakaguchi Т. Human СС chemokine liver-expressed chemokine/CCL16 is a functional ligand for CCR1, CCR2 and CCR5, and constitutively expressed by hepatocytes / Int. Immunol., 2001. - Vol. 8. - P. 1021-1029]. В нашем исследовании также выявлено увеличение более чем в 4 раза экспрессии хемокина XCL1, отвечающего за миграцию Т-лимфоцитов. Хемокин XCL1 относится к небольшому семейству С хемокинов, сохранивших только 2 из 4 консервативных цистеинов, свойственных всем хемокинам, для хемотаксиса с Т-клетками. Ген располагается вместе с родственным хемокином XCL2 на длинном плече хромосомы 1. Экспрессируется CD8+Т клетками и активированными NK клетками [Dorner B.G., Dorner М.В., Zhou X., Opitz C., Kroczek R.A. Selective expression of the chemokine receptor XCR1 on cross-presenting dendritic cells determines cooperation with CD8+T cells / Immunity, 2009. - Vol. 31. - №5. - Р. 823-833].
Обнаружено увеличение экспрессии гена CYFIP2 в ПНИЛУ в 4,7 раза. Ген CYFIP2 кодирует цитоплазматический белок, взаимодействующий с продуктом гена ломкой хромосомы X (FMR1), экспрессируется, в основном, в тканях головного мозга, лейкоцитах и в почках. В настоящее время предполагается роль CYFIP2 в регуляции апоптоза. Считается, что индуцибельный онкосупрессором р53 белок CYFIP2 выполняет проапоптотическую функцию в РК [Jackson R.S. 2nd, Cho Y.J., Stein S., Liang P. CYFIP2, a direct p53 target, is leptomycin-B sensitive / Cell Cycle, 2007. - Vol.6. -№l. - Р.95-103].
Исследования ряда авторов показали, что хемокиновые рецепторы CCR7 и CXCR4 экспрессируются на высоком уровне в клетках РМЖ. Тогда как их соответствующие лиганды, вторичные лимфоидные хемокины (SLC/CCL21) и CXCL12 продуцируются лимфатическим эндотелием в лимфатических узлах, костном мозге, легких, печени, которые представляют собой преимущественные места метастазирования при РМЖ [Muller A., Homey В., Soto Н., Ge N., Catron D., Buchanan M.E., McClanahan Т., Murphy E., Yuan W., Wagner S.N., Barrera J.L., Mohar A., Verastegui E., Zlotnik A. Involvement of chemokine receptors in breast cancer metastasis / Nature, 2001. - Vol. 410. - P. 50-56; GunnM., Tangemann K., Tam C, Cyster J., Rosen S., Williams L. A chemokine expressed in lymphoid high endothelial venules promotes the adhesion and chemotaxis of naive T lymphocytes / Proc. Natl. Acad. Sci. USA, 1998. - Vol.95. - P. 258-263]. Ингибирование взаимодействия CXCL12/CXCR4 существенно редуцирует метастазирование РК при РМЖ в лимфатические узлы и легкие [там же]. Такого типа молекулярные сигналы должны представлять собой наиболее общий механизм наведения опухолевых клеток на специфические места предназначения и могут представлять собой потенциальную терапевтическую мишень для ингибирования прогрессирования опухолей до летальных заболеваний от метастазов [Zlotnik A. Chemokines in neoplastic progression / Semin. Cancer Biol., 2004. - Vol.14. - №3. - Р. 181-185]. Полученные нами данные показали снижение экспрессии вторичных лимфоидных хемокинов CXCL12 в 5,8 раз и CXCL5 в 5,27 раза в ПНИЛУ (фиг.5).
Возможно, снижение экспрессии лигандов к хемокиновым рецепторам CXCR2 и CXCR4, высоко представленных на мембране РК, уменьшает вероятность миграции клеток в ПНИЛУ, препятствуя метастазированию опухоли.
Выполненное исследование позволило выдвинуть гипотезу о том, что полученную из ПНИЛУ биологическую субстанцию можно будет использовать для лечения рака, третичной профилактики онкологических заболеваний.
В региональной лимфатической системе в области опухоли по току лимфы отмечается рост ПНИЛУ [патент RU №2422914, 2011 г.]. Способ получения предлагаемого биоматериала заключается в гомогенизации ПНИЛУ, его последующей экстракции и отделении супернатанта путем центрифугирования с последующей лиофилизацией. При получении данного биоматериала не используются клетки, полученные из пораженного злокачественной опухолью органа. Биоматериал представляет собой лиофильно высушенный экстракт ПНИЛУ серого цвета с желтым оттенком.
Пример 1. После иссечения у больного раком ПНИЛУ, из него готовят гомогенат и разбавляют 0,85-0,9% раствором натрия хлорида в соотношении 1:10. Экстракцию производят 24 часа при температуре 3±0,5°C и значении pH 7,0, центрифугируют 10 минут при 3000 об/мин при температуре 1°C. Полученный супернатант сливают в емкость и лиофилизируют. Полученный биоматериал представляет собой лиофильно высушенный экстракт ПНИЛУ серого цвета с желтым оттенком.
Наиболее близким аналогом средства с биоматериалом, стимулирующим противоопухолевую активность, является средство для лечения онкологических заболеваний в виде раствора для инъекций при следующем соотношении компонентов (мас.%): 5-фторурацил - 0,087, метронидазол - 0,5, вода для инъекций - 1,841, низкомолекулярный полиэтилен - 66,527, эмульгатор Т-2 - 16,778, лутрол F 127 (Lutrol F 127) -1,677, кремофор RH 40 (Cremofor RH 40) - 2,520, масло оливковое - 10,070 [патент RU 2445097, 2012 г.].
Задачей изобретения является расширение арсенала средств для лечения онкологических заболеваний.
Технический результат - получение нового средства отечественного производства, содержащего предлагаемый биоматериал, стимулирующий противоопухолевую активность, эффективного при инъекционном пути введения с равномерным распределением в тканях за счет композиции инъекционного растворителя, с выраженным пролонгированным действием, удобного в применении.
Указанный технический результат достигается тем, что средство, стимулирующее противоопухолевую активность, в виде раствора для инъекций, содержащего действующее вещество и растворитель, включающий воду для инъекций, кремофор RH-40, эмульгатор Т-2 и масло растительное, согласно изобретению действующее вещество и растворитель взяты в соотношении 1:2, при этом в качестве действующего вещества содержит лиофилизат постнатальных индуцированных лимфатических узлов больного раком, растворитель дополнительно содержит глицерин, коллидон CL-M и бензиловый спирт, а в качестве масла растительного содержит масло персиковое при следующем соотношении компонентов, мас.%:
| Масло персиковое | 10,64 |
| Глицерин | 10,64 |
| Кремофор RH-40 | 5,32 |
| Эмульгатор Т-2 | 5,32 |
| Коллидон CL-M | 5,32 |
| Бензиловый спирт | 1 |
| Вода для инъекций | 61,76 |
Масло персиковое (ГОСТ 21314-75) - растительное масло, извлекаемое из персиковых косточек. Персиковое масло применяется для приготовления инъекционных растворов витаминов (эргокальциферола, ретинола ацетата), гормонов (прогестерона, синестрола, тестостерона пропионата и др.), камфоры, кризанола, а также взвесей (бийохинола).
Глицерин (ФС 42-2202-84) - нелетучий сорастворитель.
Кремофор RH-40 (Cremofor® RH-40) BASF (Германия) №013635/01-2002 - оксиэтилированное гидрогенизированное касторовое масло, улучшает структуру растворителя, повышает биодоступность введенных в состав действующих веществ за счет поверхностно-активных свойств.
Эмульгатор Т-2 (ТУ 18-17-05-76) придает массе достаточную упругость, использован в качестве стабилизатора, пластификатора и эмульгатора, улучшает структуру растворителя, повышает биодоступность введенных в состав действующих веществ за счет поверхностно-активных свойств.
Коллидон CL-M Kollidon® CL-M BASF (Германия) - белый гигроскопичный порошок. Загуститель. Нетоксичен, представляет собой тонкодисперсный порошок с низкой объемной плотностью, причем 90% частиц имеют размер менее 15 микрон. Это вещество служит стабилизатором суспензий в жидких лекарственных формах для перорального применения. При введении в организм коллидон способствует рассасыванию действующего вещества из места инъекции, что, в свою очередь, повышает биодоступность композиции, а также снижает риск местных побочных явлений. Увеличение содержания коллидона выше 5,5 мас.% приводит к сильному увеличению вязкости и соответственно ухудшению прохождения композиции через иглу шприца. Концентрации коллидона менее 0,1% в композиции недостаточно для стабильного комплексообразования.
Бензиловый спирт ГОСТ 8751-72 - консервант, применяется для обеззараживания масляных растворов препаратов для внутримышечного введения в фармакологии.
Пример 2. Состав 100,0 эмульсии растворителя биоматериала: вода для инъекций - 61,76; масло персиковое - 10,64; глицерин - 10,64; кремофор RH-40 (Cremofor RH-40) - 5,32; эмульгатор Т-2 - 5,32; коллидон CL-M - 5,32; бензиловый спирт - 1,0.
Получают эмульсию инъекционного растворителя следующим образом.
На водяной бане расплавляют кремофор RH-40 (Cremofor RH-40), эмульгатор Т-2, коллидон CL-M при температуре 70°C в выпарительной чашке. К сплаву добавляют масло персиковое, глицерин и 5% воды для инъекций. Водную фазу эмульгируют. К полученному составу добавляют остальное количество воды для инъекций. Состав эмульгируют в течение 20 минут. К полученной смеси добавляют бензиловый спирт. Полученную композицию тщательно перемешивают, фильтруют, расфасовывают в стерильные флаконы под обкатку и стерилизуют при 100°C 30 минут.
Готовое средство инъекционного растворителя биоматериала в виде эмульсии представляет собой однородную вязкую массу белого цвета с желтоватым оттенком, плотность - 1,14 г/см3, pH - 6,2. Полученный раствор - эмульсия для инъекций имеет жидкую однородную вязкую консистенцию.
Пример 3.
После иссечения ПНИЛУ из него готовят гомогенат и разбавляют 0,85-0,9% раствором натрия хлорида в соотношении 1:10. Экстракцию производят 24 часа при температуре 3±0,5°C и значении pH 7,0, центрифугируют 10 минут при 3000 об/мин при температуре 1°C. Полученный супернатант сливают в емкость, лиофилизируют и растворяют в эмульсии инъекционного растворителя в соотношении 2:1 (эмульсия: лиофилизат). За счет консистенции и физико-химических свойств композиции полученный раствор надежно удерживается в тканях при инъекционном введении, за счет компонентов растворителя оказывает пролонгированное действие действующего вещества. Получаемый раствор инъекционный биоматериала удобен и гигиеничен в применении.
В доступной научно-медицинской и патентной литературе не было обнаружено сведений об известности предлагаемого биоматериала, стимулирующего противоопухолевую активность, содержащего лиофилизат ПНИЛУ больного раком, а также средства, содержащего лиофилизат ПНИЛУ больного раком в качестве действующего вещества, а в качестве растворителя воду для инъекций, кремофор RH-40, эмульгатор Т-2, масло персиковое, глицерин, коллидон CL-M и бензиловый спирт. Таким образом, заявляемая группа изобретений соответствует критерию «новизна».
Исследованиями авторов установлено, что предлагаемый биоматериал, стимулирующий противоопухолевую активность, содержащий лиофилизат ПНИЛУ больного раком, при, например, инъекционном введении в виде раствора, содержащего биоматериал в качестве действующего вещества, а в качестве растворителя воду для инъекций, кремофор RH-40, эмульгатор Т-2, масло персиковое, глицерин, коллидон CL-M и бензиловый спирт при определенном соотношении компонентов, обеспечивает торможение роста опухоли и увеличение продолжительности жизни. Таким образом, заявляемая группа изобретений соответствует критерию «изобретательский уровень».
Получение предлагаемых биоматериала и средства с биоматериалом, стимулирующих противоопухолевую активность, легко воспроизводимо и при использовании достигается указанный технический результат. Таким образом, заявляемая группа изобретений соответствует критерию «промышленная применимость».
1. Биоматериал, стимулирующий противоопухолевую активность, содержащий лиофилизат лимфатических узлов млекопитающего, отличающийся тем, что содержит лиофилизат постнатальных индуцированных лимфатических узлов больного раком.
2. Биоматериал по п.1, отличающийся тем, что для его получения проводят гомогенизацию постнатальных индуцированных лимфатических узлов больного раком в физиологическом растворе в соотношении 1:10, экстракцию, отделение супернатанта путем центрифугирования, лиофилизацию супернатанта, при этом экстракцию производят 24 ч при температуре 3±0,5°C и значении pH 7,0, центрифугируют 10 мин при 3000 об/мин и температуре 1°C.
3. Средство, стимулирующее противоопухолевую активность, в виде раствора для инъекций, содержащего действующее вещество и растворитель, включающий воду для инъекций, кремофор RH-40, эмульгатор Т-2 и масло растительное, отличающееся тем, что действующее вещество и растворитель взяты в соотношении 1:2, при этом в качестве действующего вещества содержит лиофилизат постнатальных индуцированных лимфатических узлов больного раком, растворитель дополнительно содержит глицерин, коллидон CL-M и бензиловый спирт, а в качестве масла растительного содержит масло персиковое при следующем соотношении компонентов, мас.%:
| Масло персиковое | 10,64 |
| Глицерин | 10,64 |
| Кремофор RH-40 | 5,32 |
| Эмульгатор Т-2 | 5,32 |
| Коллидон CL-M | 5,32 |
| Бензиловый спирт | 1 |
| Вода для инъекций | 61,76 |