Способ определения генотипов золотистого стафилококка
Иллюстрации
Показать всеИзобретение касается способа определения генотипов золотистого стафилококка. Представленный способ включает получение чистой культуры микроорганизмов на плотной питательной среде с последующим выделением и амплификацией ДНК возбудителя с помощью мультиплексной полимеразной цепной реакции (ПЦР) и с детекцией результатов методом электрофореза в агарозном геле. При осуществлении мультиплексной ПЦР используют четыре пары праймеров, комплементарных к участкам гена внеклеточной термонуклеазы (nuc), гена лейкоцидина Пантона-Валлентайна (pvl), гена белка токсического шока (tst) и гена устойчивости к метициллину (mecA). Генотипы золотистого стафилококка определяют по наличию или отсутствию генов вирулентности pvl и tst и гена устойчивости к метициллину mecA или их сочетаний. Изобретение позволяет определять отдельные генотипы золотистого стафилококка одновременно в одной мультиплексной реакции, а также исключить предварительный этап идентификации микроорганизма. 1 ил., 2 табл., 2 пр.
Реферат
Изобретение относится к области медицинской микробиологии и молекулярной эпидемиологии, а именно к идентификации основных генетических вариантов золотистого стафилококка, различающихся по степени клинической и эпидемиологической значимости.
Золотистый стафилококк (Staphylococcus aureus) по данным многоцентровых исследований [1, 2] является ведущим возбудителем внутрибольничных инфекций у пациентов реанимационных отделений, специализированных ожоговых и хирургических стационаров. Наибольшее клиническое и эпидемиологическое значение имеет распространение метициллин (оксациллин)-резистентных штаммов золотистого стафилококка (MRSA), частота которых в отдельных стационарах в России достигает 50-60% [3]. Тяжесть ситуации усугубляется тем, что возникновение внутрибольничных инфекций приводит к появлению и распространению резистентности к противомикробным препаратам, при этом проблема антибиотикорезистентности стафилококков выходит за пределы медицинских стационаров, затрудняя лечение инфекций, распространяющихся среди населения.
Начиная с 90-х годов XX века, вспышки стафилококковых инфекций, обусловленных метициллин-резистентными штаммами, получили распространение в негоспитальных условиях. В частности, отмечена циркуляция во внебольничной среде эпидемических клонов негоспитальных MRSA (community-acquired MRSA, CA-MRSA), таких как клоны USA-300, USA-400 и др. [4]. Характерным признаком (маркером) этих эпидемических клонов является продукция лейкоцидина Пантона-Валлентайна - двухкомпонентного токсина - суперантигена, ассоциируемого с тяжелыми некротизирующими заболеваниями кожи и мягких тканей, пневмониями, сепсисом [5, 6].
Описаны также эпидемические варианты золотистого стафилококка, продуцирующие белок токсического шока (TSST). Данный фактор патогенности задействован в патогенезе тяжелых септических состояний, включая синдром токсического шока, синдром «ошпаренной кожи» у новорожденных [7].
Таким образом, наиболее важные с клинических и эпидемиологических позиций штаммы золотистого стафилококка характеризуются устойчивостью к метициллину (оксациллину) и/или продукцией лейкоцидина Пантона-Валлентайна и белка токсического шока.
В настоящее время для идентификации стафилококков широко используется культуральный микробиологический метод, что нашло свое отражение в документах, регламентирующих деятельность микробиологических лабораторий [ 8].
В то же время данный метод требует продолжительного (не менее 48 часов) времени проведения исследования. К недостаткам данного метода относится также недостаточная чувствительность при определении метициллин-резистентности.
Известен ряд методов, позволяющих идентифицировать варианты стафилококков, обладающих патогенными свойствами.
Известен способ определения патогенных стафилококков по плазмокоагулирующей активности [9], предусматривающий внесение 12-часовой культуры стафилококка в плазму, разведенную изотоническим раствором хлорида натрия. Полученную микробную взвесь инкубируют при температуре 37°С в течение 5 часов. Регистрируют электрическое сопротивление микробной взвеси с 3-го до 5-го часа инкубирования. Причем при показателях сопротивления раствора 64-84 кОм делают заключение о патогенности стафилококка по наличию плазмокоагулирующей активности.
Недостатком данного способа является техническая сложность реализации ввиду необходимости регистрировать электрическое сопротивление микробной взвеси в течение инкубирования, а также недостаточная информативность, так как данный метод позволяет оценивать лишь один параметр, имеющий клиническое значение (плазмокоагулирующую активность).
Известен способ дифференциации стафилококковой микрофлоры слизистой оболочки носа человека [10], включающий выделение из микрофлоры слизистой оболочки носа чистых культур стафилококков, их идентификацию и определение у чистой культуры способности к инактивации природного дипептида карнозина. К нормальной микрофлоре слизистой оболочки носа человека относят золотистый стафилококк, не обладающий способностью к инактивации карнозина (антикарнозиновой активностью - АКрА), и все другие виды стафилококков, обладающих АКрА при уровне выраженности данного признака, равном или меньше 0,7 мкг/мл. К микрофлоре, способной вызвать развитие местных гнойно-воспалительных заболеваний, относят золотистый стафилококк с уровнем выраженности АКрА больше нуля и все другие виды стафилококков с уровнем выраженности данного признака больше 0,7 мкг/мл.
К недостаткам данного метода относится продолжительность выполнения, так как требуется предварительная идентификация микроорганизма и недостаточная информативность (оценивается выраженность продукции лишь одного фактора патогенности).
В качестве прототипа по наиболее близкой технической сущности нами выбран способ, идентифицирующий основные генетические варианты золотистого стафилококка, различающиеся по степени клинической и эпидемиологической значимости [11], включающий микробиологическую идентификацию культуры золотистого стафилококка, выделение ДНК из чистой культуры на плотной питательной среде, проверку отсутствия ингибиторов полимеразной цепной реакции в пробах выделенной ДНК амплификацией гена gyrA, амплификацию с последующей детекцией методом электрофореза в агарозном геле фрагментов генов факторов патогенности sea-e, seg-j, sem-o, tst, eta, etb, lukS-PV-lukF-PV, lukE-lukD, lukM, hla, hlb, hld, hlg, hlg-2, и edin и идентификацию основных генетических вариантов золотистого стафилококка на основании обнаружения в изучаемой ДНК отдельных генов факторов патогенности или их сочетаний.
К недостаткам способа, выбранного нами в качестве прототипа, относится длительность выполнения, обусловленная необходимостью предварительной идентификации микроорганизма и предварительной проверки отсутствия ингибиторов полимеразной цепной реакции, неудобство и дороговизна выполнения, обусловленные необходимостью постановки множества реакций в различных температурных условиях для идентификации каждого исследуемого гена в отдельности.
Задачей изобретения является сокращение времени проведения способа определения генотипов золотистого стафилококка, снижение стоимости способа, а также упрощение способа.
Техническим результатом, достигаемым с помощью изобретения, является возможность определения отдельных генотипов золотистого стафилококка, различающихся по степени клинической и эпидемиологической значимости, одновременно в одной мультиплексной реакции, а также исключение предварительного этапа идентификации микроорганизма.
Указанный технический результат достигается тем, что получают чистую культуру микроорганизмов на плотной питательной среде с последующим выделением и амплификацией ДНК возбудителя с помощью мультиплексной полимеразной цепной реакции (ПЦР) с детекцией результатов методом электрофореза в агарозном геле, причем используют мультиплексную ПЦР с четырьмя парами праймеров:
nuc 1 5'-GCGATTGATGGTGATACGGT-3',
nuc 2 5'-AGCCAAGCCTTGACGAACTAAAGC-3,
luk-PV- 1 5'-ATCATTAGGTAAAATGTCTGGACATGATCCA-3',
luk-PV- 2 5'-GCATCAAGTGTATTGGATAGCAAAAGC-3',
mecA - 1 5'-ACTGCTATCCACCCTCAAAC-3',
mecA - 2 5'-CTGGTGAAGTTGTAATCTGG-3'
tsst1f - 5'-ACCACCCGTTTTATCGCTTGAACG-3'
tsst1r - 5'-AGCCCTTTGTTGCTTGCGACA-3', комплементарных к участкам гена внеклеточной термонуклеазы (nuc), гена лейкоцидина Пантона-Валлентайна (pvl), гена белка токсического шока (tst) и гена устойчивости к метициллину (mecA). Генетические группы (генотипы) золотистого стафилококка определяют по наличию или отсутствию генов вирулентности pvl и tst и гена устойчивости к метициллину mecA или их сочетаний. ДНК микроорганизма идентифицируют как ДНК золотистого стафилококка при образовании в результате амплификации продукта размером 279 пар оснований, соответствующего гену nuc. Генотипы золотистого стафилококка дифференцируют по наличию одного или нескольких специфических продуктов амплификации: для гена mecA - в размере 163 пар оснований, для гена pvl - 433 пар оснований, для гена tst - в размере 540 пар оснований.
Заявляемый способ осуществляют следующим образом:
Производят посев клинического материала на плотную селективную или дифференциально-диагностическую питательную среду (например, желточно-солевой агар Чистовича) для получения чистой культуры микроорганизма.
Из изолированных колоний тестируемого микроорганизма выделяют геномную ДНК, для чего используют следующую процедуру: суспензию бактерий в стерильной бидистиллированной воде инкубируют в течение 15 мин при 95° С в закрывающихся пластиковых микропробирках объемом 1.5 мл. После кратковременного центрифугирования (30 сек при 12000 об/мин) надосадочную жидкость используют в качестве образца ДНК непосредственно или замораживают при -20° С для последующего анализа.
Амплификацию проводят в 25 мкл смеси, содержащей следующие реагенты (расчет приведен на одну пробу):
10-кратный ПЦР-буфер с MgCl2 - 2,5 мкл;
20 мМ смесь из четырех дезоксинуклеотидтрифосфатов dNTP - 2,5 мкл;
праймеры:
- 10 мкМ nuc 1 5'-GCGATTGATGGTGATACGGT-3' - 1 мкл;
- 10 мкМ nuc 2 5'-AGCCAAGCCTTGACGAACTAAAGC-3- 1 мкл;
- 10 мкМ luk-PV-1 5'-ATCATTAGGTAAAATGTCTGGACATGATCCA-3'- 1 мкл;
- 10 мкМ luk-PV-2 5'-GCATCAAGTGTATTGGATAGCAAAAGC-3'- 1 мкл;
- 20 мкМ mecA - 1 5'-ACTGCTATCCACCCTCAAAC-3'- 1 мкл;
20 мкМ mecA - 2 5'-CTGGTGAAGTTGTAATCTGG-3'- 1 мкл;
20 мкМ tsst1f - 5'-ACCACCCGTTTTATCGCTTGAACG-3'- 1 мкл;
- 20 мкМ tsst1r - 5'-AGCCCTTTGTTGCTTGCGACA-3'- 1 мкл;
Hot-start Taq-полимераза (5 ед./мкл) - 0,5 мкл;
дистиллированная (деионизированная) автоклавированная вода - 8,5 мкл;
геномная ДНК - 3 мкл.
ПЦР проводят по следующей программе: предварительная денатурация при 95 ̊С - 15 мин с последующими 30 циклами амплификации (10 сек денатурации при 94 ̊С, 20 сек отжига при 58 ̊С, 30 сек удлинения при 72 ̊С) и финальным удлинением при 72 ̊С в течении 5 минут.
Анализ продуктов амплификации проводят разделением фрагментов ДНК в 1,0% агарозном геле.
Генетические группы (генотипы) золотистого стафилококка определяют по наличию или отсутствию генов вирулентности pvl и tst и гена устойчивости к метициллину mecA или их сочетаний. ДНК микроорганизма идентифицируют как ДНК золотистого стафилококка при образовании в результате амплификации продукта размером 279 пар оснований, соответствующего гену nuc. Генотипы золотистого стафилококка дифференцируют по наличию одного или нескольких специфических продуктов амплификации: для гена mecA - в размере 163 пар оснований, для гена pvl - 433 пар оснований, для гена tst - в размере 540 пар оснований.
Отличительными существенными признаками заявляемого способа являются:
- использование мультиплексной ПЦР с четырьмя парами праймеров, то есть одновременное использование четырех пар праймеров в одной мультиплексной ПЦР:
nuc 1 5'-GCGATTGATGGTGATACGGT-3',
nuc 2 5'-AGCCAAGCCTTGACGAACTAAAGC-3,
luk-PV-1 5'-ATCATTAGGTAAAATGTCTGGACATGATCCA-3',
luk-PV-2 5'-GCATCAAGTGTATTGGATAGCAAAAGC-3',
mecA - 1 5'-ACTGCTATCCACCCTCAAAC-3',
mecA - 2 5'-CTGGTGAAGTTGTAATCTGG-3'
tsst1f - 5'-ACCACCCGTTTTATCGCTTGAACG-3'
tsst1r - 5'-AGCCCTTTGTTGCTTGCGACA-3';
- указанные четыре пары праймеров в одной реакции комплементарны к участкам гена внеклеточной термонуклеазы (nuc), к участкам гена лейкоцидина Пантона-Валлентайна (pvl), к участкам гена белка токсического шока (tst), к участкам гена устойчивости к метициллину (mecA);
- генетические группы (генотипы) золотистого стафилококка определяют по наличию или отсутствию генов вирулентности pvl и tst и гена устойчивости к метициллину mecA или их сочетаний;
- причем ДНК микроорганизма идентифицируют как ДНК золотистого стафилококка при образовании в результате амплификации продукта размером 279 пар оснований, соответствующего гену nuc;
- генотипы золотистого стафилококка дифференцируют по наличию одного или нескольких специфических продуктов амплификации: для гена mecA - в размере 163 пар оснований, для гена pvl - 433 пар оснований, для гена tst - в размере 540 пар оснований.
- отсутствие предварительной проверки отсутствия ингибиторов полимеразной цепной реакции;
Причинно-следственная связь между отличительными существенными признаками и достигаемым результатом:
Выбор в качестве диагностических маркеров для определения генетических групп (генотипов) золотистого стафилококка последовательностей фрагментов участков гена лейкоцидина Пантона-Валлентайна (pvl), гена белка токсического шока (tst) и гена устойчивости к метициллину (mecA) основан на многочисленных данных о широкой представленности данных генов в геномах эпидемических штаммов этого возбудителя.
Предложенные олигонуклеотидные праймеры к данным генам подобраны с учетом отсутствия в них протяженных участков взаимной комплементарности и комплементарности с праймерами к гену внутриклеточной термонуклеазы и имеют близкие температуры отжига.
При конструировании праймеров выбраны участки генов-мишеней, различающиеся по величине. В частности праймеры для гена nuc имеют следующую локализацию в геноме штамма золотистого стафилококка USA300_TCH1516 (№ последовательности в Genebank CP000730.1): nuc1 - 880448 - 880467, nuc2 - 880726 - 880703. Праймеры luk-PV-1 и luk-PV-2 комплементарны последовательностям от 1561456 до 1561426 и от 1561024 до 1561050 в геноме того же штамма. Праймеры mecA-1 и mecA-2 комплементарны последовательностям от 45996 до 45977 и от 45834 до 45853 в геноме штамма N315 (№ последовательности в Genebank BA000018.3). Праймеры tsst1f и tsst1r комплементарны последовательностям от 2139708 до 2139685 и от 2139169 до 2139189 в геноме штамма Mu3 (№ последовательности в Genebank AP009324.1 ).
Такая конструкция праймеров позволяет использовать их одновременно в одной реакции, проводимой в формате мультиплексной ПЦР.
Мультиплексный характер реакции с использованием праймеров к видоспецифическому гену nuc, используемому в качестве внутреннего контроля качества проведения реакции, позволяет не проводить предварительной проверки проб ДНК на наличие специфических ингибиторов ПЦР, и, соответственно, упрощает и ускоряет идентификацию генотипов золотистого стафилококка.
Использование данных праймеров для специфической амплификации участков гена внеклеточной термонуклеазы (nuc), гена лейкоцидина Пантона-Валлентайна (pvl) и гена устойчивости к метициллину (mecA) позволяет осуществлять одновременно (в одной пробе) идентификацию бактерий до вида (золотистый стафилококк) и внутривидовую дифференциацию на генетические группы (генотипы), различающиеся по содержанию гена устойчивости к метициллину (оксациллину) и гена лейкоцидина Пантона-Валлентайна, в том числе позволяет выявлять наиболее опасные с эпидемиологических позиций штаммы стафилококков - MRSA, штаммы, продуцирующие лейкоцидин Пантона-Валлентайна или белок токсического шока.
Исходя из локализации участков генов-мишеней, комплементарных предложенным нами олигонуклеотидным праймерам, определяют основные генетические варианты золотистого стафилококка методом электрофореза в агарозном геле по количественным значениям, характеризующим размер полученных продуктов реакции:
ДНК возбудителя идентифицируют как ДНК золотистого стафилококка, не содержащего генов вирулентности pvl и tst и гена устойчивости к метициллину mecA при образовании в результате амплификации одного продукта размером 279 пар оснований, другие генотипы золотистого стафилококка дифференцируют по наличию одного или нескольких специфических продуктов амплификации: для гена mecA - в размере 163 пар оснований, для гена pvl - 433 пар оснований, для гена tst - в размере 540 пар оснований.
Совокупность отличительных существенных признаков является новой и позволяет, в отличие прототипа, определять отдельные генотипы золотистого стафилококка, различающиеся по степени клинической и эпидемиологической значимости, одновременно в одной мультиплексной реакции, а также исключить предварительный этап идентификации микроорганизма, что, по сравнению с прототипом, сокращает время проведения способа определения генотипов золотистого стафилококка, снижает стоимость способа, а также упрощает его проведение.
Примеры реализации способа:
Пример 1. Эпидемиологическое обследование травматологического стационара в связи с выявлением в нем случаев внутрибольничной инфекции.
Заявляемый способ был апробирован для выявления вероятного источника инфекции при расследовании серии внутрибольничных заражений, вызванных метициллин-резистентыми штаммами золотистого стафилокококка (MRSA) в отделении гнойной остеологии травматологического стационара.
В марте 2010 года в данное отделение в течение 10 дней (с 15 по 25 марта) поступило 4 пациента с диагнозом «хронический посттравматический остеомиелит». Пациент С. (история болезни № 12573) поступил 15.03.10. 17.03.10 пациенту было проведено микробиологическое исследование отделяемого свищевого хода, в результате выделен золотистый стафилококк. 19.03.10 золотистый стафилококк был выделен при посеве раны пациента В. (история болезни № 12576), которому проводились лечебно-диагностические манипуляции в той же перевязочной, что и пациенту С. Затем 20 и 21.03.10 культуры золотистого стафилококка были выделены у пациентов Н. и П. (истории болезни № 12580 и 12581) и в смыве с поверхности тележки для транспортировки пациентов после текущей дезинфекции (№ бактериологического посева 0845). Проведенная по заявляемому способу идентификация культур с одновременной дифференциацией на генотипы позволила подтвердить, что все выделенные изоляты являются золотистыми стафилококками, причем изолят, выделенный от пациента С., был отнесен к генотипу nuc+mec+pvl (метициллин-резистентный, содержащий ген лейкоцидина Пантона-Валлентина, не содержащий ген белка токсического шока), а изоляты, выделенные от других пациентов, имели генотип nuc+mec (метициллин-резистентный, не содержащий ген лейкоцидина Пантона-Валлентина, не содержащий ген белка токсического шока). Таким образом, пациент С. не мог быть источником инфекции для остальных пациентов, как это могло бы следовать, исходя из хронологии возникновения случаев стафилококковой инфекции.
Первый случай в серии внутрибольничных заражений штаммами золотистого стафилококка с генотипом nuc+mec (метициллин-резистентный, не содержащий ген лейкоцидина Пантона-Валлентина, не содержащий ген белка токсического шока) наблюдался у больного В., поэтому был сделан вывод о том, что этот пациент явился источником инфекции для пациентов Н. и П., а наиболее вероятным фактором передачи явилась тележка для транспортировки пациентов, с поверхности которой был выделен изолят золотистого стафилококка того же генотипа. Учитывая, что идентификация генотипов золотистого стафилококка заняла небольшое время (4 часа от момента получения чистой культуры), имелась возможность своевременно провести противоэпидемические мероприятия (в частности, изоляцию пациентов, дезинфекционные мероприятия) и не допустить дальнейшего распространения MRSA-инфекции, вызванной данными генотипами.
Пример 2. Эпидемиологическое обследование отделения родильного дома в связи с регистрацией случаев гнойно-септической инфекции новорожденных (омфалитов).
В марте 2012 года в отделении «Семейные роды» одного из родильных домов г. Санкт-Петербурга было зарегистрировано два случая омфалитов с выделением из пупочной ранки метициллин-резистентных штаммов золотистого стафилококка. В отношении заболевших были проведены изоляционно-ограничительные мероприятия и назначена антибактериальная терапия.
После выписки заболевших детей и заключительной дезинфекции в отделении было решено оценить эффективность проведенных мероприятий, для чего было организовано микробиологическое обследование объектов окружающей среды родильного дома и находящихся в отделении детей. Одномоментно 20.03.2012 были взяты смывы с поверхностей, рук медицинского персонала, кожи детей (всего 55 смывов). Исследуемый материал высевали на маннитол-солевой агар (селективная среда для стафилококков), а затем выросшие колонии подвергали идентификации по заявляемому способу. Из 11 протестированных изолятов 6 были идентифицированы как штаммы золотистого стафилококка:
смыв № 12 (пеленальный стол до дезинфекции), № 14 (кожа новорожденного В.), № 35 ( фонендоскоп неонатолога З.), № 50 ( кожа новорожденного Е.), № 51 (смыв с рук неонатолога В.), № 52 (фонендоскоп неонатолога В.).
Изученные штаммы были отнесены к двум генотипам: изоляты 12, 14, 35 были отнесены к генотипу nuc+mec (метициллин-резистентный, не содержащий ген лейкоцидина Пантона-Валлентина, не содержащий ген белка токсического шока), изоляты 50, 51, 52 - к генотипу nuc+mec+tst (метициллин-резистентный, не содержащий ген лейкоцидина Пантона-Валлентина, содержащий ген белка токсического шока). Таким образом, несмотря на проведенные в стационаре изоляционно-ограничительные и дезинфекционные мероприятия, циркуляция метициллин-резистентного штамма продолжалась за счет рук медицинского персонала и фонендоскопов, не подвергавшихся адекватной дезинфекции. Учитывая, что штаммы, продуцирующие белок токсического шока, являются наиболее эпидемиологически опасными возбудителями тяжелых поражений кожи и мягких тканей у новорожденных [7], по результатам проведенного обследования в отделении были проведены экстренные противоэпидемические мероприятия, включая изменение алгоритма обработки рук медицинского персонала и изменение режима дезинфекции фонендоскопов.
Доказательства эффективности заявляемого способа:
1. Оценка эффективности заявляемого способа при видовой идентификации стафилококков
Заявляемый способ апробирован нами при исследовании коллекции тестовых культур стафилококков различных видов, депонированных в лаборатории кафедры эпидемиологии, паразитологии и дезинфектологии СЗГМУ им. И.И. Мечникова. В качестве методов сравнения был использованы два метода: классический бактериологический метод идентификации с использованием селективно-диагностических сред [8], применявшийся как часть способа, принятого за прототип, и метод идентификации золотистого стафилококка при помощи ПЦР [12].
Результаты тестирования представлены в таблице 1 - Результаты апробации заявляемого способа на коллекции тест-культур микроорганизмов в сопоставлении с общеизвестными аналогами - способами идентификации золотистого стафилококка.
Как видно из представленной таблицы, заявляемый нами способ идентификации является специфичным, т.к. не наблюдалось амплификации при исследовании ДНК культур микроорганизмов, не являющихся золотистыми стафилококками. Заявляемый способ не уступает по своей чувствительности способам сравнения, поскольку наблюдалось полное совпадение в идентификации культур золотистого стафилококка заявляемым способом, так и способом прототипом и аналогом.
2. Оценка эффективности заявляемого способа при генетическом типировании золотистого стафилококка
Заявляемый способ был апробирован при генетическом типировании 176 культур золотистого стафилококка, депонированных в лаборатории кафедры эпидемиологии, паразитологии и дезинфектологии СЗГМУ им. И.И. Мечникова. В качестве положительных контролей амплификации генов nuc, mecA, tst и pvl были использованы штаммы S. aureus CCUG 35601 (генотип 3 - mecA - позитивный, pvl - негативный), S. aureus CCUG 47167 (генотип 2 - mecA - негативный, pvl - позитивный), штамм S. aureus SMI Sa778 (генотип 6 mecA - позитивный, tst - позитивный) из коллекции Шведского института контроля за инфекциями.
Результаты генетического типирования золотистого стафилококка представлены в таблице 2 - Результаты апробации заявляемого способа при генетическом типировании культур золотистого стафилококка.
Как видно из представленной таблицы, заявляемый нами способ позволяет идентифицировать не менее шести различных генотипов золотистого стафилококка, в том числе эффективно осуществлять идентификацию штаммов MRSA, имеющих гены факторов патогенности.
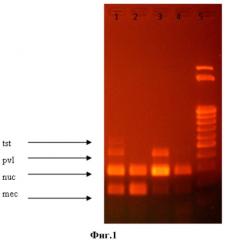
На Фиг.1 представлены результаты амплификации генов mecA, nuc, pvl и tst в мультиплексной ПЦР: дорожка 1 - продукты ПЦР размером 163, 279, 433 и 540 пар оснований, соответствующие результату амплификации ДНК штамма золотистого стафилококка, содержащего все четыре определяемых гена, дорожки 2 и 4 - продукты ПЦР размером 163, 279 пар оснований, соответствующие результату амплификации ДНК штамма золотистого стафилококка, содержащего ген mecA и не содержащего других генов факторов патогенности; дорожка 3 - продукты ПЦР размером 163, 279, 433 пар оснований, соответствующие результату амплификации ДНК штамма золотистого стафилококка, содержащего ген pvl и ген mec и не содержащего гена tst; 5 - маркер молекулярного веса (100 н.п.)
Как видно из представленных результатов, применение заявляемого способа позволяет, основываясь на размере полученных продуктов полимеразной цепной реакции, выявлять генетические группы (генотипы) золотистого стафилококка, различающиеся по наличию или отсутствию генов факторов патогенности pvl и tst и гена устойчивости к метициллину mecA.
Таким образом, заявляемый способ позволяет одновременно в одной мультиплексной реакции дифференцировать основные генетические варианты золотистого стафилококка, различающиеся по степени клинической и эпидемиологической значимости.
Стоимость способа прототипа составляет 1500 руб., заявляемого способа - 120 руб.
При выполнении способа, выбранного нами в качестве прототипа, требуется не менее 28 часов (после получения чистой культуры микроорганизма), а при заявляемого способе - 4 часа (после получения чистой культуры микроорганизма), следовательно, заявляемый нами способ позволяет сократить время идентификации ДНК золотистого стафилококка с одновременной дифференциацией его на основные генотипы.
В отличие от способа, выбранного нами в качестве прототипа, заявляемый способ позволяет определять отдельные генотипы золотистого стафилококка, различающиеся по степени клинической и эпидемиологической значимости, одновременно в одной мультиплексной реакции, а также исключить предварительный этап идентификации микроорганизма, что сокращает время проведения способа, снижает его стоимость, а также упрощает его проведение.
ЛИТЕРАТУРА
1. Richards MJ, Edwards JR, Culver DH, et al. Nosocomial infections in medical intensive care units in the United States. National Nosocomial Infections Surveillance System. Crit Care Med 1999;27(5): 887-92.
2. Witte W, Klare I, Nubel U, Strommenger B, Werner G (2008) Emergence and spread of antibiotic resistant Gram positive bacterial pathogens. Int J Med Microbiol 298:365-377.
3. Web-ресурс: http://www.antibiotic.ru
4. Vandenesch F, Naimi T, Enright MC, Lina G, Nimmo GR, Heffernan H,et al. Community-acquired methicillin-resistant Staphylococcus aureus carrying Panton-Valentine leukocidin genes: worldwide emergence. Emerg Infect Dis 2003;9:978-84.
5. Baba T, Takeuchi F, Kuroda M, Yuzawa H, Aoki K, Oguchi A, et al.Genome and virulence determinants of high virulence community-acquired MRSA. Lancet. 2002;359:1819-27.
6. Gillet Y, Issartel B, Vanhems P, Fournet JC, Lina G, Bes M, et al.Association between Staphylococcus aureus strains carrying gene for Panton-Valentine leukocidin and highly lethal necrotising pneumonia in young immunocompetent patients. Lancet. 2002;359:753-9.
7. Takahashi, N., H. Nishida, H. Kato, K. Imanishi, Y. Sakata, and T. Uchiyama.
1998. Exanthematous disease induced by toxic shock syndrome toxin
1 in the early neonatal period. Lancet 351:1614-1619.
8. Приказ № 535 МЗ СССР от 22.04.1985. «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений. Видовая идентификация стафилококков».
9. RU 2332461, 08.11.2006.
10. RU 2318021, 26.05.2006.
11. Jarraud S, Mougel C, Thioulouse J, Lina G, Meugnier H, Forey F, Nesme X, Etienne J, Vandenesch F. Relationships between Staphylococcus aureus genetic background, virulence factors, agr groups (alleles), and human disease. Infect Immun. 2002 Feb;70(2):631-41.
12. Brakstad OG, Aasbakk IK, Maeland JA. Detection of Staphylococcus aureus by polymerase chain reaction amplification of the nuc gene. Journal of Clinical Microbiology, July 1992, p. 1654-1660 Vol. 30, No. 7.
13. Web-ресурс: http://blast.ncbi.nlm.nih.gov/
Таблица 1
Результаты апробации заявляемого способа на коллекции тест-культур микроорганизмов в сопоставлении с часто применяющимися способами идентификации Staphylococcus aureus
Таблица 2
Результаты апробации заявляемого метода при генетическом типировании культур Staphylococcus aureus.
Способ определения генотипов золотистого стафилококка, включающий получение чистой культуры микроорганизмов на плотной питательной среде, выделение и амплификацию ДНК возбудителя с помощью полимеразной цепной реакции (ПЦР) с последующей детекцией результатов методом электрофореза в агарозном геле, о т л и ч а ю щ и й с я тем, что используют мультиплексную ПЦР с четырьмя парами праймеров:nuc 1 5'-GCGATTGATGGTGATACGGT-3',nuc 2 5'-AGCCAAGCCTTGACGAACTAAAGC-3, luk-PV-1 5'-ATCATTAGGTAAAATGTCTGGACATGATCCA-3', luk-PV-2 5'-GCATCAAGTGTATTGGATAGCAAAAGC-3', mecA - 1 5'-ACTGCTATCCACCCTCAAAC-3', mecA - 2 5'-CTGGTGAAGTTGTAATCTGG-3'tsst1f - 5'-ACCACCCGTTTTATCGCTTGAACG-3'tsst1r - 5'-AGCCCTTTGTTGCTTGCGACA-3', комплементарных к участкам гена внеклеточной термонуклеазы (nuc), гена лейкоцидина Пантона-Валлентайна (pvl), гена белка токсического шока (tst) и гена устойчивости к метициллину (mecA), и генетические группы (генотипы) золотистого стафилококка определяют по наличию или отсутствию генов вирулентности pvl и tst и гена устойчивости к метициллину mecA или их сочетаний, причем ДНК микроорганизма идентифицируют как ДНК золотистого стафилококка при образовании в результате амплификации продукта размером 279 пар оснований, соответствующего гену nuc, а генотипы золотистого стафилококка дифференцируют по наличию одного или нескольких специфических продуктов амплификации: для гена mecA - в размере 163 пар оснований, для гена pvl - 433 пар оснований, для гена tst - в размере 540 пар оснований.