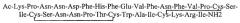Антитела против g-белка распираторно-синцитиального вируса (rsv)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и иммунологии. Предложено изолированное моноклональное антитело или его иммунореактивный фрагмент, которое связывается с эпитопом G-белка штамма А2 респираторно-синцитиального вируса (RSV). Также описаны молекула нуклеиновой кислоты, его кодирующая, клетка-хозяин, содержащая такую молекулу нуклеиновой кислоты, способ получения антитела и фармацевтическая композиция, содержащая антитело. Предложенная группа изобретений может быть использована для лечения респираторно-синцитиального вируса. 5 н. и 9 з. п. ф-лы, 37 ил., 1 табл., 9 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительных заявок на патенты США № 61/000469, поданной 25 октября 2007 г., и № 61/089401, поданной 15 августа 2008 г. Содержание каждого из этих документов включено в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к антителам, которые иммунореактивны по отношению к функционально важному эпитопу, содержащемуся на G-белке респираторно-синцитиального вируса (RSV), которые минимально иммуногенны при введении человеку. Эти антитела могут быть использованы для повышения резистентности людей к инфекции RSV, равно как и для снижения инфекционной нагрузки у уже инфицированных лиц, или облегчения симптомов, вызванных инфекцией RSV.
УРОВЕНЬ ТЕХНИКИ
Инфекция RSV представляет собой давнюю и опасную проблему во всем мире, включая Соединенные Штаты Америки, Европу, Австралию и Японию. Особое беспокойство она вызывает в случаях недоношенных младенцев, маленьких детей и пожилых людей и, безусловно, для всех людей с ослабленной иммунной системой. Подсчитано, что около двух третей детей в возрасте до 1 года и почти все дети в возрасте от 1 до 4 лет хотя бы один раз были инфицированы RSV, при этом большинство случаев выздоровления происходит без необходимости медицинского вмешательства. Тем не менее, у 5-10% наблюдается длительная тяжелая инфекция, что считается фактором, провоцирующим симптомы одышки и астмы в более позднем детстве. RSV имеет два основных поверхностных гликопротеина, F и G. Единственное на рынке моноклональное антитело против RSV было одобрено только для профилактического применения у недоношенных детей для предупреждения инфекции RSV, и оно направлено против F-белка. Это антитело, паливизумаб (Synagis®, от MedImmune), является широко применимым благодаря консервативности последовательности F-белка среди штаммов. Напротив, G-белок является довольно вариабельным, за исключением центрального домена «CX3C», который был почти неизменным у около 100 просеквенированных штаммов. Эта область включает мотив, который, как было показано, взаимодействует с рецепторами фракталкинов. Считается, что такое взаимодействие способствует длительному течению заболевания, характерному для RSV, подавляя эффективный иммунный ответ на данный вирус: Tripp, R. A., et al., Nature Immunology (2001) 2:732-738. Также было показано, что эта область является антагонистом Toll-подобного рецептора 4, который, как полагают, способствует подавлению эффективного иммунного ответа: Polack, et al., Proc. Natl. Acad. Sci. USA (2005) 102:8996-9001; Shingai, et al., Int'l Immunology (2008) epub July 8.
Первоначальные попытки профилактики RSV с помощью вакцинации оказались контрпродуктивными. Вакцинации инактивированным в формалине RSV или G-гликопротеином RSV сопутствовали увеличение тяжести заболевания и легочная эозинофилия, что объясняется ранее отмеченной консервативностью последовательности области G-белка, обозначенной CX3C, которая имитирует хемокиновый фракталкин. (Haynes, L. M., et al., J. Virol. (2003) 77:9831-9844.) Пассивная иммунизация с использованием антител, направленных против G-белка, обычно считается нецелесообразной из-за отсутствия консервативности последовательности этого белка среди штаммов.
Впоследствии той же группой было подтверждено, что ответы антител против G-белка, вызванные инфекцией RSV или вакцинацией, соответствовали ингибированию связывания G-белка с CX3C-фракталкиновым рецептором и модуляции хемотаксиса лейкоцитов, опосредованного G-белком RSV (Harcourt, J. L., et al., J. I. D. (2004) 190:1936-1940), и что ингибирование этого связывания отрицательно сказывается на Т-клеточных ответах (Harcourt, J. L., et al., J. Immunol. (2006) 176:1600-1608). Более современные исследовательские работы по созданию вакцин предотвращают обострение болезни, связанное с фиксированной в формалине вакциной, но было обнаружено, что иммунитет, полученный благодаря более новым вакцинам, быстро ослабевает (от недель до нескольких месяцев), в соответствии с низкой иммунологической памятью в отношении природных RSV: Yu, et al., J. Virol. (2008) 82:2350-2357. Повторные инфекции обычны для этого вируса, в отличие от многих других. За этот эффект могут быть ответственны иммуносупрессивные свойства G-белка.
Моноклональные антитела, направленные против G-белка, известны уже более 20 лет. В работе Anderson, L. J., et al., J. Virol. (1988) 62:4232-4238 описана способность смесей моноклональных антител (mAb) против белков F и G, а также индивидуальных mAb нейтрализовывать RSV. Относящиеся к связыванию G-белка mAb, в особенности 131-2G, позднее были изучены Sullender, W., Virol. (1995) 209:70-79 в антигенном анализе. Было установлено, что это антитело связывается как с RSV группы А, так и группы B, представляющих основные штаммы RSV.
Помимо этого, работа Mekseepralard, C., et al., J. Gen. Virol. (2006) 87:1267-1273 резюмирует более ранние статьи, показывающие, что пассивно введенные антитела как против F, так и против G-белков защищают от экспериментальной инфекции в моделях на грызунах. Эти статьи включают Routledge, et al., J. Gen. Virol. (1988) 69:293-303; Stott, E. J., et al., J. Virol. (1986) 60:607-613; Taylor, G., et al., Immunol. (1994) 52:137-142; и Walsh, E. E., et al., Infect. Immun. (1984) 43:756-758. В исходной статье Mekseepralard и др. отметили, что моноклональное антитело, специфичное против G-белка (1C2), нуждается в гликозилировании для нейтрализации вируса в присутствии комплемента in vitro или при использовании in vivo у мышей. Авторы отмечают, что аминокислоты 173-186 G-белка консервативны и что 1C2 было направлено против консервативной области; однако способ получения неиммуногенных антител был относительно грубым, а именно Fab мышей «химеризовали» на Fc область человека.
Помимо этого, в работе Corbeil, S., et al., Vaccine (1996) 14:521-525 показано, что система комплемента участвует в защите мышей при контрольной стимуляции RSV после пассивной иммунизации моноклональным антителом мыши 18A2B2, даже если это антитело не проявляет вируснейтрализующую способность in vitro.
Публикация РСТ WO 00/43040 описывает использование антител против субстанции P для смягчения воспаления дыхательных путей, связанного с инфекцией RSV. Продукция субстанции Р, известного провоспалительного медиатора, увеличивается посредством введения G-белка RSV и отсутствует у мутантов RSV, у которых отсутствует G-белок или в центральной консервативной области присутствует подавляющая функцию точечная мутация: Haynes, et al., J. Virol. (2003) 77:9831-9844.
Патент США 2006/0018925 описывает и заявляет права на антитела и малые пептиды, способные блокировать взаимодействие области CX3C G-белка с его рецептором. Эти композиции предложены как полезные для модуляции инфекции RSV и стимуляции иммунитета. Хотя предложена гуманизация антител мышей, демонстрирующих лечебно-профилактическое значение этих антител, фактически никаких гуманизированных форм не было получено или описано.
Публикация РСТ WO2007/101441, переуступленного компании Symphogen, направлена на получение рекомбинантных поликлональных антител для лечения инфекций RSV. Поликлональные рекомбинантные антитела состоят из индивидуальных моноклональных антител, выделенных из сыворотки крови человека. В таблице 5 этой публикации описываются 12 моноклональных антител, которые, как утверждается, связываются с «консервативной областью» со 164 по 176 аминокислоты G-белка RSV подтипа А. Пятеро из них были проверены на аффинность с G-белком, и эти аффинности оказались в диапазоне 100-500 пМ. Двое из этих антител были проверены на способность к нейтрализации в реакции подавления бляшкообразования (PRNT); одно показало значение EC50 около 2,5 мкг/мл, а другое вообще не проявило никаких нейтрализующих свойств.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Антитела, специфически иммунореактивные по отношению к G-белку RSV по сравнению с F-белком, в том числе те, которые иммунореактивны по отношению к штаммам обеих групп А и B и имеют высокую аффинность к G-белку и сильную вируснейтрализующую способность, были идентифицированы у людей-доноров, достоверно незадолго инфицированных RSV. Кроме того, антитело мыши против G-белка, первоначально описанное в работе Anderson, et al., J. Virol. (1988) 62:4232-4238, было модифицировано таким образом, чтобы свести к минимуму вероятность иммунологического отторжения при введении человеку. Антитела по данному изобретению находят применение в качестве терапевтических средств, а также для повышения резистентности к RSV у людей. В конкретном плане, антитела к консервативному мотиву в положениях 160-176 G-белка подтипа A терапевтически эффективны при устранении вируса у субъектов, которые уже инфицированы, и для ослабления воспаления дыхательных путей, характерного для инфекции RSV, а также для профилактического применения.
Таким образом, в одном аспекте данное изобретение направлено на моноклональные антитела или их иммунореактивные фрагменты, которые связывают эпитоп приблизительно в пределах положений 160-176 G-белка штамма A RSV и которые минимально иммуногенны при введении человеку. Эти антитела показывают вируснейтрализующие способности в стандартных тестах бляшкообразования по нейтрализации RSV и демонстрируют в таких тестах EC50, составляющую <500 нг/мл, предпочтительно <200 нг/мл, более предпочтительно <100 нг/мл. Антитела по данному изобретению также имеют аффинности к G-белку RSV-A2, составляющие <1 нМ, предпочтительно <500 пМ, более предпочтительно <100 пМ. Антитела по данному изобретению, в одном варианте осуществления, связываются в пределах 30 остатков хемокинового мотива CX3C, содержащегося в G-белке RSV, либо непосредственно с ним, как минимум с его частью, в области, которая имеет высокую степень идентичности аминокислот среди множества штаммов RSV. Хемокиновый мотив CX3C находится примерно в положениях аминокислот 182-186 штамма RSV-A2 и в соответствующих положениях G-белка других штаммов. Было установлено, что соответствующая область, внутри которой связываются антитела по данному изобретению, заключена в пределах остатков 160-176 G-белка RSV-A2 и соответствующих положений G-белка других штаммов. Эта область высококонсервативна в штамме A и содержит лишь небольшие аминокислотные различия между штаммами A и B. В частности, высококонсервативная область имеет последовательность HFEVFNFVPCSIC в положениях 164-176 RSV-A2. Предпочтительно антитела по данному изобретению связывают эпитоп, включающий последовательность FEVFNF или последовательность VFNFVPCSIC. В одном варианте осуществления, антитела по данному изобретению иммунореактивны по отношению к этой области консервативной аминокислотной идентичности и, таким образом, с G-белком штаммов этого вируса как группы A, так и группы B, а потому - с G-белком большинства штаммов.
Для использования в способах по данному изобретению для лечения инфекции RSV или с целью повышения резистентности к RSV, моноклональные антитела и фрагменты по данному изобретению могут быть иммунореактивны по отношению к множеству штаммов обеих групп А и В, и одного единственного моноклонального антитела может быть достаточно, чтобы произвести желаемый эффект. В ином случае, субъекту, подлежащему лечению, или которого предстоит сделать резистентным, может быть введено более чем одно единственное моноклональное антитело, в частности, когда одно антитело в протоколе обладает более высокой реакционной способностью по отношению к штаммам группы А, а другие - более высокой реакционной способностью по отношению к штаммам группы B.
Данное изобретение также включает фармацевтические композиции, пригодные для профилактики или лечения, в том числе смягчения воспаления, которые содержат в качестве действующего средства единственное антитело или иммунореактивный фрагмент по данному изобретению либо не более 2 антител или фрагментов по данному изобретению.
Другие аспекты по данному изобретению включают способы использования антител для лечения RSV у людей или для индуцирования резистентности у этих субъектов.
Моноклональные антитела по данному изобретению могут быть получены рекомбинантно, и, следовательно, данное изобретение также включает рекомбинантные материалы для такого получения, равно как и клеточные линии или иммортализованные клетки, а также не относящиеся к человеку многоклеточные организмы или их клетки, или микробные клетки, для получения этих антител. В одном варианте осуществления клетки, полученные у людей, получают в «иммортализованной» форме, в которой их модифицируют, чтобы обеспечить секрецию антител в течение достаточно длительного периода времени, чтобы их можно было охарактеризовать и клонировать соответствующую кодирующую последовательность.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фигура 1 представляет собой график, показывающий частоту встречаемости в м.д. антител к различным антигенам RSV у людей. Желательный штамм-независимый анти-G фенотип (Gab) встречается достаточно редко, примерно 10 частей на миллион (м.д.) в совокупности, и снижается до 1 м.д. у отдельных субъектов. «Смеш.» относится к антителам, связывающим как F, так и G; поскольку F и G не имеют гомологии последовательностей, связывание, вероятно, объясняется общими углеводными детерминантами.
Фигура 2A представляет собой схему G-белка RSV с указанием области CX3C и расположения консервативных дисульфидных связей. Схематический вариант является универсальным для всех штаммов, хотя конкретные нумерации положений немного отличаются от одного штамма к другому.
На фигуре 2B графически представлено связывание сывороток от подвергшихся действию RSV субъектов относительно панели перекрывающихся 12-мерных пептидов из G-белка RSV, обнаружившее слабую иммуногенность центральной консервативной области.
На фигуре 2C графически представлена частота полиморфизма для коллекции более 75 штаммов RSV в зависимости от положения в G-белке, обнаружившая замечательную консервативность в центральной консервативной области и в местах альтернативного сплайсинга, что создает растворимую форму G-белка.
На фигуре 3 показаны результаты исследования иллюстративного моноклонального антитела (131-2G) мышей относительно матрицы пептидов с перекрывающимися последовательностями. Это исследование выявило эпитоп, с которым связывается данное mAb. В иллюстративном случае эпитоп находится в пределах 30 остатков мотива CX3C.
Фигуры 4A-4D: На панелях A и B представлены сводные диаграммы крови от двух доноров. На панели A показан донор, обладающий ценной частотой встречаемости Ga/Gb перекрестно-реагирующих клонов. На панели B показан донор, у которого этого нет. Каждая точка диаграммы изображает относительное связывание с 3 пробами для «молекулярного отпечатка» антител, секретируемого единичным клоном. Панель C представляет собой количественный профиль «молекулярного отпечатка» секретируемого белка единичной B-клетки, трансформированной вирусом Эпштейн-Барра (EBV). На панели D показаны профили клеток 4 поколения от клетки HEK293, трансформированной генами антител из клетки на панели C. Этот профиль идентичен таковому на панели C, в пределах точности анализа, как определено с помощью репликатов на панели D.
На фигурах 5A-5B показаны последовательности тяжелых цепей (панель А) и легких цепей (панель B) для репрезентативных антител по данному изобретению.
На фигурах 6A-6F показаны результаты определения аффинности двух антител по данному изобретению, полученные с помощью биосенсоров Biacore. Как показано на панелях E и F, антитело 3D3 связывает G-белок и не показывает непосредственно детектируемой скорости диссоциации. На панелях A и D показано связывание антител с поверхностью сенсора. На панелях B и E показано увеличение сигнала сенсора, по мере того как белок Ga протекает параллельно поверхности и захватывается связанным антителом, за чем следует снижение сигнала, по мере того как поверхность промывают буфером, позволяющим связанному белку Ga десорбироваться с поверхности. На панелях C и F аналогичным образом показаны скорости ассоциации и скорости диссоциации для белка Gb.
Фигура 7 представляет собой график связывания различных антител по данному изобретению по сравнению с Synagis® F белок-связывающим антителом, определенный в тесте ELISA с использованием живого вируса для покрытия микропланшет.
Фигура 8 представляет собой график, на котором по оси Х отложена аффинность к G-белку относительно связывания с вирусом по оси Y. Два данных показателя коррелируют, хотя 3D3 показывает несколько меньшую аффинность к живому вирусу, чем можно было бы предполагать, исходя из его аффинности к G-белку.
На фигурах 9A и 9B показано сравнение связывания нескольких антител со штаммами А2 и А5.
На фигуре 10 показаны результаты анализов на вируснейтрализующую способность. Результаты приведены в виде числа бляшек, нанесенных в зависимости от мкг антитела.
На фигуре 11 показано сравнение антитела 3G12 по данному изобретению с антителом Synagis® по нейтрализации штамма B RSV.
На фигуре 12 показано сравнение профилактической активности двух антител по данному изобретению с коммерческим антителом Synagis®.
На фигурах 13A-13C показана терапевтическая эффективность mAb 131-2G в модели на мышах пост-инфекции RSV (обработка в день +3 после инфекции), включая дозозависимое снижение вирусной нагрузки (панель А) наряду с другими мерами по снижению воспаления легких: клетки NK и клетки PMN (панель B), а также интерферон-гамма (IFNγ) (панель C).
На фигуре 14 показана динамика вирусного титра в модели на мышах, обработанных антителами 3G12, 3D3 или Synagis® в малых дозах, что подчеркивает эффективное преимущество высокоаффинных антител по данному изобретению.
Фигура 15 представляет собой кривую зависимости «доза-эффект», оценивающую влияние антител на количество копий RSV в легких RSV-инфицированных мышей при обработке в день +3 после инфекции.
На фигуре 16 показана сравнительная способность Synagis®, 3D3 и 3G12 снижать вирусную нагрузку на конечных стадиях инфекции после обработки в день +3 после инфекции.
На фигуре 17 показано влияние контрольного антитела, анти-F антитела и анти-G антитела на клетки BAL в легких RSV-инфицированных мышей. Обработку проводили в день +3 после инфекции.
На фигурах 18A и 18B показано, что F(ab')2 иммуноспецифические фрагменты анти-G mAb также эффективны, как интактные mAb, для уменьшения воспаления у RSV-инфицированных мышей, когда их дают в день +3 после инфекции, но неэффективны для снижения вирусной нагрузки.
На фигурах 19A-19C показано влияние анти-G mAb на продукцию IFNγ в клетках BAL при различных моментах начала введения антител, начиная от профилактического (день -1) до дня +3 и дня +5 после инфекции.
На фигуре 20 показан титр антител против центральной консервативной области G-белка RSV у пожилых пациентов, инфицированных вирусом RSV. Пациенты были отобраны в зависимости от выраженности клинических признаков и симптомов, тяжелых или легких. Отсутствие поддающегося оценке титра к центральной консервативной области коррелирует с тяжелым заболеванием.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем документе термин «лечить» относится к снижению вирусной нагрузки у субъекта, который уже инфицирован RSV, или к смягчению симптомов болезни у этого субъекта. Такие симптомы включают бронхиолит, воспаление дыхательных путей, застой крови в легких и затруднение дыхания.
Термин «придает резистентность к» относится к профилактическому эффекту, при котором вирусная инфекция RSV в результате контрольной стимуляции, как минимум, снижает свою тяжесть.
«Иммортализованные клетки» относятся к клеткам, которые могут пережить значительно больше пересевов, чем немодифицированные первичные изолированные клетки. В контексте настоящего изобретения термин «иммортализованные» не обязательно означает, что клетки продолжают секретировать антитела в течение очень длительных периодов времени, а только то, что они могут выживать дольше, чем культуры первичных клеток. Время, за которое происходит секреция антитела, должно только быть достаточным для его идентификации и воссоздания кодирующих нуклеотидных последовательностей.
Фраза «минимально иммуногенные при введении людям» означает, что ответ на введение в организм человека похож на таковой, когда таким людям вводят человеческие или гуманизированные антитела. Известно, что человеческие или гуманизированные антитела действительно вызывают ответ у 5-10% обработанных людей. Это верно даже для антител, которые выделены непосредственно у людей, так как существует определенный уровень фонового «шума» у вызванной иммунной реакции. Иммунный ответ может быть гуморальным, или клеточным, или обоюдным. В частности, у этого процента лиц можно обнаружить повышенные уровни цитокинов.
Фраза «консервативная область G-белка RSV» относится к аминокислотной последовательности, содержащей 50 аминокислот, предпочтительно 30 аминокислот, более предпочтительно 20 аминокислот, по обе стороны от области CX3C, что показано для конкретного штамма на фигуре 2A. Консервативная область в основном вытянута в 3'-5' направлении от конкретной области CX3C G-белка. Так, используя G-белок RSV штамма A2 в качестве модели, консервативная область, соответствующая антителам по данному изобретению, вытянута примерно со 160 по 188 остаток, предпочтительно со 160 по 176.
Антитела по данному изобретению имеют ряд желательных свойств. Во-первых, они иммунореактивны с G-белком из множества штаммов RSV и, как правило, иммунореактивны с G-белками и штаммов типа A, и штаммов типа B. Во-вторых, они обладают довольно высокой аффинностью к G-белку, некоторые из них в диапазоне от <2 пМ. Так, антитела по данному изобретению имеют аффинности, составляющие, по меньшей мере 10 нМ, предпочтительно 1 нМ, более предпочтительно 500 пМ, еще лучше 100 пМ, либо 50 пМ, 10 пМ или 1 пМ, а также все значения между этими предпочтительными иллюстративными точками. Было установлено, что коммерческие антитела Synagis®, направленные против F-белка, имеют аффинность около 5 нМ. Антитела против F-белка с более высокой аффинностью, Numax™ (мотавизумаб), по оценкам, имеют аффинность около 50 пМ. Антитела по данному изобретению показывают превосходную способность работать в качестве терапевтических средств, а также демонстрируют способность снижать количество вирусов в легких на пике инфекции. Они также проявляют эту способность в точке, где обычно инфекция себя исчерпывает. Это особенно полезно, поскольку субъекты, выздоравливающие после инфекции RSV, могут продолжать распространять вирус и, следовательно, могут инфицировать других в постклинических условиях. Антитела и их фрагменты также лечат симптомы инфекции, в том числе воспаление легких.
Антитела по данному изобретению были получены двумя иллюстративными путями. В одном подходе, отмеченные выше существующие моноклональные антитела, 131-2G, которые, как известно, иммунореактивны с консервативной областью G-белка, были сначала просеквенированы, а затем гуманизированы путем гибридизации константной области человека с модифицированными вариабельными областями человека (как тяжелыми, так и легкими цепями). Вариабельные области были выбраны на основе высокой гомологии с вариабельными областями антитела 131-2G, а затем модифицированы, чтобы вставить гипервариабельные аминокислоты 131-2G. Общеизвестны способы такой гуманизации, обеспечивающие правильный набор аминокислотных замен, которые можно выбрать. В случае 131-2G, оригинальная гибридомная линия экспрессировала более одной легкой цепи, требуя выбора, которая из них на самом деле ответственна за связывание консервативного мотива RSV. Это было определено авторами настоящего изобретения, и в одном варианте осуществления антитела по данному изобретению служат примером гуманизированной формы mAb 131-2G.
В альтернативном способе антитела по данному изобретению были выделены из людей-доноров, инфицированных RSV, с помощью патентованного CellSpot™ способа, который описан в патенте США 7413868, международных публикациях согласно PCT WO 2005/045396 и WO 2008/008858, все включены посредством ссылки.
В этом способе были проанализированы 40 образцов RSV-инфицированных доноров в рамках процесса, производящего ~500000 антитело-продуцирующих клеток на каждый образец крови. Так, в общей сложности ~20000000 различных B-клеток были проанализированы на продукцию антител, которые являются специфическими для консервативной области G-белка. Только ~10% доноров имели подходящую частоту Ga/Gb специфичных клонов (то есть независимых от штамма), и такие клоны присутствовали только у ~1/50000 клеток, даже у представителей с самой высокой частотой. В целом, частота желательных клеток составила ~0,003%, что достаточно низко для целесообразности выделения стандартными методами, но легко достижимо с помощью CellSpot™. На фигуре 1 показан спектр реакционных способностей к антигенам RSV для 24 доноров. Как показано на этой фигуре, даже у тех лиц, у кого были обнаружены антитела, перекрестно реагирующие с G-белком, полученным из штаммов как A, так и B, преобладание этих антител значительно меньше, чем антител, иммунореактивных с F-белком, либо с Ga или Gb по отдельности. Удивительно большое число клонов распознают как белок F, так и G (обозначено «смеш.»), которые, вероятно, распознают общие углеводные детерминанты. Аффинности таких анти-углеводных антител, как правило, низки и далее не рассматривались. Самая высокая аффинность антител, найденная у этой группы доноров, аффинность порядка 1 пМ, происходила от одного из доноров с очень низкой частотой Ga/Gb специфичных клонов, ~1 м.д. А именно, обнаружение этого в высшей степени подходящего клона было бы маловероятным без всестороннего скрининга полного репертуара от всех доноров.
Для того чтобы выполнить этот скрининг, В-клетки были иммортализованы вирусом Эпштейна-Барра и оценивались в соответствии с описанными выше способами (см. пример 2 для подробностей). Были выявлены подходящие B-клетки, и были получены и просеквенированы нуклеотидные последовательности, кодирующие выявленные моноклональные антитела. Затем с ними производили манипуляции в рамках рекомбинантных технологий, чтобы они могли продуцировать антитела в линии клеток млекопитающих.
Важный аспект функции G-белка свойственен секретируемой форме белка, s(G), созданной с помощью сайта альтернативного сплайсинга в районе остатка 50. Конструирование вируса, у которого отсутствует s(G), привело к снижению уровня легочной инфильтрации клеток (Maher, et al., Microbes Infect. (2004) 6:1049-1055). С другой стороны, примирование мышей посредством s(G) увеличивает продукцию IL-5 и эозинофилию легких (Johnson, et al., J. Virol. (1998) 72:2871-2880). Соответственно, супрессия активности s(G) важна для эффективного лечения RSV. Для достижения этой цели необходимо высокоаффинное антитело, что общеизвестно в данной области (например, патент США 7083950). Поскольку центральная консервативная область непосредственно причастна к функции s(G) как иммуномодулирующее средство, эффективные антитела против s(G) должны быть нацелены на этот мотив.
Наше исследование репертуара человеческих B-клеток субъектов, подвергнутых действию RSV, было безоценочным в поисках антител, которые связываются с G-белком обоих штаммов А и B (Ga/Gb перекрестно-реактивные антитела). Поскольку исследование было обширным (40 субъектов, от каждого ~500000 проверенных B-клеток), замечательной находкой является то, что все Ga/Gb перекрестно-реактивные антитела, связывающие линейные эпитопы, подходящие для картирования, распознают эпитопы в пределах нескольких остатков друг от друга внутри центральной консервативной области. Эта область, как известно, имеет низкую иммуногенность, как показано на фигуре 2B (Plotnicky-Gilquin, et al., Virology (2002) 303:130-137), что согласуется с низкой частотой высокоаффинных к этой области клонов, о чем здесь сообщалось. Авторы также далее охарактеризовали эту область путем изучения опубликованных последовательностей G-белков из >75 RSV изолятов. Большинство остатков белка показывают в данной выборке от нескольких до многих полиморфизмов. Две области поразительно свободны от полиморфизмов: сайт альтернативного сплайсинга, который создает s(G), и центральная консервативная область, с которой связываются все Ga/Gb перекрестно-реактивные антитела (фигура 2С). А именно, авторы обнаружили, что область, которая высококонсервативна, что служит признаком особо важной функциональности, также является низкоиммуногенной. Целый ряд механизмов может быть причиной такой низкой иммуногенности, например, отсутствие близлежащих сайтов протеолитического расщепления, подходящих для эффективного презентирования данной области совместно с антигенами гистосовместимости для экспозиции остальной части иммунной системы. Каким бы ни был механизм, этот неожиданный результат понятен: те вирусы, которые выжили, показывают низкую иммуногенность к этой области. Поэтому авторы предвидели, что увеличение активности иммунной системы против этой области путем пассивной трансплантации подходящих антител будет эффективным, и моделями на животных было подтверждено, что дело обстоит именно так. Сайт альтернативного сплайсинга, хотя и консервативен в равной степени, не является необычайно низкоиммуногенным, указывая на то, что его важность заключается только в отношении создания s(G), таким образом делая его плохой мишенью для пассивной иммунотерапии.
Получение человеческих или гуманизированных антител по данному изобретению осуществляется обычными рекомбинантными методами, такими как получение в клетках яичника китайского хомячка или в других эукариотических клеточных линиях, таких как клетки насекомых. В качестве альтернативы известны также методы получения рекомбинантных материалов, в том числе антител, в растениях и в трансгенных животных, например в молоке крупного рогатого скота, либо в системах единичных клеток, происходящих из микробов, или растений, или насекомых.
Кроме того, поскольку нуклеотидные последовательности, кодирующие антитела, соответствующие фрагменты, связывающие тот же эпитоп, например Fab, F(ab')2 или Fv фрагменты, могут быть получены рекомбинантными методами (или протеолитической обработкой самого белка), и антитела могут быть получены в одноцепочечной форме. В данной области известны различные методы управления производством рекомбинантных антител.
Для использования в терапии полученные рекомбинантными методами антитела или фрагменты составляют в фармацевтические композиции при помощи соответствующих вспомогательных средств и вводят в соответствии со стандартными протоколами. Данные фармацевтические композиции могут иметь в качестве единственного активного ингредиента моноклональное антитело или фрагмент по данному изобретению, особенно моноклональное антитело или фрагмент, который перекрестно реактивен с G-белком как A, так и B штаммов. В качестве альтернативы два моноклональных антитела могут быть отдельными активными ингредиентами, когда один более сильно реагирует с G-белком штамма A, а другой - более сильно с G-белком штамма B. Во всех этих случаях могут присутствовать дополнительные терапевтические средства, в том числе одно или несколько антител, иммунореактивных с F-белком, либо другие лекарственные средства, которые являются эффективными против RSV или воспаления. Так, например, такие противовоспалительные средства, как стероидные и нестероидные противовоспалительные соединения, могут быть включены в данные композиции. Также данные соединения могут включать питательные вещества, такие как витамины, или любое другое полезное соединение, отличное от антитела.
В одном варианте осуществления, когда составы для введения используются в целях повышения резистентности к инфекции, применяют полные антитела, включающие комплемент-содержащую Fc область. Как правило, данные антитела вводят при уровнях дозировки 0,01-20 мг/кг массы человека, либо в количествах в пределах 0,01-5 мг/кг, либо в промежуточных количествах в указанных пределах. В одном варианте осуществления применяют количества в пределах 0,1-1,0 мг/кг. Может быть полезным повторное введение, разделенное несколькими днями, либо несколькими неделями, либо несколькими месяцами. Также могут быть предложены бустерные инъекции через 1 или 2, или 5, или 10 лет.
В других вариантах осуществления, для терапевтического эффекта в целях снижения вирусной нагрузки, также используются полные антитела, включающие комплемент-содержащую Fc область. Количества, вводимые в рамках таких протоколов, составляют порядка 0,001-50 мг/кг или промежуточные значения в этом диапазоне, такие как 0,01, 1 или 10 мг/кг. Также может быть применено повторное введение. Терапевтическое воздействие назначают как можно скорее после диагностики инфекции, хотя введение в течение нескольких дней также находится в рамках данного изобретения. Также может быть применено повторное введение. В целях уменьшения воспалительной реакции в легких необходимо использовать только иммуноспецифические фрагменты антител. Уровни дозировки аналогичны таковым для полных антител. Введение смесей иммуноспецифических фрагментов и целых антител также входит в сферу данного изобретения.
Введение композиций антител по данному изобретению, как правило, проводят в виде инъекций, в большинстве случаев внутривенных инъекций. Таким образом, предпочтительным является парентеральное введение. Однако включенным является любой применимый способ введения.
Данные составы изготавливают способами, широко известными в данной области для введения композиций антител. Подходящие составы могут быть найдены в стандартных фармакологических справочниках, таких как Remington's Pharmaceutical Sciences, самое последнее издание, Mack Publishing Co., Easton, PA, включенное в данный документ посредством ссылки. Данные составы, как правило, пригодны для парентерального введения, в том числе в виде изотонических растворов, которые включают буферы, антиоксиданты и т.д., а также эмульсий, которые включают средства доставки, такие как липосомы, мицеллы и наночастицы.
Желательные протоколы и составы зависят от решения лечащего практикующего врача, равно как и от конкретного состояния данного субъекта. Уровни дозировки при необходимости будут зависеть от возраста, общего состояния здоровья и тяжести инфекции субъекта.
Следующие примеры представлены, чтобы проиллюстрировать, но не ограничить данное изобретение.
Пример 1
Клонирование и гуманизация 131-2G
Клонирование и секвенирование mAb 131-2G. Тотальную мРНК экстрагировали из 131-2G гибридомы в соответствии с инструкцией производителя (RNeasy™ kit: Qiagen Santa Clarita, Ca). Семь специфичных для данных семейств 5' VγFR1 праймеров, сконструированных для нацеливания на семейства генов Igγ, с VH1 по VH7, и один консенсусный 3' Cγ1 праймер применяли для амплификации и секвенирования вариабельной области тяжелой цепи 131-2G. Один консенсусный 5' Vk праймер сконструировали для амплификации каждого из Vk семейств, и один обратный праймер, специфичный для каппа-константной области, применяли для амплификации и секвенирования каппа-легкой цепи. Транскрипты VH и VL амплифицировали из 100 нг тотальной РНК с помощью полимеразной цепной реакции с обратной транскрипцией (RT-PCR).
Две реакции PCR проводили для 131-2G гибридомы: одну для каппа-легкой цепи (κ) и одну для гамма-тяжелой цепи (γ1). Для амплификации применяли набор QIAGEN® OneStep RT-PCR kit, (Qiagen Catalog № 210212). Экстрагированные продукты PCR непосредственно секвенировали, применяя праймеры, специфичные для константной области. Выведенные последовательности сравнивали с известными последовательностями зародышевых ДНК V- и J-областей Ig с помощью V-BASE2 и выравнивания VH и VL генов в базе данных зародышевых линий мышей. Анализ последовательностей: исходя из информации по нуклеотидным последовательностям, были получены данные о V- и J-генных сегментах тяжелой и легкой цепи 131-2G. На основании данных о последовательностях сконструировали комплекты новых праймеров, специфичных к лидерной последовательности VH и VK цепей Ig 131-2G. Анализ последовательности и частоты использования V-генов: гены тяжелых цепей 131-2G происходили из семейства генов зародышевой линии VH1, зародышевый ген D-области представляет собой DSP2.2, а J-область была из зародышевой линии JH3. Гены легких цепей происходили из семейств генов зародышевых линий Vκ1(K1A5) и Jκ4.
Использование V-сегмента IgH-VJ558 семейства VH1 в 131-2G:
Использовани