Стимулирующая адгезию временная маска для покрытых поверхностей
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к сосудистой хирургии и кардиологии, и может быть использована при проведении стентирования. Предложено имплантируемое медицинское устройство, представляющее собой цилиндрический интралюминальный скаффолд, выполненный из множества секций и мостиковых элементов, имеющий люминальную поверхность и аблюминальную поверхность, множество сквозных отверстий, расположенных на секциях и мостиковых элементах. Антитромботическое покрытие, закрепленное только на люминальной и аблюминальной поверхностях и поверхностях стенок интралюминального скаффолда, а не на поверхности сквозных отверстий. Терапевтический препарат, размещенный по меньшей мере в одном из множества сквозных отверстий, при этом терапевтический агент не является антитромботическим покрытием и не покрывается антитромботическим покрытием. Также предложен способ покрытия интралюминального скаффолда путем нанесения маски на внутренние поверхности отверстий и удаления ее после нанесения на скаффолд антитромботического материала. Изобретения обеспечивают эффективную профилактику и лечение рестеноза за счет локальной одновременной доставки различных лекарственных препаратов на стенте, закрепленных посредством усиленной адгезии и приемов маскирования и демаскирования. 2 н. и 12 з.п. ф-лы, 4 табл., 12 ил., 3 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
1. Область техники, к которой относится изобретение
Настоящее изобретение относится к поддерживающим ткани медицинским устройствам и более конкретно к расширяемым неизвлекаемым устройствам, которые имплантируют внутрь просветов трубчатых органов тела живого животного или человека для поддерживания органа и сохранения его в раскрытом состоянии и которые имеют отверстия для доставки многообразных благотворно действующих средств к месту медицинского вмешательства, а также поверхностное покрытие из антитромботического препарата. Настоящее изобретение также относится к способу маскирования и демаскирования для стимулирования адгезии матриц из терапевтического препарата и полимера к стенкам, формирующим отверстия в медицинском устройстве.
2. Обсуждение прототипа
В прошлом для поддерживания проходного отверстия в раскрытом состоянии были разработаны постоянные или биоразлагаемые устройства для имплантации внутри проходного отверстия в организме. Эти устройства обычно вводят подкожно и транслюминально продвигают до размещения в желательном местоположении. Эти устройства затем либо расширяют механически, например расширением оправки или баллона, размещенного внутри устройства, или же они расширяются сами за счет высвобождения запасенной энергии при приведении в действие внутри организма. Будучи расширенными внутри просвета, эти устройства, называемые стентами, оказываются заключенными внутри ткани организма и становятся постоянным имплантатом.
Известные конструкции стентов включают спиральные стенты из монофиламентной проволоки (патент США № 4969458); сварные металлические сетчатые трубки (патенты США №№ 4733665 и 4776337); и, наиболее известные, тонкостенные металлические цилиндры с протяженными в осевом направлении щелями, сформированными вдоль окружности (патенты США №№ 4733665, 4739762 и 4776337). Известные конструкционные материалы для использования в стентах включают полимеры, органические тканые материалы и биосовместимые металлы, такие как нержавеющая сталь, золото, серебро, тантал, титан, и сплавы с эффектом памяти формы, такие как никелид титана.
Патент Соединенных Штатов № 6241762, который приведен здесь для сведения, представляет конструкцию непризматического стента, которая устраняет несколько эксплуатационных недостатков предшествующих стентов. В дополнение, предпочтительные варианты исполнения, раскрытые в этом патенте, представляют стент с крупными, недеформируемыми продольными и соединительными элементами, которые могут содержать отверстия без ущерба механическим характеристикам продольных или соединительных элементов или всего устройства в целом. Далее, эти отверстия могут служить в качестве крупных, защищенных резервуаров для доставки разнообразных благотворно действующих средств к месту имплантации устройства без необходимости поверхностного покрытия на стенте.
Из многих проблем, которые могут быть разрешены с помощью основанной на стентах адресной доставки благотворно действующих препаратов, одной из важнейших является рестеноз. Рестеноз представляет собой наиболее существенное осложнение, которое может возникать вследствие васкулярных интервенций, таких ангиопластика и имплантация стентов. Проще говоря, рестеноз представляет собой процесс заживления раны, который сокращает диаметр просвета сосуда в результате отложения внеклеточного матрикса и пролиферации клеток гладкой мышечной ткани сосудов и который в конечном итоге приводит к повторному сужению или даже повторной окклюзии просвета. Несмотря на внедрение усовершенствованных хирургических методов, устройств и фармацевтических препаратов общий уровень частоты рестеноза для стентов из обнаженного металла по-прежнему регистрируют в интервале от приблизительно двадцати пяти процентов до приблизительно пятидесяти процентов в течение периода времени от шести до двадцати месяцев после проведения ангиопластики. Для лечения этого состояния зачастую требуются дополнительные процедуры повторной васкуляризации, тем самым усиливая травмирование и риски пациента.
Многообещающие результаты в подавлении рестеноза показали традиционные стенты с поверхностными покрытиями из разнообразных благотворно действующих средств. Например, патент Соединенных Штатов № 5716981 раскрывает стент, который имеет поверхностное покрытие из композиции, включающей полимерный носитель и паклитаксель. Патент представляет подробные описания способов нанесения покрытий на поверхности стента, такие как набрызгивание и погружение, а также желательный характер самого покрытия: следует «покрывать стент гладко и равномерно» и «обеспечивать равномерное, прогнозируемое, продолжительное высвобождение антиангиогенного фактора». Однако поверхностные покрытия в реальности могут слабо регулировать кинетические характеристики выделения благотворно действующих средств. Эти покрытия непременно должны быть очень тонкими, типично с толщиной от пяти до восьми микрон (5-8 мкм). По сравнению с этим площадь поверхности стента очень велика, так что весь объем благотворно действующего средства в целом имеет очень короткий диффузионный пробег для перехода в окружающую ткань. Полученный суммарный профиль высвобождения лекарственного средства скорее характеризуется резким начальным выбросом, с последующим быстрым достижением асимптотического уровня, нежели «равномерным, продолжительным выделением», или линейным характером высвобождения.
Увеличение толщины поверхностного покрытия оказывает благоприятное действие, которое проявляется в улучшении кинетических параметров высвобождения лекарственного препарата, в том числе в способности лучше контролировать выделение лекарственного средства и в возможности повышения дозировки лекарственного средства. Однако увеличенная толщина покрытия приводит к возрастанию общей толщины стенки стента. Это нежелательно по многим соображениям, в том числе ввиду повышенного риска травмирования просвета сосуда во время имплантации, сокращения поперечного сечения потока в просвете трубчатого органа после имплантации и повышенной уязвимости покрытия к механическому нарушению или повреждению во время расширения и имплантации. Толщина покрытия является одним из нескольких факторов, которые оказывают влияние на кинетические характеристики высвобождения благотворно действующего средства, и тем самым ограничения по толщине сужают диапазон скоростей высвобождения, продолжительности такового и тому подобных, каковые могут быть достигнуты.
Поверхностные покрытия могут также ограничивать доставку комбинаций из нескольких лекарственных средств из стента. Например, если из поверхностного покрытия должны были выделяться комбинации нескольких лекарственных препаратов, то скорости высвобождения, периоды продолжительности выделения и прочие характеристики выделения нельзя простым путем контролировать по отдельности. Однако рестеноз включает множественные биологические процессы и может излечиваться более эффективно с использованием комбинации лекарственных препаратов, выбранных для воздействия на эти различные биологические процессы.
Статья авторов Chao-Wei Hwang et al., озаглавленная «Движущие силы физиологического транспорта, обусловливающие распределение лекарственных средств при доставке с использованием стентов», раскрывает важную взаимосвязь между пространственными и временными параметрами распределения лекарственных препаратов с выделяющих лекарственное средство стентов и механизмы внутриклеточного транспорта лекарственных препаратов. В поиске путей улучшения механической работоспособности и структурных характеристик конструкции стентов развивались до более сложных геометрических форм с присущей таковым неоднородностью распределения в окружном и продольном направлениях аксиальных элементов (продолин) стента. Примерами этой тенденции являются типичные имеющиеся в продаже на рынке стенты, которые расширяются с образованием примерно ромбической или многоугольной конфигурации, будучи используемыми в просвете трубчатых органов тела. Оба типа были использованы для доставки благотворно действующего средства в форме поверхностного покрытия. Исследования показали, что трубчатые части тканей, непосредственно соседствующие с продольными и поперечными элементами, получают лекарственные препараты с гораздо более высокими концентрациями, чем более отдаленные части ткани, такие как расположенные в средней части продольно протяженных ячеек с «ромбовидной» формой. Существенно то, что этот градиент концентрации лекарственного средства внутри стенки просвета трубчатого органа остается более высоким с течением времени для гидрофобных благотворно действующих средств, таких как паклитаксель или рапамицин, которые до настоящего времени зарекомендовали себя как наиболее эффективные препараты против рестеноза. Поскольку локальные концентрации и градиенты лекарственных препаратов неразрывно связаны с биологическими эффектами, первоначальное пространственное расположение источников благотворно действующих средств (продольных и поперечных элементов стента) является ключевым фактором эффективности.
В дополнение к субоптимальному пространственному распределению благотворно действующих средств существуют прочие потенциальные недостатки, присущие стентам с поверхностным покрытием. Определенные фиксированные носители на основе полимерных матриц, часто используемые в покрытиях на устройствах, типично оставляют значительную процентную долю благотворно действующего средства в покрытии в неопределенном состоянии. Поскольку такие благотворно действующие средства могут быть цитотоксичными, например паклитаксель, то могут возникать подострые и хронические проблемы, такие как хроническое воспаление, поздний тромбоз, и задержанное или неполное заживление стенки сосуда. Кроме того, сами полимерные носители часто вызывают воспаление ткани стенки сосуда. С другой стороны, употребление биоразлагаемых полимерных носителей на поверхностях стентов может иметь результатом «неправильное расположение» или полости между стентом и тканью стенки сосуда после разложения полимерного носителя. Полости создают возможность эпициклического перемещения стента относительно соседней ткани. Возникающие проблемы включают микроабразию и воспаление, дрейф стента и неудачную реэндотелиализацию стенки сосуда.
Ранние клинические испытания на людях привели к выводу, что могут иметь место определенные недостатки, связанные с первым поколением устройств для доставки лекарственных средств. Последующее врачебное наблюдение участвующих в клинических испытаниях пациентов в течение от шести до восемнадцати месяцев после имплантации покрытых лекарственными средствами стентов показывает, что у значительного числа пациентов могут возникать неправильное расположение продольных и поперечных элементов стентов относительно артериальных стенок и краевой рестеноз. Краевой рестеноз возникает сразу же за пределами ближайшей и отдаленной кромок стента и прогрессирует вокруг кромок стента и во внутреннем (люминальном) пространстве, зачастую приводя к необходимости повторной реваскуляризации пациента.
Еще один потенциальный недостаток состоит в том, что расширение стента может вызывать деформацию вышележащего полимерного покрытия, обусловливая отслаивание, растрескивание или разрушение покрытия, каковые могут влиять на кинетические характеристики высвобождения лекарственного препарата или оказывать прочие неблагоприятные воздействия. Эти эффекты наблюдались в покрытых лекарственным средством стентах первого поколения, когда эти стенты расширялись до увеличенных диаметров, тем самым препятствуя их использованию в артериях с более крупным диаметром. Далее, расширение такого покрытого стента в кровеносном сосуде, пораженном атеросклерозом, будет прилагать сдвиговые усилия в окружном направлении к полимерному покрытию, что может вызывать отслоение покрытия от нижележащей поверхности стента. Такое отделение опять же может оказывать неблагоприятное воздействие, включая эмболизацию фрагментами покрытия вплоть до закупоривания сосуда.
Еще одна проблема, которая может быть разрешена с помощью локальной доставки благотворно действующих средств на основе стентов, представляет собой тромбоз. В дополнение к одному или более терапевтическим препаратам для лечения рестеноза стент может быть покрыт антитромботическим средством. Однако, в зависимости от характера покрытий на поверхности стента, например покрытия из антитромботического средства, для усиления адгезии прочих терапевтических средств к покрытым поверхностям стента может(-гут) быть предпочтительным(-ыми) дополнительный(-ные) слой (слои) или грунтовочный(-ные) слой (слои). Альтернативно, вместо грунтовочного(-ных) слоя(-ев) может быть использован способ маскирования и демаскирования.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Стимулирующая адгезию временная маска для поверхностей с гепариновым покрытием согласно настоящему изобретению преодолевает затруднения, кратко описанные выше.
В соответствии с первым аспектом настоящее изобретение предлагает способ нанесения покрытия на интралюминальную трехмерную структуру (скаффолд), имеющую множество отверстий. Способ включает нанесение маски на внутренние поверхности множества отверстий в интралюминальном скаффолде, нанесение покрытия на поверхности интралюминального скаффолда, причем покрытие включает антитромботический материал, удаление маски и любого второго покрытия, прилипшего к маске, с внутренних поверхностей множества отверстий в интралюминальном скаффолде, и заполнение множества отверстий одним или более терапевтическими препаратами.
В соответствии с еще одним аспектом настоящее изобретение представляет имплантируемое медицинское устройство. Имплантируемое медицинское устройство включает по существу цилиндрический интралюминальный скаффолд, имеющий люминальную поверхность и аблюминальную поверхность, причем расстояние между люминальной поверхностью и аблюминальной поверхностью определяет поверхности стенок интралюминального скаффолда, интралюминальный скаффолд, также включающий множество отверстий, определяющих внутренние поверхности, антитромботическое покрытие, закрепленное на люминальной, аблюминальной поверхностях и поверхностях стенок интралюминального скаффолда, и по меньшей мере одно терапевтическое средство, осажденное по меньшей мере в одном из множества отверстий и находящееся в непосредственном контакте с внутренними поверхностями таковых.
Принимая во внимание недостатки прототипа, было бы преимущественным создание стента, способного доставлять относительно большой объем благотворно действующего средства в травмированное место просвета сосуда, в то же время избегая многочисленных потенциальных проблем, связанных с поверхностными покрытиями, содержащими благотворно действующие средства, без увеличения эффективной толщины стенок стента и без вредного воздействия на характеристики механического расширения стента.
Далее, было бы преимущественным создание поддерживающего ткань устройства с различными благотворно действующими средствами, помещенными в различные отверстия, для достижения желательного пространственного распределения двух или более благотворно действующих средств.
Далее, было бы преимущественным создание поддерживающего ткань устройства с различными благотворно действующими средствами, помещенными в различные отверстия, для достижения желательных различных кинетических параметров высвобождения для двух или более благотворно действующих средств из одного и того же устройства.
Далее, было бы преимущественным создание поддерживающего ткань устройства, имеющего все поверхности, покрытые антитромботическим средством, и затем использование грунтовочного материала в проемах или отверстиях в таковом для усиления адгезии одного или более благотворно действующих средств, которыми заполнены отверстия.
Настоящее изобретение направлено на способ маскирования и демаскирования для создания покрытого гепарином стента, имеющего резервуары или отверстия в таковом, в котором гепариновое покрытие покрывает все поверхности стента, за исключением внутренних стенок резервуаров или отверстий в стенте. Применением описываемого здесь способа маскирования и демаскирования стент, который может быть изготовлен из любого пригодного биосовместимого материала, включающего металлы, сплавы и полимеры, может быть снабжен гепариновым покрытием, которое покрывает определенные поверхности, такие как люминальная, аблюминальная или муральная (стеночная), и боковые поверхности продольных и соединительных элементов, но не покрывает внутренние стенки резервуаров или отверстий. Этим путем резервуары или отверстия могут быть заполнены в соответствии с описываемыми здесь способами с применением дополнительного грунтовочного материала или без такового.
Общая концепция настоящего изобретения состоит в нанесении полимерной маски на поверхности резервуаров или отверстий в элементах стента до нанесения на стент покрытия из антитромботического средства, например гепарина, и затем в удалении полимерной маски и части, или предпочтительно всего целиком, любого гепаринового покрытия, прилипшего поверх маски, тем самым получая стент, имеющий резервуары или отверстия по существу с обнаженными металлическими поверхностями, в то же время оставляя прочие детали покрытыми гепарином.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеприведенные и прочие признаки и преимущества изобретения будут очевидными из нижеследующего более подробного описания предпочтительных вариантов осуществления изобретения, иллюстрированных сопроводительными чертежами.
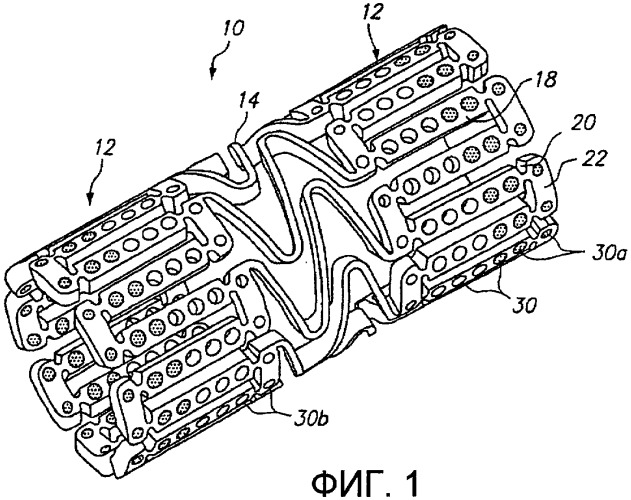
Фиг.1 представляет трехмерное изображение расширяемого медицинского устройства с благотворно действующим средством на концах в соответствии с настоящим изобретением.
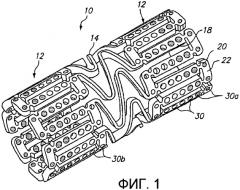
Фиг.2 представляет трехмерное изображение расширяемого медицинского устройства с благотворно действующим средством в центральной части и без благотворно действующего средства на концах в соответствии с настоящим изобретением.
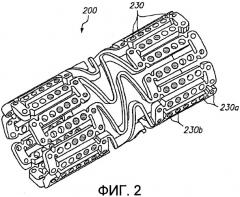
Фиг.3 представляет трехмерное изображение расширяемого медицинского устройства с различными благотворно действующими средствами в различных отверстиях в соответствии с настоящим изобретением.
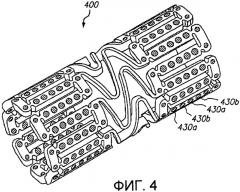
Фиг.4 представляет трехмерное изображение расширяемого медицинского устройства с различными благотворно действующими средствами в попеременных отверстиях в соответствии с настоящим изобретением.
Фиг.5 представляет увеличенный вид сбоку части расширяемого медицинского устройства с содержащими благотворно действующее средство отверстиями в мостиковых элементах в соответствии с настоящим изобретением.
Фиг.6 представляет увеличенный вид сбоку части расширяемого медицинского устройства с разветвительным отверстием в соответствии с настоящим изобретением.
Фиг.7 представляет вид поперечного сечения расширяемого медицинского устройства, имеющего комбинацию из первого средства, такого как противовоспалительный препарат, в первом множестве отверстий, и второго средства, такого как антипролиферативный препарат, во втором множестве отверстий, в соответствии с настоящим изобретением.
Фиг.8 представляет график скоростей высвобождения для одного примера противовоспалительного и антипролиферативного средств, доставляемых расширяемым медицинским устройством из фиг.7, в соответствии с настоящим изобретением.
Фиг.9A-9C представляют фрагментарные схематические изображения альтернативного примерного варианта осуществления расширяемого медицинского устройства в соответствии с настоящим изобретением.
Фиг.10 иллюстрирует реакцию сочетания между PLGA (сополимера молочной и гликолевой кислот) с концевой кислотной карбоксильной группой и PEI (полиэтиленимином) с низкой молекулярной массой в соответствии с настоящим изобретением.
Фиг.11 иллюстрирует реакцию сочетания между PLGA (сополимера молочной и гликолевой кислот) с концевой кислотной карбоксильной группой и PEI (полиэтиленимином) с высокой молекулярной массой или разветвленным таковым в соответствии с настоящим изобретением.
Фиг.12A, 12B и 12C представляют виды поперечных сечений секции стента в условиях исполнения способа соответственно настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Фиг.1 иллюстрирует расширяемое медицинское устройство, имеющее множество отверстий, включающих благотворно действующее средство, для доставки в ткани с помощью расширяемого медицинского устройства. Расширяемое медицинское устройство 10, иллюстрированное на фиг.1, представляет собой отрезок трубчатого материала для формирования цилиндрического расширяемого устройства. Расширяемое медицинское устройство 10 включает множество цилиндрических секций 12, соединенных между собой множеством мостиковых элементов 14. Мостиковые элементы 14 позволяют поддерживающему ткань устройству изгибаться в осевом направлении при прохождении причиняющим боль извилистым путем в сосудистой системе до места развертывания и обеспечивают устройству возможность изгибаться в продольном направлении, когда необходимо согласование с кривизной просвета поддерживаемого трубчатого органа. Каждая из цилиндрических трубчатых частей 12 сформирована в виде сети из удлиненных продольных элементов 18, которые соединены друг с другом упругими подвесками 20 и окружными поперечными элементами 22. Во время расширения медицинского устройства 10 упругие подвески 20 деформируются, тогда как продольные элементы 18 не деформируются. Дополнительные подробности одного примера расширяемого медицинского устройства описаны в патенте США № 6241762, который приведен здесь для сведения.
Как иллюстрировано на фиг.1, удлиненные продольные элементы 18 и окружные поперечные элементы 22 включают отверстия 30, некоторые из каковых включают благотворно действующее средство для доставки в просвет трубчатого органа, в который имплантировано расширяемое медицинское устройство. В дополнение, другие части устройства 10, такие как мостиковые элементы 14, могут включать отверстия, как обсуждается ниже в отношении фиг.5. Предпочтительно, отверстия 30 сформированы в недеформируемых частях устройства 10, таких как продольные элементы 18, так, чтобы отверстия не деформировались и благотворно действующее средство доставлялось без опасности разрушения, вытеснения или иным образом повреждения во время расширения устройства. Дополнительное описание одного примера способа, каковым благотворно действующее средство может быть помещено внутри отверстий 30, приведено в патентной заявке США с серийным № 09/948987, поданной 7 сентября 2001 года, которая приведена здесь для сведения.
Примерные варианты осуществления настоящего изобретения могут быть дополнительно усовершенствованы с использованием анализа методом конечных элементов и других способов, для оптимизации размещения благотворно действующих средств внутри отверстий 30. По существу, форма и местоположение отверстий 30 могут быть модифицированы для максимизации объема полостей, в то же время с сохранением относительно высокой прочности и жесткости продольных и поперечных элементов в отношении упругих подвесок 20. Согласно одному предпочтительному примерному варианту осуществления настоящего изобретения отверстия имеют площадь по меньшей мере 5×10-6 квадратных дюймов (3,22×10-3 мм2) и предпочтительно по меньшей мере 7×10-6 квадратных дюймов (4,5×10-3 мм2). Обычно объем заполнения отверстий благотворно действующим средством варьирует от приблизительно пятидесяти процентов до приблизительно девяносто пяти процентов объема отверстия.
Определения
Предполагается, что термины «средство», «терапевтический препарат» или «благотворно действующее средство» интерпретируются максимально широко и используются так, что включают любое терапевтическое средство или лекарственный препарат, а также неактивные агенты, такие как барьерные слои, слои носителя, слои терапевтического препарата или защитные слои.
Термины «лекарственный препарат» и «терапевтическое средство» употребляются взаимозаменяемо для обозначения любой терапевтически активной субстанции, которая доставляется в просвет трубчатого органа в теле живого организма, для оказания желательного, обычно благотворного, действия. Благотворно действующие средства могут включать один или более лекарственных препаратов или терапевтических средств.
Настоящее изобретение используется для доставки антинеопластических препаратов, антиангиогенных препаратов, ангиогенных факторов, противовоспалительных средств, иммуносупрессантов, таких как рапамицин, противорестенозных препаратов, антитромбоцитарных средств, вазодилататоров, антитромботических препаратов, антипролиферативных средств, например таких, как паклитаксель, и антитромбинов, например таких, как гепарин.
Термин «эрозия» означает процесс, в ходе которого компоненты среды или матрицы претерпевают саморассасывание, и/или деградацию, и/или разложение в результате химических, или физических, или ферментативных процессов. Например, в случае биоразлагаемых полимерных матриц эрозия может происходить за счет расщепления или гидролиза полимерных цепей, тем самым повышая растворимость матрицы и суспендированных благотворно действующих средств.
Термин «скорость эрозии» представляет собой время, затрачиваемое на протекание процесса эрозии, обычно выражаемую в единицах площади на единицу времени.
Термины «матрица» или «саморассасывающаяся матрица» используются взаимозаменяемо для обозначения среды или материала, которые при имплантации субъекту не вызывают нежелательного отклика, достаточного для отторжения матрицы. Сама матрица обычно не обусловливает никакого терапевтического отклика, хотя матрица может содержать или заключать в себе благотворно действующее средство, как определено здесь. Матрица также представляет собой среду, которая может просто обеспечивать поддержку, структурную целостность или структурные барьеры. Матрица может быть полимерной, неполимерной, гидрофобной, гидрофильной, липофильной, амфифильной и тому подобной. В дополнение, понятие «саморассасывающаяся матрица» также следует понимать как означающее полное поглощение матрицы организмом с течением времени.
Термин «отверстия» включает как сквозные отверстия, так и углубления.
Термин «фармацевтически приемлемый» имеет отношение к такой характеристике, как нетоксичность для реципиента или пациента, и пригодности для поддержания устойчивости благотворно действующего средства, и обеспечению возможности доставки благотворно действующего средства к целевым клеткам или ткани.
Термин «полимер» имеет отношение к молекулам, образованным путем химического объединения двух или более повторяющихся структурных единиц, называемых мономерами. Соответственно этому в пределы термина «полимер» могут входить, например, димеры, тримеры и олигомеры. Полимер может быть синтетическим, природного происхождения или полусинтетическим. В предпочтительной форме термин «полимер» имеет отношение к молекулам, которые обычно имеют молекулярную массу (Mw) больше приблизительно 3000, и предпочтительно больше приблизительно 10000, и молекулярную массу (Mw) меньше приблизительно 10 миллионов, предпочтительно меньше приблизительно миллиона и более предпочтительно меньше приблизительно 200000. Примеры полимеров включают, но не ограничиваются таковыми, сложные эфиры поли-альфа-гидроксикислот, такие как полимолочная кислота (PLLA или DLPLA), полигликолевая кислота, сополимер молочной и гликолевой кислот (PLGA), сополимер молочной кислоты и капролактона; трехблочные блок-сополимеры этиленоксида, лактида и гликолида (PEO-block-PLGA и PEO-block-PLGA-block-PEO); полиэтиленгликоль и полиэтиленоксид, поли(блок-этиленоксид-блок-пропиленоксид-блок-этиленоксид); поливинилпирролидон; полиортоэфиры; полисахариды и производные полисахаридов, такие как полигиалуроновая кислота, полиглюкоза, альгиновые кислоты, хитин, хитозан, производные хитозана, целлюлоза, метилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, циклодекстрины и замещенные циклодекстрины, такие как сульфобутиловые простые эфиры бета-циклодекстрина; полипептиды и белки, такие как полилизин, полиглутаминовая кислота, альбумин; полиангидриды; полигидроксиалканоаты, такие как полигидроксивалерат, полигидроксибутират и тому подобные.
Термин «первоначально» в отношении целенаправленной доставки обозначает количество, больше приблизительно пятидесяти процентов от общего количества терапевтического средства, при условии, что кровеносный сосуд является основным направлением доставки.
Разнообразные примерные варианты осуществления настоящего изобретения, описанные здесь, предусматривают размещение различных благотворно действующих средств в различных отверстиях в расширяемом устройстве или благотворно действующего средства в некоторых отверстиях, но не в других таковых. Конкретная структура расширяемого медицинского устройства может варьировать без выхода за пределы смысла изобретения. Поскольку каждое отверстие заполняют независимо, благотворно действующее средство в каждом отверстии может иметь индивидуальный химический состав и фармакокинетическую характеристику.
Один пример применения различных благотворно действующих средств в различных отверстиях в расширяемом медицинском устройстве или размещения благотворно действующих средств в некоторых отверстиях и отсутствия таковых в других отверстиях состоит в разрешении проблемы краевого рестеноза. Как обсуждалось выше, современное поколение покрытых стентов может быть сопряжено с трудностями в отношении краевого рестеноза или рестеноза, возникающего непосредственно за кромками стента и прогрессирующего вокруг стента и внутрь самого люминального пространства.
Причины краевого рестеноза в стентах первого поколения для доставки лекарственных средств до сих пор остаются не вполне понятными. Может быть так, что область повреждения ткани вследствие ангиопластики и/или имплантации стента распространяется за пределы диффузионного диапазона современного поколения благотворно действующих средств, таких как паклитаксель, который склонен к интенсивному распределению в ткани. Подобное явление наблюдалось в случаях радиационной терапии, в которых малые дозы радиации на кромках стента проявляли стимулирующее действие при наличии повреждения. В этом случае проблема разрешалась облучением по большей длине, чтобы облучению подвергалась неповрежденная ткань. В случае стентов для доставки лекарственных средств размещение увеличенных доз или более высоких концентраций благотворно действующих средств вдоль кромок стента, помещение различных препаратов на кромках стента, которые более легко диффундируют через ткань, или размещение различных благотворно действующих средств или комбинаций благотворно действующих средств на кромках устройства может способствовать устранению проблемы краевого рестеноза.
Фиг.1 иллюстрирует расширяемое медицинское устройство 10 с «горячими концами» или благотворно действующим средством, размещенным в отверстиях 30а на концах устройства, чтобы оказывать воздействие и сокращать краевой рестеноз. Остальные отверстия 30b в центральной части устройства могут быть пустыми (как показано) или могут содержать благотворно действующее средство с более низкой концентрацией.
Другие механизмы краевого рестеноза могут включать цитотоксичность конкретных лекарственных препаратов или комбинаций лекарственных средств. Такие механизмы могли бы включать физическое или механическое сокращение ткани подобно таковому, наблюдаемому при образовании рубцов эпидермальной ткани, и стент мог бы предотвращать сократительный отклик внутри его собственных границ, но не за пределами его кромок. Далее, механизм этой последней формы рестеноза может иметь отношение к остаточным явлениям продолжительной или локальной доставки лекарственного средства к артериальной стенке, которое сказывается даже после того, как само лекарственное средство уже перестает находиться на стенке. То есть рестеноз может представлять собой отклик на форму токсического повреждения, обусловленного лекарственным препаратом и/или носителем лекарственного средства. В этой ситуации могло бы быть полезным исключение определенных средств с кромок устройства.
Фиг.2 иллюстрирует альтернативный примерный вариант осуществления расширяемого медицинского устройства 200, имеющего множество отверстий 230, в котором отверстия 230b в центральной части устройства заполнены благотворно действующим средством и отверстия 230а на кромках устройства оставлены пустыми. Устройство на фиг.2 называется как имеющее «холодные концы».
В дополнение к применению для сокращения краевого рестеноза, расширяемое медицинское устройство 200 на фиг.2 может быть использовано в сочетании с расширяемым медицинским устройством 10 на фиг.1 или другим стентом для доставки лекарственных средств, когда первоначальная процедура стентирования должна быть дополнена введением дополнительного стента. Например, в некоторых случаях устройство 10 из фиг.1 с «горячими концами» или устройство с равномерным распределением лекарственного средства может быть имплантировано неправильно. Если лечащий врач определяет, что устройство не покрывает достаточной части просвета трубчатого органа, с одного конца существующего устройства может быть введено дополнительное устройство с небольшим перекрыванием существующего устройства. Когда дополнительное устройство имплантируют, устройство 200 из фиг.2 используют так, чтобы «холодные концы» медицинского устройства 200 предотвращали двойное дозирование благотворно действующего средства на участке перекрывания устройств 10, 200.
Фиг.3 иллюстрирует дополнительный альтернативный примерный вариант осуществления изобретения, в котором в различных отверстиях расширяемого медицинского устройства 300 размещены различные благотворно действующие средства. Первое благотворно действующее средство помещено в отверстия 330а на концах устройства, и второе благотворно действующее средство расположено в отверстиях 330b в центральной части устройства. Благотворно действующее средство может содержать различные лекарственные препараты, одни и те же лекарственные препараты в различных концентрациях, или различные вариации одного и того же лекарственного препарата. Примерный вариант осуществления согласно фиг.3 может быть использован для оснащения расширяемого медицинского устройства 300 либо «горячими концами», либо «холодными концами».
Предпочтительно, каждая концевая часть устройства 300, которая включает отверстия 330а, содержащие первое благотворно действующее средство, охватывает по меньшей мере одно отверстие и вплоть до приблизительно пятнадцати отверстий от кромки. Это расстояние соответствует длине примерно от приблизительно 0,005 до приблизительно 0,1 дюйма (0,127-2,54 мм) от кромки нерасширенного устройства. Расстояние от кромки устройства 300, которое включает первое благотворно действующее средство, предпочтительно составляет примерно одну секцию, где секция определяется дистанцией между мостиковыми элементами.
Различные благотворно действующие средства, включающие различные лекарственные препараты, могут быть размещены в различных отверстиях в стенте. Это обеспечивает возможность доставки двух или более благотворно действующих средств с одиночного стента с любым желательным профилем доставки. Альтернативно, различные благотворно действующие средства, включающие один и тот же лекарственный препарат с различными концентрациями, могут быть размещены в различных отв