Фармакодинамические маркеры, индуцированные интерфероном альфа
Иллюстрации
Показать всеИзобретение относится к иммунологии. Предложены варианты применения вариантов набора генов (фармакодинамических (ФД) маркеров) с повышенной регуляцией экспрессии или действия, индуцируемых интерфероном альфа (ИФНα). Описаны варианты способа идентификации пациентов для получения MEDI-545 по обнаружению таких профилей экспрессии ИФНα-индуцируемых ФД маркеров. Использование изобретения обеспечивает распознавание тех пациентов, для которых лечение нейтрализующим антителом MEDI-545 может быть действительно эффективным, что может найти применение в медицине. 7 н. и 3 з.п. ф.-лы, 90 ил., 33 табл., 22 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармакодинамическим (ФД) маркерам, индуцируемым интерфероном альфа (ИФНα), зондам и наборам, которые выявляют ФД маркеры, а также к способам их применения.
Предпосылки создания изобретения
Настоящее изобретение включает ФД маркеры, индуцируемые ИФНα. ФД маркеры могут применяться в способах лечения пациентов терапевтическим агентом, который связывает и модулирует действие ИФНα, способах идентификации пациентов в качестве кандидатов для применения терапевтического агента, который связывает и модулирует действие ИФНα, способах диагностирования у пациента расстройства, связанного с повышенными уровнями ИФНα, способах мониторинга прогрессирования заболевания у пациента, получающего лечение терапевтическим агентом, который связывает и модулирует действие ИФНα, и способах идентификации перспективных лекарственных средств для лечения ИФНα-опосредованных расстройств.
Краткое описание изобретения
В одном из вариантов осуществления настоящего изобретения описан способ идентификации пациента в качестве кандидата для лечения терапевтическим агентом, который связывает и модулирует действие ИФНα. В образце, взятом у пациента, выявляют наличие или отсутствие профиля экспрессии ИФНα-индуцируемых ФД маркеров.
В другом варианте осуществления настоящего изобретения описан способ лечения пациента с заболеванием или расстройством, опосредованным ИФН первого типа (ИФН I типа) или ИФНα. Агент, который связывает и модулирует действие ИФН I типа или ИФНα, вводят пациенту. Агент нейтрализует у пациента профиль экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα.
В еще одном из вариантов осуществления настоящего изобретения описан способ лечения аутоиммунного заболевания пациента, у которого проявляется умеренный или выраженный ИФН I типа или ИФНα ФД маркерный профиль. Агент, который связывает и модулирует действие ИФН I типа или ИФНα, вводят пациенту. Агент нейтрализует у пациента профиль экспрессии ФД маркеров, индуцируемных ИФН I типа или ИФНα.
Еще один вариант осуществления настоящего изобретения относится к способу нейтрализации у пациента, нуждающегося в этом, профиля экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα. Агент, который при введении пациенту связывает и нейтрализует действие ИФН I типа или ИФНα, вводят пациенту. Агент нейтрализует у пациента профиль экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα.
В другом варианте осуществления настоящего изобретения описан способ диагностики у пациента расстройства, связанного с повышенными уровнями ИФНα. Наличие или отсутствие профиля экспрессии ФД маркеров, индуцируемых ИФНα, устанавливают в образце, взятом у пациента.
В еще одном из вариантов осуществления настоящего изобретения описан способ мониторинга прогрессирования заболевания у пациента, которого лечат терапевтическим агентом, связывающим и модулирующим действие ИФНα. Первый профиль экспрессии ФД маркеров, индуцируемых ИФНα, получают в первом образце, взятом у пациента. Терапевтический агент, который связывает и модулирует действие ИФНα, вводят пациенту. Второй профиль экспрессии ФД маркеров, индуцируемых ИФНα, получают во втором образце, взятом у пациента. Сравнивают первый и второй профили экспрессии ФД маркеров, индуцируемых ИФНα.
В еще одном из вариантов осуществления настоящего изобретения описан способ идентификации перспективного терапевтического средства для лечения ИФНα-опосредованных расстройств. Клетки, включающие профиль экспрессии ФД маркеров, индуцируемых ИФНα, приводят в соприкосновение с агентом. Выявляют в клетках наличие или отсутствие изменения в профиле экспрессии ФД маркеров, индуцируемых ИФНα.
Другой вариант осуществления настоящего изобретения включает набор зондов.
Еще один вариант осуществления настоящего изобретения включает набор, содержащий зонды.
В еще одном из вариантов осуществления настоящего изобретения описан способ выявления действия ИФН в образце. Клетки, включающие полинуклеотидную последовательность, представляющую репортерный ген под контролем ИФН-стимулирующего ответ элемента, инкубируют с образцом. Выявляют экспрессию репортерного гена.
Краткое описание фигур
Фиг.1. Анализ методом количественной ПЦР TaqMan экспрессии гена IFI44 в цельной крови здоровых доноров, простимулированной ИФНα.
Фиг.2. Анализ методом количественной ПЦР TaqMan экспрессии гена IRF2 в цельной крови здоровых доноров, простимулированной ИФНα.
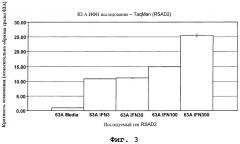
Фиг.3. Анализ методом количественной ПЦР TaqMan экспрессии гена RSAD2 в цельной крови здоровых доноров, простимулированной ИФНα.
Фиг.4. Анализ методом количественной ПЦР TaqMan экспрессии гена G1P3 в цельной крови здоровых доноров, простимулированной ИФНα.
Фиг.5. Анализ методом количественной ПЦР TaqMan экспрессии гена HERC5 в цельной крови здоровых доноров, простимулированной ИФНα.
Фиг.6. Нейтрализация продуктом MEDI-545 экспрессии гена RAB8B, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.7. Нейтрализация продуктом MEDI-545 экспрессии гена IRF7, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.8. Нейтрализация продуктом MEDI-545 экспрессии гена MARCKS, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.9. Нейтрализация продуктом MEDI-545 экспрессии гена IL6ST, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.10. Нейтрализация продуктом MEDI-545 экспрессии гена Ly6E, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.11. Нейтрализация продуктом MEDI-545 экспрессии гена IFIT3, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.12. Нейтрализация продуктом MEDI-545 экспрессии гена IFIT1, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.13. Нейтрализация продуктом MEDI-545 экспрессии гена HERC5, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.14. Нейтрализация продуктом MEDI-545 экспрессии гена OAS1, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.15. Нейтрализация продуктом MEDI-545 экспрессии гена OAS3, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.16. Нейтрализация продуктом MEDI-545 экспрессии гена RSAD2, индуцированной ИФН-α, в цельной крови здоровых доноров.
Фиг.17. Стимуляция ex vivo цельной крови идентифицирует гены, индуцируемые ИФН типа I.
Фиг.18. Нейтрализация продуктом MEDI-545 25 генов, наиболее индуцируемых ИФН I типа, в цельной крови отдельных пациентов с волчанкой.
Фиг.19. Heatmap целевой модуляции и схема анализа главных компонентов (АГК) с применением индуцируемых ИФН I типа зондов, обдающих самой повышенной регуляцией в цельной крови пациента 1541 до и после лечения антителом MEDI-545.
Фиг.20. Heatmap целевой модуляции и схема анализа главных компонентов (АГК), основанные на 25 генах, индуцируемых ИФН I типа, с наиболее повышенной регуляцией в цельной крови пациента 1449 до и после применения антитела MEDI-545.
Фиг.21. Heatmap целевой модуляции по расчетам 165 генов, индуцируемых ИФН I типа, с повышенной регуляцией в цельной крови пациента, обработанного 0,3 мг/кг антитела MEDI-545.
Фиг.22. Анализ главных компонентов (АГК) с применением 169 зондов устанавливает, что 24/35 больных с СКВ, индуцируемой ИФН I типа, обладают статистически значимой формой колебаний ИФН I типа в цельной крови.
Фиг.23. Антитело MEDI-545 нейтрализует 25 индуцируемых ИФН I типа зондов с наиболее повышенной регуляцией у пациентов с волчанкой. Целевую нейтрализацию 25 ФД маркеров, индуцируемых ИФН I типа, с самой повышенной регуляцией генов измеряют на 1, 4, 7, 14 и 28 сутки для каждого пациента. Дозы находятся в диапазоне от 0 (плацебо) до 3 мг/кг MEDI-545.
Фиг.24. Антитело MEDI-545 нейтрализует 25 индуцируемых ИФН I типа зондов с самой повышенной регуляцией у пациентов с волчанкой. Целевую нейтрализацию топовых 25 ФД маркеров, индуцируемых ИФН I типа, с самой повышенной регуляцией генов измеряют на 1, 4, 7, 14 и 28 сутки для каждого пациента. Дозы находятся в диапазоне от 0 (плацебо) до 30 мг/кг MEDI-545.
Фиг.25а и б. Heatmap (а) и АГК (б), показывающие нейтрализацию топовых 25 зондов, индуцируемых ИФН I типа, в цельной крови пациента с СКВ, которому вводили 30 мг/кг MEDI-545 на 0, 1, 4, 7 и 14 сутки после дозирования.
Фиг.26а и б. АГК график пациентов с волчанкой до (а) и после (б) дозирования контроля плацебо показывают, что нет тенденции к изменению генной кривой, индуцируемой ИФН I типа. 25 наборов генных зондов, индуцируемых ИФН I типа, с самой повышенной регуляцией используют для проведения анализа АГК.
Фиг.27. Повышена регуляция подтипов ИФНα I типа в цельной крови отдельных пациентов с волчанкой.
Фиг.28. Распределение стандартного кратного изменения топовых 25 зондов, индуцируемых ИФН I типа, в цельной крови отдельных пациентов с волчанкой.
Фиг.29а-в. В тесте попарного ранжирования кратности изменения установили, что антитело MEDI-545 нейтрализует гены ИФН I типа в клиническом исследовании. Самые нейтрализованные гены показаны для (а) пациентов СКВ с характеристикой гена ИФН I типа на 14 сутки после применения антитела MEDI-545; (б) пациенты с СКВ, не имеющие признака гена ИФН I типа через 14 суток после применения антитела MEDI-545; и (в) пациенты с СКВ на 14 сутки после применения плацебо. Отмеченные желтым цветом признаки генов ИФН I типа определены в качестве имеющих.
Фиг.30. Иерархическое кластерирование 1384 зондов показывает, что они по-разному регулируются ИФНα подтипами, ИФНβ, ИФНγ и ФНОα в простимулированной ex vivo цельной крови. Каждая линия соответствует одному набору зондов, а каждая колонка соответствует отдельному образцу. Длины разветвлений показывают корреляцию, с которой наборы зондов/образцы соединены, причем более длинные ветки показывают более слабую корреляцию. Цвет означает уровень относительной экспрессии отдельных наборов генов по сравнению со стандартной экспрессией контролей, не подвергавшихся воздействию. Красный цвет означает повышенную регуляцию по сравнению с контролем; зеленый цвет означает пониженную регуляцию по сравнению с контролем; черный цвет означает отсутствие изменений.
Фиг.31а-31б. (а). Иерархическое кластерирование относительной экспрессии 25 наборов индуцируемых ИФН I типа генов, которые сверхэкспрессируются в цельной крови ех vivo при исследовании различных ИФНα подтипов, ИФНβ, ИФНγ и ФНОα. (б). Heatmap относительной экспрессии тех же 25 наборов генов по сравнению с контролем без обработки в кератиноцитах ех vivo при исследовании ИФНα2а, ИФНβ, ИФНγ и ФНОα. Красный цвет означает повышенную регуляцию генной экспрессии относительно контроля, не подвергшегося обработке, зеленый цвет означает пониженную регуляцию генной экспрессии относительно контроля, не подвергшегося обработке, черный цвет означает отсутствие существенного изменения в генной экспрессии испытуемых образцов относительно контроля.
Фиг.32а-32в. Сверхэкспрессия распределения стандартного (а) и среднего (б) кратного изменения 25 индуцируемых ИФН I типа зондов установлена в 26 парах образцов поврежденной кожи, сравниваемых с образцами неповрежденной кожи. (в) в результате усреднения стандартного и среднего кратного изменения для 25 индуцируемых ИФН I типа зондов установлена сверхэкспрессия в 26 парах образцов поврежденной кожи и неповрежденной кожи.
Фиг.33а-33г. Относительная экспрессия отдельных индуцируемых ИФН I типа генов ((a) HPSE, (б) OASL и (в) HERC6) и генов, не индуцируемых ИФН ((г) SERPINB4), на поврежденной коже по сравнению с неповрежденной кожей и неповрежденной коже по сравнению с нормальной кожей у больных псориазом на основании данных по микроматрицам. Кратное изменение этих генов в поврежденной коже сравнивают с генами парного образца неповрежденной кожи, хотя неповрежденную кожу сравнивают со стандартом 21 контроля нормальной кожи. Величина j9 для HPSE, OASL, HERC6 и SERPINB4 представляет сравнение между нормальной кожей и неповрежденной кожей, между поврежденной кожей и нормальной кожей (представлены парами): 0,468, <0,00001; 0,376, <0,00001; 0,03, <0,00001; 0,0002, <0,00001.
Фиг.34а-34б. (а) Иерархическое кластерирование всех профилированных от больных псориазом (21 нормальный (синий линии) 26 парных образцов неповрежденной кожи (черные линии) и поврежденной кожи (красные линии) от 24 больных псориазом и 3 образцов поврежденной кожи (красные линии) от 3 больных псориазом, у которых парные образцы неповрежденной кожи не дают достаточного количества кРНК для гибридизации или сканируемого выравнивания, имеют коэффициенты масштабирования, которые более чем в три раза превышают стандарт), используя 164 индуцируемых ИФН I типа наборов генов с повышенной регуляцией в поврежденной коже по сравнению с данными у большей части неповрежденной кожи. Каждая линия соответствует одному набору зондов, причем каждая колонка соответствует одному образцу. Длины разветвлений показывают степень корреляции, с которой образцы соединены, причем более длинные ответвления показывают более слабую корреляцию. Цвет означает уровень относительной экспрессии отдельных наборов генов по сравнению со стандартной экспрессией 21 нормального образца. Красный цвет означает повышенную регуляцию по сравнению с контролем; зеленый цвет означает пониженную регуляцию по сравнению с контролем, (б) АГК всех образцов больных псориазом профилированных по 164 повышенной регуляции ИФН I типа-индуцируемых зондов, установленных в поврежденной коже по сравнению с данными у большинства парных образцов неповрежденной кожи. (АГК подсчитывают и данные визуализируют в продукте компании Spotfire). Каждый кружок представляет один образец (синие кружки=нормальная кожа; черные кружки=кожа без повреждений; красные кружки=поврежденная кожа).
Фиг.35. Сверхэкспрессия выбранных индуцируемых ИФН I типа генов в 18 парах поврежденной и неповрежденной кожи от 18 больных псориазом, основыванная на анализе taqMan кРВ-ПЦР, используя BioMark™ 48.48 динамическую систему фирмы Fluidigm.
Фиг.36а-36б. Корреляция коэффициента распределения сверхэкспрессированных генов в кожных повреждениях пациентов с псориазом между результатами taqMan и результатами выравнивания. Гены группируют, основываясь на коэффициенте корреляции между результатом количественной РВ-ПЦР TaqMan и измерений по микроматрицам, (а) корреляция коэффициента распределения всех 40 генов с повышенной регуляцией в кожных повреждениях, которые подтверждаются с помощью количественной РВ-ПЦР TaqMan; (б) корреляция коэффициента распределения 29 индуцируемых ИФН-генов.
Фиг.37а-37г. Сравнение taqMan кРВ-ПЦР анализа, используя BioMark™ 48.48 динамическую систему и результаты генного чипа Affymetrix® для выбранных генов ISG15 и МХ1, индуцируемых ИФН I типа.
Фиг.38. Подтверждение с помощью TaqMan кРВ-ПЦР результатов сверхэкспрессии генов IFI27 и CXCL10, индуцируемых ИФН I типа, полученных с помощью генного чипа Affymetrix®.
Фиг.39а-39е. Стимулирование ex vivo нормальных кератиноцитов лейкоцитарным ИФН и ИФНα2а и доза-зависимая нейтрализация индуцируемых ИФН I типа генов с помощью ИФНα антитела, (а) нейтрализация сверхэкспрессии гена ISG15 в ответ на 350 МЕд/мл ИФНα2а, (б) нейтрализация сверхэкспрессии гена ISG15 в ответ на 150 МЕд/мл лейкоцитарного ИФН, (в) нейтрализация сверхэкспрессии гена USP18 в ответ на 350 МЕд/мл ИФНα2а, (г) нейтрализация сверхэкспрессии гена USP18 в ответ на 150 МЕд/мл лейкоцитарного ИФН, (д) нейтрализация сверхэкспрессии гена IFIT2 в ответ на 350 МЕд/мл ИФНα2а, и (е) нейтрализация сверхэкспрессии гена IFIT2 в ответ на 150 МЕд/мл лейкоцитарного ИФН. Кривую титрования каждой дозы получают по результатам трех повторов. Сверхэкспрессию отдельных генов без ИФНα антитела нормализуют до 1.
Фиг.40а-40в. Относительная экспрессия и РНК и средние кратные изменения ИФН I типа α подтипов (фиг.40а), других представителей интерферонов типа I (фиг.40б), и ИФНα рецепторов (фиг.40в) в кожных повреждениях (КП) или в коже без повреждений (КБП) по сравнению с кожей здорового нормального контрольного субъекта (ЗНК). Стандартные и относительные уровни иРНК указанных цитокинов и их рецепторов в нормальной коже двух здоровых доноров были масштабированы до 1, основываясь на исследованиях taqMan кВР-ПЦР, используя матричные карты TaqMan низкой плотности (TaqMan low density - TLDA) от фирмы Applied Biosciences. Красный цвет: относительное кратное изменение иРНК в неповрежденной коже по сравнению с нормальной кожей; красный цвет: относительное кратное изменение иРНК в поврежденной коже по сравнению с неповрежденной кожей. Величины p для сверхэкспрессии указанных отдельных генов в неповрежденной коже или в поврежденной коже по сравнению со здоровой нормальной кожей (перечислены попарно) следующие: ИФНα1, 0,303, <0,001; ИФНα2, 0,389, 0,072; ИФНα5, <0,001, 0,002; ИФНα6, 0,664, 0,093; ИФНα7, 0,586, 0,077; ИФНα8, 0,430, 0,049; ИФНα14, 0,224, 0,049; ИФНα17, 0,552, 0,0203; ИФНα21, 0,113, 0,003; ИФНβ, 0,255, 0,022; ИФНк, 0,03, <0,001; ИФНω, 0,516, 0,049; ИФНAR1, 0,192, <0,001; ИФНAR2, <0,001, <0,001, соответвенно.
Фиг.41. Относительная экспрессия иРНК и средние кратные изменения рецепторов ИФНγ, ФНОα и ИФНγ в поврежденной коже (ПК) или неповрежденной коже (НК) по сравнению с кожей от здоровых нормальных контролей (ЗНК). Средние величины относительных уровней иРНК цитокинов и их рецепторов в нормальной коже двух здоровых доноров были масштабированы до 1, основываясь на исследованиях taqMan кВР-ПЦР, используя TLDA от фирмы Applied Biosciences. Черный цвет: относительное кратное изменение иРНК в неповрежденной коже по сравнению с нормальной кожей; красный цвет: относительное кратное изменение иРНК в поврежденной коже по сравнению с нормальной кожей. Величины p по экспрессии отдельных генов в неповрежденной коже или в поврежденной коже по сравнению с нормальной здоровой кожей (представлены попарно) следующие: ИФНγ, 0,02, <0,001; ИФНGR1, <0,001, <0,001; ИФНGR2, <0,001, <0,001; ФНОα, <0,001, <0,001, соответственно.
Фиг.42. Диаграмма Венна, иллюстрирующая и число наборов зондов, которые изменены под действием ИФН I типа, ИФНγ и ФНОα во время стимуляции ex vivo, и наборы зондов, которые изменены в поврежденной коже по сравнению с неповрежденной кожей. Красные номера: наборы зондов, которые показывают повышенную экспрессию при обработке цитокином, или сравнения с исходным уровнем неповрежденной кожи; зеленые номера: наборы зондов, которые показывают пониженную экспрессию при обработке цитокином или сравнении с исходным уровнем неповрежденной кожи. Пресекающиеся области представляют наборы зондов, которые являются общими для обоих сравнений.
Фиг.43а и 43б. Совместная экспрессия генов, индуцируемых ИФН I типа, тип-II ИФН и ФНО, в поврежденной/неповрежденной коже пациентов с псориазом, основанная на результатах генного чипа Affymetrix genechip®. ИФН I типа, тип-II ИФН и ФНОα индуцируемые гены были отобраны, основываясь на экспериментах по стимулированию ех vivo (примеры 10 и 16). Набор зондов по меньшей мере с двухкратным изменением в поврежденной коже относительно неповрежденной расценивается в качестве сверхэкспрессируемого. (а) число ИФН I типа, ИФНα и ФНОα индуцируемых генов с повышенной регуляцией в поврежденной коже показывает строгую корреляцию. (б) число ИФН I типа, ИФНα и ФНОα индуцируемых генов в поврежденной коже существенно отличается при попарных сопоставлениях.
Фиг.44. Иммуногистохимический анализ образцов биопсии из кожи больных псориазом, неповрежденной кожи и кожи здоровых доноров. BDCA2 является специфическим маркером для клеточных инфильтратов pDC, которые содержатся в большем количестве в поврежденной коже по сравнению с неповрежденной кожей и полностью отсутствуют в нормальной коже. CD83 является маркером для mDC, CD4 присутствует на Т-клетках и дентритных клетках. Окрашивание белка STAT1 наблюдают в эпидермисе поврежденной кожи (и в ядре, и в цитоплазме) и в кожных одноядерных воспалительных клетках, но не в коже без повреждений и не в здоровой коже. Повышение белка ISG15 наблюдают в коже при псориазе и в меньшей степени в коже без повреждений, но не выявляют в здоровой коже.
Фиг.45. Диаграмма Венна, иллюстрирующая число наборов зондов, которые показывают измененную экспрессию на уровне иРНК в поврежденной коже по сравнению с неповрежденной кожей или в неповрежденной коже по сравнению с нормальной кожей у больных псориазом. Величины, заштрихованные красным, означают число наборов зондов с существенно повышенной регуляцией, хотя такие величины, заштрихованные зеленым цветом, означают число наборов зондов с существенно пониженной регуляцией. Перекрывающаяся область представляет наборы зондов, общие для обоих сопоставлений.
Фиг.46. Графическое представление сигнального метаболического пути ИФН, который активируется в поврежденной коже больных псориазом. Визуализацию метаболического пути получают с помощью интегрального программного обеспечения GeneGo′s MetaCore. Отдельные символы означают хорошо описанные белки или белковые комплексы. Стрелки, связывающие белки, представляют стимулирующее, ингибирующее или взаимодействующее действие белка на белок-мишень. Термометры, находящиеся рядом с отдельными символами, представляют относительные уровни экспрессии (красный цвет означает сверхэкспрессию, зеленый цвет означает пониженную экспрессию) транскриптов, которые включают белок (или белковый комплекс) в определенном метаболическом пути.
Фиг.47а и 47б. Таблица представляет кратное изменение (fold change - fc; log2 преобразование) и величину q (рассчитанную по FDR) топовых 100 наборов генов с повышенной регуляцией в поврежденной коже по сравнению с непроврежденной кожей при псориазе. Также перечисленными являются log2 трансформированные кратные изменения и величины q этих генов при сравнении неповрежденной кожи со здоровой нормальной кожей контролей. ИФН I типа индуцированные гены выделены жирным шрифтом.
Фиг.48. Специфическое отделение поврежденной кожи от неповрежденной кожи и нормальной кожи - иерархическое кластерирование всех образцов, используя профили транскрипции всех генов на матрице целого генома (Affymetrix целый геном U133 plus v2.0 матрица).
Фиг.49. Набор зондов, идентифицированных в качестве индуцируемых ИФНα, по перекрыванию на фиг.42.
Фиг.50. Набор зондов, идентифицированных в качестве индуцируемых ИФНα, по перекрыванию на фиг.42.
Фиг.51. Набор зондов, идентифицированных в качестве индуцируемых ИФН I типа, по перекрыванию на фиг.42.
Фиг.52. Иммуногистохимический анализ биопсийных образцов из кожных повреждений пациентов с СКВ, обработанных плацебо, для обнаружения pDC, mDC и Т-клеточных инфильтратов.
Фиг.53. Иммуногистохимический анализ биопсийных образцов из кожных повреждений пациентов с СКВ, обработанных плацебо, для обнаружения HERC5, ISG15 и IP10 белков, белков, экспрессированных с индуцированных ИФН I типа генов.
Фиг.54. Иммуногистохимический анализ биопсийных образцов из кожных повреждений у пациентов с СКВ, обработанных 10 мг/кг MEDI-545, для выявления pDC, mDC и Т-клеточных инфильтратов.
Фиг.55. Иммуногистохимический анализ биопсийных образцов из кожных повреждений пациентов с СКВ, обработанных продуктом MEDI-545 в количестве 10 мг/кг, для обнаружения HERC5, ISG15 и белков IP10, белков, экспрессированных с индуцируемых ИФН I типа генов.
Фиг.56. Иммуногистохимический анализ биопсийных образцов из кожных повреждений пациентов с СКВ, обработанных антителом MEDI-545 в количестве 10 мг/кг, для обнаружения pDC, mDC и Т-клеточных инфильтратов.
Фиг.57. Иммуногистохимический анализ биопсийных образцов из кожных повреждений пациентов с СКВ, обработанных продуктом MEDI-545 в количестве 10 мг/кг, для обнаружения HERC5, ISG15 и белков IP10, белков, экспрессированных с типа индуцируемых ИФН I типа генов.
Фиг.58а и 58б. Heatmap (а) и АГК (б), показывающие нейтрализацию топовых 25 ИФН I типа индуцируемых генов в биопсийном образце кожи пациента с СКВ, обработанного MEDI-545 в количестве 10 мг/кг на 0 сутки и 7 сутки после дозирования.
Фиг.59а-г. Выявление активности ИФН I и II типа в биоисследовании ИФН.
Фиг.60а и 60б. Выявление MEDI-545 (а) и MEDI-546 (б)-опосредованной нейтрализации действия ИФНα в биоисследовании ИФН.
Фиг.61. Выявление анти-ИФНα-опосредованной нейтрализации действия ИФНα в биоисследовании ИФН.
Фиг.62. Выявление анти-ИФНα-опосредованной нейтрализации действия ИФНα в биоисследовании ИФН.
Фиг.63. Выявление анти-ИФНα-опосредованной нейтрализации действия ИФНα в биоисследовании ИФН.
Фиг.64. Heatmap модуляции генной экспрессии в цельной крови здоровых доноров, простимулированных ex vivo ИФНα, ФНОα или ИФНα/β. Отрицательный контроль (ОК).
Фиг.65. Индуцируемые ИФН I типа гены содержатся среди генов с наиболее повышенной регуляцией в цельной крови пациентов с СКВ.
Фиг.66. Регуляция молекул иРНК ИФНγ, ИФНω, ИФНАR1 и ИФНАR2 повышена в цельной крови пациентов с волчанкой.
Фиг.67. Heatmap показывает модулирование экспрессии гена в МКПК здорового донора ех vivo, простимулированную сывороткой пациентов с волчанкой.
Фиг.68а и 68б. (а) График АГК показывает пациентов с волчанкой, у которых имеется сильный/умеренный индуцируемый ИФН I типа показатель (примерно 66% в данной выборке) собрана вместе. (б) Таблица показывает 25 генов, использованных для анализа АГК.
Фиг.69. Подтверждение сверхэкспрессии отдельных индуцируемых ИФН I типа генов у пациентов с волчанкой, основанное на исследованиях taqMan KPB-ПЦР (количественная реального времени полимеразная цепная реакция), используя BioMark™ 48.48 динамический массив фирмы Fluidigm (массив с переменными границами).
Фиг.70а и 70б. (а) Способность четырех разных образцов сыворотки пациентов с СКВ индуцировать действие ИФН I типа в исследовании репортерного гена. (б) Число транскриптов, индуцированных по меньшей мере трехкратно в МКПК здорового человека каждым из четырех разных образцов сыворотки пациентов с СКВ после совместного инкубирования на протяжении 4 ч.
Фиг.71a и 716. Большинство генов, нейтрализованных воздействием анти-ИФНα антителом через 4 ч после совместного инкубирования сыворотки пациента с СКВ и МКПК здорового человека, является ИФН I типа генами, хотя большинство генов, нейтрализованных анти-ИФНα антителом через 18 ч после совместного инкубирования сыворотки пациента с СКВ и МКПК здорового человека, не является ИФН I типа генами, что было показано (а) анализом heatmap и представлено (б) в виде гистограмм.
Фиг.72а и 71б. Представлены (а) ИФН I типа гены и (б) гены, не относящиеся к ИФН I типа генам, регуляция которых была повышена и нейтрализована анти-ИФНα антителом 18 ч после совместного инкубирования сыворотки пациента с СКВ и МКПК здорового человека, но регуляция которых не была повышена после 4 ч совместного инкубирования сыворотки пациента с СКВ и МКПК здорового человека.
Фиг.73. Представлены метаболические пути и клеточные процессы, нейтрализованные анти-ИФНα антителом 18 ч после совместного инкубирования сыворотки пациента с СКВ и МКПК здорового человека.
Фиг.74а и 74б. Выявление (а) повышенных и (б) пониженных уровней специфических белков в сыворотке пациентов с волчанкой.
Фиг.75. Анализ QuantiGenePlex 1.0 ИФН-индуцируемых генных подписей в цельной крови 5 здоровых доноров, простимулированных 20 Ед/мл ИФНα2b.
Фиг.76. Доза-зависимые изменения в генной экспрессии в крови одного здорового донора, после обработки множественными концентрациями ИФНα2b.
Фиг.77. Выявление ИФН-индуцируемых транскриптов в образцах цельной крови субъектов с СКВ, сохраняемых в пробирках PAXgene, с выявляемой и невыявляемой активностью ИФНα в сыворотке.
Фиг.78. Корреляция между QuantiGenePlex и Fluidigm технологиями в образцах цельной крови субъектов с СКВ, сохраняемых в пробирках PAXgene.
Фиг.79. Продольное тестирование образцов СКВ после введения анти-ИФНα моноклонального антитела: сравнение QuantiGenePlex 2.0 и Fluidigm технологий.
Фиг.80. Типичный вариант heatmap, визуализирующий (в убывающем порядке) показатель сверхэкспрессии генов ИФН I типа; показатель сверхэкспрессии гранулоцитов; показатель пониженной экспрессии Т-клеток, показатель пониженной экспрессии NK-клеток и показатель пониженной экспрессии В-клеток в цельной крови 46 больных СКВ (показано красной линией около heatmap) по сравнению с цельной кровью от 24 здоровых доноров (показано синей линией около heatmap) ИФН = интерферон; СКВ = системная красная волчанка.
Фиг.81а-81в. Гены, индуцируемые ИФН I типа, в цельной крови пациентов с СКВ могут применяться для разделения пациентов с СКВ с признаком генов ИФН I типа и здоровых нормальных контролей. (а) Трехмерная диаграмма АГК цельной крови 46 образцов от пациентов с СКВ, используя 114 индуцируемых ИФН I типа зондов, показывает повышенную регуляцию в цельной крови пациентов с СКВ по сравнению с соответствующим показателем от 24 здоровых доноров. (б) Диаграмма АГК цельной крови от 54 пациентов с СКВ в предстоящем исследовании, используя набор 114 индуцируемых ИФН I типа генов с повышенной регуляцией, подтверждает сверхэкспрессию генов ИФН I типа у пациентов с СКВ. (в) График АГК цельной крови от 100 образцов СКВ в настоящем и последующих исследованиях с применением панели из 21 индуцируемого ИФН I типа гена с повышенной регуляцией у пациентов с СКВ по сравнению с 24 здоровыми донорами. Каждая точка представляет один образец (синие точки - здоровые субъекты; красные точки - пациенты с СКВ). ИФН = интерферон; АГК = анализ главных компонент; СКВ = системная красная волчанка.
Фиг.82. Относительная экспрессия молекул иРНК и средние кратные изменения (горизонтальные гистограммы) рецепторов ФНО-α, ИФН-γ и ИФН-γ-рецепторов в цельной крови пациентов с СКВ по сравнению со здоровыми контрольными субъектами (Р<0,05 для всех). Средние величины относительных уровней иРНК указанных цитокинов и их рецепторов в цельной крови 24 здоровых доноров были масштабированы до 1, основываясь на исследованиях taqMan кВР-ПЦР. ИФН = интерферон; КРВ-ПЦР = количественная реального времени транскриптазная полимеразная цепная реакция; СКВ = системная красная волчанка; ФНО = фактор некроза опухоли.
Фиг.83а-83в. TaqMan кРВ-ПЦР подтверждает сверхэкспрессию ИФН I типа - индуцируемых генов в цельной крови пациентов с СКВ. (а) Относительные кратные изменения 15 индуцируемых ИФН I типа генов (в общем обозначаемых 1-15) у пациентов с СКВ сравнивают со здоровыми донорами (p<0,05 для всех). Средние значения относительных уровней иРНК генов в объединенной РНК от 24 здоровых доноров были масштабированы до 1, основываясь на исследованиях taqMan кВР-ПЦР. Горизонтальные линии представляют среднее кратное изменение. (б и в) Оценка TaqMan кРВ-ПЦР сверхэкспрессии панели из 21 гена индуцированных ИФН I типа генов в цельной крови пациентов с СКВ методом определения, применимым для выравнивания целого генома. Относительная сверхэкспрессия 21 гена, индуцируемого ИФН I типа, у двух пациентов с СКВ, показана с помощью методов с применением микрочипа (слева) и TaqMan (справа). Коэффициенты корреляции между TaqMan QRT-PCR и микрочипом составляют 0,9861 и 0,9888 для пациентов Х и Y, соответственно. ИФН = интерферон; КРВ-ПЦР = количественная реального времени обратной транскриптазы полимеразная цепная реакция; СКВ = системная красная волчанка.
Фиг.84. Величина сверхэкспрессии генов ИФН I типа в цельной крови пациентов с СКВ по измерениям средней кратности изменения 25 наиболее сверхэкспрессируемых индуцируемых ИФН I типа генов или по оценке генов ИФН I типа у отдельных пациентов с СКВ. Горизонтальные линии представляют средние величины. Пациентов, у которых оценка показателя генов ИФН I типа ≥10, оценивают в качестве обладающих сильными показателями генов ИФН I типа; пациентов, у которых оценка показателя генов ИФН I составляет 4-10, оценивают в качестве обладающих умеренными показателями генов ИФН I типа; пациентов, у которых оценка показателей генов ИФН I типа ≤4, оценивают в качестве обладающих слабыми показателями ИФН I типа. ИФН = интерферон; СКВ = системная красная волчанка.
Фиг.85а-85в. Разделение 35 пациентов с СКВ на группы с низким (а; зеленый цвет), умеренным (б; серый цвет) и высоким (в; красный цвет) показателем гена ИФН I типа основано на средней кратности изменения по панели из 21 гена индуцируемых ИФН I типа генов. Плотности для каждого пациента с СКВ подсчитывают и изображают графически, используя кратное изменение для каждого из 21 гена от каждого пациента с СКВ по log2 шкале для представления распределения величин кратного изменения 21 гена. Вертикальные пунктирные линии разделяют 3 класса оценок генных подписей: 7 пациентов со слабым проявлением генов ИФН I типа = среднее кратное изменение <1,91 (0,93 по log2 шкале), 8 пациентов с умеренным проявлением генов ИФН I типа = среднее кратное изменение 1,91-5,53 и 20 пациентов с сильным проявлением генов ИФН I = среднее кратное изменение >5,53 (2,47 по log2 шкале). ИФН = интерферон; СКВ = системная красная волчанка.
Фиг.86. Доза-зависимая нейтрализация с помощью антитела MEDI-545 21 индуцируемого ИФН-α/β гена с повышенной регуляцией у пациентов с СКВ.
Фиг.87а и 87б. Heatmap (а) и АГК (б), показывающие нейтрализацию 21 индуцируемого ИФН-α/β гена с повышенной регуляцией в цельной крови пациентов с СКВ, обработанной MEDI-545 в количестве 30 мг/кг (0, 1, 4, 7 и 14 сутки после дозировки).
Фиг.88а и 88б. Диаграммы АГК, полученные с применением 21 индуцируемого ИФН-α/β зонда с повышенной регуляцией, не показывают нейтрализации ИФН подписи у пациентов, обработанных плацебо.
Фиг.89. Нейтрализация 21 индуцируемого ИФН-α/β гена с повышенной регуляцией установлена у пациентов после лечения антителом MEDI-545 в количестве 0,3, 1,0, 3,0, 10,0 и 30,0 мг/кг.
Фиг.90. Методология подсчета нейтрализации мишени для фиг.89.
Подробное описание изобретения
Настоящее изобретение охватывает способы идентификации, диагностики, лечения и мониторинга прогрессирования заболевания у пациентов. К пациентам относятся какие-либо животные с ИФН I типа или ИФНα-индуцируемым заболеванием, расстройством или состоянием. Пациент может иметь заболевание, расстройство или состояние в качестве результата экспериментального исследования, например, это может быть экспериментальная модель, разработанная для заболевания, расстройства или состояния. В другом варианте у пациента может быть заболевание, расстройство или состояние в отсутствие экспериментальной манипуляции. К пациентам относятся люди, мыши, крысы, лошади, свиньи, кошки, собаки и какие-либо другие животные, используемые для исследования.
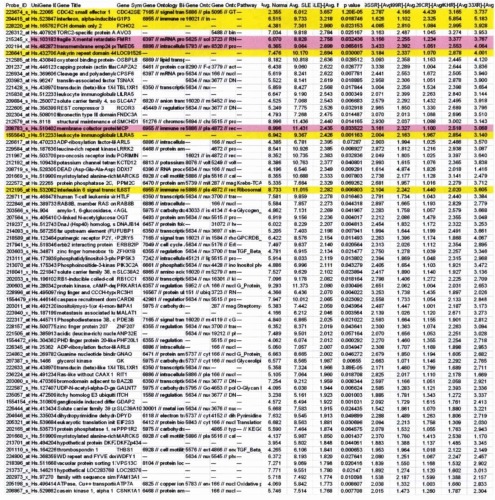
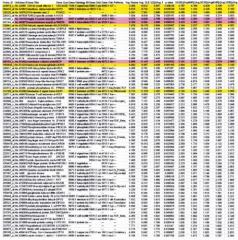
Пациент может иметь профиль экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα. Профиль экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα, может быть сильным профилем, умеренным профилем или слабым профилем. Профиль экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα, может быть легко определен в качестве сильного, умеренного или слабого путем выяснения кратности нарушения регуляции профиля экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα, у пациента (например, кратного увеличения у пациента экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα, регуляция которых повышена), относительно контрольного образца (образцов) или контрольного пациента (пациентов) и сравнения кратности регуляции у пациента по сравнению с другими пациентами, имеющими профиль экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα. Кратность нарушения регуляции может быть подсчитана известными в данной области способами. См., например, пример 8.
Профиль экспрессии ФД маркеров, индуцируемых ИФН I типа или ИФНα, может включать повышение регуляции какой-либо группы генов или группы генов, выявленных зондами, указанными в табл.19, 20, 21, 22, 23, 24, 26, 28 или 30. Группа генов или группа генов, выявляемых зондами, идентифицированными в табл.19, 20, 21, 22, 23, 24, 26, 28 или 30, может включать какие-либо по меньшей мере 2, какие-либо по меньшей мере 3, какие-либо по меньшей мере 4, какие-либо по меньшей мере 5, какие-либо по меньшей мере 6, какие-либо по меньшей мере 7, какие-либо по меньшей мере 8, какие-либо по меньшей мере 9, какие-либо по меньшей мере 10, какие-либо по меньшей мере 11, какие-либо по меньшей мере 12, какие-либо по меньшей мере 13, какие-либо по меньшей мере 14, какие-либо по меньшей мере 15, какие-либо по меньшей мере 16, какие-либо по меньшей мере 17, какие-либо по меньшей мере 18, какие-либо по меньшей мере 19, какие-либо по меньшей мере 20, какие-либо по меньшей мере 21, какие-либо по меньшей мере 22, какие-либо по меньшей мере 23, какие-либо по меньшей мере 24, какие-либо по меньшей мере 25, какие-либо по меньшей мере 26, какие-либо по меньшей мере 27, какие-либо по меньшей мере 28, какие-либо по меньшей мере 29, какие-либо по меньшей мере 30, какие-либо по меньшей мере 40 или какие-либо по меньшей мере 50 генов, или генов, выявленных зондами, идентифицированных в указанных таблицах.
Группой генов, которые могут быть включены в профиль экспрессии пациента ФД маркеров, индуцируемых ИФН I типа