Питательная среда для выращивания мицелиальных грибов-дерматомицетов из клинического материала
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Питательная среда для выращивания мицелиальных грибов-дерматомицетов из клинического материала содержит глюкозу, агар бактериологический, пептон мясной, гидролизат казеина, дрожжевой экстракт, хлористый натрий, углекислый натрий, L-цистин, тиогликолевую кислоту и дистиллированную воду в заданном соотношении компонентов. Изобретение позволяет сократить сроки выращивания мицелиальных грибов-дерматомицетов из клинического материала. 1 табл., 2 ил., 4 пр.
Реферат
Изобретение относится к медицинской микробиологии и может быть использовано для выделения из клинического материала наиболее значимых возбудителей - патогенных грибов-дерматомицетов, возбудителей микозов человека и животных.
Суть изобретения заключается в составлении эффективной плотной полусинтетической питательной среды для получения первичных культур грибов-дерматомицетов из клинического материала с учетом их потребностей в элементах питания и физиологических особенностей.
Для выделения и идентификации грибов в настоящее время в клинической микробиологии используют плотные и жидкие питательные среды Сабуро, рекомендованные министерством здравоохранения СССР приказом №535 от 22 апреля 1985 года «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». По своему составу она относится к полусинтетическим средам, в состав которых, наряду с веществами неопределенного состава, входят соединения известной химической природы. Среда Сабуро: пептон - 10 г, глюкоза (или мальтоза) - 40 г, агар - 18… 20 г, вода дистиллированная - 1 л, pH 5,6… 5,8, бульон готовят аналогично, но без агара [2].
Однако на сегодняшний день процент положительных результатов культурального исследования дерматомицетов на среде Сабуро при положительном ответе в прямой микроскопии и несомненной клинической картине остается невысоким. По сообщениям А.Ю. Сергеева, выделить культуру возбудителя в 1994-1996 гг. удавалось в 36% случаев [3], что не может считаться оптимальным для лабораторной диагностики. Существуют зарубежные фирменные среды для трихофитонов (Mycosel, Mycobiotic) с аналогичными показателями по высеваемости грибов из первичного клинического материала. Это, вероятно, связано с рядом особенностей данного рода грибов. Во-первых, сравнительно медленным ростом - в отличие от большинства мицелиалькых грибов, рост трихофитонов начинается на 5-7 день после посева (плесневых грибов на 2 день), во-вторых, более высокими пищевыми потребностями трихофитонов. Большинство видов дерматомицетов для начала роста требует наличия в питательной среде полного набора витаминов и белков животного происхождения.
Целью заявленного изобретения является разработать плотную полусинтетическую питательную среду для получения первичных культур грибов-дерматомицетов из клинического материала, удовлетворяющую установленным критериям эффективности, что является необходимым условием надежных результатов любого клинического микробиологического исследования, и обеспечивающую получение точных и объективных результатов.
Технический результат предлагаемого изобретения заключается в получении плотной полусинтетической питательной среды для получения первичных культур грибов-дерматомицетов из клинического материала.
Осуществление изобретения достигается приготовлением питательной среды, содержащей на 1 литр дистиллированной воды: глюкоза - 30,0 г, агар бактериологический - 20,0 г, пептон мясной - 5,0 г, гидролизат казеина - 2,5 г, дрожжевой экстракт - 0,8 г, хлористый натрий - 0,4 г, углекислый натрий - 0,16 г, L-цистин - 0,12 г, кислота тиогликолевая - 0,08 г, pH среды - 6,5.
Компоненты последовательно растворяют в воде, вносят агар и подогревают до расплавления агара. При необходимости среду фильтруют. Затем добавляют глюкозу, тщательно перемешивают и устанавливают pH 6,5. После этого разливают в стерильную посуду и стерилизуют 60 мин при 120°С.
Пример 1. Способ получения композиции. В 1 л дистиллированной воды растворяли навески: пептон мясной - 5,0 г, гидролизат казеина - 2,5 г, дрожжевой экстракт - 0,8 г, хлористый натрий - 0,4 г, углекислый натрий - 0,16 г, L-цистин - 0,12 г, кислота тиогликолевая - 0,08 г. Перемешивали полученный раствор. К растворенным компонентам добавляли агар бактериологический - 20,0 г и подогревали до расплавления агара. Фильтровали при необходимости (в случае присутствия нерастворимых частиц). Затем добавляли глюкозу - 30,0 г и тщательно перемешивали. Устанавливали pH 6,5.
Готовую среду разливали в стерильную посуду и стерилизовали 60 мин при 120°С.
Свежеприготовленную среду разливали в чашки Петри в количестве не менее 20 мл и в тот же день производили посев материала.
Отличие предлагаемого состава среды заключается в том, что с целью повышения эффективности высева дерматомицетов в среду добавляются L-цистин и углекислый натрий для нейтрализации свободных радикалов и снижения окислительно-восстановительного потенциала среды и тиогликолевую кислоту, способствующую высвобождению элементов гриба из кератиновых масс за счет разрушения дисульфидных связей в кератине патогенного материала (кожные чешуйки, ногти, волосы), что обеспечивает контакт элементов гриба с питательными веществами среды и более быстрое начало роста дерматомицетов.
Для лучшего понимания изобретения приводим примеры эффективности предлагаемой среды.
Исследование эффективности предлагаемой среды, в отличие от среды Сабуро, проводили методом сравнительного анализа роста грибов-дерматомицетов как в модельных опытах, так и на клиническом материале. В модельных опытах учитывали скорость и характер роста колонии и проявления морфологических особенностей грибов дерматомицетов. Исследование проводилось в течение 21 суток с 3 видами грибов (Trichophyton rubrum, Trichophyton mentagrophytes, Epidermophyton floccosum). Данные виды грибов являются наиболее часто выделяемыми от больных возбудителями микозов. Штаммы были получены из коллекции типовых и патогенных культур микологической лаборатории Казанского научно-исследовательского института эпидемиологии и микробиологии Роспотребнадзора. В работе использовались как музейные штаммы, так и выделенные от больных с диагнозом микоз.
Пример 2. Питательная среда, способствующая ускорению роста грибов дерматомицетов, позволяет добиться большей эффективности выявления дерматомицетов, поскольку скорость роста дерматомицетов - важный фактор в характеристике эффективности среды в связи с частой контаминацией клинического материала быстрорастущими плесневыми грибами. Известно, что грибы дерматомицеты растут в 2, а иногда и в 4 раза медленнее плесневых грибов [4]. Для проявления типичных признаков дерматомицетов - ветвления, спороношения, пигментации в настоящее время рекомендуется выдерживать время инкубации посевов до 1 месяца [6].
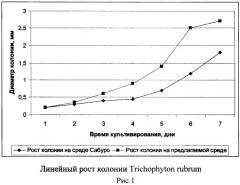
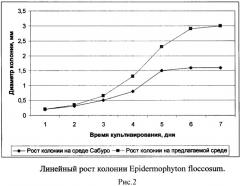
Для исследования влияния состава среды на линейный рост колоний музейные тест-штаммы грибов Trichophyton rubrum и Epidermophyton floccosum высевали в центр плотной питательной среды немногочисленным инокулюмом одной плотности. Диаметр колонии измеряли в двух взаимно перпендикулярных направлениях в двух-трех повторностях через каждые 24 часа [5]. Посев тест-штаммов на предлагаемую нами среду показал увеличение скорости роста в 1,5 -2 раза, по сравнению с посевами на среду Сабуро (Рисунок 1, 2). Однако учитывая, что данные виды грибов на поверхности некоторых лимитирующих рост плотных сред образуют широко распространенную, но тонкую пленчатую колонию, а при росте на плотной оптимальной среде колония гриба может достигать такого же диаметра, но быть высокой, пушистой, иметь обильно развитый воздушный мицелий, то помимо скорости роста колоний определяли также плотность гиф колонии [5]. Плотность гиф определяли их общей длиной, представляющей суммарную длину главной гифы и ее ответвлений всех порядков, в одном поле зрения под микроскопом при увеличении 20х20. Плотность определяли в разных участках растущей части колонии. На шестой день длина гифы (Н) Trichophyton rubrum на среде Сабуро и на предлагаемой среде составила 648 и 817 мкм соответственно. Длина гифы Epidermophyton floccosum составила 547 мкм на среде Сабуро и 651 мкм на предлагаемой среде.
Пример 3. Получение питательной среды, на которой грибок давал бы типичную колонию и более дифференцированные органы плодоношения, является важной задачей для идентификации дерматомицетов. Анализ дифференциально-диагностических особенностей штаммов грибов Trichophyton rubrum, Trichophyton mentagrophytes, выращенных на предлагаемой среде и среде сравнения Сабуро, показал эффективность предлагаемой среды. В десяти случаях из десяти штамм Trichophyton rubrum выделял в среду яркий пигмент насыщенно красного цвета, что является одним из основных диагностических признаков данного вида (таблица 1). Тогда как штаммы, выращенные на среде Сабуро, выделяли в среду пигмент бледно-розового цвета, а в 3-х случаях пигмент отсутствовал.
Микроскопическая картина у разных штаммов Trichophyton mentagrophytes, выращенных на среде Сабуро, отличалась от выращенных на предлагаемой среде. Семь из десяти штаммов не имели спороносные гифы, микроконидии отсутствовали.
Пример 4. Оценка эффективности предлагаемой среды на клиническом материале, полученном от больных с ограниченными дерматомикозами-онихомикозами. Критерии включения в исследование: наличие у больных онихомикоза, подтвержденного положительными результатами микологического обследования (микроскопией ногтевых пластин в 20% КОН или люминисцентная микроскопия с калькофлюором белым).
Крупные кусочки ногтей разрезались на несколько частей в стерильных условиях. Затем равное количество материала одновременно засевали на исследуемые среды. На седьмые сутки после посева из 25 образцов, посеянных на среду Сабуро, рост дерматомицетов был выявлен в 44% (11 образцов). Культуральный посев на предлагаемую среду выявил грибы дерматомицеты в 18 образцах, что составило 72%. При этом контаминация плесневыми грибами не препятствовала идентификации дерматомицетов.
Таким образом, предлагаемая нами питательная среда позволяет выполнить поставленную задачу - получить ускоренный рост дерматомицетов, обладающих характерными признаками (пигментация, спорообразование), позволяющими проводить их выявление и идентификацию в первичной культуре.
ЛИТЕРАТУРА
1. Приказ Министерства здравоохранения СССР №535 от 22 апреля 1985 года «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений».
2. Семенов С.М. Лабораторные среды для актиномицетов и грибов. Справочник. - М.: Агропромиздат, 1990. - 240 с.
3. Сергеев А.Ю., Сергеев Ю.В. Грибковые инфекции. Руководство для врачей. 2 изд. - М.: Изд-во БИНОМ, 2008. - 480 с.
4. Сергеев А.Ю. Грибковые заболевания ногтей. 2 изд. - М.: Национальная академия микологии, 2007. - 164 с.
5. Методы экспериментальной микологии. Справочник (Дудка И.А., Васер С.П., Элланская И.А. и др.). - Киев.: Наукова думка, 1982. - 550 с.
6. Медицинская микология: руководство / В.А. Андреев, А.В. Зачиняева, А.В. Москалев, В.Б. Сбойчаков; под ред. В.Б. Сбойчакова. - М.: ГЭОТАР-Медиа, 2008. - 208 с.
| Таблица 1 | ||||||||||||||
| Формирование дифференциально-диагностических элементов у грибов дерматомицетов при культивировании на исследуемых средах. | ||||||||||||||
| Штаммы | Рост штаммов грибов на среде Сабуро, сутки | Рост штаммов грибов на предлагаемой среде, сутки | ||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| Т. rubrum | П | П | М, А | |||||||||||
| Т. rubrum | П | П | М | |||||||||||
| Т. rubrum | П | П | М, А | |||||||||||
| Т. rubrum | П | П | ||||||||||||
| Т. rubrum | П | |||||||||||||
| Т. rubrum | П | |||||||||||||
| Т. rubrum | П | П | ||||||||||||
| Т. rubrum | П | |||||||||||||
| Т. rubrum | П | П | М | |||||||||||
| Т. rubrum | П | П | М, А | |||||||||||
| Т. mentagrophytes | П, З | П | З | |||||||||||
| Т. mentagrophytes | П | П, З | ||||||||||||
| Т. mentagrophytes | П | З | М | |||||||||||
| Т. mentagrophytes | П | З | ||||||||||||
| Т. mentagrophytes | П | З | П | З | ||||||||||
| Т. mentagrophytes | П, З | П, З | ||||||||||||
| Т. mentagrophytes | П, З | |||||||||||||
| Т. mentagrophytes | П | П | З, М | |||||||||||
| Т. mentagrophytes | П | З | ||||||||||||
| Т. mentagrophytes | П | З | ||||||||||||
| П - образование пигмента, М - микроконидии, А - артроконидии, З - завитки или узелки. |
Питательная среда для выращивания мицелиальных грибов-дерматомицетов из клинического материала, содержащая на один литр дистиллированной воды: глюкоза - 30,0 г, агар бактериологический - 20,0 г, пептон мясной - 5,0 г, гидролизат казеина - 2,5 г, дрожжевой экстракт - 0,8 г, хлористый натрий - 0,4 г, углекислый натрий - 0,16 г, L-цистин - 0,12 г, кислота тиогликолевая - 0,08 г, pH среды - 6,5.