Генетическая конструкция, содержащая hgdnf под контролем температурочувствительного промотора для регулируемой экспрессии нейротрофического фактора как в клетках, так и непосредственно в организме млекопитающих
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и медицины. Предложена генетическая конструкция на основе векторной плазмиды pEGFP-N1 с геном устойчивости к неомицину, содержащая под контролем терморегулируемого промотора гена белка теплового шока hsp70 Drosophila melanogaster ген человеческого нейротрофического фактора GDNF с элементами теплового шока HSE 4-8 и ген зеленого флуоресцентного белка GFP. Изобретение может быть использовано при терапии нейродегенеративных заболеваний, травматических нарушениях иннервации, а также при ишемическом инсульте головного мозга млекопитающих (в том числе и человека), поскольку понижение температурного порога активации (от 39 до 42 градусов цельсия) экспрессии терапевтического гена GDNF позволяет снизить негативное воздействие высоких температур на человеческий организм при применении для лечения нейродегенеративных заболеваний конструкции, включающей терапевтический ген GDNF, что достигается использованием hsp 70 Drosophilla melanogaster. Таким образом достигается температурорегулируемая временная активация GDNF для стимуляции нейральной дифференцировки нейральных предшественников, а также предотвращает негативные последствия от гиперэкспрессии трансгенного фактора. 26 ил., 7 пр.
Реферат
Настоящее изобретение относится к областям биологии и медицины, в частности к молекулярной генетике и клеточной биологии. Данное изобретение необходимо для регулируемой продукции человеческого нейротрофического фактора GDNF в клетках и тканях млекопитающих. Получена конструкция, содержащая ген человеческого GDNF под контролем температурорегулируемого промотора гена белка теплового шока Hsp70 Drosophila melanogaster с регуляторной зоной. Для получения трансгенной клеточной культуры в вектор введен ген устойчивости к неомицину.
Известно, что нейродегенеративные заболевания (болезнь Паркинсона, болезнь Альцгеймера и др.), а также ишемический инсульт и травмы нейрального направления - важнейшие социально значимые заболевания, одни из существенных причин инвалидности и смертности людей в трудоспособном и пожилом возрасте. Широкое распространение при лечении этих заболеваний приобретают методы клеточной и генной терапии с использованием клеток с модифицированными генами, обеспечивающими терапевтический эффект. Особенно перспективна возможность использования региональных стволовых клеток самого пациента, индуцированных к развитию в нужном направлении. Наилучшим трансплантационным материалом служат собственные стволовые клетки из красного костного мозга и других тканей, содержащих мезенхимальные стволовые/прогениторные клетки. Однако так как у интактных региональных стволовых/прогениторных клеток существуют ограничения потенциала дифференцировок, существенное значение имеет разработка способов управления специализацией тралсплантируемых клеток и повышения их жизнеспособности, а также способов предотвращения образования рубцовой ткани в местах трансплантации.
Главными факторами, определяющими природу и рост афферентных и эфферентных волокон трансплантатов, являются среда, в которой находятся трансплантаты мозга, ростовые способности трансплантата, наличие или отсутствие рубца на границе между трансплантатом и мозгом хозяина. Однако уже в течение первой недели после операции астроциты реципиента начинают мигрировать в трансплантат и замещать раневой канал глиальным рубцом. При этом в глиальных септах и в участках глиального рубца густота врастающих в имплантат капилляров существенно ниже таковой в окружающей ткани мозга реципиента. Это может привести к весьма недолгому переживанию трансплантата и его полному отмиранию в результате нехватки питательных веществ уже в течение нескольких месяцев после операции, что, в конечном итоге, сводит эффект к нулю. Для достижения лучшей эффективности нейротрансплантации необходима максимальная интеграция трансплантата с мозгом реципиента, что возможно только при отсутствии глиомезодермальной капсулы (Корочкин, 2000).
Для достижения максимального клеточно- и генно-терапевтического эффекта и обеспечения безопасности для пациента необходим поиск факторов, способных трансформировать стволовые клетки в нужном для лечения направлении. В случае удачного подбора таких элементов появляется возможность повышения эффективности генной и клеточной терапии при лечении многих заболеваний, требующих использования метода трансплантации тканей.
Разработка генных конструкций, сдвигающих дифференцировку стволовых и прогениторных клеток в нейральном направлении и благоприятно влияющих на приживляемость трансплантата, а также исследование функционирования полученных конструкций в трансфицированных клетках в культуре до и после трансплантации имеют решающее значение для развития клеточной и генной терапии. Огромное значение при этом играет выбор факторов с нейропротекторными свойствами.
Особый интерес из исследуемых учеными факторов представляет глияпроизводный нейротрофический фактор (GDNF). На данный момент известно, что GDNF играет важную роль в развитии и выживаемости клеток нервного гребня, а также их миграции в почки и вегетативную нервную систему. GDNF охарактеризован как фактор роста, способствующий выживанию дофаминэргических нейронов среднего мозга. GDNF является одним из главных факторов выживания для дофаминэргических нейронов среднего мозга. Только GDNF может обеспечить рост аксонов и гипертрофию нейронов этого типа (Åkerud, et al., 1999). Этот фактор участвует в сигнальном пути через рецепторный комплекс GFRα1-RET, который собирается на мембранах как развивающихся, так и зрелых дофаминэргических нейронов. Однако исследование на нокаутных мышах показало, что сигналинг с участием GFRα1-RET не является необходимым на эмбриональной стадии развития дофаминэргаческих нейронов in vivo.
Но GDNF все же остается необходимым в процессе постнатального развития для поддержания жизнедеятельности клеток, их пластичности и направленной иннервации участков-мишеней. Это косвенно подтверждается тем фактом, что GDNF экспрессируется в значительном количестве в стриатуме в течение первых нескольких постнатальных недель, когда формируется направленная иннервация дофаминэргическими нейронами различных структур мозга. К тому же в отличие от нейронов дикого типа мышей, трансплантированные эмбриональные дофаминэргические нейроны GDNF-дефицитных мышей не способны к выживанию и иннервации стриатума, деиннервированного 1-метил-4-фенил-1,2,3,6-тетрагидропиридином(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, (MPTP)) (Granholm et al., 2000). Кроме того, антисмысловое ингибирование экспрессии GDNF резко уменьшает разрастание аксонов дофаминэргических нейронов в поврежденном стриатуме (Batchelor et al., 2000). Последующие исследования на нокаутных мышах необходимы для выяснения необходим ли сигналинг с участием GDNF для постнатального выживания нейронов или для направленной иннервации ими участков мозга.
Таким образом, ученые и врачи давно пытаются использовать GDNF в практике. Например, повреждение нейронов периферической нервной системы обычно ведет к хроническим нейропатическим болям. Как правило, при таком заболевании возникают нарушения в сенсорных проводящих путях. В лабораторных условиях на модели нейропатической боли было доказано участие нейротрофических факторов, т.к. их блокировка антителами приводила к уменьшению гипералгезии (аномально высокой чувствительности организма к болевым стимулам) (Zhou et al., 2000). Группа ученых во главе с McMahon показала, что экзогенное введение GDNF может предотвращать некоторые аксотомические изменения сенсорных нейронов. В ответ на травмы периферических нервов RET-экспрессирутощие сенсорные нейроны разрастаются отростками вокруг других сенсорных нейронов, возможно так происходит из-за локальной продукции GFLs в поврежденных участках (Li et al., 2001). Важно отметить, что в моделях нейропатической боли при интратекальном введении (под оболочки спинного мозга) GDNF наблюдается обезболивающий эффект, в частности происходит восстановление работы Na+-каналов, поврежденной в результате травмы (Boucher et al., 2000). Поврежденные аксоны сенсорных нейронов периферической системы способны нормально восстанавливаться, но не могут достигнуть своей главной мишени - спинного мозга. Постоянное интратекальное введение GDNF может преодолеть это: при травмах дорсального корня спинного мозга введение этих нейротрофов приводит к восстановлению строения и функций сенсорных нейронов, они достигают спинного мозга и формируют правильные функционирующие контакты с клетками-мишенями (Ramer et al., 2000). В экспериментальных моделях локальной ишемии экзогенное введение GDNF до или сразу после аноксии способствовало значительному уменьшению ишемических повреждений головного мозга. Во взрослом организме наблюдается сильный ответ на введение GDNF, т.к. у нейронов переднего мозга после ишемического инсульта резко возрастает количество RET и GFRα1. Интересен тот факт, что в культурах нейронов коры больших полушарий введение GDNF не способно предотвратить гибель клеток путем апоптоза, но способно предотвратить некроз, снижая приток ионов Ca++ через Ca-опосредованные NMDA-рецепторы (N-метил-D-аспартат) (Nicole et al., 2001). Таким образом, GDNF следует вводить сразу после ишемического инсульта.
Существующие на данный момент способы лечения болезни Паркинсона направлены на устранение симптомов и не приостанавливают разрушение дофаминэргических нейронов среднего мозга. На различных моделях болезни Паркинсона было показано, что GDNF может предотвращать нейротоксически спровоцированную гибель дофаминэргических нейронов и способствует восстановлению их функциональной активности (Grondin et al., 1998). Однако введение GDNF в боковые желудочки головного мозга пациента с болезнью Паркинсона не оказало никакого положительного эффекта и повлекло за собой побочные эффекты, например, потерю веса (Kordower et al., 1999). Последние усовершенствования доставки GDNF, тестируемые на моделях мышей с болезнью Паркинсона, заключали в себе: 1. совместное введение GDNF и гепарина, который увеличивает распространение GFLs; 2. введение новых вирусных векторов; 3. введение GDNF-продуцирующих стволовых нейрональных клеток, которые поддерживают постоянный высокий уровень экспрессии GDNF (Kordower et al., 2000; Åkerud et al., 2001). Вопрос правильной доставки GFLs крайне важен, т.к. постоянная доставка GDNF в стриатум не приводит к потере веса и способствует функционально активной иннервации стриатума (Björklund et al., 2000). В сочетании с мерами безопасности, включая способы контроля экспрессии генов, новые средства для доставки GDNF выглядят перспективными для лечения болезни Паркинсона (Zurn et al., 2001). Чрезвычайно важно помнить, что гиперэкспрессия нейротрофического фактора может быть также опасна, как и ее недостаток. Так, например, продолжительное введение подкожно GDNF в постнатальный период или трансгенная гиперэкспрессия GDNF в скелетных мышцах приводят к гипериннервации нервно-мышечных соединений, этот эффект сохраняется и во взрослом состоянии (Keller-Peck et al., 2001; Zwick et al., 2001). Ряд исследователей отмечают побочные эффекты, такие как потеря веса и возможность опухолевых новообразований, наблюдаемые при гиперэкспрессии GDNF (Meng et al. 2000). Данные нарушения могут быть устранены контролируемой экспрессией нейротрофического фактора.
Оригинальность предложенного изобретения заключается в получение конструкции, где активирование GDNF in vivo чрезвычайно активно в течение до 7 дней с постепенным затуханием. Таким образом, активность GDNF ограничена во времени и участвует только в восстановлении иннервации, не обладая постоянной повышенной экспрессией, приводящей к негативным последствиям в организме. Данную конструкцию можно использовать как генотерапевтический препарат, так и в виде трансгенных клеток, продуцирующих этот нейротрофический фактор ограниченное время.
Таким образом, технической задачей изобретения является получение генетической конструкции для введения гена нейротрофического фактора GDNF в клетки млекопитающих (в том числе человека), где активация гена будет регулироваться повышением температуры (в интервале от 39 до 42°C). GDNF способен индуцировать нейральную дифференцировку и стимулировать восстановление иннервации. Данная плазмида может быть использована как в клетках млекопитающих (in vitro), так и в организме млекопитающих (in vivo) для фундаментальных и прикладных целей. Плазмида может вводиться в организм млекопитающих и в качестве трансгенных клеток, и непосредственно как генотерапевтический материал («голая» плазмида). Плазмида применима при терапии нейродегенеративных заболеваний, травматических нарушениях иннервации, а также при ишемическом инсульте головного мозга млекопитающих (в том числе и человека).
Поставленная техническая задача и технический результат достигаются получением генетической конструкции экспрессирующейся в клетках млекопитающих (в том числе и человека), сконструированной на основе векторной плазмиды pEGFP-N1 с геном устойчивости к неомицину, содержащей фрагмент ДНК, кодирующий регуляторную последовательность промотора, с элементами теплового шока HSE более 4, промотор гена белка теплового шока hsp70 Drosophila melanogaster, ген нейротрофического фактора GDNF человека, ген зеленого флуоресцентного белка (GFP), находящихся под контролем данного промотора, при этом промотор способен активироваться под действием температуры теплового шока млекопитающих или токсическом воздействии.
Пример 1
Нами была создана генно-инженерная конструкция, имеющая в своем составе ген нейротрофического фактора GDNF под контролем промотора гена белка теплового шока дрозофилы hsp70 и регуляторной зоны, содержащей 4HSE.
Для синтезирования гена нейротрофического фактора был применен метод ПЦР, для клонирования вставки использовались праймеры: T3 (5'-attaaccctcactaaaggga-3') и gdnf-BamHI (5'-tggatcccagatacatccacaccttttagcgg-3'). С помощью указанных праймеров из плазмиды phGDNF был клонирован фрагмент GDNF соответствующими сайтами рестрикции (рис.1). Программа синтеза: 94°С - 1,5 мин, 94°С - 15 сек, 57°С - 20 сек, 72°С - 15 сек, 72°С - 10 мин, количество циклов: 30. Полученный фрагмент ДНК был выделен из геля с помощью реагента Qiagen.
Данный фрагмент был переклонирован в фирменный вектор pGEM-T Easy (Promega), согласно протоколу. Полученная конструкция была проверена с помощью рестриктного анализа с последующим секвенированием с праймерами M13R и M13F. (Рис.1)
Из данной конструкции был вырезан ген нейротрофического фактора GDNF по сайтам рестрикции EcoRV-BamHI (600bp) и встроен в плазмиду, содержащую промотор hsp70 Drosophila и регуляторную зону с 4 HSE, по сайтам рестрикции SmaI/BamHI. Наличие вставки в данных конструкциях было проверено с помощью рестриктного анализа по различным сайтам, в том числе по сайтам клонирования методом ПЦР с праймерами gdnf-F (5'-ggaatcggcaggctgcagctg-3') и gfp-R (5'-aataaagcttgcatggcggtaatacg-3').
Также было проведено секвенирование с помощью праймеров gdnf-F (5'-ggaatcggcaggctgcagctg-3') и gdnf-R (5'-aatgctttcttagaatatggt-3'). (Рис.2)
Схема генно-инженерной конструкции представлена на рис.3.
После выделения и очистки эта конструкция была введена в культуру клеток линии НЕК293 методом трансфекции с использованием реагента ExGene 500 (Fermentas, R0511).
Трансфекция производилась согласно протоколу. Культура клеток линии НЕК-293 инкубировалась при 37°С в CO2 инкубаторе. После селекции на гентамицине в течение 10 дней трансфекцированные клетки были рассеяны на 25 см2 культуральные флаконы. Далее необходимо было отобрать под флуоресцентным микроскопом колонии клеток, которые экспрессировали GDNF, маркированные зеленым флуоресцентным белком GFP. Наблюдалось активное свечение клеток. Тем не менее, мы проверили наличие нашей конструкции в клетках. Для этого была выделена РНК из данной культуры клеток для последующего анализа с помощью RT-PCR и Вестерн-блот.
Для RT-PCR лизировали клетки тризолом согласно протоколу, синтезировали кДНК с помощью обратной ревертазы. Программа синтеза кДНК (RT): 70°С - 5 мин, 37°С - 5 мин, 37°С - 60 мин, 70°С - 5 мин, 20°С - 30 сек. Синтезированная кДНК была использована для реакций ПЦР с различными праймерами: GAPDH R (5'-cccctggccaaggtcatccatgacaactt-3') GAPDH F (5'-ggccatgaggtccaccaccctgttgctgta-3'); gdnf-F (5'-ggaatcggcaggctgcagctg-3') и GDNF-BamHI (5'-tggatcccagatacatccacaccttttagcgg-3'). Также была проведена Вестерн-блот гибридизация с трансфецированной культурой клеток.
Для получения трансгенной клеточной культуры в конструкцию введен ген устойчивости к неомицину, что позволяет производить селекцию трансфицированных клеток на G418.
Трансфицированные клетки линии НЕК293 были выведены в линию по устойчивости к неомицину. Наличие строенных генов gdnf и gfp и экспрессия белка в выведенной трансгенной культуре подтверждалось сиквенсом и Вестерн-блот гибридизацией. Из культуры клеток был выделен белок в SDS буфере по протоколу (Amersham Bioscience). Далее данные белки были разогнаны в 10% акриламидном геле и проанализированы с помощью Вестерн-блот гибридизации. Для переноса была использована нитроцеллюлозная мембрана (Amersham Bioscience, #RPN68D). Данная мембрана была обработана антителами: Rabbit polyclonal anti-GFP (Abeam #ab 290, 1:2000) и вторичными anti-Rabbit, конъюгированными с пероксидазой хрена (HRP, 1:2000). Детекция белков осуществлялась при помощи реагента ECL (Amersham Biocsience, #RPN2109) на пероксидазу. Доказано наличие конструкта в клетках.
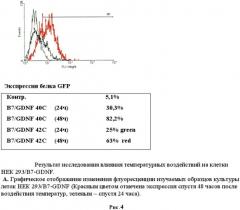
После 24 часов культивирования анализировали воздействие температуры на культуры клеток. Клетки были прогреты в инкубаторе при температурах в диапазоне от 37° С до 42°С в течение 60 минут. Экспрессию маркерного белка GFP наблюдали с помощью флуоресцентного микроскопа Olympus. Было обнаружено, что наблюдается зеленое свечение клеточной культуры после воздействия температуры. Было обнаружено, что максимальная экспрессия белка GFP наблюдалась при 40°C спустя 48 часов после прогрева в случае использования 4 зон HSE (рис.2). Другая 1/3 часть исследуемых клеток после воздействия температуры была зафиксирована в 4% растворе параформа и использовалась для измерения интенсивности свечения при помощи метода проточной цитофлуориметрии на приборе FACScan (Becton Dickinson, США). Данные приведены для двух температур 40 и 42°C с различным интервалом после температурного воздействия. Следует отметить, что по данным цитофлуориметра экспрессия маркерного зеленого флуоресцентного гена наблюдалась уже при 39°C, что является результатом использования в регуляции промотора 4 элементов теплового шока (HSE). Следует отметить еще один факт: при активации 40°C наблюдается снижение свечения (т.е. активности промотора) через 48 часов, что также может быть связано с использованием в регуляции промотора 4 элементов теплового шока (HSE).
После 72 часов наблюдается уменьшение синтеза белка GFP. Однако при повторном нагревании наблюдается вторичная активация синтеза белка. Также 1/3 клеток была использована для выделения тотальной ДНК согласно протоколу. Полученная тотальная ДНК была исследована методом ПЦР анализа на наличие гена GFP в клеточной линии НЕК293. Для метода ПЦР использовался амплификатор фирмы BioRad, праймеры: gfpF (5'-cgtcagatccgctagegctaccgg-3') и gfpR (5'-aataaagcttgcatggcggtaatacg-3'). Программа: 95°C - 3 мин, 94°С - 20 сек, 55°С - 15 сек, 72°С - 30 сек, 72°С - 5 мин, количество циклов: 30.
Таким образом, показано, что данная система активированной экспрессии GDNF работает в культуре клеток НЕК293. Установлено, что оптимальное время действия температурной активации составляет 60 минут, а максимальное свечение зеленого флуоресцентного белка GFP наблюдается через 48 часов после воздействия температуры. Был выявлен эффект повторного включения промотора и возникновения свечения зеленого флуоресцентного белка после повторного воздействия температуры.(Рис.4)
Для оценки способности трансгенных клеток НЕК293, экспрессирующих gdnf/gfp выживать внутри нервной ткани была проведена их инъекция в головной мозг мышам линии black6. Трансгенные клетки НЕК293 (пассаж 2) были стимулированы тепловым шоком при температуре 42°С в течение 60 минут в среде DMEM, 10% ЭБС. В качестве контроля использовали нетрансгенные клетки НЕК293. 1×106 GFP-меченых клеток в 2 мкл раствора Хенкса локально вводили в стриатум мышам. По окончании эксперимента (через 24 часа, 3 дня и 5 дней) мышей перфузировали 4% раствором параформальдегида, мозг извлекали и после дополнительной фиксации и пропитки в 30% растворе сахарозы замораживали при -20°С. Затем готовили срезы толщиной 40 мкм. Выживаемость трансплантированных НЕК293 оценивали под микроскопом по зеленой флуоресценции экспрессируемого ими белка ОРР. (Рис.5)
В ходе исследований было обнаружено, что трансплантированные трансгенные клетки ведут себя отлично от клеточной культуры. Активная экспрессия наблюдалась через сутки и плавно снижалась в течение трех суток. По всей видимости, более длительная активность промотора связана с воспалительными процессами при трансплантации. Данный результат крайне привлекателен, так как активность гена gdnf нужна именно для приживления трансплантата и, как следствие, снижения глиального рубца при приживлении. (Рис.6, 7)
Пример 2
Была создана генно-инженерная конструкция, имеющая в своем составе ген нейротрофического фактора GDNF под контролем промотора гена белка теплового шока дрозофилы hsp70 и регуляторной зоны, содержащей 8HSE.
Для синтезирования гена нейротрофического фактора был применен метод ПЦР, для клонирования вставки использовались праймеры: T3 (5'-attaaccctcactaaaggga-3') и gdnf-BamHI (5'-tggatcccagatacatccacaccttttagcgg-3'). С помощью указанных праймеров из плазмиды phGDNF был клонирован фрагмент GDNF соответствующими сайтами рестрикции. Программа синтеза: 94°С - 1,5 мин, 94°С - 15 сек, 57°С - 20 сек, 72°С - 15 сек, 72°С - 10 мин, количество циклов: 30. Полученный фрагмент ДНК был выделен из геля с помощью реагента Qiagen.
Данный фрагмент был переклонирован в фирменный вектор pGEM-T Easy (Promega) согласно протоколу. Полученная конструкция была проверена с помощью рестриктного анализа (рис.8) с последующим секвенированием с праймерами M13R и M13F.
Из данной конструкции был вырезан ген нейротрофического фактора GDNF по сайтам рестрикции EcoRV-BamHI (600bp) и встроен в плазмиду, содержащую промотор hsp70 Drosophila и в одном случае регуляторную зону с 4 HSE, в другом - 8 HSE, по сайтам рестрикции SmaI/BamHI. Наличие вставки в данных конструкциях было проверено с помощью рестриктного анализа по различным сайтам, в том числе по сайтам клонирования методом ПЦР с праймерами gdnf-F (5'-ggaatcggcaggctgcagctg-3') и gfp-R (5'-aataaagcttgcatggcggtaatacg-3').
Также было проведено секвенирование с помощью праймеров gdnf-F (5'-ggaatcggcaggctgcagctg-3') и gdnf-R (5'-aatgctttcttagaatatggt-3') (Рис.9)
Схема генно-инженерной конструкции представлена на рис.10.
После выделения и очистки эти конструкции были введены в культуру клеток линии НЕК293 методом трансфекции с использованием реагента ExGene 500 (Fermentas, R0511).
Трансфекция производилась согласно протоколу. Культура клеток линии НЕК293 инкубировалась при 37°С в CO2 инкубаторе. После селекции на гентамицине в течение 10 дней трансфекцированные клетки были рассеяны на 25 см2 культуральные флаконы. Далее необходимо было отобрать под флуоресцентном микроскопом колонии клеток, которые экспрессировали GDNF, маркированные зеленым флуоресцентным белком GFP. Наблюдалось активное свечение клеток. Тем не менее, мы проверили наличие нашей конструкции в клетках. Для этого была выделена РНК из данной культуры клеток, для последующего анализа с помощью RT-PCR и Вестерн-блот.
Для RT-PCR лизировали клетки тризолом согласно протоколу, синтезировали кДНК с помощью обратной ревертазы. Синтезированная кДНК была использована для реакций ПЦР с различными праймерами: GAPDH R (5'-cccctggccaaggtcatccatgacaactt-3') GAPDH F (5'-ggccatgaggtccaccaccctgttgctgta-3'); gdnf-F (5'-ggaatcggcaggctgcagctg-3') и GDNF-BamHI (5'-tggatcccagatacatccacaccttttagcgg-3'). Также была проведена Вестерн-блот гибридизация с трансфецированной культурой клеток.
Для получения трансгенной клеточной культуры в конструкцию введен ген устойчивости к неомицину, что позволяет производить селекцию трансфицированных клеток на G418.
Трансфицированные клетки линии НЕК293 были выведены в линию по устойчивости к неомицину. Наличие встроенных генов gdnf и gfp и экспрессия белка в выведенной трансгенной культуре подтверждалось сиквенсом и Вестерн-блот гибридизацией. Из культуры клеток был выделен белок в SDS буфере по протоколу (Amersham Bioscience). Далее данные белки были разогнаны в 10% акриламидном геле и проанализированы с помощью Вестерн-блот гибридизации. Для переноса была использована нитроцеллюлозная мембрана (Amersham Bioscience, # RPN68D). Данная мембрана была обработана антителами: Rabbit polyclonal anti-GFP (Abeam #ab 290, 1:2000) и вторичными anti-Rabbit, конъюгированными с пероксидазой хрена (HRP, 1:2000). Детекция белков осуществлялась при помощи реагента ECL (Amersham Biocsience, #RPN2109) на пероксидазу. Доказано наличие конструкта в клетках.
Было обнаружено, что наблюдается зеленое свечение клеточной культуры после воздействия температуры. Исследуемые клетки после воздействия температуры были зафиксированы в 4% растворе параформа и использовались для измерения интенсивности свечения при помощи метода проточной цитофлуориметрии на приборе FACScan (Becton Dickinson, США). Были проанализированы данные для двух температур 40 и 42°C с различным интервалом после температурного воздействия. Наличие восьми элементов теплового шока (HSE) в регулируемой зоне промотора гена белка теплового шока hsp70 сказывается на изменениях активации данного промотора.
Наличие восьми элементов теплового шока (HSE) в регулируемой зоне промотора гена белка теплового шока hsp70 сказывается на изменениях активации экспрессии GDNF. В полученной конструкции наблюдается более интенсивное накопление светящихся клеток в трансгенной культуре. Так, например, при воздействии температуры в 40°С на клеточную культуру через 24 часа обнаруживалось 43% светящихся клеток, причем этот процент увеличился через 48 часов до 51% в отличие от стимуляции промотора в B7/gdnf-gfp. При воздействии температуры в 42°С наблюдается уменьшение процента светящихся клеток (32%) по сравнению с процентом светящихся клеток при воздействии 40°С, однако их количество резко увеличивается через 48 часов (53%). Исследование при помощи цитофлуориметрии экспрессии данного промотора с восемью регуляторными последовательностями (HSE) при более низких температурах показал, что экспрессия GDNF и маркерного гена наблюдается уже при температуре 38°С (12%) и увеличивалась при повышении температуры. Таким образом, можно утверждать, что увеличение элементов теплового шока (до восьми) в регуляторной зоне промотора гена белка теплового шока hsp70 дрозофилы усиливает чувствительность данного промотора к повышению температуры даже на 2°С (до 38°С) и усиливает экспрессию при воздействии повышенного порога температурного режима в интервале 38°С-42°С.
После 72 часов наблюдается уменьшение синтеза белка GFP. Однако при повторном нагревании наблюдается вторичная активация синтеза белка. Также 1/3 клеток была использована для выделения тотальной ДНК согласно протоколу. Полученная тотальная ДНК была исследована методом ПЦР анализа на наличие гена GFP в клеточной линии НЕК293. Для метода ПЦР использовался амплификатор фирмы BioRad, праймеры: gfpF (5'-cgtcagatccgctagcgctaccgg-3') и gfpR (5'-aataaagcttgcatggcggtaatacg-3').
Было установлено, что оптимальное время действия температурной активации составляет 60 минут, а максимальное свечение зеленого флуоресцентного белка GFP наблюдается через 48 часа после воздействия температуры. Был выявлен эффект повторного включения промотора и возникновения свечения зеленого флуоресцентного белка после повторного воздействия температуры.
Для оценки способности трансгенных клеток НЕК293, экспрессирующих gdnf/gfp, выживать внутри нервной ткани была проведена их инъекция в головной мозг мышам линии black6. Трансгенные клетки НЕК293 (пассаж 2) были стимулированы тепловым шоком при температуре 42°С в течение 60 минут в среде DMEM, 10% ЭБС. В качестве контроля использовали не трансгенные клетки НЕК293. 1×106 GFP-меченых клеток в 2 мкл раствора Хенкса локально вводили в стриатум мышам. По окончании эксперимента (через 24 часа, 3 дня и 5 дней) мышей перфузировали 4% раствором параформальдегида, мозг извлекали и после дополнительной фиксации и пропитки в 30% растворе сахарозы замораживали при -20°С. Затем готовили срезы толщиной 40 мкм. Выживаемость трансплантированных НЕК293 оценивали под микроскопом по зеленой флуоресценции экспрессируемого ими белка GFP. (Рис.11 и 12)
В ходе исследований было обнаружено, что трансплантированные трансгенные клетки ведут себя отлично от клеточной культуры. Активная экспрессия наблюдалась через сутки и плавно снижалась в течение трех суток. По всей видимости, более длительная активность промотора связана с воспалительными процессами при трансплантации. Данный результат крайне привлекателен, так как активность гена gdnf нужна именно для приживления трансплантата и, как следствие, снижения глиального рубца при приживлении.
Следует отметить, что увеличение регуляторной зоны промотора сказалось на активации промотора и длительности этой активности при трансплантации. Причем данные свойства при трансплантации отличались от потенциала промотора в культуре. Было обнаружено, что при использовании трансгенных клеток, содержащих F7/gdnf-gfp, снижается эффективность свечения через 24 часа по сравнению с трансгенными клетками, содержащими B7/gdnf-gfp. Однако при этом значительно увеличивается время активности промотора. Так, мы наблюдали единичные светящиеся клетки и через пять дней. Предполагается, что это связано с увеличением HSE зон (от 4 до 8) в регуляторной области промотора. Для дальнейших исследований использовали F7/gdnf-gfp. (Рис.13-15)
Пример 3. Влияние температурочувствительной экспрессии GDNF на морфологию трансгенных клеток
Методом Вестерн-блот анализа был подтвержден синтез трансгенного фактора в трансфицированных клетках НЕК293 после воздействия хитшоковой температуры. Таким образом, можно утверждать, что нами получена трансгенная клеточная культура, регулируемо экспрессирующая GDNF. Далее методом Вестерн-блот анализа была исследована секреция фактора из клеток в среду. Для этого трансгенные клетки были подвергнуты воздействию повышенной температуры (42°С) и после культивации трансгенных клеток в течение двух суток была отобрана кондиционная среда с чашек. Затем был выделен белок из кондиционной среды и проанализирован на наличие GDNF. Результаты подтвердили секрецию GDNF из клеток в среду (рис.16).
В ходе иммуногистохимического анализа было обнаружено, что трансгенные клетки НЕК293 не приобретали нейральных характеристик без воздействия температурного шока (42°С), что достаточно привлекательно для ведения трансгенной культуры.
При исследовании трансгенной культуры НЕК293 было обнаружено значительное изменение фенотипического профиля клеток после воздействия повышенной температуры, стимулирующей экспрессию GDNF. Клетки образуют множественные отростки (рис.17) и при последующем наращивании собираются в сферообразные структуры (рис.18). Следует отметить, что такого эффекта при воздействии температуры на контрольные НЕК293 (трансгенные по гену gfp) не наблюдалось.
Нельзя утверждать, что данные приобретенные свойства связаны с нейральной дифференцировкой трансгенных клеток, так как не было обнаружено изменение интенсивности экспрессии маркеров, характерных для нейральных клеток. Однако можно утверждать, что подтвержденная экспрессия GDNF фенотипически меняет саму трансгенную клетку. Для подтверждения эффективности трансгенного фактора были проведены предварительные эксперименты по активизации экспрессии GDNF при трансплантациях. Полученные трансгенные культуры НЕК293, экспрессирующие химерный белок GDNF-GFP, были трансплантированы в стриатум мыши. Спустя 7 дней на срезах мозга обнаружен синтез зеленого флуоресцентного белка в зоне трансплантации. При исследовании другой группы мышей показано, что через 10 дней происходит затухание зеленого свечения трансплантированных клеток, что возможно связано со снижением воспалительного процесса в зоне трансплантации.
Пример 4. Влияние кондиционной среды с трансгенных клеток hsp70/gdnf-gfp на образование нервных отростков и подвижность клеток в сетчатке глаза крысы
Изолированные глаза крыс промывали в 70% этиловом спирте и в двух сменах стерильного фосфатного буфера (DPBS; «Sigma»). Сетчатку выделяли в охлажденном DPBS, содержащем 0,8% глюкозы (G1 - DPBS). Выделенную сетчатку измельчали на фрагменты размером 1-2 мм2, эксплантаты промывали раствором антибиотиков и помещали в культуральную чашку с полной питательной средой (DMEM/F12 с добавлением цитокинов, антибиотиков и 5% сыворотки).
Эксплантаты культивировали в прикрепленном виде в чашке Петри диаметром 30 мм.
Культивирование проводили в инкубаторе во влажной камере при температуре +37°С и содержании углекислоты 5% в культуральной среде - DMEM/F12 (1:1) с добавлением цитокинов, антибиотиков и 5% эмбриональной телячей сыворотки. Смену среды производили каждые 2-3 суток.
Затем культуральную среду меняли на кондиционную среду, снятую с культивируемых трансгенных клеток НЕК293/hsp70/gdnf-gfp. (Следует отметить, что различий использования кондиционных сред с культур трансгенных клеток НЕК293/F7/gdnf-gfp и НЕК293/B7/gdnf-gfp не было).
Культивирование производилось в течение 21 суток, далее образцы фиксировали и хранили в забуференнном растворе антифриза до окрашивания антителами.
Во время эксперимента состояние эксплантата и поведение клеток контролировали ежедневно с помощью инвертированного микроскопа с фазовым контрастом. Для количественной оценки роста культивируемых эксплантатов использовали индекс площади - отношение площади эксплантата вместе с зоной выселяющихся клеток к исходной площади эксплантата.
По окончании эксперимента эксплантаты промывали фосфатным буфером и фиксировали 4% раствором параформальдегида в физиологическом растворе с добавлением 0,01 молярного фосфатного буфера при рН 7,4 в течение 20 минут при 4°С. После промывки фиксированных прикрепленных эксплантатов в фосфатном буфере дно культуральной чашки подсушивали и окружали эксплантаты с выселившимися клетками гидрофобной полоской, после чего проводили их иммуногистохимическую окраску. Для этого использовали метод непрямого иммуногистохимического окрашивания с использованием коктейля моноклональных мышиных антител к маркеру коммитированных нейробластов - β-III тубулину в разведении 1:100 (Chemicon, MAB1637) и поликлональных кроличьих антител к маркеру глиальных клеток - кислому глиальному фибриллярному белку - GFAP в разведении 1:80 (Sigma, G9269). Реакцию с первичными антителами проводили в течение 12 часов при 4°С. После промывки в фосфатном буфере эксплантаты покрывали смесью вторичных антител к иммуноглобулину кролика, меченых Техасским красным (красное свечение при зеленом освещении) и антител к иммуноглобулину мыши, меченых Су 2 (зеленое свечение при синем освещении) оба в разведении 1:100.
В течение первых 5-7 суток культивирования происходило оседание и распластывание эксплантатов сетчатки человека на дне культуральной чашки. Наблюдалось также небольшое количество клеток, выселившихся из эксплантата на дно. При рассматривании в фазовом контрасте на данном этапе эксплантаты сетчатки при культивировании с кондиционной средой от НЕК293/hsp70/gdnf-gfp и без нее по внешнему виду и по количеству выселившихся на дно клеток не отличались. На 14 день культивирования происходит дальнейшее выселение клеток из эксплантата на дно культуральной чашки и их расселение по значительной территории. При диаметре эксплантата 2 мм клетки расселялись на расстояние более 2 мм от первоначальных внешних границ эксплантата. В эксплантатах, культивируемых с кондиционной средой от НЕК293/hsp70/gdnf-gfp, начинают формироваться многочисленные длинные разветвленные отростки, выходящие за пределы эксплантатов и иногда доходящие до эксплантатов, прикрепившихся по соседству. В контроле отростков не наблюдается. На 17 и особенно на 21 сутки культивирования продолжается выселение клеток из эксплантата на дно чашки. В эксплантатах, культивируемых с кондиционной средой от НЕК293/hsp70/gdnf-gfp, происходит дальнейшее увеличение числа отростков, их длины и разветвленности. В эксплантатах, культивируемых с кондиционной средой от НЕК293/ hsp70/gdnf-gfp появляется незначительное количество коротких отростков. (Рис.19 и 20)
Пример 5. Введение трансгенных клеток НЕК293/hsp70/gdnf-gfp в мозг мышей
Для того чтобы проанализировать способность НЕК293, трансфицированных геном gdnf (экспрессирующие также маркерный белок GFP), влиять на клетки мозга реципиента (мыши), эти клетки были инъецированы в кору и стриатум мышей линии Black6, не экспрессирующих белок GFP. Для сравнения свойств трансфицированных клеток с нетрансфицированными были проведены также опыты с инъекциями в мозг мышей линии Black6, не экспрессирующих белок GFP контрольных НЕК293. Операция по введению ЕТ-1. Животное наркотизировали хлоралгидратом и помещали в стереотаксис и после продольного разреза кожи головы открывали доступ к черепу. Отверстие в черепе диаметром 1 мм проделывается согласно координатам АР0 L2,5 с правой стороны. Наркотизированное животное помещается в стереотаксис. С помощью микрошприца, помещенного в устройство микроподачи и соединенного капиллярной трубочкой с иглой, закрепленной в стереотаксисе ET-1 в количестве 1 микрограмм в объеме 1 микролитр, вводится через упомянутое отверстие на глубину 3 мм. Инъекцию проводили в течение 10 минут при постепенном поднятии кончика иглы с глубины 3 мм до глубины 1 мм. Таким образом, эндотелин был введен в комплекс хвостатое ядро-скорлупа и в сенсомоторную область коры мозга мыши.
Введение контрольных и трансфицированных НЕК293/hsp70/gdnf-gfp клеток в ишемизированный мозг. По окончании инъекции ET-1 инъекционную иглу вынимали и на ее место погружали иглу с клеточной суспензией. Инъецировали приблизит