Стабильная жидкая фармацевтическая композиция комплекса 3-(2,2,2-триметилгидразиний) пропионат-2-этил-6-метил-3-гидроксипиридина дисукцината, обладающая антигипоксическим, антиоксидантным и адаптогенным действием
Иллюстрации
Показать всеИзобретение относится к стабильной жидкой фармацевтической композиции, включающей 3-(2,2,2-триметилгидразиний)пропионат-2-этил-6-метил-3-гидроксипиридина дисукцинат в количестве 0,1-50 мас.%, вспомогательные вещества в количестве 0,01-50 мас.% и воду. Заявленное изобретение позволяет получать стабильные фармацевтические составы для инъекционного, перрорального и местного применения, обладающие выраженной антигипоксической, антиоксидантной и адаптогенной активностью. 31 з.п. ф-лы, 1 ил., 14 табл., 60 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины и ветеринарии, а именно к разработке удобных в применении стабильных жидких лекарственных форм нового биологически активного соединения - комплекса 3-(2,2,2-триметилгидразиний) пропионат-2-этил-6-метил-3-гидроксипиридина дисукцината (далее «Комплекс»), обладающего антигипоксическим, антиоксидантным и адаптогенным действием и высокой химической устойчивостью. Жидкие лекарственные формы «Комплекса» могут быть предназначены как для парентерального введения, так и для перрорального и местного применения, что достигается введением в состав необходимых вспомогательных веществ.
Уровень техники
Комплекс 3-(2,2,2-триметилгидразиний) пропионат-2-этил-6-метил-3-гидрокси-пиридина дисукцинат - новое биологически активное соединение (синтезировано ООО «НВЦ Агроветзащита»), полученное на основе двух известных антигипоксантов (сукцината 2-этил-6-метил-3-гидроксипиридина и 3-(2,2,2-триметилгидразиний) пропионата дигидрата), разработанное в связи с тем, что оба эти вещества имеют ряд особенностей физико-химических свойств, создающих сложности при разработке готовых лекарственных форм.
Известны фармацевтические составы на основе сукцината 2-этил-6-метил-3-гидроксипиридина (ЭМГПС) в различных лекарственных формах: растворы для инъекций, гранулированные порошки, капсулы, таблетки для перорального применения, гели, перевязочные материалы (RU 2065299, RU 2144822, RU 2145855, RU 2149648, RU 2293558, RU 2205640, RU 2398583, UA 74283 и др.). Жидкие лекарственные формы имеют значительные преимущества, т.к. позволяют получить быстрый эффект, в частности, при использовании инъекционного способа введения, что важно при острых нарушениях - инфарктах, инсультах и т.п. Другие жидкие лекарственные формы - «капли», удобны для перорального применения в педиатрии и ветеринарии. Лекарственные формы - «спрей», «гель», удобны для наружного применения, в т.ч. в хирургии. Однако ЭМГПС в водных растворах легко окисляется с появлением интенсивного желто-коричневого окрашивания и потерей фармакологической активности, при этом данный эффект наблюдается даже в ампулах, заполненных под инертным газом, т.к. достаточным для окрашивания оказывается тех незначительных количеств воздуха, которые остаются при продувке и попадают в ампулы при запайке. Легкая окисляемость ЭМГПС является препятствием для разработки лекарственной формы «капли» и лекарственной формы «спрей» с механическим распрыскивателем. В патенте RU 2205640, опубл. 10.06.2003 предложено добавлять для стабилизации инъекционных растворов избыток янтарной кислоты, однако при этом раствор становится сильнокислым, что ведет к значительной болезненности инъекций и раздражению кожных покровов в случае формы «спрей»; в то же время, как показывал практический опыт, недостаточно эффективен для защиты от окисления. В патенте RU 2380089 опубл. 27.01.2010 в качестве стабилизатора, предохраняющего от окисления предложено добавлять метабисульфит натрия. При этом окисление и окрашивание раствора ЭМГПС в процессе хранения полностью исключается. Однако данное решение имеет тот недостаток, что сульфиты высокоалергенны и в том числе вызывают приступы бронхиальной астмы у больных с соответствующей бронхолегочной патологией [см. Особые указания для растворов в/в и в/м введения препаратов Метадоксил и Но-шпа на http://www.webvidal.ru]. Даже перроральное введение сульфитов и пиросульфитов с продуктами питания и фармацевтическими препаратами стимулирует развитие аллергических реакций, выведение из организма кальция [Hugot D., Causeret J., Leclerc J. Effets d l′ingest on de sulfites sur l;excretion du calcium chez le rat. Ann. Biol. Anim. Biochim. Biophys., 5, 53-59 (1965)], разрушает тиамин, Bn, биотин, вызывая клинически выраженный авитаминоз [Bhagat В., Lockett M.F., The effect of sulphite in solid diets on the growth or rats. Food Cosmet. Toxicol., 2, 1-13 (1964); Shtenberg A.J., Ignat′ev A.D. Toxicological evaluation of some combinations of food preservatives. Food Cosmet. Toxocol., 8, 369-380 (1970)], повреждает бронхо-легочную систему, сердце, почки, щитовидную железу [Вредные вещества в промышленности. Неорганические и элементоорганические соединения: Справочник. / Под ред. проф. Н.В.Лазарева, Изд.7-е перер. и допол. Л.: Химия, 1977, стр.65; Rehm H.J., Wittmann Н. Beitrag zur Kenntnis der antimikrobiellen Wirkung der schwefligen Saure. II. Mitteilung. Die Wirkung der dissoziierten und imdissoziierten Saure auf verschiedene Mikroorganismen. Z. Lebensin. Unters. Forsch., 120 (6), 465-478 (1963)], угнетает жизненно необходимые ферменты [Gunnison A.F. Sulphite toxicity. A critical review of in vitro and in vivo data. Food Cosmet. Toxicol., 19, 667-682 (1981); Pfleiderer G., Jeckel D., Wieland T. Uber die Einwirkung von Sulit auf einige DPN hidrierende Enzyme, Biochem. Z., 328, 187-194 (1956)] обладает мутагенным действием [Mukai F., Hawryluk I., Shapiro R. The mutagenic specifity of sodium bisulfate. Biochem. Biophys. Res. Commun. 39, 983-988 (1970)]. Поскольку инъекционный ЭМГПС нередко применяют в больших дозах и длительно [RU 2309664, опубл. 10.11.2007; RU 2290930, опубл. 10.01.2007; Справочник ВИДАЛЬ. Лекарственные препараты в России: Справочник. М.: АстраФармСервис, 2011, стр.Б-856], очевидны недостатки использования метабисульфита натрия в качестве стабилизатора инъекционной формы препарата, т.к. с одной стороны, возможна индукция фатального приступа бронхиальной астмы, с другой - углубление и усиление патологических изменений в сердечно-сосудистой системе и почках, нарушение функции щитовидной железы. В клиническом смысле использование сульфитов или пиросульфитов как стабилизаторов ЭМГПС значительно сужает сферу применения высокоэффективного препарата, оставляя без необходимости адекватной терапии большой контингент больных.
Следует отметить, что известный ЭМГПС (мексидол, мексикор, мексифин и др.) обладает рядом физико-химических свойств, препятствующих разработке удобных жидких лекарственных форм:
1. Растворы ЭМГПС имеют pH от 4,2 до 4,5, а при увеличении pH свыше 5 скорость окисления резко возрастает и раствор коричневеет за несколько дней
2. При повышении pH до физиологических значений (6÷7) из концентрированных (более 5%) растворов ЭМГПС выпадает малорастворимая двузамещенная соль
3. ЭМГПС образует со многими органическими соединениями (в т.ч. с кофакторами - пиридоксальфосфатом, рибофлавин-5-нуклеотидом и др.) малорастворимые комплексы.
Еще больше технологических проблем связано с использованием 3-(2,2,2-триметилгидразиний) пропионата дигидрата (мельдония) - данный препарат является очень неустойчивым гидратом, теряющим воду и изменяющим качество уже при температуре более 25-3°C. С другой стороны, мельдоний очень гигроскопичен. Субстанция мельдония при хранении очень быстро слеживается и требует в последующем размола. При изготовлении инъекционных форм водный раствор мельдония сильно выщелачивает стекло, и при этом практически не обладает буферными свойствами (и даже напротив, оказывает дифференцирующий эффект при изменении pH) - в результате после стерилизации и хранения инъекционный раствор становится щелочным выше допустимого предела и ускоряется разрушение мельдония с образованием токсичного триметиламина. Инъекционные растворы мельдония при контроле качества быстро разрушают pH-чувствительные стеклянные электроды, что также вызывает определенные технологические трудности и ведет к экономическим потерям. Щелочные растворы мельдония (с pH выше 8) при внутримышечной инъекции болезненны и могут вызвать некроз тканей.
Таким образом, известные жидкие фармацевтические составы с антигипоксическим действием, содержащие в качестве действующего вещества ЭМГПС или мельдоний, обладают рядом недостатков, ограничивающих их применение.
Раскрытие изобретения
Задачей данного изобретения является расширение ассортимента стабильных фармацевтических составов с антигипоксическим, антиоксидантным и адаптогенным действием, пригодных для изготовления инъекционных и инфузионных форм, а также лекарственных форм для перрорального применения (капли, сироп) и наружного применения (спрей, гели, мази). Поставленная задача решается использованием в качестве действующего вещества высокоактивного как антигипоксанта и антиоксиданта, и в то же время химически стабильного комплекса 3-(2,2,2-триметилгидразиний) пропионат-2-этил-6-метил-3-гидроксипиридина дисукцината (далее «Комплекс»). При этом достигается не только хорошая стабильность лекарственных форм при хранении, но и выраженный синергический эффект фрагментов Комплекса, выражающийся в возрастании биологического действия, в то время как токсичность Комплекса по сравнению с его фрагментами сильно снижается. Это объясняется влиянием Комплекса на разные элементы патогенетического механизма при гипоксии: 2-этил-6-метил-3-гидроксипиридин оказывает прямое антиоксидантное действие на перекисное окисление липидов в мембранах клеток, а 3-(2,2,2-триметилгидразиний) пропионат препятствует накапливанию короткоцепочечных жирных кислот и развитию ацидоза в цитоплазме клетки, нормализуя обмен веществ в условиях гипоксии.
При проведении клинических исследований разработанных лекарственных форм препарата Комплекс выявлено значимое адаптогенное действие [см. примеры 43-48]. Подобно всем стерически затруденным фенолам, препарат in vivo при различной патологии оказывал прямое антиоксидантное действие, что выражается в значительном снижении уровня перекисного окисления по сравнению с контролем в тканях разных органов; выраженное антиоксидантное действие на клетки печени можно рассматривать как гепатопротекторное действие [примеры 49]. При этом защитное действие достаточно селективно по отношению к тканям макроорганизмов - по отношению к патогенам, защитное действие не проявляется, в т.ч. к простейшим (бабезии [пример 43], патогенным клещам [пример 42]; Комплекс не препятствует развитию акарицидного эффекта амитраза.
Комплекс обладает очень высокой растворимостью в воде, что облегчает разработку лекарственных форм «капли» и «спрей». Высокая растворимость Комплекса при отсутствии склонности к образованию малорастворимых продуктов с разными веществами (что характерно для ЭМГПС) позволяет вводить в состав жидких лекарственных форм большой ассортимент вспомогательных веществ, в результате чего удается разработать препараты с оптимальным патогенетическим лечебным воздействием на то или иное заболевание. При этом возможна адаптация лекарственной формы для специфического контингента пациентов - к примеру, для детей и животных.
Из значимых вспомогательных веществ в составе стабильных жидких фармацевтических композиций, использование которых часто необходимо для решения поставленных задач, можно выделить следующие группы: консерванты-бактериостатики; добавки, корректирующие вкус; добавки, обладающие местно-анестезирующим действием; электролиты; гелеобразователи и другие.
Для нестерильных перроральных и для местного применения форм важна возможность введения в стабильный жидкий фармацевтический состав необходимых количеств консервантов-бактериостатиков, в особенности подавляющих рост плесневых грибов. В качестве таковых можно использовать либо индивидуальные вещества, разрешенные для использования в пищевой и фармацевтической промышленности, либо их сочетания. Наиболее эффективны и безопасны сорбиновая кислота или ее фармацевтически приемлемые соли, бензойная кислота или ее фармацевтически приемлемые соли; но можно использовать также эфиры п-оксибензойной кислоты (парабены), с меньшей эффективностью такие спирты, как 1,2-пропиленгликоль, бензиловый спирт, 2-феноксиэтанол.
В процессе исследований было обнаружено, что традиционные антибиотики с относительно узким спектром действия, в силу чего не используемые в качестве консервантов, в фармацевтических составах с достаточно высоким содержанием Комплекса проявляют бактериостатическое действие столь широкого спектра, что также делает возможным их использование в качестве консервантов. Это можно наблюдать при использовании доксициклина (в виде основания или фармацевтически приемлемой соли), и/или азитромицина (в виде основания или фармацевтически приемлемой соли), и/или спирамицина (в виде основания или фармацевтически приемлемой соли), и/или рокситромицина (в виде основания или фармацевтически приемлемой соли), и/или кларитромицина (в виде основания или фармацевтически приемлемой соли), и/или мидекамицина (в виде основания или фармацевтически приемлемой соли), и/или линкомицина (в виде основания или фармацевтически приемлемой соли), и/или клиндамицина (в виде основания или фармацевтически приемлемой соли), и/или хлорамфеникола, и/или тиамфеникола, и/или флорфеникола, и/или ципрофлоксацина (в виде основания или фармацевтически приемлемой соли), и/или бензидамина (в виде основания или фармацевтически приемлемой соли), и/или тербинафина (в виде основания или фармацевтически приемлемой соли), и/или нафтифина (в виде основания или фармацевтически приемлемой соли), и/или гексетидина (в виде основания или фармацевтически приемлемой соли). При этом фармацевтические композиции Комплекса, предназначенные для местного применения в хирургии, при использовании в их составе в качестве консервантов высокоэффективных антибиотиков, могут оказывать не только ранозаживляющее, антиоксидантное, местное иммуностимулирующее действие, но и прямое воздействие на патогенный агент, что позволяет упростить терапевтические процедуры.
Возможность применения антибиотиков в качестве консервантов в фармацевтических составах с Комплексом реализуется и тем, что отсутствует образование нерастворимых аддуктов Комплекса и антибиотика, характерное, к примеру, для ЭМГПС и мельдония в индивидуальном состоянии.
В качестве консервантов-бактериостатиков для фармацевтических составов Комплекса можно использовать и известные четвертичные аммонийные соли: 1,2-этилен-бис-(N,N-диметил-карбодецил-оксиметил)аммония дихлорид, и/или декаметилен-бис(триметиламмоний бромид), и/или 1,10-Декаметилен-бис(N,N- диметилментоксикарбонилметал)аммония дихлорид, и/или бензилдодецил-диметиламмония хлорид, и/или додецилдиметил(2-феноксиэтал)аммония бромид, и/или бензилдиметил[3-(миристоиламино)пропил]аммоний хлорид, и/или
гексадецилтриметал-аммония бромид- в этом случае также не образуются осадки, и обеспечивается достаточно широкий спектр бактериостатической активности композиции. Для усиления дополнительных полезных эффектов (антибактериальное действие, иммуностимулирующее и т.п.) или улучшения потребительских свойств (реология, внешний вид, запах и т.п.) можно применять сочетание нескольких консервантов-бактериостатиков из числа указанных. Концентрация бактериостатиков, может быть в интервале 0,01-5,0%, в зависимости от эффективности антимикробного действия и состава стабильной фармацевтической композиции. К примеру, растворы Комплекса с фруктозой [пример 18] требуют повышенных концентраций консервантов.
Использование фармацевтического состава с очень низким (ниже 4,5) или очень высоким (более 7,5) pH характеризуется значительной болезненностью внутримышечных инъекций, а в случае местного применения возможно повреждение кожных покровов. Поэтому в состав указанных композиций целесообразно вводить слабые органические основания, образующие буферные системы и поддерживающие значение pH на оптимальном уровне (регуляторы кислотности). В этом качестве могут быть использованы органические соединения, по меньшей мере, с одной азотсодержащей группой - как относительно биологически инертные (диизопропиламин и/или трет-бутиламин), так и обладающие высокой биологической активностью в нужном для разрабатываемого препарата спектре (2-диметиламиноэтиловый эфир бензгидрола, и/или 1-метил-2[2-(α-метил-п-хлорбензгидрилокси)этил]пирролидин, и/или N-диметиламиноэтил-N-(п-хлорбензил)аминопиридин, и/или 3,6-диметил-9-(2-метилпиридил-5)этил-1,2,3,4-тетрагидро-γ-карболин, и/или 3 -метил-9-бензил-1,2,3,4-тетрагидрокарболин, и/или N,N-ди(2,4-ксилилиминометил)метиламин, и/или (E)-N-(6,6-диметил-2-гептен-4-инил)-N-метил-1-нафтилметиламин, и/или (Е)-N-циннамил-N-метил-1-нафтилметиламин, и/или 1,3-бис(2-этилгексил)-5-метил-1,3-диазинан-5-амин).
Для регулирования кислотности еще более выгодно использовать органические соединения, по меньшей мере, с одной азотсодержащей группой, и, по меньшей мере, с одной кислородсодержащей протонодонорной группой. В качестве кислородсодержащей протонодонорной группы здесь предполагают гидроксил (например, моноэтаноламин, и/или диэтаноламин, и/или триэтаноламин, и/или диметиламиноэтанол, и/или диэтиламиноэтанол, и/или меглюмин, и/или триоксиметиламинометан, и/или 2-этил-6- метил-3-гидроксипиридин) либо карбоксил (например, декспантенол, и/или доксициклин (основание), и/или азитромицин (основание)). Для этих соединений характерна высокая растворимость в воде, отсутствие выраженного запаха, несколько меньшая основность аминогрупп, что облегчает доведение pH до нужного уровня. Ряд из этих соединений обладают значимой, хотя и не очень выраженной, терапевтической активностью - проявляют гепатопротекторное действие (диметиламиноэтанол, этаноламин), ноотропное (диметиламиноэтанол) и т.п., что также полезно.
Очень удобно для поддержания нужного значения pH использовать хорошо растворимые и являющиеся сами буферными системами аминокислоты, из них наиболее удобны технологически L-лизин и L-аргинин. Кроме этого, можно использовать глицин, и/или L-α аланин, и/или β-аланин. Эти регуляторы кислотности также обладают значимой и полезной биологической активностью. В качестве основания можно вводить триметилгидразинийпропионата дигидрат, образующий в водных растворах буферную систему с гидросукцинат-ионами, входящими в структуру молекулы Комплекса, в этих случаях спектр биологической активности фармацевтической композиции не подвергается изменению, что иногда имеет значение. Триметилгидразинийпропионата дигидрат можно вводить в виде концентрированных водных растворов или в виде порошка.
В качестве добавок улучшающих вкус перроральных стабильных лекарственных форм, могут быть использованы многоатомные спирты, такие как ксилит, и/или сорбит, и/или сахара (фруктоза и проч.). Правда, экспериментально установлено, что растворы Комплекса, содержащие альдегидосахара (глюкоза и др.), постепенно желтеют; но растворы с фруктозой стабильны. Известно, что сладкий вкус воспринимается как приятный, и человеком, и большинством животных, в том числе и птицами. Поэтому стабильные жидкие лекарственные формы, обладающие приятным сладко-кислым вкусом, охотно поедаются животными. При этом водные растворы многоатомных спиртов обладают высокой растворяющей способностью по отношению к Комплексу.
Высокоэффективно и целесообразно в качестве корректирующей вкус добавки введение в состав фармацевтической композиции глицирризиновой кислоты или ее фармацевтически приемлемых солей. Помимо очень выраженного сладкого вкуса, глицирризиновая кислота и ее соли обладает противовоспалительным, антибактериальным и противовирусным действием. Ее также можно использовать в сочетании с вышеперечисленными многоатомными спиртами.
Для стабильных жидких лекарственных форм, предназначенных для наружного применения у животных, важной задачей является подавление «вылизывания», т.к. собаки и кошки склонны к вылизыванию ран, в результате препарат убирается с «мишени» и животное получает непредсказуемую дозу биологически активного вещества, что может быть опасным. Для многих видов животных наиболее просто эта проблема решается введением в состав препарата фармацевтически приемлемых веществ с сильным горьким вкусом. Наиболее известен алкалоид хинин (в виде основания или фармацевтически приемлемой соли), обладающий также противовоспалительной и противопротозойной активностью. Однако хинин в настоящее время дорог и мало доступен. Экспериментально установлено, что высокой горечью, препятствующей вылизыванию, обладают также общеизвестные препараты: пирацетам, и/или хлорамфеникол, и/или метронидазол, дифенгидрамин (в виде основания или фармацевтически приемлемой соли), тиамфеникол, флуфеникол, линкомицин (в виде основания или фармацевтически приемлемой соли), клиндамицин (в виде основания или фармацевтически приемлемой соли) и некоторые другие. При этом пирацетам - известный ноотроп, тканевый метаболический антигипоксант и хороший растворитель для Комплекса; обладает также свойствами пинетранта, облегчая абсорбцию Комплекса с кожных покровов. Хлорамфеникол, тиамфеникол, флуфеникол, линкомицин, клиндамицин и метронидазол - известные эффективные антибиотики. Дифенгидрамин - активный антигистаминный препарат, проявляющий сильное местно-анастезирующее действие.
Для лечения ран, различных кожных повреждений, ожогов целесообразно введение в лекарственные формы для местного применения достаточно сильного, но безопасного анестетика. Использование высокорастворимых анестетиков амидной или эфирной группы (дикаин, лидокаин, новокаин, пирокаин, артикаин) возможно, но часто не безопасно из-за высокой абсорбции с раневой поверхности в кровоток и проявление кардиотоксического действия. Ряд препаратов этой группы в процессе метаболизма может к тому же образовывать производные п-аминобензойной кислоты, стимулирующей рост микрофлоры в ране (к примеру, новокаин). Поэтому более целесообразно применение с указанной целью препаратов иных групп, обладающих сильным местно-анестезирующим действием, среди которых наиболее приемлемы известные антигистаминные препараты - дифенгидрами (в виде основания или фармацевтически приемлемой соли), и/или клемастин (в виде основания или фармацевтически приемлемой соли), и/или димебон (в виде основания или фармацевтически приемлемой соли), и/или мебгидролин (в виде основания или фармацевтически приемлемой соли), оказывающие кроме местно-анестезирующего значительное противовоспалительное и иммуномодулирующее действие, а также в ряде случаев подавляющие резистентность микрофлоры к антибиотикам. В качестве некардиотоксичного препарата-анестетика можно использовать бензофурокаин (в виде основания или фармацевтически приемлемой соли), обладающий также ненаркотическим центральным анальгетическим действием и стимулирующий микроциркуляцию крови в тканях. Сильным местно-анестезирующим действием при отсутствии кардиотоксичности обладает эффективный противовоспалительный препарат бензидамин (в виде основания или фармацевтически приемлемой соли); кроме этого, он обладает широким спектром антибактериальной активности. Указанные аспекты фармацевтической активности бензидамина делают целесообразным его использование в составах «Комплекса», предназначенных для местного применения.
В качестве анестетика возможно использование ацетиламинонитропропоксибензола, оказывающего как и бензидамин анальгетическое и антисептическое действие. Все отмеченные анестетики могут применяться в составах «Комплекса» самостоятельно или в сочетании друг с другом.
В ряде случаев, при тяжелых заболеваниях, определенные преимущества имеет инфузионное введение достаточно разбавленных лекарственных веществ; это позволяет поддерживать стабильную и оптимальную концентрацию лекарственного вещества в кровотоке, тогда как при других способах введения концентрация меняется, особенно в случае быстро метаболизирующих препаратов. В патенте RU 2398583, опубл. 10.09.2010 предложен инфузионный раствор на основе ЭМГПС; в качестве вспомогательного вещества предложен хлористый натрий, обеспечивающий необходимую осмотичность препарата. Комплекс, в отличие от ЭМГПС, позволяет использовать в составе инфузионного раствора наряду с солями натрия, соли калия, и/или магния, и/или кальция в концентрациях, эквивалентных концентрации в плазме крови, что обеспечивает лучшую переносимость препарата, меньшую вероятность побочных эффектов (пример 6); к тому же Комплекс сам более безопасен и не проявляет характерные для высоких доз ЭМГПС нейротоксические эффекты, при большей выраженности терапевтических эффектов.
В хирургии для эффективного использования антигипоксантов-антиоксидантов, обладающих ранозаживляющим действием, препятствующих развитию фиброза, стимулирующих местный иммунитет, необходимы специальные лекарственные формы (спреи, гели). Спреи удобно применять для нанесения на рану или смачивания салфеток, но гель - более предпочтительная форма, поскольку его легко наносить на раневую поверхность и он может долго удерживаться в необходимой зоне. Известна разработка [RU 2259816, опубл. 10.09.2005] геля ЭМГПС, однако он не получил широкого применения, в частности из-за значительного раздражающего действия. На основе Комплекса возможна разработка ряда удобных и эффективных гелей для хирургии - как медицинской, так и ветеринарной (примеры 26, 27). Гелевые формы удобно использовать в стоматологии в качестве эффективного средства лечения парадонтоза и других заболеваний десен (пример 28). Поскольку мельдоний и все его производные стимулируют циркуляцию лимфы и оказывают лечебное воздействие при различных формах лимфостаза; с этой целью можно использовать технологически более удобный Комплекс; в этом случае также удобна гелевая форма (пример 29). В качестве гелеобразователей - модификаторов реологических свойств можно использовать различные эфиры целлюлозы - натрий карбоксиметилцеллюлозу, и/или метилцеллюлозу, и/или оксипропилцеллюлозу, и/или оксиэтилцеллюлозу, смешанные эфиры типа оксиэтилметилцеллюлозы и другие (пример 26, 27). В качестве гелеобразователей-«загустителей» можно использовать такие полимеры как поливинилпирролидон и/или специальные акрилатные полимеры марки «ойдражит». Большой интерес представляет использование природных полимеров - агара, и/или пектина, и/или гиалуроновой кислоты и ее фармацевтически приемлемых солей, и/или низкомолекулярного хитозана и его фармацевтически приемлемых производных, и/или желатина, и/или полисахаридов, и/или хондроитинов в виде фармацевтически приемлемых солей. Эти модификаторы реологических свойств сами обладают значимыми терапевтическими эффектами (пример 28, 29).
Высокая устойчивость Комплекса в водных растворах и отсутствие образования малорастворимых аддуктов с кислотами и другими фармацевтическими агентами позволяют разрабатывать на основе Комплекса сложные эффективные стабильные лекарственные формы, содержащие естественные метаболиты, оказывающие определенные терапевтические эффекты. В качестве естественных метаболитов можно использовать инозин, и/или глицин, и/или аргинин, и/или лизин. Известен препарат цитофлавин [http://www.rlsnet.ru/tn_index_id_23160.htm], представляющий собой сочетание янтарной кислоты как антигипоксанта, рибоксина, ряда кофакторов и витаминов. Поскольку янтарная кислота «in vivo» довольно слабый антигипоксант с очень быстрым метаболизмом, ее замена на высокоэффективный и безопасный Комплекс позволит значительно увеличить терапевтическую эффективность препарата (пример 7). В качестве кофакторов можно использовать рибофлавин, и/или кокарбоксилазу, и/или пиродоксальфосфат
Перроральная стабильная жидкая лекарственная форма, содержащая Комплекс, аминокислоты и витамины, обладающая гепатопротекторным и нейропротекторным действием (характерное свойство всех эффективных антиоксидантов), может быть использована в наркологии, в частности для быстрого и безопасного купирования абстинентного синдрома при алкоголизме и наркомании, в качестве вспомогательного средства при процедуре детоксикации (пример 18).
Предлагаемые жидкие лекарственные формы на основе Комплекса более стабильны, чем инъекционные препараты с ЭМГПС, однако при наличии технических условий выгодно использовать в качестве стабилизатора углекислоту. Наполнение флаконов под углекислотой или, по меньшей мере, использование углекислоты в качестве инертного газа при фильтрации раствора через мембраны позволяет несколько увеличить стабильность водных растворов Комплекса.
Для оральных жидких лекарственных форм, которые невозможно изолировать от постоянного контакта с окружающей средой, в качестве дополнительного стабилизатора, как показали опыты, эффективно введение ингибиторов окисления из класса стерически затрудненных фенолов, способных образовывать в цепных реакциях окисления очень стабильные радикалы, обрывая тем самым радикальные цепи. Т.к. большинство этих ингибиторов окисления очень плохо растворимы в водных системах, наиболее удобно использовать полиоксиэтилированные стерически затрудненные фенолы, которые к тому же препятствуют кристаллизации компонентов фармацевтической композиции при значительном охлаждении; это упрощает хранение и перевозку продукции. В настоящее время на рынке доступен полиоксиэтилированный токоферол (торговое название «Ферол A»), наиболее удобный в качестве стабилизатора жидких оральных форм на основе Комплекса (см. пример 33, 39), это позволяет увеличить допустимый срок хранения до 5 лет и снизить требования к температурному режиму при хранении и перевозке препарата. Можно также использовать близкие по свойствам синтетические водорастворимые антиоксиданты, например полиоксиэтилированный ионол или полиоксиэтилированный 2,4,6-тритретбутилфенол.
Таким образом, использование в составе жидких лекарственных форм стабильного к окислению и гидролизу «Комплекса» позволяет разработать большой ассортимент лекарственных препаратов с антигипоксантным, антиоксидантным и адаптогенным действием для инъекционного, перрорального и местного применения. Примеры реализации наиболее актуальных для медицины и ветеринарии стабильных жидких лекарственных форм приведены в примерах 1-50, которые, однако, не исчерпывают весь спектр возможных стабильных жидких лекарственных форм на основе «Комплекса».
Биологические эффекты некоторых из заявленных стабильных фармацевтических композиций приведены в примерах 40-50.
Краткое описание чертежей
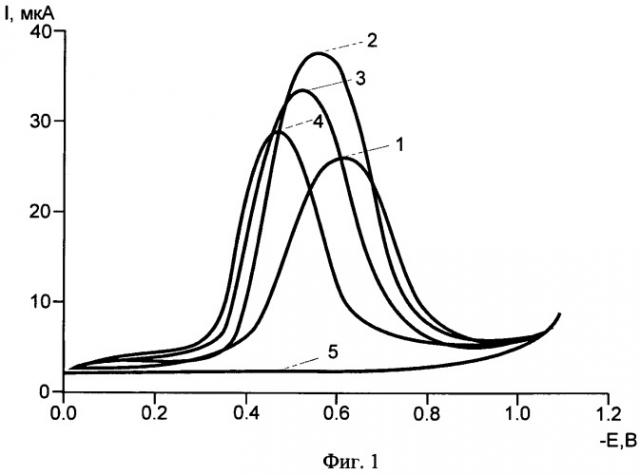
На Фиг.1 показаны вольтамперограммы тока электровосстановления кислорода в фоновом электролите (фосфатный буфер pH 6,86) в зависимости от времени протекания процесса.
Линия 1 - в отсутствии «Комплекса» (1)
Линия 2 - через 60 сек
Линия 3 - через 120 сек
Линия 4 - через 180 сек
Линия 5 - линия остаточного (фонового) тока в отсутствии кислорода в растворе Концентрация «Комплекса» 0,5 мг/мл.
Пример 1 (5% инъекционная форма)
В предварительно простерилизованный мерный стакан вместимостью 2 л загружают 1900 мл воды для инъекций, при перемешивании стеклянной палочкой вносят 100 г Комплекса, перемешивают до полного растворения, добавляют воду до объема 2 л. После исчезновения кристаллов Комплекса раствор фильтруют через пакет фильтров с диаметром пор 0,45 мкм и 0,22 мкм, разливают в токе азота в ампулы светозащитного стекла по 2 мл, запаивают в токе азота и стерилизуют автоклавированием при 122±1°C в течение 8 минут. Ампулы проверят на наличие механических включений, упаковывают по 10 штук в блистеры, блистеры упаковывают в картонные футляры. Получают 976 ампул, 97 упаковок, раствор в ампулах имеет следующие параметры:
- содержание основного вещества - 5,0%
- цветность - соответствует эталону Y7
- прозрачность - не отличается от воды
Органические примеси:
- содержание 2,6-диметил-3-гидроксипиридина - менее 0,2% в пересчете на основное вещество
- содержание β-аланина - 0,6% в пересчете на основное вещество
- фумаровая кислота - не определяется
- pH - 4,35
Упаковки с ампулами хранят при нормальных условиях. Через 3 года хранения параметры раствора следующие
- содержание основного вещества - 5,0%
- цветность - на уровне эталона Y7
- прозрачность - не отличается от воды
Органические примеси:
- содержание 2,6-диметил-3-гидроксипиридина - менее 0,2% в пересчете на основное вещество
- содержание β-аланина - 0,7% в пересчете на основное вещество
- фумаровая кислота - не определяется
- pH - 4,7
Пример 2 (2,5% инъекционная форма)
В предварительно простерилизованный мерный стакан вместимостью 2 л загружают 1900 мл воды для инъекций, при перемешивании стеклянной палочкой вносят 50 г субстанции Комплекса, перемешивают до полного растворения добавляют воду до объема 2 л. После исчезновения кристаллов Комплекса раствор фильтруют через пакет фильтров с диаметром пор 0,45 мкм и 0,22 мкм, разливают в асептических условиях в токе азота в ампулы по 2 мл из стекла класса НС-3, запаивают в токе азота и стерилизуют автоклавированием при 122±1°C в течение 8 минут. Ампулы проверят на наличие механических включений, упаковывают по 10 штук в блистеры, блистеры упаковывают в картонные футляры. Получают 988 ампул, 98 упаковок, раствор в ампулах имеет следующие параметры:
- содержание основного вещества - 2,5%
- цветность - не отличается от воды
- прозрачность - не отличается от воды
Органические примеси:
- содержание 2,6-диметил-3-гидроксипиридина - не обнаруживается
- содержание β-аланина - 0,5% в пересчете на основное вещество
- фумаровая кислота - не определяется
- pH - 4,48
Упаковки с ампулами хранят при нормальных условиях. Через 3 года хранения параметры раствора следующие:
- содержание основного вещества - 2,5%
- цветность - на уровне эталона Y7
- прозрачность - не отличается от воды
Органические примеси:
- содержание 2,6-диметил-3-гидроксипиридина - не обнаруживается
- содержание β-аланина - 0,7% в пересчете на основное вещество
- фумаровая кислота - не определяется
- pH - 4,51
Пример 3 (50% капли)
В предварительно простерилизованный мерный стакан вместимостью 2 л загружают 1 кг субстанции Комплекса, 10 г сорбата калия, 1 г бензоата натрия и 1 л воды для инъекций. Раствор медленно нагревают до 35-40°C при перемешивании, после полного растворения добавляют воду до объема 2 л, сироп отфильтровывают от механических примесей через крупнопористую стеклянную пластину и разливают во флаконы темного стекла, снабженные капельницами, объемом 50 мл. Получают 39 флаконов, которые упаковывают в пеналы.
Параметры раствора:
- содержание основного вещества - 50%
- цветность - соответствует эталону Y6
- прозрачность - соответствует эталону 1
Органические примеси:
- содержание 2,6-диметил-3-гидроксипиридина - 6,2% в пересчете на основное вещество
- содержание β-аланина - 0,6% в пересчете на основное вещество
- фумаровая кислота - не обнаружено
- pH - 4,22
- вкус - выраженно-кислый без неприятных оттенков
- запах - едва ощутимый, нейтральный
Упаковки с ампулами хранят при нормальных условиях.
Через 3 года хранения при нормальных условиях параметры раствора следующие:
- содержание основного вещества - 50%
- цветность - на уровне эталона Y6
- прозрачность - соответствует эталону 1
Органические примеси:
- содержание 2,6-диметил-3-гидроксипиридина - менее 0,2% в пересчете на основное вещество
- содержание β-аланина - 0,6% в пересчете на основное вещество
- фумаровая кислота - не определяется
- pH - 4,21
- вкус - выраженно-кислый без неприятных оттенков
- запах - едва ощутимый, нейтральный
Во всех просмотренных флаконах механические примеси, в т.ч. связанные с кристаллизацией субстанции, отсутствуют.
Пример 4 (спрей 25%)
Предварительно готовят 50%-ный раствор ксилита, для чего в 2-литровый стакан загружают 1 л воды для инъекций и вносят при перемешивании 1 кг ксилита. Растворение ксилита сопровождается значительным снижением температуры, поэтому стакан подогревают, поддерживая температуру 20-25°C. Готовый раствор фильтруют на воронке с крупнопористой стеклянной пластиной. Для приготовления раствора для спрея в стакан помещают 1 л раствора ксилита, раствор подогревают до 25-30°C и при перемешивании вносят 500 г субстанции Комплекса, перемешивают до растворения и добавляют раствор ксилита до объема 2 л. К раствору добавляют 1 г сорбиновой кислоты, перемешивают до растворения и фильтруют через фильтр с крупнопористой пластиной. Раствор фасуют в флаконы темного стекла объемом 100 мл, снабженные микронасосом («спрей»). Флаконы упаковывают в картонные пеналы.
Параметры раствора на момент фасовки:
- содержание основного (действующего) вещества - 25%
- цветность - соответствует эталону Y6
- прозрачность - соответствует эталону N1
Органические примеси:
- содержание 2,6-диметил-3-гидроксипиридина - не обнаруживается
- содержание Рβ-аланина - 0,5% в пересчете на основное вещество
- фумаровая кислота - не обнаруживается
- pH - 4,22
- вкус - кисло-сладкий без неприятных оттенков
- запах - едва ощутимый, н