Способ реализации термоабляции опухоли костей
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии. Определяют место расположения и размер опухоли. Намечают точки для ввода основных и дополнительных нагревателей. Высокотемпературный нагрев (термоабляцию) проводят в два этапа. На первом этапе проводят термоабляцию вокруг опухоли в пределах здоровой ткани кости. Для этого в намеченные точки вокруг опухоли под воздействием ультразвуковых колебаний вводят основные нагреватели, определяя внутреннюю нагреваемую объемную область. После этого проводят первый этап термоабляции при температуре основных нагревателей не менее 65. Заданную температуру стабилизируют в течение всего времени воздействия. На втором этапе проводят полную термоабляцию всей внутренней нагреваемой объемной области ткани кости. Для этого в область кости, заключенную между основными нагревателями, в намеченные точки под воздействием ультразвуковых колебаний вводят дополнительные нагреватели. После этого осуществляют высокотемпературную абляцию при температуре всех (основных и дополнительных) нагревателей не менее 65°C. Заданную температуру нагревателей стабилизируют в течение всего времени воздействия. Способ позволяет обеспечить равномерную и стабильную высокотемпературную абляцию опухоли кости в пределах здоровых тканей, за счет чего снижается вероятность метастазирования и возможность снизить объем хирургического вмешательства. 6 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к области медицины и ветеринарии, а именно к способу реализации метода высокотемпературной деструкции (термоабляции) ткани кости, заключающемуся в высокотемпературном воздействии на патологически измененные участки кости человека или животного.
Как отмечено в [1. Патент РФ №2468796, МПК (2006.01), A61K 31/541, A61K 31/54, A61K 31/00, A61P 35/00, A61P 19/08, опубликовано 10.12.2012, Бюл. №34], раковые опухоли костей относятся к злокачественному несоответствующему норме росту, обнаруженному в костях, например, к ним относятся первичные опухоли костей, такие как остеосаркома. К опухолям костей также могут относиться вторичные или метастатические опухоли, обнаруженные в костях, которые распространяются из других органов, например груди, легких и простаты. Кроме того, остеосаркома является наиболее распространенной опухолью костей также у собак и обычно поражает собак среднего возраста и крупного размера. Эта форма рака встречается у собак в десять раз чаще, чем у людей. В данной области медицины существует потребность в развитии методов лечения рака кости.
В [1] описан способ лечения рака кости без применения термического воздействия. Согласно способу [1], частично удаляют опухоль кости у субъекта. После этого производят обработку области, примыкающей к тому участку кости, где опухоль была, по меньшей мере, частично удалена, гелем, содержащим тауролидин, таурултам, их смесь или их раствор, находящийся в равновесном состоянии. В предпочтительных вариантах осуществления этого изобретения гель является рассасывающимся. Особенно предпочтительно, если это гель на водной основе, включающий фибриллярный белок с поперечными сшивками или состоящий из него.
Кроме того, в настоящее время для лечения опухоли кости используют прямое термическое воздействие на опухолевую ткань с целью ее разрушения - абляцию опухоли. Наиболее распространенными являются радиочастотная абляция, ультразвуковая абляция, лазерная абляция, микроволновая абляция [2. Vogl TJ, Helmberger TK, Mack MG, Reiser MF (eds) Percutaneous Tumor Ablation in Medical Radiology. 2008, Springer-Verlag, Berlin, Heidelberg, New York pp 258]. Каждый способ имеет свои достоинства и недостатки.
Из уровня техники известна система фокусированного воздействия ультразвуком высокой интенсивности для сканирования и лечения опухолей [3. Патент на изобретение RU №2210409, опубликован 20.08.2003, МПК A61N 7/02, A61F 7/00]. Согласно этому способу фокусируют ультразвук высокой интенсивности (HIFU), который используют как для сканирования (определения места положения и формы опухоли), так и для лечения опухолей. Для этого формируют из ультразвуковых волн объемную точку с высокой энергией (фокальную зону). Энергия в этой зоне достигает свыше 1000 Вт/см2 и температура мгновенно повышается до >70°C. Воздействуют сформированной фокальной зоной на опухолевую ткань. При этом разрушающее воздействие проводят в фиксированной точке (для опухолей размером менее 1 см3), или в последовательных точках (для опухолей размером более 1 см3), при этом две соседние точки разрушения перекрываются на 1/10-1/2 часть для того, чтобы обеспечить полное разрушение опухолевой ткани. В случае, когда опухолевая ткань имеет форму длинных тяжей, осуществляют непрерывное разрушающее воздействие, то есть облучение проводят однократно в течение 30 с. Применение ультразвука для абляции костной ткани описано так же в монографии [2]. Принципиальные недостатки способа, описанного в [3], связаны с закономерностями распространения УЗ колебаний в тканях человеческого тела и заключаются в следующем, во-первых, при использовании метода деструкции с применением ультразвука практически невозможно избежать поражения здоровых клеток организма даже при сколь угодно высоком уровне фокусирования ультразвуковых колебаний, что требует в свою очередь проведения точного сканирования формы опухоли и ее места расположения. Во-вторых, ультразвук практически полностью отражается от кортикального слоя кости. В-третьих, ультразвук может изменять направление при переходе из одной среды в другую. Эти недостатки существенно ограничивают возможности применения данного способа случаями расположения опухоли на поверхности или около поверхности кости. Кроме того, осуществление данного способа требует специального сложного дорогого оборудования и высококвалифицированных специалистов как в области медицины, так и в области специальной техники.
Из уровня техники известен способ оперативного лечения опухолей костей [4. Патент РФ №2087132, МПК A61B 17/56, A61B 17/22, опубликовано 20.08.1997 г.]. Согласно этому способу опухоль удаляют путем резекции, после чего осуществляют пластику дефекта кости костными трансплантатами с применением дренажной системы. Для этого после удаления опухоли в стенках остаточной костной полости формируют дренажные отверстия в количестве, определяемом ее величиной и достаточном для свободного оттока крови в окружающие мягкие ткани. Этот способ позволяет предупредить формирование гематомы и нагноение в остаточной костной полости после удаления опухоли. Однако данный способ основан на хирургическом вмешательстве, существенно ослабляет кость, требует костных трансплантатов и не исключает метастазирование.
Из уровня техники известен патент [5. Патент РФ №2217088, опубликован 27.11.2003, МПК A61B 17/56, A61B 18/20], в котором описан способ лечения доброкачественных опухолей и опухолеобразных поражений костей у детей [6. Л.В. Прокопова, Н.Г. Николаева. Сравнительная оценка результатов сохранных операций при доброкачественных опухолях и опухолеподобных поражениях костей у детей. Ортопедия, 5, 1991, с.61-65.], который является наиболее близким по технической сути и взят за прототип. После определения места расположения и размера опухоли, согласно способу [6] в компактном слое кости образуют окно, через которое удаляют патологические ткани, а здоровые ткани остаточной костной полости подвергают обработке CO2-лазером (лазерная абляция). При резком истончении кортикальных стенок их удаляют вместе с патологическими тканями, а стенки, сохраняющие механическую прочность, подвергают лазерной обработке. Этот способ, как и аналог [4], позволяет предупредить формирование гематомы и нагноение в остаточной костной полости после удаления опухоли, благодаря обработке костной полости CO2-лазером. Однако способ [6] достаточно травматичен для пациентов, так как очень часто сильно ослабляется механическая прочность кости, что в определенных случаях требует осуществления пластики и укрепления кости. Кроме того, лазерная обработка проводится высокосфокусированным лучом, что допускает возможность появления необработанных участков поверхности остаточной костной полости (неравномерная термоабляция). Кроме того, этот способ не исключает метастазирования, потому что лазерную обработку костной полости проводят после удаления патологического очага, когда метастазы уже могут быть унесены кровотоком при проведении его резекции. Кроме того, для реализации данного способа требуется узкоспециализированное дорогостоящее оборудование - CO2-лазер. Эти недостатки снижают эффективность способа [6] и снижают возможность его широкого применения.
Задачей изобретения является повышение эффективности локальной термоабляции опухоли кости при одновременном снижении травматичности способа за счет уменьшения объема хирургического вмешательства.
Технический результат заключается в обеспечении равномерной и стабильной высокотемпературной абляции опухоли кости в пределах здоровых тканей при одновременном упрощении реализации заявляемого способа и повышении возможности его широкого применения.
Для решения задачи и достижения технического результата заявляемый способ, как и прототип, содержит такие общие операции, как определение места расположения и размера опухоли с последующим высокотемпературным воздействием на кость в пределах здоровых тканей.
В отличие от прототипа в заявляемом способе высокотемпературному воздействию (термоабляции) подвергают как здоровые, так и опухолевые ткани кости. Термоабляцию осуществляют путем непосредственного нагрева ткани кости в заданных точках, при этом нагрев проводят в два этапа. На первом этапе проводят термоабляцию вокруг опухоли в пределах здоровой ткани. Для этого в намеченные точки вокруг опухоли под воздействием ультразвуковых колебаний вводят основные нагреватели, определяя внутреннюю нагреваемую объемную область. После этого осуществляют высокотемпературную абляцию при температуре основных нагревателей не менее 65°C, при этом стабилизируют заданную температуру в течение всего времени воздействия. На втором этапе проводят полную термоабляцию всей внутренней нагреваемой объемной области ткани кости, заключенной между основными нагревателями и включающей как здоровые, так и опухолевые ткани. Для этого в область кости, заключенную между основными нагревателями, в намеченные точки под воздействием ультразвуковых колебаний вводят дополнительные нагреватели. После этого осуществляют высокотемпературную абляцию при температуре всех (основных и дополнительных) нагревателей не менее 65°C, стабилизируя заданную температуру в течение всего времени воздействия всех нагревателей.
В частных случаях на первом этапе высокотемпературной абляции температура основных нагревателей составляет 90-95°C при времени воздействия 8-12 минут. На втором этапе высокотемпературной абляции температура всех (основных и дополнительных) нагревателей составляет 90-95°C при времени воздействия 20-25 минут. Основные нагреватели располагают в намеченных точках на удалении 8-12 мм друг от друга и на расстоянии не менее 5-7 мм от границы опухолевой ткани кости. Дополнительные нагреватели располагают в намеченных точках опухолевой ткани кости равномерно и на удалении 8-12 мм друг от друга. Введение основных и дополнительных нагревателей осуществляют под воздействием ультразвуковых колебаний с частотой 20-25 кГц и амплитудой 10-100 мкм.
В частном случае нагреватель выполняют в виде иглы.
Из уровня техники в известных источниках информации не выявлен способ реализации термоабляции кости, характеризующийся той же совокупностью признаков, что и заявляемый способ. Это подтверждает новизну заявляемого способа.
Из уровня техники не обнаружены имеющие перспективу широкого применения способы термоабляции опухоли кости, в которых равномерная и стабильная высокотемпературная абляция как здоровых, так и опухолевых тканей снижает травматичность способа за счет уменьшения объема хирургического вмешательства, связанного с удалением части пораженной кости, как например, в аналогах [1, 4] и прототипе [6]. Опухоль, подвергнутая термоабляции, остается внутри кости. И как отмечено в [3] «медицинские исследования показали, что когда разрушенная опухоль остается в теле, она усиливает иммунитет организма; в конечном счете, она рассасывается в организме и замещается фиброзной тканью». То есть при реализации термоабляции предлагаемым способом отсутствует необходимость непременной хирургической операции. Это обеспечивается тем, что термоабляцию проводят в два этапа. На первом этапе проводят термоабляцию вокруг опухоли. Для этого в намеченные точки вокруг опухоли вводят основные нагреватели, определяя внутреннюю нагреваемую объемную область. После этого проводят первый этап термоабляции при температуре основных нагревателей не менее 65°C, стабилизируя заданную температуру. Результат первого этапа термоабляции, как и в известном из уровня техники способе, описанном в [7. Патент РФ №2467720, МПК A61B 18/12, A61N 7/00 (2006.01), опубликован 27.11.2012, Бюл. №33], основан на том, что тепловые поля, излучаемые нагревателями (нагревательными иглами в [7]), расположенными в намеченных точках вокруг опухоли в пределах здоровых тканей, суммируются друг с другом, образуя внутреннюю нагреваемую объемную область (внутреннюю нагреваемую зону в [7]), включающую опухолевую ткань и часть здоровой ткани, ограниченной нагревателями. Здоровая ткань, находящаяся за пределами нагревателей, нагревается незначительно. Это связано с тем, что в здоровых тканях происходит эффективный отвод тепла вследствие хорошего кровотока и отсутствует суммирование тепловых полей. Тепловые поля от каждого основного нагревателя перекрываются между собой и все вместе образуют замкнутую внутреннюю нагреваемую объемную область биоткани с нарушенным кровоснабжением, охватывающую опухоль (фиг.2, 3 в [7]) и позиция 9 фиг.3 заявляемого способа. Нарушенное кровоснабжение биоткани в объемной области уменьшает отходящий от нее поток тепла, а также вызывает дополнительное разрушение клеток опухоли за счет гипоксии (недостатка кислорода в тканях), что повышает эффективность термоабляции (локальной гипертермии в [7]). Этот результат подтверждается экспериментальными исследованиями авторов как в заявляемом способе, так и в источнике [7]. Однако в известном способе [7] этот результат доказан при введении нагревателей в мягкие ткани, тогда как в заявляемом способе - в ткани кости. Кроме того, в [7] используется температура воздействия 45°C, в заявляемом же способе температура воздействия является более высокой и составляет не менее 65°C, что позволяет создать вокруг пораженной ткани кости не только замкнутую объемную область биоткани с нарушенным кровоснабжением как в [7], но и получить дополнительный технический результат, а именно создать границу объемной области, прогретую до температуры коагуляции белка, т.е. обеспечить разрушение (обжигание) тканей.
На втором этапе проводят полную термоабляцию всей внутренней нагреваемой объемной области. Для этого в намеченные точки в нагреваемую объемную область под воздействием ультразвуковых колебаний вводят дополнительные нагреватели и осуществляют высокотемпературную абляцию при температуре всех (основных и дополнительных) нагревателей не менее 65°C, стабилизируя их заданную температуру в течение всего времени воздействия. На втором этапе термоабляции высокотемпературному воздействию подвергаются как здоровые, так и опухолевые ткани всей внутренней нагреваемой объемной области. При этом ее граница оказывается подвергнутой двойному высокотемпературному воздействию, что в еще большей степени способствует изоляции опухолевой ткани кости от здоровой. При этом двойному высокотемпературному воздействию подвергается часть опухолевой ткани кости, непосредственно прилегающая к здоровой ткани, что еще в большей степени снижает вероятность метастазирования. Заявляемый способ прост в реализации, так как высокотемпературная абляция осуществляется путем передачи тепла в пораженную ткань кости нагревателями и не требует узкоспециализированного дорогостоящего оборудования как в [3, 6].
Изобретение явным образом для специалиста не следует из уровня техники и соответствует, по мнению заявителей, требованиям критерия охраноспособности «изобретательский уровень».
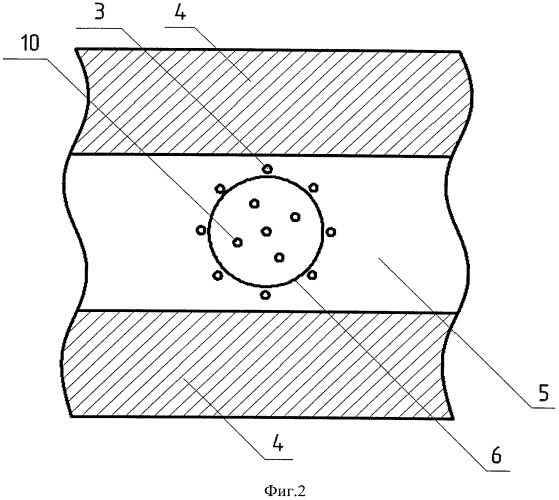
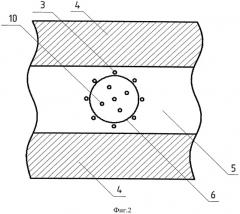
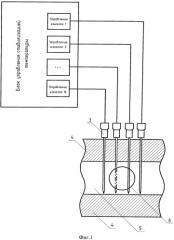
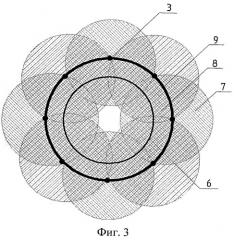
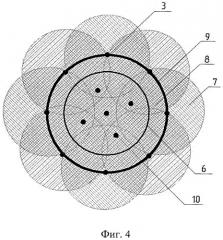
Способ поясняется чертежами и примером конкретного выполнения. На фиг.1 показаны схема устройства для реализации заявляемого способа и схематичное изображение разреза кости в плоскости, параллельной установленным нагревателям. На фиг.2 схематично показан разрез кости в плоскости, перпендикулярной установленным нагревателям. На фиг.3 схематично показано наложение тепловых полей, образованных основными нагревателями, расположенными вокруг опухоли (первый этап термоабляции). На фиг.4 схематично показано наложение тепловых полей, образованных всеми (основными и дополнительными) нагревателями, расположенными как вокруг, так и внутри опухоли (второй этап термоабляции).
Заявляемый способ может быть реализован с помощью устройства, показанного на фиг.1. Это устройство содержит блок управления стабилизацией температуры, имеющий управляющие каналы 1, 2, … N, с основными нагревателями 3 фиг.1 и дополнительными нагревателями 10 фигуры 2 и 4. Позицией 4 на фиг.1 обозначен кортикальный слой костной ткани, позицией 5 - губчатая ткань кости, 6 - контур опухоли. На фигурах 3 и 4 использованы следующие обозначения: 7 - тепловые поля, образованные основными нагревателями; 8 - зоны наложения тепловых полей, образованных основными нагревателями (зона абляции или внутренняя нагреваемая объемная область биоткани с нарушенным кровоснабжением); 9 - граница внутренней нагреваемой объемной области, подвергаемая двойной высокотемпературной абляции.
Суть заявляемого способа рассмотрена на конкретном примере, в котором высокотемпературному воздействию подвергалась бедренная кость животного (свиньи), при этом количество основных нагревателей было равно 8, а дополнительных - 5, фиг.4. После определения места локализации опухоли, при помощи рентгеновского исследования, наметили точки для ввода основных нагревателей 3 и дополнительных 10, определяя тем самым внутреннюю нагреваемую объемную область. Далее по намеченным точкам с помощью ультразвукового устройства через кортикальный слой костной ткани 4 в губчатую ткань кости 5, фиг.1, вводили основные нагреватели 3 на равном удалении друг от друга вокруг опухоли 6, фиг.3. Расстояние от границы опухоли 6, фиг.2, до нагревателей не менее 5 мм. При введении нагревателей 3 под воздействием ультразвуковых колебаний с частотой 22 кГц и амплитудой 45 мкм произошло нарушение кровоснабжения и прижигание каналов введения нагревателей вследствие явления кавитации. После введения основных нагревателей 3 фиг.3, осуществляли первый этап высокотемпературной абляции при температуре основных нагревателей 95°C в течение 10 минут, при этом с помощью блока управления стабилизацией температуры фиг.1 поддерживали температуру на заданном уровне в течение всего времени воздействия. Тепловые поля 7 от основных нагревателей 3 образовали внутреннюю нагреваемую объемную область с границей 9 вокруг опухоли 6 фиг.3. Температура ткани на границе 9 по показаниям термодатчиков (не показаны) составила 92-93°C. В центре опухоли 6 температура составила 62-64°C. Таким образом, на первом этапе термоабляции образовалась граница внутренней нагреваемой объемной области, прогретая до температуры, вызывающей коагуляцию белка. Это приводит к нарушению кровоснабжения опухоли и к снижению вероятности распространения метастазов.
На втором этапе в область кости, заключенную между основными нагревателями 3, в намеченные ранее точки под воздействием ультразвуковых колебаний с частотой 22 кГц и амплитудой 45 мкм вводили дополнительные нагреватели 10 фиг.4. После этого осуществляли полную высокотемпературную абляцию всеми нагревателями (основными 3 и дополнительными 10) при температуре 95°C в течение 25 минут, стабилизируя заданную температуру в течение всего времени воздействия. Наложение тепловых полей от нагревателей 3 и 10, фиг.4, привело к тому, что температура во всей внутренней нагреваемой области, включая ее границу 9, достигла 92-94°C.
Таким образом, высокотемпературному воздействию подвергался весь объем кости, заключенный между основными нагревателями, а граница внутренней нагреваемой объемной области 9 была подвергнута двукратному высокотемпературному воздействию на том же уровне температуры, что в еще большей степени вызвало повреждение опухолевой ткани и обеспечило снижение вероятности метастазирования. Проведенная термоабляция позволяет снизить объем хирургического вмешательства, связанного с удалением опухоли, а в ряде случаев предоставляет возможность полностью отказаться от операции. Указанное обстоятельство имеет особенно важное значение при наличии множественного поражения костей скелета у ослабленных больных.
Все параметры в заявляемом способе определены экспериментально. Приведенный конкретный пример способа реализации термоабляции опухоли кости не исключает использования для этой цели других устройств. Изобретение промышленно применимо. Заявляемый способ является простым с точки зрения его применения, так как его реализация возможна с помощью известных и доступных устройств и блоков с достижением указанного технического результата.
1. Способ реализации термоабляции опухоли костей, заключающийся в определении места расположения и размера опухоли с последующим высокотемпературным воздействием на костную ткань, отличающийся тем, что высокотемпературному воздействию - термоабляции подвергают как здоровые, так и опухолевые ткани кости, при этом нагрев проводят в два этапа: на первом этапе проводят термоабляцию вокруг опухоли в пределах здоровой ткани кости, для этого в намеченные точки вокруг опухоли под воздействием ультразвуковых колебаний вводят основные нагреватели, определяя внутреннюю нагреваемую объемную область и проводят первый этап термоабляции при температуре основных нагревателей не менее 65°C, стабилизируя заданную температуру в течение всего времени воздействия; на втором этапе проводят полную термоабляцию всей внутренней нагреваемой объемной области ткани кости, для этого в область кости, заключенную между основными нагревателями, в намеченные точки под воздействием ультразвуковых колебаний вводят дополнительные нагреватели и осуществляют высокотемпературную абляцию при температуре всех (основных и дополнительных) нагревателей не менее 65°C, стабилизируя их заданную температуру в течение всего времени воздействия.
2. Способ реализации термоабляции опухоли костей по п.1, отличающийся тем, что на первом этапе высокотемпературной абляции температура основных нагревателей составляет 90-95°C при времени воздействия 8-12 минут.
3. Способ реализации термоабляции опухоли костей по п.1, отличающийся тем, что на втором этапе высокотемпературной абляции температура всех (основных и дополнительных) нагревателей составляет 90-95°C при времени воздействия 20-25 минут.
4. Способ реализации термоабляции опухоли костей по п.1, отличающийся тем, что основные нагреватели располагают в намеченных точках на удалении 8-12 мм друг от друга и на расстоянии не менее 5-7 мм от границы опухолевой ткани кости.
5. Способ реализации термоабляции опухоли костей по п.1, отличающийся тем, что дополнительные нагреватели располагают в намеченных точках опухолевой ткани кости равномерно и на удалении 8-12 мм друг от друга.
6. Способ реализации термоабляции опухоли костей по п.1, отличающийся тем, что основные и дополнительные нагреватели вводят под воздействием ультразвуковых колебаний с частотой 20-25 кГц и амплитудой 10-100 мкм.
7. Способ реализации термоабляции опухоли костей по п.1, отличающийся тем, что нагреватели выполняют в виде иглы.