Соли изофосфорамидного иприта и его аналогов
Иллюстрации
Показать всеНастоящее изобретение относится к эффективному для лечения гиперпролиферативных заболеваний кристаллическому соединению, имеющему формулу (I)
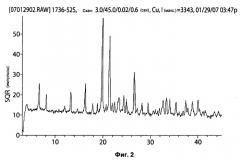
где A+ представляет собой сопряженную кислоту трис(гидроксиметил)аминометана (Tris); Х и Y независимо друг от друга представляют собой хлор, температура плавления которого составляет 103,37°С-105,77°С, и спектр рентгеновской порошковой дифракции представлен на Фигуре 2, а также его применению для лечения различных онкологических заболеваний. Предложено новое кристаллическое соединение, обладающее повышенной стабильностью, эффективное для лечения гиперпролиферативных заболеваний. 7 н. и 8 з.п. ф-лы, 32 ил., 2 табл., 16 пр.
Реферат
Предпосылки создания изобретения
Аутопсии солдат, погибших во время Первой мировой войны, показали, что сернистый иприт оказывает диспропорциональный эффект на быстро делящиеся клетки, на основании чего было сделано предположение, что соединения сернистого иприта могут оказывать противоопухолевый эффект. В действительности, ранее некоторые исследователи пытались лечить раковые заболевания путем непосредственного введения сернистого иприта в опухолевую ткань. Эти исследования ограничивались чрезвычайно высокой токсичностью соединений сернистого иприта, поэтому были предложены аналоги азотистого иприта, такие как мехлорэтамин, которые являются менее токсичными.
Поскольку большинство аналогов мехлорэтамина обладают недостаточной селективностью действия, были разработаны пролекраства, такие, как соединения фосфорамида, которые могут активироваться за счет высокой концентрации фосфорамидаз, присутствующих в неопластических клетках. Наиболее эффективными считаются два фосфорамидных алкилирующих агента, циклофосфамид (СРА, от англ. Cyclophosphamide) и его изомерное соединение Ифосфамид (Ifos).
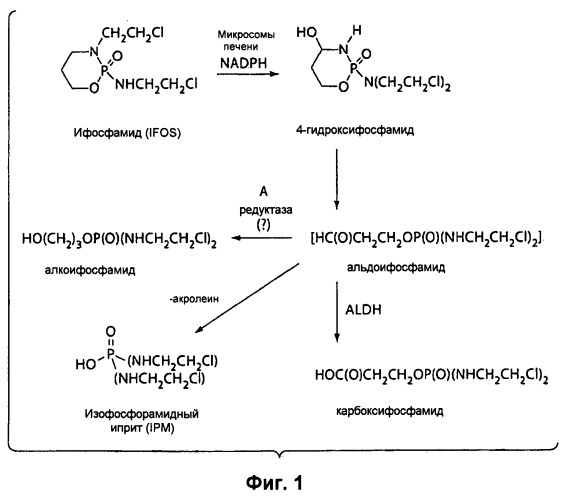
Согласно Рис.1, изофосфорамидный иприт (IPM, от англ. Isophosphoramide Mustard) является обычным метаболитом СРА и Ifos. Считается, что IPM обладает лишь частью той противоопухолевой активности, которой обладают СРА и Ifos. Попытки использовать чистый IPM в качестве противоопухолевого агента оказались неудачными, частично по причине нестабильности соединения. IPM был синтезирован, была проведена предварительная оценка его биологических свойств, но, к сожалению, IPM является слишком нестабильным соединением, чтобы можно было его выделить и использовать для лечения человека.
Краткое описание изобретения
В настоящем изобретении раскрываются кристаллические соединения, имеющие формулу (I)
где А+ представляет собой алифатическое аммониевое соединение; а Х и Y независимо друг от друга являются уходящими группами.
Согласно определенным вариантам своего осуществления, изобретение относится к фармацевтическим композициям, включающим соединение по формуле (I) и фармацевтически приемлемый растворитель или наполнитель. Также в изобретении описываются способы получения таких соединений и композиций.
Кроме того, в настоящем изобретении описывается лиофилизат и способ получения лиофилизата, включающего изофосфорамидный иприт (IPM) и/или аналог IPM, один или более эквивалент основы, и эксципиент. Согласно определенным вариантам осуществления изобретения, способ включает обеспечение контакта кристаллической соли IPM или его аналога и алифатического амина, такого, как трис(гидроксиметил)аминометан (Tris), или смеси IPM и его аналогов и одного или более алифатического амина (предпочтительно, в соотношении, приблизительно, 1:1 IPM или его аналога к амину или аминам) с водой с последующей лиофилизацией полученной смеси. Согласно определенным вариантам осуществления изобретения, исходная смесь и конечный лиофилизат содержать эксципиент, такой как маннитол, безводная лактоза, сахароза, D(+)-трегалоза, декстран 40 или повидон (PVP К24), предпочтительно маннитол.
Такие композиции включают лиофилизаты, предпочтительно, содержащие эксципиент, такой как маннитол, безводная лактоза, сахароза, D(+)-трегалоза, декстран 40 или повидон (PVP K24), предпочтительно маннитол, и соединение по формуле
где А+ представляет собой аммониевое соединение, выбранное из группы протонированных (сопряженных с кислотой) или четвертичных форм алифатических аминов и ароматических аминов, включая основные аминокислоты, гетероциклические амины, замещенные и незамещенные пиридины, гуанидины и амидины; а Х и Y независимо друг от друга являются уходящими группами.
Также в настоящем изобретении раскрываются фармацевтические композиции, адаптированные для перорального введения, включающие фармацевтически приемлемый растворитель или эксципиент и соединение, заявленное в соответствии с настоящим изобретением.
Согласно определенным вариантам своего осуществления, изобретение относится к способам лечения гиперпролиферативных заболеваний, например, при помощи соединений или композиций, заявленных в соответствии с изобретением. Согласно определенным вариантам своего осуществления, изобретение относится к лечению гиперпролиферативных заболеваний, к которым относятся лейкозы, включая острые лейкозы (такие, как острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелогенный лейкоз и миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный лейкозы и эритролейкоз), хронические лейкозы (такие, как хронический миелоцитарный (гранулоцитарный) лейкоз, хронический миелогенный лейкоз и хронический лимфоцитарный лейкоз), истинная полицитемия, лимфома, болезнь Ходжкина, неходжкинская лимфома (медленно растущие формы и высокодифференцированные формы), множественная миелома, макроглобулинемия Вальденстрема, болезнь тяжелых цепей, миелодиспластический синдром, волосяноклеточный лейкоз и миелодисплазия.
Дополнительными примерами заболеваний, для лечения которых могут использоваться соединения и композиции, заявленные в соответствии с настоящим изобретением, являются твердые опухоли, такие как саркомы и карциномы, включая, без ограничений указанными, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, циклофосфамид (СРА)-устойчивую саркому, и другие саркомы, синовиому, мезотелиому, опухоль Эвинга, лейомиосаркому, рабдомиосаркому, карциному толстой кишки, лимфонеоплазии, рак поджелудочной железы, рак груди, рак легких, рак яичников, рак предстательной железы, гепатоцеллюлярную карциному, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, медуллярную карциному, бронхогенную карциному, почечноклеточную карциному, гепатому, карциному желчных протоков, хориокарциному, опухоль Вильмса, цервикальный рак, опухоли яичек, карциному желчного пузыря и опухоли ЦНС (такие как глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, менингиома, меланома, нейробластома и ретинобластома).
Краткое описание Рисунков
На Рисунке 1 представлена схема, иллюстрирующая метаболизм ифосфамида, включая образование акролеина и изофосфорамидного иприта.
На Рисунке 2 представлены результаты рентгеновской порошковой дифрактометрии IPM•Tris.
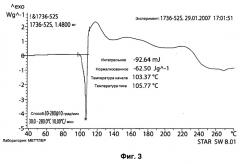
На Рисунке 3 представлена дифференциальная сканирующая калориметрия (DSC, от англ. Differential Scanning Calorimetry) IPM•Tris.
На Рисунке 4 представлен термогравиметрический анализ (TGA, от англ. Thermogravimetric Analysis) IPM•Tris.
На Рисунке 5 представлены результаты сканирующей электронной микроскопии (SEM, от англ. Scanning Electron Microscope) кристаллической соли IPM•Tris.
На Рисунке 6 представлен сравнительный анализ действия IPM•(LYS)2 и IPM•Tris на ксенотрансплантат рака груди человека МХ-1.
На Рисунке 7 представлен сравнительный анализ противоопухолевой активности IP и IPM•Tris при пероральном введении на МХ-1 ксенотрансплантат рака груди человека.
На Рисунке 8а представлена вариабельность маркеров RD и RH30 клеток рабдомиосаркомы при обработке их IPM•(LYS)2 в различных концентрациях.
На Рисунке 8b представлена вариабельность маркеров SKES1 и SKPNDW клеток саркомы Эвинга при обработке их IPM•(LYS)2 в различных концентрациях.
На Рисунке 8 с представлена вариабельность маркеров OS230, OS229, OS222 и SaOS клеток остеосаркомы при обработке их IPM•(LYS)2 в различных концентрациях.
На Рисунке 8d представлена вариабельность маркеров SY01 и HSSYII клеток синовиальной саркомы при обработке их IPM•(LYS)2 в различных концентрациях.
На Рисунке 9а представлена вариабельность маркеров RH30 клеток рабдомиосаркомы при обработке их IPM•(LYS)2 в различных концентрациях как один раз в день, так и три раза в день.
На Рисунке 9b представлена вариабельность маркеров OS229 клеток остеосаркомы при обработке их IPM•(LYS)2 в различных концентрациях как один раз в день, так и три раза в день.
На Рисунке 10 показано, что введение трех максимальных толерантных доз (MTD, от англ. Maximum Tolerated Dose) IPM•(LYS)2 в клетки циклофосфамид-устойчивой остеосаркомы с маркером OS31, имплантированные мышам женского пола с тяжелым комбинированным иммунодефицитом (scid*/* мыши) СВ17, приводит к существенному замедлению опухолевого роста, в каждом из трех режимов дозирования (контрольном, 175 мг/кг ежедневно 1 раз в день, и 100 мг/кг ежедневно 3 раза в день).
На Рисунке 11 а показана устойчивость клеток остеосаркомы с маркером OS31, имплантированных scid*/* мышам женского пола линии СВ17, к циклофосфамиду, выраженная через относительный объем опухоли, при этом лечение включает введение IPM•(LYS)2 и плацебо.
На Рисунке 11b показана устойчивость клеток остеосаркомы с маркером OS33, имплантированных scid*/* мышам женского пола линии СВ17, к циклофосфамиду, выраженная через относительный объем опухоли, при этом лечение включает введение IPM•(LYS)2 и плацебо.
На Рисунке 12 представлена активность IPM•(LYS)2, выраженная через относительный объем опухоли, при введении его в клетки остеосаркомы с маркером OS31, имплантированные scid*/* мышам женского пола линии СВ17, в дозе 100 мг/кг ежедневно 3 раза в день при сравнении с плацебо.
На Рисунке 13 показан ответ опухоли молочной железы SC MX-1 на интраперитонеальное и пероральное введение солевого раствора ежедневно 1 раз в день в течение 5 дней (режим q1d×5).
На Рисунке 14 показан ответ опухоли молочной железы SC MX-1 на интраперитонеальное введение IPM•Tris, IPM и IPM•(LYS)2 в режиме q1d×5.
На Рисунке 15 показан ответ опухоли молочной железы SC MX-1 на пероральное введение IPM•Tris, IPM и IPM•(LYS)2 в режиме q1d×5.
На Рисунке 16 показан ответ опухоли молочной железы SC MX-1 на интраперитонеальное и пероральное введение солевого раствора в режиме q1d×5.
На Рисунке 17 показан ответ опухоли молочной железы SC MX-1 на интраперитонеальное введение IPM•Tris, IPM и IPM•(LYS)2 в режиме q1d×5.
На Рисунке 18 показан ответ опухоли молочной железы SC МХ-1 на пероральное введение IPM•Tris, IPM и IPM•(LYS)2 в режиме q1d×5.
На Рисунке 19 показан ответ опухолей молочной железы МХ-1 на лечение IPM•Tris в комбинации с доксорубицином в дозе 12 мг/кг в день IPM'Tris, которую вводят однократно в течение 5 дней (q1d×5) и 8 мг/мл доксорубицина, которую вводят 4 раза в день в течение 3 дней (q4d×3).
На Рисунке 20 представлен эффект IPM•Tris на выживаемость, в комбинации с доксорубицином, в дозе 12 мг/кг в день IPM•Tris Q1D×5 и 8 мг/кг доксорубицина Q4D×3.
На Рисунке 21 показан ответ опухолей молочной железы МХ-1 на лечение IPM•Tris в комбинации с доксорубицином в дозе 24 мг/кг в день IPM•Tris Q1D×5 и 8 мг/кг в день доксорубицина Q4D×3.
На Рисунке 22 показан эффект IPM•Tris на выживаемость, в комбинации с доксорубицином, в дозе 24 мг/кг в день IPM•Tris Q1D×5 и 8 мг/кг доксорубицина Q4D×3.
На Рисунке 23 показан ответ опухолей молочной железы МХ-1 на лечение IPM•Tris в комбинации с доксорубицином в дозе 54 мг/кг в день IPM•Tris Q1D×5 и 8 мг/кг в день доксорубицина Q4D×3.
На Рисунке 24 эффект IPM•Tris на выживаемость, в комбинации с доксорубицином, в дозе 54 мг/кг в день IPM•Tris Q1D×5 и 8 мг/кг доксорубицина Q4D×3.
На Рисунке 25 показана токсичность IPM•Tris/доксорубицина при таком комбинированном введении.
На Рисунке 26 ответ опухолей молочной железы МХ-1 на лечение IPM•Tris в комбинации с доцетакселем в дозе 54 мг/кг в день IPM•Tris Q1D×5 интраперитонеально и 10 мг/кг в день доцетакселя Q6D×3 внутривенно.
На Рисунке 27 ответ опухолей молочной железы МХ-1 на лечение IPM•Tris в дозе 36 мг/кг в день интраперитонеально или в дозе 81 мг/кг в день перорально.
На Рисунке 29 представлена фармакокинетика IPM•Tris при пероральном и внутривенном введении крысам женского пола Спраг-Доули.
На Рисунке 30 представлена площадь под фармакокинетической кривой (AUC) с увеличением доз IPM•Tris при пероральном и внутривенном введении.
На Рисунке 31 представлена Cmax с увеличением доз IPM•Tris при пероральном и внутривенном введении.
На Рисунке 32 представлена стабильность IPM в буферном растворе при pH 7.0 и 25°С.
Подробное описание изобретения
I. Соли IPM и его аналогов
Заявленные композиции включают кристаллические соли IPM или его аналогов. Согласно определенным вариантам осуществления изобретения, заявленные соли включают один или более катион. Согласно определенным вариантам осуществления изобретения, катионами могут быть сопряженная с аминным основанием кислота или четвертичный аммониевый катион.
Согласно определенным вариантам осуществления изобретения, заявленные кристаллические соединения включают соли IPM или его аналогов. Такие соединения включают кристаллические соединения, имеющие формулу (I):
где А+ представляет собой аммониевое соединение, выбранное из группы протонированных (сопряженных с кислотой) или четвертичных форм алифатических аминов и ароматических аминов; а Х и Y независимо друг от друга являются уходящими группами. Согласно определенным вариантам осуществления изобретения, Х и Y независимо друг от друга представляют собой галоген. Предпочтительно, Х и Y являются одинаковыми соединениями. Согласно таким вариантам осуществления изобретения, Х и Y оба представляют собой Cl.
Отдельными примерами подходящих сопряженных с аминными основаниями кислот являются, без ограничений указанными, кислоты сопряженные с моно-, бис- или трис-(2-гидроксиэтил)амином, 2-гидрокси-терт-бутиламином, N,N-диметил-N-(2-гидроксиэтил)амином, и трис(гидроксиметил)аминометаном (Tris).
Согласно определенным вариантам своего осуществления, изобретение относится к соединениям, включающим кристаллические соли IPM или его аналогов, при этом IPM или его аналог и противоион, предпочтительно, Tris, находятся в соотношении от 2:1 до 1:2, предпочтительно, 1:1. Согласно определенным вариантам осуществления изобретения, кристаллическая композиция включает более чем одну полиморфную форму кристаллов, например, две, три, четыре или даже пять полиморфных кристаллических форм. Согласно еще одному альтернативному варианту осуществления изобретения, кристаллическая композиция включает единичную полиморфную кристаллическую форму. Согласно определенному варианту осуществления изобретения, такие соли являются более стабильными, чем IPM и его аналоги в форме свободных кислот.
Согласно определенным вариантам осуществления изобретения, соединение представляет собой кристаллическую соль с соотношением IPM:Tris, составляющим 1:1.
Согласно еще одному варианту осуществления изобретения, температура плавления кристаллического твердого вещества составляет, приблизительно, от 100 до 110°С, приблизительно, от 102 до 108°С, приблизительно, от 103 до 106°С, или даже от 105 до 106°С.
Согласно определенным вариантам осуществления изобретения, соединение, например, кристаллическая соль с соотношением IPM:Tris 1:1, является, по крайней мере, приблизительно, на 80% химически чистой, по крайней мере, на 85% химически чистой, по крайней мере, на 90% химически чистой, по крайней мере, на 95% химически чистой, по крайней мере, на 98% химически чистой, или даже по крайней мере на 99% химически чистой. Согласно данным вариантам осуществления изобретения, содержание примесей в изолированном веществе не превышает 1% по весу. Согласно определенным вариантам осуществления изобретения, степень химической чистоты измеряют относительно всех других компонентов композиции, в то время как согласно другим вариантам осуществления изобретения (например, если соединение является частью фармацевтической композиции или лиофилизированной смеси), степень химической чистоты может измеряться относительно продуктов распада соединения (например, фосфорсодержащих продуктов распада соединения), или побочных продуктов, образующихся в процессе получения соединения (например, фосфорсодержащих продуктов распада соединения), тем самым исключаются другие соединения, целенаправленно добавляемые в композицию.
Согласно определенным вариантам осуществления изобретения, заявленные соединения представляют собой соли IPM или его аналогов, при этом период полураспада такой соли при комнатной температуре (например, около 23°С) в присутствии воды, больше, чем период полураспада IPM (например, в форме свободной кислоты) в присутствии воды при тех же условиях. Согласно данному определенному варианту осуществления изобретения, соль IPM имеет период полураспада в присутствии воды, равный периоду полураспада самого IPM или превышающий его, по крайней мере, в два раза в присутствии воды, более предпочтительно превышающий его, по крайней мере, в пять раз.
Согласно определенным вариантам осуществления изобретения, заявленные соединения представляют собой соли IPM или его аналогов, при этом указанные соли являются стабильными при комнатной температуре в присутствии воды, по крайней мере, в течение одного дня, двух дней, трех дней, четырех дней, пяти дней, шести дней, или даже в течение недели.
Используемый здесь термин "стабильный" означает, что химическая чистота соли IPM или его аналога по прошествии периода времени (например, одного месяца, двух месяцев, трех месяцев, шести месяцев, года и т.д.) составляет, по крайней мере, 90%, по крайней мере, 95%, по крайней мере, 97%, или даже, по крайней мере, 99% от исходной величины, которая может быть определена, например, при помощи HPLC с использованием испарительного детектора светорассеяния (ELSD, от англ. Evaporate Light Scattering Detection). Такое исследование может осуществляться, например, с использованием колонки С18 и изократической системы с мобильной фазой, включающей 0,005 М гептафтормасляной кислоты и 0,1% трифторуксусной кислоты в воде.
Согласно определенным вариантам своего осуществления, настоящее изобретение относится к лиофилизатам, включающим соединение, имеющее формулу:
где А+ представляет собой аммониевое соединение, выбранное из группы протонированных (сопряженных с кислотой) или четвертичных форм алифатических аминов и ароматических аминов, включая основные аминокислоты, гетероциклические амины, замещенные и незамещенные пиридины, гуанидины и амидины; а Х и Y независимо друг от друга являются уходящими группами.
Примерами подходящих аминных оснований (и их соответствующих аммониевых ионов), которые могут использоваться в заявленных соединениях, являются, без ограничений указанными, пиридин, N,N-диметиламинопиридин, диазабициклононан, диазабициклоундецен, N-метил-N-этиламин, диэтиламин, триэтиламин, диизопропилэтиламин, моно-, бис- или трис-(2-гидроксиэтил)амин, 2-гидрокси-терт-бутиламин, трис-(гидроксиметил)аминометан, N,N-диметил-N-(2-гидроксиэтил)амин, три-(2-гидроксиэтил)амин и N-метил-D-глюкамин.
Согласно определенным вариантам своего осуществления, изобретение относится к лиофилизатам, включающим соединение, имеющее формулу:
При этом согласно формуле, В может представлять собой, для каждого n, независимо выбранную основную молекулу. Согласно одному варианту воплощения формулы, соединение В может быть выбрано из группы основных аминокислот, ароматических аминов, замещенных и незамещенных пиридинов, циклических и ациклических гуанидинов, а также циклических и ациклических амидинов. Обычно, n представляет собой число от 1 до 3, таким образом, что формула может включать различные основные группы. Специалисту в данной области очевидно, что представленная структура изофосфорамидного иприта включает кислый протон, и, соответственно, существует преимущественно в форме его сопряженного основания при физиологическом показателе pH и в присутствии основания, такого, как соединение В. Аналогично, В, представляя собой основную группу, существует преимущественно в форме сопряженной кислоты при физиологическом показателе pH и в присутствии изофосфорамидного иприта и аналогов изофосфорамидного иприта. Возможные варианты рассматриваемых соединений представлены в Таблице 1.
| В | n | X | Y |
| лизин | 2 | Cl | Cl |
| NH3 | 2 | Cl | Cl |
| циклогексиламин | 2 | Cl | Cl |
| N-метил-D-глюкамин | 2 | Cl | Cl |
| N,N-диметиламинопиридин | 1 | Cl | Cl |
| Аргинин | 2 | Cl | Cl |
| Лизин | 2 | Cl | -SO2CH3 |
| Лизин | 2 | Br | -SO2CH3 |
| Трис(гидроксиметил)аминометан | 1 | Cl | Cl |
II. Композиции и Методы
Согласно определенным вариантам своего осуществления, настоящее изобретение относится к фармацевтической композиции, включающей соль IPM или его аналога и фармацевтически приемлемый растворитель или эксципиент. Согласно данным вариантам осуществления изобретения, концентрация соли IPM или его аналога в растворе составляет, приблизительно, от 3 мг/мл до, приблизительно, 30 мг/мл, или даже больше. Такие солевые растворы можно приготовить, например, путем растворения кристаллического соединения, имеющего, формулу (I), или лиофилизата IPM или его аналога, заявленного в соответствии с настоящим изобретением, в солевом растворе, например, с одновременным помешиванием при комнатной температуре. Согласно данному варианту осуществления изобретения, солевой раствор приготавливают таким образом, что концентрация хлорида натрия составляет, приблизительно, 0,5%, 0,9%, 2,5%, 2,7%, 3,0%, 4,0%, или даже 5,0%.
Согласно определенным вариантам осуществления изобретения, из кристаллического соединения, имеющего формулу (I) или лиофилизата IPM или его аналога, заявленных в соответствии с настоящим изобретением, может быть приготовлен водный раствор. Такой водный раствор (например, в воде или изотоническом солевом растворе) остается стабильным при комнатной температуре в течение, по крайней мере, 60 минут, 80 минут, 100 минут, 120 минут, 140 минут, или даже, в течение, приблизительно, 160 минут при комнатной температуре.
Согласно определенным вариантам осуществления изобретения, кристаллическое соединение, имеющее формулу (I), такое как соль IPM и Tris, имеет растворимость в воде, по крайней мере, приблизительно, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл или даже 80 мг/мл. Согласно определенным вариантам осуществления изобретения, кристаллическое соединение, имеющее формулу (I), такое, как соль IPM или Tris, имеет растворимость в воде, по крайней мере, приблизительно, 200 мг/мл, по крайней мере, 500 мг/мл, по крайней мере, 800 мг/мл, по крайней мере, 1000 мг/мл, по крайней мере, 1200 мг/мл или даже, по крайней мере, 1400 мг/мл. Согласно определенным вариантам осуществления изобретения, показатель pH раствора кристаллического соединения в воде, составляет, приблизительно, от 4,5 до, приблизительно, 10, например, приблизительно, от 5,0 до 8,5, предпочтительно, приблизительно от 5,0 до, приблизительно, 7.0. Согласно определенным вариантам осуществления изобретения, показатель pH такого раствора равен, приблизительно, 5,0.
Согласно определенным вариантам своего осуществления, изобретение относится к набору, включающему кристаллическое соединение, имеющее формулу I, и солевой раствор.
Лиофилизаты, описанные в настоящем изобретении, включают IPM или его аналоги, которые составляют рецептуру с одним или более эквивалентом основания. Поскольку IPM и его аналоги являются кислото-неустойчивыми и кислыми соединениями, заявленные лиофилизаты являются значительно более стабильными и имеют ряд других преимуществ. Преимущества заявленных композиций, касающиеся их синтеза, стабильности и биологической доступности, будут очевидны специалистам после рассмотрения настоящей заявки. Дополнительными преимуществами IPM и IPM аналогов, которые составляют рецептуру вместе с одним или более эквивалентом основания, являются повышенная растворимость в воде или биологических жидкостях организма.
Согласно определенным вариантам осуществления изобретения, заявленные лиофилизаты, представляют собой соли изофосфорамидного иприта или аналогов изофосфорамидного иприта, включая один или более катион. Согласно определенным вариантам осуществления изобретения, катионом может быть сопряженная с аминным основанием кислота, или четвертичный аммониевый катион. Подходящими противоионами для изофосфорамидного иприта или его аналогов являются сопряженные с основанием кислоты (в данном описании используемые термины, которые относятся к аминам, должны интерпретироваться как их сопряженные кислоты, если в тексте дополнительно не оговаривается, что речь идет об изолированных аминах), включая основные аминокислоты, гетероциклические амины, ароматические амины, пиридины, гуанидины и амидины. Из алифатических аминов наиболее предпочтительными для использования в заявленных соединениях являются ациклические алифатические амины, и также циклические и ациклические ди- и триалкиламины. Кроме того, подходящими противоионами, которые могут использоваться в заявленных соединениях, являются четвертичные аммониевые противоионы. Согласно определенным вариантам осуществления изобретения, такой лиофилизат может дополнительно содержать наполнитель. Подходящими наполнителями являются, без ограничений указанными, маннитол, безводная лактоза, сахароза, D(+)-трегалоза, декстран 40 и повидон (PVP K24).
Согласно определенным вариантам осуществления изобретения, заявленные соединения и композиции, такие как лиофилизаты, являются стабильными при комнатной температуре в течение, по крайней мере, двух недель, по крайней мере, трех недель, по крайней мере, месяца, по крайней мере, в течение двух месяцев, по крайней мере, в течение трех месяцев, или даже, по крайней мере, в течение шести месяцев. Согласно определенным вариантам осуществления изобретения, соли являются стабильными при низких температурах (например, 0°С, 2°С, 4°С, 6°С и т.д.) в течение, по крайней мере, двух недель, по крайней мере, трех недель, по крайней мере, месяца, по крайней мере, в течение двух месяцев, по крайней мере, в течение трех месяцев, или даже, по крайней мере, в течение шести месяцев. Согласно данным вариантам осуществления изобретения, заявленные соединения и композиции, такие как лиофилизаты, являются стабильными в течение, по крайней мере, месяца, по крайней мере, двух месяцев, по крайней мере, четырех месяцев, или даже в течение, по крайней мере, шест и месяцев при низкой температуре (например, от 0°С до 20°С, от 0°С до 10°С, или даже от 2°С до 8°С). Согласно данным определенным вариантам осуществления изобретения, лиофилизат содержит соль IPM или его аналога. Согласно определенным вариантам осуществления изобретения, лиофилизат содержит IPM•Tris или IPM(LYS)2, предпочтительно, IPM•Tris, и, согласно наиболее предпочтительным вариантам осуществления изобретения, такие композиции дополнительно содержат наполнитель, такой как маннитол.
Согласно дополнительному варианту осуществления изобретения, описанные выше соли могут включать второй амин или аммониевую группу. Согласно одному варианту осуществления изобретения, заявленные лиофилизаты содержат более чем один эквивалент амина на каждый эквивалент изофосфорамидного иприта или аналога изофосфорамидного иприта. Такие варианты включают соединения, в которых соотношение амина к изофосфорамидному иприту или его аналогу не является целым числом. Согласно определенным вариантам осуществления изобретения, соотношение амина к изофосфорамидному иприту или аналогу изофосфорамидного иприта составляет два к одному или три к одному. В действительных вариантах осуществления изобретения, получают соли, содержащие два эквивалента азотистого основания на эквивалент изофосфорамидного иприта. Согласно определенным вариантам осуществления изобретения, основание амина, которое используется для получения солей изофосфорамидного иприта или аналога изофосфорамидного иприта, содержит более чем одну азотистую группу; такие основания могут обозначаться термином "многоосновные". Более конкретно, определенными примерами многоосновных оснований, которые могут использоваться в соответствии с настоящим изобретением, являются основания с двумя аминными группами; их обозначают термином "двухосновные". Например, одной из подходящих двухосновных молекул является N,N-диметиламинопиридин, который включает две группы аминного основания.
Определенные заявленные лиофилизаты, включающие изофосфорамидный иприт или его аналоги, содержат две уходящие группы. Без ограничения одной определенной теорией, считается, что две уходящие группы in vivo замещаются биомолекулами нуклеофила, такими, как нуклеиновые кислоты и белки, что обеспечивает перекрестную связь с биомолекулами. Термин "уходящая группа" относится к группе, которая может быть замещена нуклеофилом. Относительно заявленных соединений, термин "уходящая группа" относится к группе, которая может быть замещена с образованием промежуточного соединения азиридиния, или может быть непосредственно замещена биомолекулой нуклеофила, такой, как нуклеиновая кислота, с образованием, например, 7-алкилированного гуанидинового соединения. Примерами походящих уходящих групп являются галогены и сульфонаты (-SO2R). Согласно одному варианту воплощения заявленных солей аналогов изофосфорамида, соединение представляет собой соединение "смешанных" уходящих групп, включая две различные уходящие группы, например, галоген и сульфонат, или два различных галогена, например, бром и хлор. В патенте США номер 6,197,760 Struck раскрывается способ получения таких соединений с разными уходящими группами.
Согласно определенным вариантам осуществления изобретения, лиофилизаты заявленных солей имеют лучшую стабильность при восстановлении в растворе по сравнению с лиофилизатами чистого изофосфорамидного иприта. Согласно данным вариантам осуществления изобретения, лиофилизат, приготовленный из заявленных солей IPM или его аналогов и эксципиента, такой, как лиофилизат IPM или его аналога и Tris, дополнительно содержащий эксципиент, например, наполнитель, такой, как маннитол, и восстановленный в солевом растворе (предпочтительно, 5% растворе хлорида натрия) сохраняет >90% активности в течение, по крайней мере, 30 минут, 60 минут, 90 минут, 120 минут, 140 минут, или даже в течение, приблизительно, 160 минут.
Согласно данному варианту осуществления изобретения, при растворении соли IPM или его аналога, например, IPM•Tris, или лиофилизата из соли IPM или его аналога, например, IPM•Tris, и дополнительного эксципиента, например, наполнителя, такого как маннитол, в солевом растворе сохраняется, по крайней мере, 96%, по крайней мере 97%, по крайней мере, 98%, или даже, по крайней мере, 99% химической чистоты соединения в течение, по крайней мере, 30 минут, 60 минут, 90 минут, 3 часов или даже 4,5 часов и более при комнатной температуре. Согласно определенным вариантам осуществления изобретения, такие восстановленные растворы являются более стабильными, чем восстановленные растворы IPM•(LYS)2 при одинаковых условиях. Согласно данным вариантам осуществления изобретения, восстановленный IPM•(LYS)2 распадается, по крайней мере, в 1,25 раз быстрее, по крайней мере, в 1,5 раза быстрее, по крайней мере, в два раза быстрее, или даже, по крайней мере, в три или четыре раза быстрее, чем соль IPM или его аналога.
Согласно определенным вариантам осуществления изобретения, когда лиофилизат включает соль IPM или его аналога и эксципиент, например, если лиофилизат включает соль IPM или его аналога, Tris, и маннитол, такая смесь имеет растворимость в воде, по крайней мере, приблизительно, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл или даже 80 мг/мл.
Согласно определенным вариантам осуществления изобретения, лиофилизаты заявленных солей IPM или его аналогов являются более стабильными, чем лиофилизаты чистого изофосфорамидного иприта, то есть в форме свободной кислоты. Согласно предпочтительным вариантам осуществления изобретения, лиофилизат заявленных солей имеет более длительный срок хранения, чем лиофилизаты чистого изофосфорамидного иприта, предпочтительно, по крайней мере, в два раза более длительный срок хранения, еще более предпочтительно, по крайней мере, в пять раз более длительный срок хранения. Согласно определенным вариантам осуществления изобретения, лиофилизат состоит из Tris соли IPM, которая может быть как в кристаллической, так и не в кристаллической форме перед растворением.
Как описано выше, согласно определенным вариантам осуществления изобретения, такие лиофилизаты дополнительно содержат эксципиент, например, наполнитель, предпочтительно маннитол. Согласно определенным вариантам осуществления изобретения, лиофилизат содержит наполняющий агент, выбранный из группы, включающей маннитол, безводную лактозу, сахарозу, D(+)-трегалозу, декстран 40 и повидон (PVP K24), предпочтительно, маннитол. Согласно определенным вариантам осуществления изобретения, добавление такого эксципиента может улучшать стабильность лиофилизата, по сравнению с лиофилизатом, не содержащим такого наполнителя. Согласно данному варианту осуществления изобретения, такой лиофилизат является стабильным при температуре, приблизительно, -70°С, приблизительно, -20°С, или даже 5°С, например, в течение одного месяца, двух месяцев, трех месяцев, шести месяцев, девяти месяцев, одного года или даже в течение двух лет и более.
Согласно определенным вариантам осуществления изобретения, если лиофилизат содержит наполнитель, такой, как маннитол, его количество составляет, приблизительно, от 1% до 10%, или, приблизительно, от 1% до 5% (вес/объем). Перед процессом лиофилизации или после восстановления, такие композиции могут содержать, приблизительно, от 15 мг/мл до, приблизительно, 25 мг/мл IPM, и/или амина, такого как Tris в концентрации, приблизительно, от 0,5 до 1,5 М, предпочтительно, приблизительно эквимолярно количеству IPM. Согласно определенным вариантам осуществления изобретения, при получении раствора перед лиофилизацией, вместо последовательного добавления IPM и амина, такого как Tris, как отдельных компонентов, их добавляют вместе в форме кристаллической соли IPM•Tris, как раскрывается в заявке.
Согласно определенным вариантам своего осуществления, изобретение относится к наборам, содержащим заявленный лиофилизат и солевой раствор.
Соединения, заявленные в соответствии с настоящим изобретением, могут вводиться перорально, местно, чрескожно, парентерально, посредством ингаляции или при помощи спрея; при этом они могут вводиться посредством лекарственных форм, содержащих подходящие нетоксичные фармацевтически приемлемые эксципиенты, адъюванты и носители.
Согласно определенным вариантам осуществления изобретения, предпочтительным является парентеральное введение заявленных солей IPM или его аналогов посредством инъекций. Согласно определенным вариантам осуществления изобретения, предпочтительным является пероральное введение заявленных солей IPM или его аналогов. Согласно определенным вариантам осуществления изобретения, при пероральном введении солей IPM и его аналогов наблюдаемые фармакокинетические параметры аналогичны таковым при внутривенном введении. Заявленные агенты могут входить в состав лекарственных форм, содержащих однократную дозу препарата, или несколько доз, в зависимости от конкретного заболевания, состояния пациента, токсичности соединения и других факторов, которые определяет специалист.
Терапевтически эффективное количество соединения или соединений, которые вводятся пациенту, может различаться в зависимости от желаемых эффектов и факторов, указанных выше.
Фармацевтические композиции, предназначенные для введения пациенту, могут содержать носители, уплотнители, растворители, консерванты, буферные агенты, поверхностно-активные вещества и другие агенты в дополнение к основным акти