Способ получения циклогексилалкилкетонов
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения насыщенного алифатического кетона, представленного общей формулой (2):
(где n указывает целое число от 1 до 3; R представляет гидроксильную группу, циклогексильную группу, алкильную группу, имеющую от 1 до 4 атомов углерода, или ацильную группу, имеющую от 1 до 4 атомов углерода), используемого в качестве исходного материала для производства лекарств, агрохимических средств, оптических функциональных материалов и функциональных материалов для электроники. Способ заключается в гидрировании по ядру ароматического кетона, представленного общей формулой (1):
(где n указывает целое число от 1 до 3; R представляет гидроксильную группу, фенильную группу, алкильную группу, имеющую от 1 до 4 атомов углерода, или ацильную группу, имеющую от 1 до 4 атомов углерода), водородом под давлением в присутствии растворителя при температуре от 20 до 120°С и в присутствии катализатора, который несет от 0,1 до 20% масс. атома рутения на носителе. Способ позволяет получить целевой продукт с высокой селективностью. 5 з.п. ф-лы, 24 пр.
Реферат
Область изобретения
Настоящее изобретение относится к превосходному по селективности методу получения насыщенных алифатических кетонов, имеющих циклогексановое кольцо (иногда сокращенно называемых циклогексилалкилкетонами), используемых в качестве различных исходных материалов для производства лекарств, агрохимических средств, оптических функциональных материалов и функциональных материалов для электроники.
Предпосылки создания изобретения
До сих пор в качестве способа приготовления циклогексилалкилкетонов был известен способ получения их из реактива Гриньяра, синтезированного из бромциклогексенов, и хлорида жирной кислоты (см. непатентный документ 1). Известен также способ получения их путем синтеза циклогексанкарбонитрила, за которым следует также реакция его с этилброммагнием (см. непатентный документ 2). Однако вышеупомянутый метод предшествующего уровня техники связан с некоторыми осложнениями, состоящими в том, что процесс является длительным, а удаление отходов, таких как соли металлов и другие, является трудным. Кроме того, в случае, когда ароматический кетон гидрируют водородом под давлением согласно методу прототипа (см. непатентный документ 3), недостатком способа является то, что в результате восстановления карбонильной группы синтезируются не циклогексилалкилкетоны, а алифатические спирты или алкилциклогексаны. Далее, патентный документ 1 описывает способ получения циклогексилалкилкетона, в котором циклогексильная группа имеет алкильный заместитель в результате гидрирования фенилалкилкетона, в котором фенильная группа имеет алкильный заместитель; однако выход в этом процессе составляет примерно 30% или менее.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1: GP A 61-260.032
Непатентные документы
Непатентный документ 1: Rouzaud J., et al., Bull. Soc. Chim. Fr., 1964, 2908-2916
Непатентный документ 2: Doucet, Rumpf, Bull. Soc. Chim. Fr., 1954, 610-613
Непатентный документ 3: Elwin E. Harris, James D'Lanni and Homer Adkins, J. Am. Chem. Soc., 60, 1938, 1467-1470
Сущность изобретения
Задачи, которые должны быть решены изобретением
Целью настоящего изобретения является предложить более технологичный способ получения циклогексилалкилкетонов, который решает проблемы в отношении процесса восстановления и вывода отходов, таких как металлы и другие, и который имеет высокую селективность при гидрировании ядра.
Способы решения проблем
Авторы настоящего изобретения тщательно изучали более технологичный способ получения циклогексилалкилкетонов и в результате нашли, что, когда ароматический кетон гидрируют по ядру водородом под давлением в присутствии катализатора, который несет атом рутения, то можно получить циклогексилалкилкетон, в то же время сохраняя в нем структуру карбонильной группы, и пришли к настоящему изобретению.
Конкретно, настоящее изобретение относится к способу получения насыщенного алифатического кетона, в котором ароматический кетон, представленный общей формулой (1), гидрируют по ядру водородом под давлением в присутствии растворителя при температуре от 20 до 120°С в присутствии катализатора, который несет от 0,1 до 20% масс. атома рутения на носителе, благодаря чему получают циклогексилалкилкетон, представленный общей формулой (2).
Химическая формула (1):
| (1) |
(в химической формуле (1) n указывает целое число от 1 до 3; R представляет гидроксильную группу, фенильную группу, алкильную группу, имеющую от 1 до 4 атомов углерода, или ацильную группу, имеющую от 1 до 4 атомов углерода);
Химическая формула (2):
| (2) |
(в химической формуле (2) n указывает целое число от 1 до 3; R представляет гидроксильную группу, циклогексильную группу, алкильную группу, имеющую от 1 до 4 атомов углерода, или ацильную группу, имеющую от 1 до 4 атомов углерода).
Эффект изобретения
Согласно способу по изобретению циклогексилалкилкетон может быть получен технологически эффективным способом, имеющим высокую селективность гидрирования ядра.
Способ осуществления изобретения
Ароматический кетон
Ароматический кетон для использования в качестве исходного материала в изобретении представляет собой двузамещенное ароматическое соединение, в котором, как показано в общей формуле (1), гидроксильная группа, фенильная группа, алкильная группа, имеющая от 1 до 4 атомов углерода, или ацильная группа, имеющая от 1 до 4 атомов углерода, прикреплена в виде R к ароматической группе в дополнение к присоединенной к ней ацильной группе. С точки зрения селективности получения намеченного продукта без гидрирования ацильной группы предпочтительной в качестве R является гидроксильная группа, фенильная группа или ацильная группа, представленная следующей общей формулой (3).
Химическая формула (3):
| (3) |
(в общей формуле (3) В указывает целое число от 1 до 3).
В общей формуле (1) n указывает целое число от 1 до 3, и с точки зрения переработки соединения в процессе n предпочтительно равно 1 или 2.
В качестве ароматического кетона, представленного общей формулой (1), могут быть приведены, как конкретный пример, п-гидроксиацетофенон, м-гидроксиацетофенон, о-гидроксиацетофенон, п-гидроксипропиофенон, м-гидроксипропиофенон, о-гидроксипропиофенон, п-гидроксибутирофенон, м-гидроксибутирофенон, о-гидроксибутирофенон, п-гидроксиизобутирофенон, м-гидроксиизобутирофенон, о-гидроксиизобутирофенон, 2-ацетилбифенил, 3-ацетилбифенил, 4-ацетилбифенил, 2-пропионилбифенил, 3-пропионилбифенил, 4-пропионилбифенил, п-фенилбутирофенон, м-фенилбутирофенон, о-фенилбутирофенон, п-фенилизобутирофенон, м-фенилизобутирофенон, о-фенилизобутирофенон, п-метилацетофенон, м-метилацетофенон, о-метилацетофенон, п-метилпропиофенон, м-метилпропиофенон, о-метилпропиофенон, п-метилбутирофенон, м-метилбутирофенон, о-метилбутирофенон, п-метилизобутирофенон, м-метилизобутирофенон, о-метилизобутирофенон, п-этилацетофенон, м-этилацетофенон, о-этилацетофенон, п-этилпропиофенон, м-этилпропиофенон, о-этилпропиофенон, п-этилбутирофенон, м-этилбутирофенон, о-этилбутирофенон, п-этилизобутирофенон, м-этилизобутирофенон, о-этилизобутирофенон, п-пропилацетофенон, м-пропилацетофенон, о-пропилацетофенон, 4-н-бутилацетофенон, 4-изобутилацетофенон, 4-третбутилацетофенон, 4-ацетилацетофенон, 4-пропионилацетофенон и 4-ацетилбутиропропиофенон и т.д.
Из вышеупомянутых ароматических кетонов, с точки зрения реакционной способности и использования, предпочтительным является гидроксиацетофенон или гидроксипропиофенон. В частности, с точки зрения скорости реакции, являются предпочтительными п-гидроксиацетофенон и м-гидроксиацетофенон с присоединенной к ним гидроксильной группой вместо п-метилацетофенона с присоединенной к нему метильной группой и 4-ацетилбифенила с присоединенной к нему фенильной группой.
Катализатор
Катализатор для использования в настоящем изобретении содержит от 0,1 до 20% масс. атомов рутения на его носителе.
Катализатор для использования в настоящем изобретении, в котором количество нанесенных атомов рутения составляет от 0,1 до 20% масс., не является специально определенным в способе получения. Например, катализатор может быть приготовлен способом нанесения содержащего атомы рутения соединения на носитель по методу пропитки, методу высушивания, методу осаждения и т.п., и затем обработкой его восстановлением, например, восстановлением водородом или химическим восстановлением с боргидридом натрия, гидразином, муравьиной кислотой или тому подобным, или без обработки восстановлением с получением намеченного катализатора.
При этом содержащее атом рутения соединение включает, например, гидрат хлорида рутения, гидрат бромида рутения, гидрат оксида рутения, хлорид гексаминрутения, бромид гексаминрутения, диакварутенийтринитратонитрозил, триацетонат рутения, трирутенийдодекакарбонил и т.д.
Носителем может быть любой носитель, инертный по отношению к заместителям ароматического соединения, которое является исходным материалом для гидрирования при условиях реакции, и может быть органический или неорганический носитель, включая, например, активированный уголь, ионообменную смолу, диоксид кремния, α-оксид алюминия, γ-оксид алюминия, кремнезем-глинозем, цеолит, а также различные типы оксидов металлов, композиты оксидов и т.д. Особенно предпочтительными, с точки зрения селективности, являются оксид алюминия и активированный уголь.
Количество рутения, наносимое на катализатор для использования в изобретении, лежит в интервале от 0,1 до 20% масс. от общей массы катализатора. Когда количество меньше чем 0,1% масс., очень большое количество катализатора должно быть использовано для достижения удовлетворительной степени гидрирования ядра, и промышленное использование его было бы затруднительным. Когда количество больше чем 20% масс., то доля рутения, принимаемого порами, может излишне увеличиться, и, если это так, может происходить гидрогенолиз или восстановление ацильной группы в порах, где диффузия недостаточна, и в связи с этим может понизиться селективность. С этой точки зрения наносимое количество составляет предпочтительно от 0,5 до 10% масс., более предпочтительно от 2 до 5% масс.
Количество катализатора, используемого в настоящем изобретении, может сильно варьироваться в зависимости от количества нанесенного активного ингредиента, типа гидрируемого исходного материала, условий реакции и другого, но обычно количество предпочтительно лежит в интервале от 0,05 до 0,5 в единицах отношения к массе исходного материала (1). С технологической точки зрения более предпочтительно количество лежит в интервале от 0,1 до 0,3.
Гидрирование
Согласно способу получения по изобретению насыщенный алифатический кетон получают гидрированием ядра вышеупомянутого ароматического кетона, представленного общей формулой (1), водородом под давлением в присутствии растворителя при температуре от 20 до 120°С.
Гидрирование в настоящем изобретении может быть достигнуто в отсутствие растворителя в зависимости от типа гидрируемого исходного материала и условий реакции, однако гидрирование предпочтительно проводят в растворителе, исходя из того, что селективность может быть повышена при выборе растворителя, наиболее подходящего для намеченной реакции, и что время реакции может быть сокращено.
Не будучи определенным конкретно, растворитель для использования в данном изобретении может быть соединением, мало активным при гидрировании и способным растворять исходный материал. В качестве конкретных примеров могут быть упомянуты углеводороды, не имеющие двойной связи, такие как н-пентан, н-гексан, циклогексан; простые эфиры, такие как диэтиловый эфир, дибутиловый эфир, тетрагидрофуран; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, 2-бутанол, трет-бутанол, н-гексанол, циклогексанол; галогеноуглеводороды, такие как четыреххлористый углерод, дихлорметан, трихлорэтан.
В настоящем изобретении из числа упомянутых выше растворителей предпочтительными являются насыщенные алифатические спирты, имеющие от 2 до 5 атомов углерода, линейные или разветвленные простые эфиры или насыщенные алифатические углеводороды, имеющие от 5 до 10 атомов углерода с точки зрения отсутствия побочных реакций и удобства обращения с ними при производстве.
Вышеупомянутые растворители могут быть использованы поодиночке или могут быть использованы в виде комбинации двух или нескольких из них.
Более предпочтительными являются диэтиловый эфир, тетрагидрофуран, метанол, этанол, н-пропанол, циклогексанол, н-гексан, гептан, и еще более предпочтительным является тетрагидрофуран.
Не будучи конкретно определенным, отношение растворителя, которое должно быть использовано, в расчете на его массу, находится предпочтительно в интервале от 0,05 до 100, более предпочтительно от 0,1 до 20 в величинах массового отношения относительно исходного материала (1).
Водород, используемый в реакции, может быть любым водородом, обычно используемым в промышленности, однако, когда используют водород, в котором количество примеси моноксида углерода мало, активность катализатора может быть превосходной. Соответственно, содержание моноксида углерода в водороде предпочтительно составляет самое большее 1%.
Не будучи конкретно определенным, давление водорода во время реакции может быть любым повышенным давлением, однако, если давление слишком низкое, реакция может занимать более продолжительное время, чем требуется, а если давление слишком высокое, скорость потребления водорода может возрасти. Соответственно, давление предпочтительно лежит в интервале от 0,5 до 20 МПа, более предпочтительно в интервале от 1 до 10 МПа.
Температура во время реакции может сильно варьироваться в зависимости от типа гидрируемого исходного материала, условий реакции и времени реакции, и может быть должным образом определена в интервале от 0 до 200°С, но предпочтительно лежит в интервале от 20 до 120°С с точки зрения селективности и экономических соображений. В особенности, для исходного материала, имеющего заместители с высокой реакционной способностью, селективность может повышаться, когда температуру выбирают предпочтительно в интервале от 20 до 100°С, более предпочтительно от 30 до 80°С, еще более предпочтительно от 30 до 60°С.
Время реакции может быть временем, за которое завершается поглощение водорода. Время может варьироваться в зависимости от типа гидрируемого исходного материала, количества катализатора и других условий реакции и поэтому не может быть определено без разброса. Обычно время может составлять от 0,5 до 20 часов.
Как описано выше, гидрирование ядра замещенного ароматического кетона легко дает намеченный гидрированный продукт с высокой селективностью.
Более точно, преимуществом способа является то, что гидрирование ядра обеспечивает очень высокую селективность.
В дополнение, вышеупомянутый рутениевый катализатор доступен по весьма недорогим ценам. Далее, катализатор может быть использован повторно, и поэтому способ гидрирования ядра является способом, дополнительно выгодным с точки зрения снижения затрат на катализатор.
Оборудование для проведения реакции, не описанное конкретно, может быть любым оборудованием, устойчивым к необходимому давлению водорода.
Способом проведения реакции предпочтительно является периодический способ с той точки зрения, что использованный катализатор должен быть отделен в жидкой фазе при температуре реакции.
Например, исходный материал из ароматического кетона, рутениевый катализатор и растворитель подают в автоклав, оборудованный электромагнитной мешалкой, затем содержимое перемешивают и устанавливают температуру жидкости, после чего давление повышают до 0,5-20 МПа вводимым в реактор водородом, затем при условиях, где давление и температуру жидкости поддерживают таковыми, дополнительно вводят водород так, чтобы поддерживать давление постоянным, затем автоклав выдерживают сам по себе до тех пор, пока водород больше не поглощается, после чего масляную фазу отбирают фильтрацией или подобным методом и затем анализируют газовой хроматографией, определяя этим образовавшийся циклогексилалкилкетон.
Циклогексилалкилкетоны
Настоящее изобретение относится к способу получения насыщенного алифатического кетона, по которому получают циклогексилалкилкетон, представленный вышеупомянутой общей формулой (2). В общей формуле (2) n указывает целое число от 1 до 3; R представляет гидроксильную группу, циклогексильную группу, алкильную группу, имеющую от 1 до 4 атомов углерода, или ацильную группу, имеющую от 1 до 4 атомов углерода. R и n в общей формуле (2) являются такими же, как упомянутые здесь выше для исходного материала - ароматического кетона.
Гидрированный по ядру продукт - циклогексилалкилкетон, который получен согласно настоящему изобретению, может быть целевым продуктом, имеющим высокую чистоту, даже если катализатор удален фильтрацией или подобным методом, и затем просто удален один растворитель, однако продукт может быть дополнительно очищен согласно обычному известному методу дистилляции, кристаллизации и т.д. Катализатор, извлеченный к этому времени, может быть повторно использован в реакции.
Селективность по циклоалкилкетону, полученному согласно способу производства по настоящему изобретению, выше, чем в обычных способах, и обычно составляет, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 85%, еще более предпочтительно, по меньшей мере, 90%, и еще более предпочтительно, по меньшей мере, 95%.
Выход циклогексилалкилкетона может быть обычно по меньшей мере 50%, но предпочтительно составляет по меньшей мере 60%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90%, и еще более предпочтительно по меньшей мере 95%.
Настоящее изобретение будет описано более конкретно ниже, но настоящее изобретение не ограничено примерами.
Условия газохроматографического анализа
Результаты реакции оценивали газовой хроматографией. Для газовой хроматографии использовали прибор GC-17A, доступный от Shimadzu Corporation с капиллярной колонкой HR-1 (⌀ 0,32 мм × 25 м), доступной от Shinwa Chemical Industries Ltd. Что касается условий нагрева, то систему нагревали от 100°С до 320°С со скоростью 5°С/мин. Соотношение цис/транс-изомера циклогексанового кольца определяли, используя капиллярную колонку Xylene Master (⌀ 0,32 мм × 50 м), доступную от Shinwa Chemical Industries Ltd. Что касается условий нагрева, то систему нагревали от 70°С до 120°С со скоростью 2°С/мин.
Пример 1
Химическая формула (4)
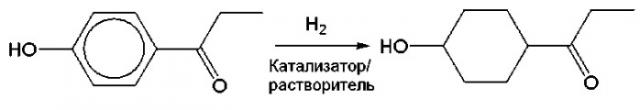
2 г катализатора 5% Ru/оксид алюминия, доступного от N.E. CHEMIKAT, 10 г п-гидроксипропиофенона (химический реагент, доступный от Wako Pure Chemicals) и 100 мл тетрагидрофурана (химический реагент, доступный от Wako Pure Chemicals) вводили в 200 мл автоклав, газ в реакторе выдували газообразным азотом, реактор устанавливали на 50°С и затем в него добавляли водород так, чтобы давление в реакторе могло равняться 4 МПа, и продолжали реакцию в течение 5 часов, после чего подачу водорода прекращали. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 98%, и выход составил 98%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 64/36.
Пример 2
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что растворителем был этанол (химический реагент, доступный от Wako Pure Chemicals). После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 96%, и выход составил 96%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 64/36.
Пример 3
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что растворителем был метанол (химический реагент, доступный от Wako Pure Chemicals). После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 96%, и выход составил 96%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 66/34.
Пример 4
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что растворителем был н-бутанол (химический реагент, доступный от Wako Pure Chemicals). После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 89%, и выход составил 89%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 64/36.
Пример 5
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что здесь повторно использовали катализатор, использованный в примере 1. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 93%, и выход составил 93%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 66/34.
Пример 6
70 г катализатора 5% Ru/оксид алюминия, доступного от N.E. CHEMIKAT, 350 г п-гидроксипропиофенона и 1750 мл этанола вводили в 10-литровый автоклав, газ в реакторе выдували газообразным азотом, реактор устанавливали на 50°С и затем в него добавляли водород так, чтобы давление в реакторе могло равняться 4 МПа, и продолжали реакцию в течение 10 часов, после чего подачу водорода прекращали. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 93%, и выход составил 93%. Соотношение цис/транс- изомеров циклогексанового кольца составляло 64/36.
Пример 7
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что вместо катализатора 5% Ru/оксид алюминия, использованного в примере 1, использовали катализатор 5% Ru/уголь (гидрат) типа А, доступный от N.E. CHEMIKAT, и время реакции составляло 6 часов. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 54%, и выход составил 54%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 69/31.
Пример 8
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что вместо катализатора 5% Ru/оксид алюминия, использованного в примере 1, использовали катализатор 5% Ru/уголь (гидрат) типа В, доступный от N.E. CHEMIKAT, и время реакции составляло 6 часов. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 90%, и выход составил 90%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 64/36.
Пример 9
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что вместо катализатора 5% Ru/оксид алюминия, использованного в примере 1, использовали катализатор 5% Ru/уголь (гидрат) типа К, доступный от N.E. CHEMIKAT, и время реакции составляло 6 часов. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 60%, и выход составил 60%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 67/33.
Пример 10
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что вместо катализатора 5% Ru/оксид алюминия, использованного в примере 1, использовали катализатор 5% Ru/уголь (гидрат) типа R, доступный от N.E. CHEMIKAT, и время реакции составляло 6 часов. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 90%, и выход составил 90%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 68/32.
Пример 11
Химическая формула (5)
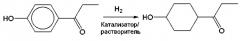
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 2, за исключением того, что вместо п-гидроксипропиофенона, использованного в примере 2, использовали п-гидроксиацетофенон (химический реагент, доступный от Wako Pure Chemicals), и время реакции составляло 4 часа. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-ацетилциклогексанолу составляла 96%, и выход составил 96%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 64/36.
Пример 12
Химическая формула (6)
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 2, за исключением того, что вместо п-гидроксипропиофенона, использованного в примере 2, использовали м-гидроксиацетофенон (химический реагент, доступный от Wako Pure Chemicals), и время реакции составляло 5 часов. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 3-ацетилциклогексанолу составляла 97%, и выход составил 97%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 40/60.
Пример 13
Химическая формула (7)
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 2, за исключением того, что вместо п-гидроксипропиофенона, использованного в примере 2, использовали о-гидроксиацетофенон (химический реагент, доступный от Wako Pure Chemicals), и время реакции составляло 5 часов. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 2-ацетилциклогексанолу составляла 96%, и выход составил 96%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 60/40.
Пример 14
Химическая формула (8)
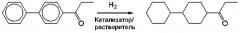
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 2, за исключением того, что вместо п-гидроксипропиофенона, использованного в примере 2, использовали 4-пропионил-1,1'-бифенил (химический реагент, доступный от Tokyo Chemical Industry), и время реакции составляло 11 часов. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионил-1,1'-бициклогексану составляла 96%, и выход составил 96%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 72/28.
Пример 15
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 14, за исключением того, что растворителем был гексан (химический реагент, доступный от Wako Pure Chemicals). После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионил-1,1'-бициклогексану составляла 96%, и выход составил 96%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 72/28.
Пример 16
Химическая формула (9)
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 2, за исключением того, что вместо п-гидроксипропиофенона, использованного в примере 2, использовали 1,4-диацетилбензол (химический реагент, доступный от Tokyo Chemical Industry). После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 1,4-диацетилциклогексану составляла 97%, и выход составил 97%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 76/24.
Пример 17
Химическая формула (10)
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 2, за исключением того, что вместо п-гидроксипропиофенона, использованного в примере 2, использовали 4'-метилацетофенон (химический реагент, доступный от Wako Pure Chemicals), и время реакции составляло 6 часов. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 1-ацетил-4-метилциклогексану составляла 96%, и выход составил 96%. Соотношение цис/транс-изомеров циклогексанового кольца составляло 22/78.
Сравнительный пример 1
Химическая формула (11)
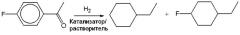
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 2, за исключением того, что вместо п-гидроксипропиофенона, использованного в примере 2, использовали ацетофенон, и время реакции составляло 6 часов. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100% и селективность по этилциклогексану составляла 99%.
Сравнительный пример 2
Химическая формула (12)
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 2, за исключением того, что вместо п-гидроксипропиофенона, использованного в примере 2, использовали 4'-фторацетофенон (химический реагент, доступный от Wako Pure Chemicals), и время реакции составляло 3,5 часа. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по этилциклогексану составляла 74% и селективность по 1-этил-4-фторциклогексану составляла 26%.
Сравнительный пример 3
Химическая формула (13)
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 2, за исключением того, что вместо п-гидроксипропиофенона, использованного в примере 2, использовали п-аминоацетофенон (химический реагент, доступный от Wako Pure Chemicals). После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 58%, и реакционная жидкость была жидкой смесью 4-амино-1-винилбензола (селективность 22%), 1-(4-аминоциклогексил)этанола (селективность 27%) и 1-(4-аминофенил)этанола (селективность 41%).
Сравнительный пример 4
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что вместо катализатора 5% Ru/оксид алюминия, использованного в примере 1, использовали медно-хромовый катализатор (203S), доступный от JGS Catalysts and Chemicals, время реакции составляло 3 часа и температура реакции была 140°С. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 0%, и селективность по 4-пропилфенолу была 100%.
Сравнительный пример 5
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что вместо катализатора 5% Ru/оксид алюминия, использованного в примере 1, использовали катализатор 2% Ru/уголь (гидрат), доступный от N.E. CHEMIKAT, время реакции составляло 2 часа и температура реакции была 140°С. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 0%, и селективность по 4-пропилциклогексанолу была 93%. Соотношение цис/транс-изомеров циклогексанового кольца 4-пропилциклогексанола составляло 53/47.
Сравнительный пример 6
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 1, за исключением того, что вместо катализатора 5% Ru/оксид алюминия, использованного в примере 1, использовали катализатор 5% Ru/уголь (гидрат), тип STD, доступный от N.E. CHEMIKAT, температура реакции была 140°С, а растворителем был циклогексан. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 0%, и селективность по 4-пропилциклогексанолу была 95%. Соотношение цис/транс-изомеров циклогексанового кольца 4-пропилциклогексанола составляло 55/45.
Сравнительный пример 7
Гидрирование и обработку реакционной жидкости проводили таким же образом, как в примере 7, за исключением того, что температура реакции была 140°С. После реакции катализатор удаляли фильтрацией, и полученный фильтрат анализировали газовой хроматографией. Было подтверждено, что конверсия сырья составляла 100%, селективность по 4-пропионилциклогексанолу составляла 14%, и селективность по 4-пропилциклогексанолу была 82%.
Промышленная применимость
Циклогексилалкилкетоны, полученные в настоящем изобретении, используют в качестве исходных материалов для красок, душистых веществ, лекарств, агрохимических средств, функциональных материалов для электроники и оптических функциональных материалов.
1. Способ получения насыщенного алифатического кетона, в котором ароматический кетон, представленный общей формулой (1):[химическая формула (1)] (где в химической формуле (1) n указывает целое число от 1 до 3; R представляет гидроксильную группу, фенильную группу, алкильную группу, имеющую от 1 до 4 атомов углерода, или ацильную группу, имеющую от 1 до 4 атомов углерода),гидрируют по ядру водородом под давлением в присутствии растворителя при температуре от 20 до 120°С и в присутствии катализатора, который несет от 0,1 до 20% масс. атома рутения на носителе, благодаря чему получают циклогексилалкилкетон, представленный общей формулой (2):[химическая формула (2)] (где в химической формуле (2) n указывает целое число от 1 до 3; R представляет гидроксильную группу, циклогексильную группу, алкильную группу, имеющую от 1 до 4 атомов углерода, или ацильную группу, имеющую от 1 до 4 атомов углерода).
2. Способ получения насыщенного алифатического кетона согласно п.1, в котором носителем является оксид алюминия или активированный уголь.
3. Способ получения насыщенного алифатического кетона согласно п.2, в котором носителем является оксид алюминия.
4. Способ получения насыщенного алифатического кетона по любому из пп.1-3, в котором ароматическим кетоном, представленным общей формулой (1), является п-гидроксиацетофенон или гидроксипропиофенон.
5. Способ получения насыщенного алифатического кетона по любому из пп.1-3, в котором растворителем является насыщенный алифатический спирт, имеющий от 2 до 5 атомов углерода, линейный или циклический простой эфир, или насыщенный алифатический углеводород, имеющий от 5 до 10 атомов углерода.
6. Способ получения насыщенного алифатического кетона по любому из пп.1-3, в котором давление водорода составляет от 0,5 до 20 МПа.