Устройство для определения концентрации гемоглобина и степени оксигенации крови в слизистых оболочках
Иллюстрации
Показать всеИзобретение относится к области медицины и может быть использовано для диагностики опухолевых заболеваний. Устройство для определения концентрации гемоглобина и степени оксигенации крови в слизистых оболочках включает источник излучения, выполненный из набора излучателей на разных длинах волн или на основе широкополосного излучателя, освещающее оптическое волокно, эластичный зонд, блок регистрации изображения в виде ПЗС-матрицы с установленной перед ней собирающей линзой и блок обработки изображения. Причем источник излучения связан с блоком управления излучателями и блоком распределения каналов посылки излучения, выход которого соединен со входом освещающего оптического волокна, расположенного в эластичном зонде, в наконечнике которого расположены два взаимно ортогональных поляризационных фильтра, один из которых связан с выходом освещающего волокна, а второй - с блоком регистрации изображения, который соединен цифровым кабелем, расположенным в зонде, с блоком обработки изображения, определяющим значения концентрации гемоглобина и степени оксигенации крови во всех точках изображения слизистой оболочки, получаемого на ПЗС-матрице. Изобретение обеспечивает повышение точности диагностики онкологических заболеваний слизистых оболочек. 8 ил., 2 табл.
Реферат
Изобретение относится к области медицинского приборостроения.
Диагностика опухолевых заболеваний является одной из актуальнейших задач современной онкологии и хирургии. Правильный диагноз на ранних этапах патологического процесса в сочетании с эффективными методами лечения позволяет повысить вероятность благоприятного исхода лечения, увеличить выживаемость и улучшить качество жизни онкологических больных.
Из всех существующих методов ранней диагностики опухолей, поражающих слизистую оболочку полых органов, включая дыхательные пути и пищеварительный тракт, ведущим остается эндоскопическое исследование. Современные эндоскопические системы формируют высококачественное изображение слизистой оболочки в реальном времени непосредственно на дисплее компьютера. Однако изображения слизистой оболочки в естественном цвете не позволяют достигнуть высокой точности диагностики, в связи с различием характеристик изображения для различных анатомических участков, а также влиянием на них спектральных характеристик эндоскопической системы и неравномерной подсветки слизистой оболочки. Кроме того, обычное эндоскопическое исследование основывается на субъективной оценке изображения слизистой оболочки врачом, исходя из его опыта, квалификации и психоэмоционального состояния (при утомлении - цветовосприятие врача снижается, при возбуждении - усиливается) [1].
Во многих опухолях плотность кровеносных сосудов становится более высокой по сравнению с нормальной тканью, поэтому знание концентрации гемоглобина в ткани может помочь отличить доброкачественные новообразования от злокачественных. Известно также, что злокачественные новообразования характеризуются более интенсивными обменными процессами и более интенсивным потреблением кислорода. Поэтому концентрация кислорода в венулах, отводящих кровь из патологических регионов, ниже нормы. В связи с этим, информация о распределении концентрации гемоглобина в слизистой оболочке и степени оксигенации крови (доля окисленного гемоглобина в общем гемоглобине), выводимая на дисплее компьютера в ходе проведения эндоскопии, могла бы значительно повысить современные возможности ранней диагностики онкологических заболеваний.
Известно устройство для определения концентрации гемоглобина и степени оксигенации крови в слизистых оболочках [2], включающее широкополосный источник света, освещающее оптическое волокно, принимающее оптическое волокно, спектрометр и блок анализа спектра диффузного отражения ткани.
В данном устройстве освещающее и принимающее оптические волокна подводятся к исследуемому участку ткани через инструментальный канал эндоскопа. В связи с этим данное устройство не обладает оперативностью и его использование приводит к увеличению времени проведения болезненной для пациента процедуры эндоскопии. Контакт оптических волокон с исследуемой поверхностью приводит к искажению результатов измерений за счет изменений объемного коэффициента рассеяния ткани и ее микроциркуляции, возникающих даже при слабом нажиме на ткань. К недостаткам данного устройства относится также и сложность его калибровки.
Наиболее близким к заявляемому изобретению является устройство для определения содержания гемоглобина в слизистых оболочках [3], включающее эластичный зонд; широкополосный источник излучения; освещающее оптическое волокно, подводящее излучение к исследуемой ткани; блок регистрации обратного излучения ткани, включающий устройство захвата изображения и спектрометр; блок обработки, связанный с вышеупомянутой системой регистрации, выполняющий измерение и обработку спектра обратного излучения ткани.
Главным недостатком данного устройства является локальность спектральных измерений обратного рассеяния ткани, выполняемых на его основе. Данные измерения позволяют судить о состоянии ткани только в одной ее точке, соответствующей нескольким пикселям изображения ткани. Между тем для более точного диагноза требуется выявлять распределение гемоглобина и оксигенации крови в пораженных участках ткани и в их окрестностях.
Предлагаемое изобретение направлено на решение задачи расширения функциональных возможностей устройства за счет получения количественных значений гемоглобина и оксигенации крови в пораженных участках ткани и в их окрестностях, повышения точности диагностики онкологических заболеваний слизистых оболочек.
Для решения данной задачи устройство для определения концентрации гемоглобина и степени оксигенации крови в слизистых оболочках, включающее источник излучения, освещающее оптическое волокно, эластичный зонд, блок регистрации изображения, блок обработки изображения, дополнительно содержит блоки управления излучателями и распределения каналов посылки излучения, два взаимно ортогональных поляризационных фильтра, цифровой кабель, причем источник излучения выполнен из набора излучателей на разных длинах волн и связан с микропроцессорным блоком управления излучателями и блоком распределения каналов посылки излучения, выход которого соединен со входом освещающего оптического волокна, расположенного в эластичном зонде, содержащем наконечник, в котором расположены два взаимно ортогональных поляризационных фильтра, один из которых связан с выходом освещающего волокна, второй - с блоком регистрации изображения, представляющим собой монохромную ПЗС-матрицу с установленной перед ней собирающей линзой, выход которого соединен цифровым кабелем, расположенным в зонде, - с блоком обработки изображения, определяющим количественные значения концентрации гемоглобина и степени оксигенации крови во всех точках изображения слизистой оболочки, получаемого на ПЗС-матрице.
Источник излучения может быть выполнен на основе широкополосного излучателя, а блок регистрации изображения - на основе цветной ПЗС-матрицы, позволяющей получать изображения в трех и более спектральных участках.
Сущность данного изобретения поясняется с помощью фиг.1-8.
Фиг.1 - Функциональная схема предлагаемого устройства.
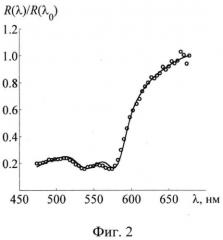
Фиг.2 - Нормированные спектры диффузного отражения слизистой оболочки легких в норме, рассчитанные в рамках предложенной модели (кривые), и сравнение с экспериментальными данными (окружности).
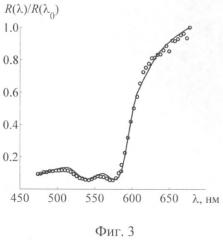
Фиг 3 - Нормированные спектры диффузного отражения слизистой оболочки легких в норме при онкологическом заболевании, рассчитанные в рамках предложенной модели (кривые), и сравнение с экспериментальными данными (окружности).
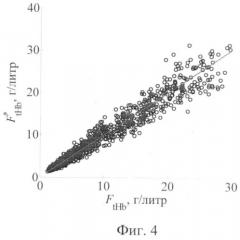
Фиг.4 - Сопоставление заданных (ось абсцисс) и восстановленных из сигналов r(λk) (ось ординат) значений концентрации гемоглобина в слизистой оболочке.
Фиг.5 - Сопоставление заданных (ось абсцисс) и восстановленных из сигналов r(λk) (ось ординат) значений степени оксигенации крови в слизистой оболочке.
Фиг.6 - Используемые при моделировании профили относительной спектральной чувствительности цветной ПЗС-матрицы Sk(λ) (кривые 1, 2, 3 для k=В, G, R соответственно) и мощности широкополосного излучателя P(λ) (кривая 4).
Фиг.7 - Смоделированная совокупность нормированных RGB-сигналов (rBR, rGR) и соответствующих им концентраций гемоглобина.
Фиг.8 - Сопоставление заданных (ось абсцисс) и восстановленных из сигналов rBR и rGR (ось ординат) значений концентрации гемоглобина в слизистой оболочке.
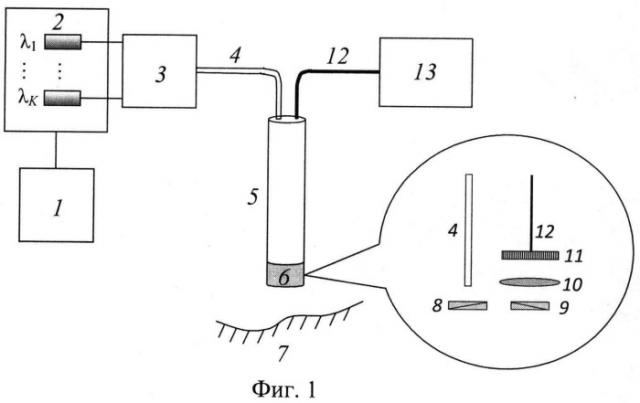
Функциональная схема предлагаемого устройства изображена на фиг.1, где 1 - микропроцессорный блок управления излучателями, 2 - источник излучения, 3 - блок распределения каналов посылки излучения, 4 - освещающее оптическое волокно, 5 - эластичный зонд, 6 - наконечник зонда, 7 - исследуемая ткань, 8 и 9 - взаимно ортогональные поляризационные фильтры, 10 - собирающая линза, 11 - ПЗС-матрица, 72 - цифровой кабель, 13 - блок обработки изображения ткани.
Данное устройство функционирует следующим образом. Микропроцессорный блок управления излучателями 1 организует чередующуюся посылку источником 2 излучения с различной длиной волны. Источник излучения 2 состоит из набора излучателей на различных длинах волн, например лазерных источников или светодиодов. Блок распределения каналов посылки излучения 3 подводит излучение от каждого излучателя к входу освещающего оптического волокна 4. В простейшем случае в качестве блока 3 может использоваться разветвленное оптическое волокно, в котором несколько волокон, каждое из которых соединено с одним из излучателей, сводятся в одно общее волокно 4. Потоки излучения на различных длинах волн направляются на исследуемую ткань 7 по оптическому волокну 4, находящемуся внутри эластичного зонда 5 для эндоскопии внутри полости тела. Отраженное от ткани излучение собирается в блоке регистрации изображения, выполненном на основе ПЗС-матрицы 11 с расположенной перед ней линзой 10. При смене спектрального состава освещающего излучения на выходе блока регистрации последовательно формируются спектральные изображения ткани в отраженном от нее свете с различными длинами волн. Для исключения попадания на светочувствительные элементы матрицы зеркально отраженного света и устранения бликов в изображении ткани, в наконечнике 6 зонда 5 установлены два взаимно ортогональных поляризационных фильтра 8 и 9, один - на выходе освещающего оптоволокна 4, второй - перед линзой 10. Естественное излучение, прошедшее через поляризационный фильтр 8, становится поляризованным. Поскольку излучение, отражаемое поверхностью ткани, сохраняет исходную поляризацию, использование скрещенных поляризаторов позволяет блокировать эту паразитную составляющую. Часть излучения, проникшая вглубь ткани, практически полностью утрачивает свою первоначальную поляризацию вследствие многократного рассеяния. При этом рассеянное обратно излучение частично проходит через поляризационный фильтр 9 и попадает на блок регистрации изображения. Сигналы от светочувствительных элементов матрицы по цифровому кабелю 12, расположенному в зонде, передаются на блок обработки изображения 13, выполняющий анализ последовательности спектральных изображений исследуемой ткани и определяющий количественные значения концентрации гемоглобина и степени оксигенации крови во всех точках изображения ткани в соответствии с нижеприведенным алгоритмом. Блок обработки изображения 13 может быть компьютером или микропроцессором, способным выдавать свои результаты любому внешнему устройству для их визуализации.
В наиболее простом варианте реализации вышеописанного устройства источник излучения может быть выполнен на основе широкополосного излучателя, такого как белый светодиод или лампа. При этом спектральную селекцию излучения, отраженного от исследуемой ткани, можно осуществлять при помощи ПЗС-матрицы, позволяющей получать изображения в нескольких спектральных участках, например в синем, зеленом и красном. С точки зрения спектральных измерений это равносильно использованию в устройстве (например, на выходе широкополосного излучателя) нескольких фильтров, выделяющих из белого света спектральные составляющие.
Алгоритм количественной интерпретации спектральных изображений слизистой оболочки. Спектральные сигналы на выходе ПЗС-матрицы (спектральные изображения ткани) определяются в соответствии с формулой
V = ( x , y , Λ k ) = G ( θ , x , y ) ∫ λ l λ r P k ( λ ) τ ( λ ) S ( λ ) R ( x , y , λ ) d λ , ( 1 )
где Λk - спектральный участок, соответствующий полосе излучения k-го излучателя; Pk(λ) - спектральная мощность k-го излучателя; х, y - координаты элемента поверхности ткани; G(θ, х, y) - геометрический фактор, зависящий от пространственного распределения освещенности ткани и угла 6 между нормалью к поверхности ткани и осью собирающей линзы; R(x, y, λ) -спектральный коэффициент диффузного отражения ткани, т.е. отношение потока излучения с длиной волны λ, отраженного элементарной площадкой с центром в точке (х, y), к падающему на нее потоку; τ(λ) - спектральное пропускание оптического волокна и собирающей линзы; S(λ) - спектральная чувствительность матрицы; λl и λr - левая и правая границы диапазона спектра, используемого блоком регистрации.
Для устранения влияния на регистрируемые спектральные изображения V(x, y, Λk) неравномерной освещенности ткани и ее положения относительно блока регистрации будем оперировать с изображениями r(x, y, Λk)=V(x, y, Λk)/V(x, y, Λ0), получаемыми путем нормировки изображений V(x, y, Λk) на опорный спектральный слой V(x, y, Λ0). Карты двумерных распределений параметров слизистой оболочки получаются в результате анализа спектральных сигналов для каждого пикселя изображения r(x, y, Λk).
Учитывая высокое пространственное разрешение современных ПЗС-матриц, использование традиционных методов решения обратных задач, основанных на многократном решении уравнения переноса излучения в исследуемой среде при различных значениях ее параметров, не позволяет получить необходимую для практики оперативность построения искомых параметрических карт. Кроме того, для использования данных методов необходимо, чтобы количество спектральных измерений значительно превышало количество неизвестных параметров среды, что является трудно достижимым в условиях проведения эндоскопии.
Для оперативного решения обратных задач оптики светорассеивающих сред при малом объемом измеряемой информации наиболее подходящим является метод множественных регрессий. Данный метод основан на построении явного аналитического выражения F, связывающего измеряемые оптические характеристики объекта s=(Sk) с его искомыми параметрами p=(рi), как p=F(s,a), где а - вектор параметров аналитического выражения. Для построения оператора F используется физико-математическая модель исследуемого объекта, позволяющая по заданным значениям вектора параметров p рассчитывать вектор результатов измерений s. На основе этой модели формируется «обучающий» ансамбль реализации p и s и выполняется его регрессионный анализ для нахождения параметров а выбранного аналитического выражения. Простейшим аналитическим выражением, позволяющим предсказывать нужный параметр pi по измеренным сигналам Sk=(k=1, …, K), является множественная линейная регрессия:
p i = a i + ∑ k = 1 K a i k ⋅ S k . ( 2 )
В действительности параметры объекта и измеряемые сигналы редко связаны линейной зависимостью, поэтому регрессия (2), как правило, не позволяет получить решение обратной задачи с приемлемой точностью. В тоже время в большинстве случаев регрессионная связь между величинами pj и Sk хорошо описывается полиномами с заданной степенью N:
p i = a i + ∑ n 1 … ∑ n K a n 1 … n K , i ⋅ S 1 n l … S K n K , ( 3 )
где ∑ i = 1 Л n i ≤ N .
Для решения задачи оперативной реконструкции двумерных распределений концентрации гемоглобина FtHb(x,y) и степени оксигенации крови S(x,y) в слизистой оболочке по ее по нормированным спектральным изображениям r(x, y, Λk) также можно использовать полиномиальные множественные регрессии вида (3), в которых p1=FtHb(x, y), p2=S(x, y) и Sk=r(x, y, Λk). Поскольку изображения r(х, y, Λk) свободны от влияния пространственного распределения освещенности ткани и ее положения относительно блока регистрации, то коэффициенты aj и a k 1 … k N , j не зависят от геометрических координат x и y. В связи с этим далее зависимость величин FtHb, S и r от координат x, y для краткости будем опускать, подчеркивая тем самым единообразие алгоритма количественной интерпретации спектральных сигналов r(Λk) для всех точек зарегистрированного изображения слизистой оболочки. Численные значения коэффициентов регрессий будем определять с использованием «обучающего» ансамбля реализации r(Λk), FtHb и S, соответствующего аппаратурным функциям конкретной эндоскопической системы. Данный ансамбль рассчитывается на основе модели переноса света в биоткани при широкой вариации ее параметров. Таким образом, априорная информация о вариациях структурных и биохимических параметров ткани в предлагаемом методе количественной интерпретации ее мультиспектральных изображений вносится на этапе численного моделирования сигналов r(Λk) и отражается в значениях коэффициентов множественных регрессий между r(Λk) и искомыми параметрами ткани.
Оптическая модель слизистой оболочки. Известно, что основными параметрами, характеризующими распространение оптического излучения в рассеивающей среде, являются коэффициенты поглощения k, рассеяния β и индикатриса рассеяния или ее средний косинус g. Причем, в оптике биологических тканей, как очень мутных сред, для описания световых полей достаточно знать не сами величины β и g, а их комбинацию - транспортный коэффициент рассеяния µs=β(1-g).
Спектр объемного коэффициента поглощения слизистой оболочки k(λ) моделируется в виде линейной комбинации спектров поглощения ее хромофоров. В видимой области основными поглощающими хромофорами биоткани являются оксигемоглобин и деоксигемоглобин, поэтому выражение для объемного коэффициента поглощения слизистой оболочки имеет вид:
k ( λ ) = k t ( λ ) + α ( D V , λ ) F t H b M H b 1 n ( 10 ) [ S ε H b O 2 ( λ ) + ( 1 − S ) ε H b ( λ ) ] , ( 4 )
где kt(λ)=A·exp[-B(λ-λ0)] - объемный коэффициент поглощения обескровленной ткани, λ0=600 нм, А (мм-1) и В (нм-1) - параметры, характеризующие спектральную зависимость kt; FtHb (г/л) - концентрация общего гемоглобина в биологической ткани; MHb=64500 г/моль - молярная масса гемоглобина; ε H b O 2 и εHb - молярные коэффициенты поглощения оксигемоглобина и деоксигемоглобина соответственно [4]; S - степень оксигенации крови; α(DV,λ) - поправочный коэффициент, учитывающий эффект локализованного поглощения света кровеносными сосудами [5]; DV - средний диаметр кровеносных сосудов.
Согласно данным [2, 6-8] транспортный коэффициент рассеяния биологических тканей в видимой области спектра с хорошей точностью аппроксимируется степенной зависимостью
μ s ( λ ) = C s ( λ 0 λ ) ν , ( 5 )
где λ0=632 нм; Cs и ν - структурные параметры ткани, характеризующие объемное содержание и размер ее «эффективных» рассеивателей. Для описания процесса рассеяния излучения используется однопараметрическая функция Хеньи-Гринштейна [9] с фактором анизотропии рассеяния g.
С учетом показателя преломления ткани и; оптическая модель слизистой оболочки определяется 9 параметрами: nt, g, А, В, Cs, ν, FtHb, D, S. В табл.1 приведены диапазоны их вариаций, выбранные путем критического анализа результатов различных авторов для нормальных и опухолевых тканей слизистых оболочек полости рта, пищевода, органов желудочно-кишечного тракта и легких. Модельные параметры могут варьироваться независимо друг от друга, но при каждой их комбинации спектральные значения оптических параметров ткани k(λ), µs(λ) не должны выходить из диапазонов, наблюдаемых в эксперименте. Исходя из вышеуказанных литературных данных, выбраны следующие ограничения: 1) 0.04≤k(632 нм)≤0.5 мм-1; 2) 1.0≤Λ(632 нм)≤50, где Λ=µs/k.
Путем независимых вариаций модельных параметров с учетом выполнения вышеуказанных ограничений, сформирован ансамбль из 103 реализаций k(λ), µs(λ), g и nt. Для каждой реализации методом Монте-Карло [9] рассчитан коэффициент диффузного отражения R(λ) на 26 длинах волн (450, 460, 470, 480, 495, 506, 514, 522, 530, 540, 548, 560, 564, 568, 574, 580, 586, 594, 600, 610, 620, 630, 640, 660, 676, 700 нм), характеризующих основные особенности спектральных кривых поглощения хромофоров биологической ткани в видимой области спектра. Расчет R(λ) выполнялся для однородного фантома ткани толщиной 4 мм с использованием 500000 фотонов.
| Табл.1. Диапазоны вариаций параметров оптической модели слизистой оболочки | |
| Параметр | Диапазон |
| nt | 1.35-1.45 |
| g | 0.5-0.95 |
| А | 0.01-0.10 мм-1 |
| В | 0.001-0.028 нм-1 |
| Cs | 1.5-2.5 мм-1 |
| ν | 1.0-2.5 |
| FtHb | 0.5-40 г/литр |
| DV | 5-30 мкм |
| S | 40-99% |
Следует отметить, что использование метода Монте-Карло для расчета коэффициентов R(λ) требует больших затрат машинного времени, что является особенно критичным при большой выборке реализации R(λ). В связи с этим нами разработан простой аналитический метод расчета R(λ), позволяющий в явном виде рассчитать коэффициент диффузного отражения среды с известными значениями показателя преломления n, коэффициента поглощения k и транспортного коэффициента рассеяния µs. Для этого используется выражение
R = ( n , k , μ s ) = ( 1 − r c ) ( 1 − r d ) R c ( k , μ s ) 1 − r d R d ( k , μ s ) , ( 6 )
где rc - коэффициент отражения нормально падающего излучения от поверхности среды; rd - коэффициент отражения поверхности среды, освещенной диффузным потоком изнутри [10]; Rc и Rd - коэффициенты отражения среды без внешней границы при направленном и диффузном освещении соответственно. Коэффициенты Rc и Rd рассчитываются при помощи аналитических выражений, связывающих их с оптическими параметрами среды k и µs:
R c , d ( k , μ s ) = exp ( − ∑ m − 0 3 δ m ( A m k m + B m μ s m ) − k δ ∑ m − 0 3 C m ( μ s k ) m ) , ( 7 )
где δ = 1 / 3 k ( k + μ s ) . Значения коэффициентов Am, Bm и Cm, получены путем аппроксимации расчетов R(n, k, µs) методом Монте-Карло и приведены в табл.2. Диапазоны значений параметров n, k, µs для которых правомерна аппроксимация (7) характерны для большинства биологических тканей в видимой области спектра: 0.01≤k≤8 мм-1, 1.0≤µs≤5 мм-1, 0.3≤µs/k≤110 мм-1, 1.35≤n≤1.45 мм-1. Средняя погрешность расчета коэффициента диффузного отражения по формулам (6), (7) относительно методом Монте-Карло составляет 1%, максимальная не превышает 6%.
| Табл.2. Коэффициенты Am, Bm и Cm выражения (7) | ||||||
| m | коэффиценты для Rc | коэффциенты для Rd | ||||
| Am | Bm | Cm | Am | Bm | Cm | |
| 0 | 4.0190 | -2.9329 | 0.0000 | 1.8691 | -1.1374 | 0.0000 |
| 1 | 3.9648 | 0.1549 | 0.9697 | 1.8515 | 0.3382 | 0.3684 |
| 2 | 1.5931 | -0.6950 | -0.6948 | 0.9910 | -0.8309 | -0.8309 |
| 3 | 0.3371 | 0.3371 | 1.5931 | 0.9704 | 0.9704 | 0.9911 |
Для подтверждения корректности используемой оптической модели слизистой оболочки и разработанного метода расчета коэффициента диффузного отражения проведено сравнение результатов моделирования спектра R(λ) с экспериментальными данными. Для этого использовались результаты in-vivo измерений спектра диффузного отражения нормальной и раковой ткани легких, проводимых в работе [3] на базе широкополосного источника света, собирающего оптического волокна и спектрометра. Поскольку в условиях проведения эндоскопии практически невозможно соблюсти идентичные условия посылки и регистрации излучения для исследуемой ткани и калибровочного образца, то абсолютные измерения R(λ) неизбежно отягощены влиянием мультипликативных геометрических параметров и использование таких измерений для валидации модельных расчетов R(λ) не является корректным. Однако для решаемой задачи абсолютные значения R(λ) не представляют особого интереса, поскольку нормированные изображения r(x, y, Λk) зависят лишь от относительной спектрального хода R(λ). В связи с этим для валидации модельных расчетов использовались нормированные экспериментальные зависимости R(λ)/R(λ0), где λ0=700 нм. Данные зависимости для двух анатомических участков слизистой оболочки легких изображены на фиг.2, 3. Там же приведены результаты расчета R(λ)/R(λ0) вышеописанным методом при следующих значениях модельных параметров (числитель - нормальная ткань, знаменатель - опухоль): nt=1.35/1.35; А=3.2/5.2(10-2 мм-1), B=2.1/1.9(10-2 нм-1), Cs=1.72/1.63 (мм-1), ν=1.0/1.0, FtHb=4.05/10.8 (г/л), DV=5.0/5.0 (мкм), S=0.78/0.98. Как видно, используемый аналитический метод расчета R(λ) позволяет достаточно хорошо (в пределах погрешностей измерения и оцифровки экспериментальных данных) воспроизвести экспериментальные зависимости R(λ)/R(λ0). К сожалению, точные значения параметров ткани, соответствующие экспериментальным данным, не известны, поэтому сделать вывод о точности их количественных оценок не представляется возможным. Тем не менее, полученные значения параметров характеризуют структуру и биохимический состав ткани в количественном аспекте и, вне всякого сомнения, могут использоваться для количественной интерпретации мультиспектральных эндоскопических изображений. Так, в частности, найденные значения модельных параметров демонстрируют существенные различия содержания гемоглобина и степени оксигенации крови в нормальной и опухолевой тканях, возможность выявления которых является ключевым моментом при ранней диагностике злокачественных новообразований.
Выбор оптимальных спектральных участков. На основе вышеописанной модели сформирован набор «обучающий» данных по параметрам слизистой оболочки и спектральным коэффициентам ее диффузного отражения R(λ) (26 спектральных значений). Расчет соответствующих им сигналов r(Λk) требует знания аппаратурной функций A(λ), учитывающей мощности излучателей, чувствительности матрицы и пропускания оптики. При известной функции A(λ) коэффициенты аналитических выражений, связывающих сигналы r(Λk) с искомыми параметрами слизистой оболочки, могут быть легко определены методом наименьших квадратов. Однако перед этим необходимо определить оптимальное количество спектральных измерений r(Λk), позволяющих определять искомые параметры ткани практически с такой же точностью, как и на основании анализа всего спектра ее диффузного отражения. Для этого проведем анализ линейно-независимых компонент, содержащихся в сигналах r(λk)=A(λk)R(λk)/R(λ0) соответствующих узким спектральным участкам Λk≡λk где k=1, …, 25; λ0=700 нм. Значения λk в порядке возрастания индекса k указаны выше. Функцию A(λk) без ограничения общности можно положить равной единице.
Известно, что системой ортонормированных векторов, позволяющих оптимальным образом аппроксимировать любую реализацию случайного вектора x, является система собственных векторов его ковариационной матрицы [11]. При этом отношение суммы соответствующих собственных чисел li к следу матрицы (суммарной дисперсии компонент x) характеризует точность этой аппроксимации и определяет меру значимости процессов, описываемых этими собственными векторами в общей изменчивости вектора х. Число линейно-независимых компонент x определяется номером собственного числа, для которого li>δx2, где δx - погрешность измерений x [12]. Результаты анализа собственных чисел ковариационной матрицы r(λk) показывают, что при δr>2% сигналы r(λk) содержат не более пяти линейно-независимых компонент ( l 5 ≈ 2.6 % ) . Следовательно, использование шести спектральных участков (с учетом нормировочной длины волны λ0) позволяет извлечь большую часть информации, содержащейся в r(λk).
Оптимальные значения λk выбирались путем компьютерного перебора различных комбинаций из вышеуказанного набора длин волн и оценки соответствующих им погрешностей восстановления параметров FtHb и S. Для каждой комбинации λk методом наименьших квадратов определялись коэффициенты регрессии между рассматриваемыми параметрами и r(λk). Использовалась следующее уравнения регрессии:
y = a 00 + ∑ k = 1 K ∑ m = 1 3 a k m [ 1 n r ( λ k ) ] m . (