Способ количественного определения углеродных наноструктур в биологических образцах и их распределения в организме
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к экспериментальной фармакологии и биофармации, и описывает способ количественного определения углеродных наноструктур, в частности наноалмазов и нанотрубок, в биологических образцах и их распределение в организме ex vivo, основанное на использовании метода масс-спектрометрии с индуктивно-связанной плазмой. Способ характеризуется тем, что поверхность углеродных наноструктур модифицируют (2,4,5-трийодфенил)-метанолом, определяют количество йода в модифицированных углеродных наноструктурах, полученные модифицированные углеродные наноструктуры вводят в организм экспериментального животного с последующим изъятием органов и тканей, их гомогенизацией в 0,5-2 М растворе NaOH, отбором пробы гомогената, разбавлением ее водой, обработкой разбавленной пробы ультразвуком до температуры 40-70°C, определением в полученной пробе количества йода методом масс-спектрометрии с индуктивно-связанной плазмой и расчетом содержания углеродных наноструктур в пробе по разности содержания йода в пробе до введения модифицированных углеродных наноструктур и после их введения в организм и пересчетом этого количества йода в содержание углеродных наноструктур в образце, используя исходное содержание йода в модифицированной углеродной наноструктуре. Способ обеспечивает мониторинг распределения углеродных наноносителей в организме in vivo.
1 з.п. ф-лы, 6 ил., 3 пр., 2 табл.
Реферат
Настоящее изобретение относится к области медицины, конкретно к экспериментальной фармакологии и биофармации, и касается способа количественного определения углеродных наноструктур, в частности наноалмазов и нанотрубок, в биологических образцах и их распределения в организме, основанного на использовании метода масс-спектрометрии с индуктивно-связанной плазмой ex vivo.
Разработка способов количественного определения углеродных наноструктур (наноалмазы, нанотрубки, фуллерены и др.) в биологических образцах и/или организме экспериментального животного является актуальной и сложной задачей современной медицины, экспериментальной фармакологии и биофармации, обусловленной широким и глубоким изучением возможности их применения в биомедицинских и биофармацевтических целях. В частности, интенсивно развивающимся направлением наномедицины и нанотехнологии является создание систем доставки лекарственных веществ на основе различных наноструктур элементарного углерода, включая наноалмазы, нанотрубки, фуллерены и др. [1]. При этом важнейшей частью их доклинических исследований является мониторинг распределения углеродных наноносителей и, в целом, систем доставки лекарственных веществ на их основе в организме in vivo. Однако выявление углеродных наноструктур на фоне биологических тканей оказывается крайне затруднено.
Известно, что для определения содержания углеродных наноструктур, например, нанотрубок и наноалмазов, в биообъектах in vitro, в том числе в отдельных клетках или тканях, используют их оптические свойства, например, люминесценцию - собственную или приобретенную (усиленную) [1,2]. Усиление люминесценции достигается за счет модифицирования поверхности углеродных наноструктур флуоресцирующими веществами или увеличения дефектности наноструктур с помощью высокоэнергетической обработки. Для визуализации углеродных наноструктур, основываясь на их оптических свойствах, применяют методы конфокальной, дифференциальной интерференционно-контрастной, флуоресцентной, рамановской микроскопии и др. [1,2].
Однако в связи с эффективным поглощением излучения видимого и ближнего ИК диапазонов биологическими объектами эти методы применимы только для качественного обнаружения углеродных наноструктур в тканях и органах. Они не позволяют получить информацию о фармакокинетике и/или биораспределении углеродных наноструктур в организме in vivo.
Известно, что для исследования биораспределения углеродных наноструктур в биомедицинских и фармацевтических исследованиях in vitro и in vivo используют их связывание с изотопами 188Re или 125I, что позволяет выявлять даже малые содержания углеродных наночастиц в тканях организма [3-6]. При этом пришивка радиометок к поверхности углеродных наноструктур может осуществляться как непосредственно, так и через биомолекулы [7].
Однако полученные комплексы (конъюгаты) типа «радиоизотоп-углеродная наноструктура» обладают радиоактивностью, существенно превышающей обычное фоновое значение. Это не позволяет повсеместно в фармакологических и биофармацевтических исследованиях применять радиохимические способы для изучения локализации и биораспределения углеродных наноструктур и требует проведения экспериментов в специальных условиях. Также к недостаткам этих способов относится небольшое время жизни радиоизотопов (например, T1/2(188Re)=17 ч), что существенно затрудняет проведение экспериментов, особенно при длительных временах экспозиции.
Известно использование для определения углеродных наноструктур in vivo метода магнитно-резонансной томографии (МРТ). С этой целью углеродные наноструктуры модифицировали органическим комплексным соединением, содержащим Gd [8-9]. Этот способ позволяет локализовать углеродные наноструктуры в организме in vivo, однако не пригоден для определения их количественного распределения. Кроме этого, метод МРТ имеет ряд существенных ограничений и не применяется при наличии сердечной недостаточности, беременности, приступах паники, клаустрофобии, необходимости физиологического мониторинга.
Известно применение метода масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС) для определения содержания йода в биологических образцах [10]. Для этого навеску биологического образца массой 20-25 мг сжигают в специальной колбе на платиновой проволоке в атмосфере кислорода. После охлаждения образец промывают 5 мл воды и 10 мл раствора 0,05-1 М NaOH и измеряют содержание йода, используя ИСП-спектрометр с предварительной калибровкой по йоду.
Данная процедура пробоподготовки за счет стадии сжигания является трудоемкой и может приводить к частичной потере образца, следовательно, к возникновению систематической ошибки измерения, что существенно снижает точность способа.
Применение метода ИСП-МС для определения содержания углеродных наноструктур в биологических образцах и/или в целостном организме в научной и патентной литературе не описано.
Для улучшения визуализации внутренних органов и анатомических структур in vivo известно применение метода рентгеновской компьютерной томографии (РКТ). Для этого использовали углеродные наноструктуры, модифицированные йодсодержащим веществом [11]. Однако метод РКТ обладает низкой чувствительностью. При этом применяемые рентгеноконтрастные препараты обычно вводят внутривенно в гипертонических растворах с концентрацией 35-90% из расчета 0,5-1 мл/кг. Эти условия могут отрицательно воздействовать на кровь, сосуды и функциональное состояние различных органов. Более того, применение такого способа детектирования для изучения распределения углеродных наноструктур, модифицированных йодсодержащим веществом, в организме нецелесообразно, поскольку высокие концентрации конъюгатов в растворе недостижимы для внутривенного применения суспензий. Показано, что такие суспензии при концентрации углеродных наночастиц порядка 10% масс. уже представляют собой густую пасту [12].
Нами метод РКТ был применен для визуализации наноалмазов in vivo в организме экспериментальных животных (кроликов). Для этого кроликам внутривенно вводилась суспензия наноалмаза, модифицированного йодсодержащим веществом, в дозе 5 мг/кг веса. На РК томограмме удалось визуализировать отдельные участки усиления поглощения рентгеновских лучей, преимущественно в кровеносной системе. Однако при этом визуализация наноалмазов в органах и тканях, вследствие слабой чувствительности метода и низкой концентрации вводимого рентгеноконтрастного агента, не наблюдалась.
Задачей настоящего изобретения является повышение чувствительности способа количественного определения углеродных наноструктур в биологических образцах и их распределения в организме.
В соответствии с изобретением описывается способ количественного определения углеродных наноструктур в биологических образцах и их распределения в организме ex vivo путем введения в организм экспериментального животного модифицированных йодсодержащим соединением углеродных наноструктур с последующим изъятием органов и тканей и определением в них содержания йода, отличающийся тем, что поверхность углеродных наноструктур модифицируют (2,4,5-трийодфенил)-метанолом, определяют количество йода в модифицированных углеродных наноструктурах, полученные модифицированные углеродные наноструктуры вводят в организм экспериментального животного с последующим изъятием органов и тканей, их гомогенизацией в 0,5-2 М растворе NaOH, отбором пробы гомогената, разбавлением ее водой, обработкой разбавленной пробы ультразвуком до температуры 40-70°C, определением в полученной пробе количества йода методом масс-спектрометрии с индуктивно-связанной плазмой и расчетом содержания углеродных наноструктур в пробе по полученному содержанию йода в образце.
При этом поверхность углеродных наноструктур модифицируют (2,4,5-трийодфенил)-метанолом путем растворения углеродных наноструктур, содержащих на поверхности хлорацильные группы, в абсолютированном тетрагидрофуране с последующим добавлением к полученной суспензии гидрида натрия и (2,4,5-трийодфенил)-метанола, перемешиванием при температуре 70-90°C, промывкой тетрагидрофураном, центрифугированием и сушкой. В модифицированных (2,4,5-трийодфенил)-метанолом углеродных наноструктурах определяют содержание йода физико-химическими методами, позволяющими определять наличие йода в образце (элементный анализ, масс-спектроскопия, рентгенофотоэлектронная спектроскопия и др.).
Основной стадией описываемого способа перед определением содержания йода в органах животного методом ИСП-МС является пробоподготовка образцов тканей или органов, содержащих углеродные наноструктуры. Для упрощения и повышения точности пробоподготовки, а также возможности использования образцов любой массы была исключена стадия сжигания биообразцов, полностью заменив ее растворением (гомогенизацией) биологического образца в растворе NaOH.
Гомогенизацию органов и тканей проводят добавлением к навеске ткани или органа 0,5-2 М раствора NaOH таким образом, чтобы на 0,1 г ткани или органа приходилось 0,5-6 мл раствора едкого натра. Полученную смесь нагревают до температуры кипения щелочного раствора и ведут процесс до полного растворения органической фазы. Затем отбирают аликвоту гомогенного раствора и разбавляют ее водой в 4-8 раз. Непосредственно перед измерением раствор биологического образца подвергают ультразвуковой обработке до тех пор, пока температура раствора не станет равной 40-70°C.
Для измерения содержания йода в полученном растворе готовят калибровочные растворы йодида калия с концентрациями 10, 5, 1, 0,5, 0,1, 0,05, 0,01 мкг/мл, соответственно. Калибровочные растворы измеряют на ИСП-спектрометре и строят калибровочную кривую зависимости «сигнал-концентрация Г». На основании этой кривой определяют содержание йода в растворенном биологическом образце. Количество углеродных наноструктур в образце рассчитывают из найденного общего содержания йода за вычетом суммарного количества эндогенного йода в биологическом образце и эффекта биологической матрицы образца, который в зависимости от каждого конкретного органа или ткани привносит определенный вклад в фоновое значение содержания йода.
Вначале определяется содержание йода в образцах органов контрольных животных, получивших физиологический раствор. Оно также учитывает матричный эффект, вносимый органической матрицей растворенного органа и связанный с возможностью присутствия в плазме исследуемого раствора органа органических остатков с молекулярной массой, равной атомной массе атома йода - 127 а.е.м. [13]. Однако он не влияет на определение реального содержание углеродных наноструктур в органе, так как при расчете используется разность измеренного количества йода в исследуемом образце и измеренного количество йода в контрольном образце, что нивелирует матричный эффект. Это можно проиллюстрировать следующей цепочкой формул:
C ( 127 I н а н о ) = C ( 127 I r e a l ) − C ' ( 127 I r e a l ) , ( 1 )
C ( 127 I r e a l ) = C ( 127 I о б р а з е ц ) − C ' ( 127 O r g a n i c ) , ( 2 )
C ' ( 127 I r e a l ) = C ( 127 I к о н т р о л ь ) − C ( 127 O r g a n i c ) , ( 3 )
C ( 127 I н а н о ) = C ( 127 I о б р а з е ц ) − C ( 127 I к о н т р о л ь ) , ( 4 )
где
C(127Iнано) - реальная концентрация йода в исследуемом биологическом образце, прямо пропорциональная концентрации модифицированной йодсодержащим соединением углеродной наноструктуре;
C(127Ireal) - реальная концентрация йода в исследуемом биологическом образце растворенного органа, содержащем модифицированную йодсодержащим соединением углеродную наноструктуру;
C'(127Ireal) - реальная концентрация йода в контрольном биологическом образце, не содержащем модифицированной йодсодержащим соединением углеродной наноструктуры;
C(127Iобразец) - измеряемая концентрация йода в исследуемом биологическом образце растворенного органа, содержащем модифицированную йодсодержащим соединением углеродную наноструктуру;
С (C(127Iконтроль) - измеряемая концентрация йода в контрольном биологическом образце, не содержащем модифицированной йодсодержащим соединением углеродной наноструктуры;
C(127Organic) - величина, фиксируемая прибором как атомы йода, но являющаяся органическими молекулами или ионами с массой, равной массе атома йода, 127 а.е.м.
По известному количеству йода в биологических образцах, содержащих модифицированные (2,4,5-трийодфенил)-метанолом углеродные наноструктуры, рассчитывают содержание углеродных наноструктур по формуле
C ( У Н С ) = C ( 127 I н а н о ) ⋅ ( 100 − C ( 127 I У Н С ) ) ( 5 )
где
C(УНС) - концентрация углеродных наноструктур в исследуемом биологическом образце;
С(127Iнано) - концентрация йода в исследуемом биологическом образце;
С(127Iунс) - концентрация йода в углеродных наноструктурах, в % масс.
Измерение содержания йода проводили на ИСП-спектрометре Elan DRC II (Perkin Elmer, США). Предел обнаружения изотопа I составляет 0,008 мкг/л.
В медицине в качестве йодсодержащих (рентгеноконтрастных) диагностических средств наиболее широко применяют следующие препараты: триомбраст (смесь солей 3,5-диацетиламино-2,4,6-трийодбензойной кислоты), йодамид (3-ацетамидометил-5-ацетамидо-2,4,6-трийодбензойной кислоты), билигност (бис-(2,4,6-трийод-3-карбоксианилид)-адипиновой кислоты), омнипак (N,N'-бис(2,3-дигидроксипропил)-5-[N-(2,3-дигидроксипропил)ацетамидо]2,4,6-трийод-изофталамид и др. [14]. Однако прямое использование коммерчески доступных йодсодержащих рентгеноконтрастных препаратов для формирования конъюгатов оказывается невыполнимым ввиду невозможности их ковалентного связывания с поверхностью углеродных наноструктур.
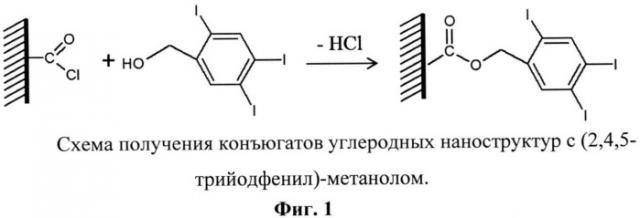
В связи с этим для создания конъюгата с углеродными наноструктурами в описываемом способе было предложено использовать (2,4,5-трийодфенил)-метанол, обеспечивающий возможность химического связывания с поверхностью углеродных наноструктур и максимального содержания йода на их поверхности. Образование конъюгата углеродных наноструктур с (2,4,5-трийодфенил)-метанолом происходит с участием поверхностных хлорацильных групп наноструктур углерода по следующей схеме (Фиг.1). Углеродные наноструктуры окисляют в смеси азотной и серной кислот, что приводит к прививке на их поверхность карбоксильных групп, которые после обработки тионилхлоридом превращаются в хлорацильные. Хлорацильные группы на поверхности углеродных наноструктур взаимодействуют с гидроксильной группой (2,4,5-трийодфенил)-метанола, в результате чего образуется конъюгат углеродных наноструктур с (2,4,5-трийодфенил)-метанолом.
Полученные вещества представляют собой ультрадисперсные порошки черного или серого цвета, содержащие от 0,1 до 2,5 масс.% йода на своей поверхности.
Содержание йода в углеродных наноструктурах определяют с помощью метода ИСП-МС, с предварительной калибровкой ИСП-спектрометра по йоду. Для этого навеску углеродных наноструктур массой от 1 до 10 мг диспергируют в 50 мл воды и с использованием ИСП-спектрометра определяют в полученном растворе содержание изотопа 127I.
Описывается также способ получения конъюгатов углеродных структур с (2,4,5-трийодфенил)-метанолом (Фиг.1), заключающийся в том, что углеродные наноструктуры, содержащие хлорацильные группы, растворяют в абсолютированном тетрагидрофуране (ТГФ) с образованием суспензии, добавляют гидрид натрия и вносят (2,4,5-трийодфенил)-метанол, полученную смесь выдерживают при постоянном перемешивании при температуре 70-90°C в течение 40-60 ч, центрифугируют, промывают растворителем и высушивают. Реагенты берут из расчета: модифицированная хлором углеродная наноструктура: (2,4,5-трийодфенил)-метанол = 1:2 по массе.
Используемые в описываемом способе получения углеродные наноструктуры, содержащие хлорацильные группы, получают путем жидкофазного окисления углеродных наноструктур смесью серной и азотной кислот и последующей обработкой тионилхлоридом. Жидкофазное окисление ведут смесью азотной и серной кислот при температуре от 80 до 130°C в течение 8-72 ч. Далее окисленные углеродные наноструктуры обрабатывают тионилхлоридом при комнатной температуре в течение 6-60 ч. Непрореагировавший тионилхлорид отгоняют перегонкой и полученный образец высушивают под вакуумом до постоянного веса.
Полученные конъюгаты углеродных наноструктур с (2,4,5-трийодфенил)-метанолом вводят экспериментальному животному внутривенно в виде суспензии в водном изотоническом растворе и через определенный промежуток времени берут пробы тканей, из которых далее отбирают навески для определения содержания йода и, следовательно, количественного определения в них содержания углеродных наноструктур.
Для исследования были взяты 32 особи кроликов породы шиншилла весом 2,7-4,9 кг, полученные из вивария Рязанского государственного медицинского университета имени академика И.П. Павлова, и 6 белых беспородных половозрелых мышей (самцы) массой 25-26 г, полученных из Центрального питомника лабораторных животных «Столбовая», Московская область.
Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.3-96 и 51000.4-96), нормативному документу «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденных Главным государственным санитарным врачом 06.04.1973 г. №1045-73, и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального комитета по биоэтике при РАН и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985 г.).
Краткое описание графических материалов.
Фиг.1. Схема получения конъюгатов углеродных наноструктур с (2,4,5-трийодфенил)-метанолом.
Фиг.2. Микрофотография конъюгата наноалмаза с (2,4,5-трийодфенил)-метанолом, полученная на просвечивающем электронном микроскопе.
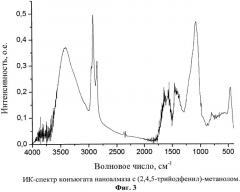
Фиг.3. ИК-спектр конъюгата наноалмаза с (2,4,5-трийодфенил)-метанолом.
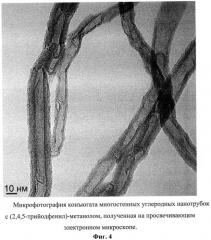
Фиг.4. Микрофотография конъюгата многостенных углеродных нанотрубок с (2,4,5-трийодфенил)-метанолом, полученная на просвечивающем электронном микроскопе.
Фиг.5. ИК-спектр конъюгата многостенных углеродных нанотрубок с (2,4,5-трийодфенил)-метанолом.
Фиг.6. а,б,в,г,д,е. Биораспределение наноалмаза в органах кролика.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Количественное определение содержания наноалмаза в организме кролика.
50 мг порошка наноалмаза обрабатывают 40 мл смеси концентрированных азотной и серной кислот в соотношении 1:4 при постоянном перемешивании и температуре 100°C в течение 24 ч. Затем окисленный наноалмаз центрифугируют при 6000 об/мин, три раза промывают водой и высушивают под вакуумом до постоянного веса. Далее окисленный наноалмаз подвергают жидкофазной обработке тионилхлоридом (30 мл) при постоянном перемешивании и комнатной температуре в течение 24 ч. Непрореагировавший тионилхлорид отгоняют перегонкой под слабым вакуумом, к полученному порошку прибавляют абсолютированный бензол, который с остатками тионилхлорида отгоняют еще раз под вакуумом. Затем из полученного наноалмаза с хлорацильными группами получают суспензию, используя 20 мл абсолютированного тетрагидрофурана, в которую вносят 100 мг (2,4,5-трийодфенил)-метанола с добавлением 50 мг гидрида натрия. Полученную смесь выдерживают при постоянном перемешивании и температуре 80°C в течение 60 ч. Полученный продукт промывают абсолютированным тетрагидрофураном, затем абсолютированным этанолом, центрифугируют и высушивают под вакуумом при 60°C в течение всей ночи. Выход целевого продукта 35,3 мг (70,6%).
Полученный продукт представляет собой серый ультрадисперсный порошок с размерами первичных частиц 2-10 нм (Фиг.2) с содержанием йода 1,7% масс., и характеризующийся ИК-спектром в диапазоне 400-4000 см-1: два сильных сигнала с максимумами частот при 2923 и 1092 см-1, широкая интенсивная полоса в области 3600-3000 см-1 с максимумом при 3400 см-1, четыре сигнала средней интенсивности с максимумами при 2953, 2854, 1637, 1560 и 469 см-1 и широкая полоса средней интенсивности в области 1466-1366 см-1 (Фиг.3).
Из порошка полученного конъюгата наноалмаза с (2,4,5-трийодфенил)-метанолом приготавливают суспензию в изотоническом растворе. Для этого к 30 мг конъюгата добавляют 3 мл изотонического водного раствора и обрабатывают ультразвуком.
Полученную суспензию с концентрацией наноалмаза 10 мг/мл вводят однократно внутривенно в бедренную вену кролика (самец, массой 3,8 кг) в дозе 5 мг/кг веса. Через 1 ч производят декапитацию, изымают органы (табл.1), берут из них навески, взвешивают и помещают в стеклянные пузырьки. Контрольным животным (масса 3,2-4,1 кг, n = 5) вводят физиологический раствор и аналогично проводят процедуру изъятия органов.
К навескам органов добавляют по 6 мл 1 М раствор NaOH и нагревают до температуры кипения в течение 30 мин до полного растворения органической фазы. Затем отбирают 3 мл раствора и разбавляют его дистиллированной водой до 15 мл. Непосредственно перед измерением раствор биологического образца подвергают ультразвуковой обработке УЗ-диспергатором до температуры 50°C.
Измерение содержания йода проводят на масс-спектрометре Perkin Elmer DRC-2, детектируя содержание изотопа 127I. Предел обнаружения составляет 0,008 мкг/л.
Калибровка прибора для проведения измерения проводится с использованием стандартных образцов, полученных разведением ГСО 7956-2001 в 1% p-pe NaOH до концентраций 10, 5, 1, 0,5, 0,1, 0,05 и 0,01 мкг/мл, соответственно. Содержание йода в образцах приведено в табл.1.
| Таблица 1 | ||||
| Содержание йода и наноалмаза в органах кролика, полученное описываемым способом (C(127Iнаноалмаз)=1,7% масс.) | ||||
| Тип органаили ткани | Содержание йода, мкг/мл | Содержаниевведенного йодаC(127Iнано),мкг/мл | Содержание наноалмаза,мкг/мл,C(наноалмаз)=C(127Iнано)·(100-C(127Iнаноалмаз)) | |
| В органе(127Iобразец) | Контроль(127Iконтроль) | |||
| Легкие | 23,7 | 0,8±0,1 | 22,9 | 22,9·(100-1,7)=2251 |
| Печень | 9,4 | 0,4±0,1 | 9 | 9·(100-1,7)=885 |
| Почка | 1,8 | 0,5±0,1 | 1,3 | 1,3·(100-1,7)=128 |
| Селезенка | 30,2 | 0,3±0,1 | 29,9 | 22,9·(100-1,7)=2939 |
| Сердце | 1,7 | 1,7±0,1 | 0 | 0 |
| Мозг | 0,5 | 0,5±0,1 | 0 | 0 |
Пример 2.
Количественное определение содержания многостенных углеродных нанотрубок (МСНТ) в организме мыши.
100 мг порошка МСНТ обрабатывают 60 мл смеси концентрированных азотной и серной кислот в соотношении 1:4 при постоянном перемешивании и температуре 110°C в течение 24 ч. Затем окисленные МСНТ центрифугируют при 6000 об/мин, дважды промывают водой и высушивают под вакуумом до постоянного веса. Далее окисленные МСНТ подвергают жидкофазной обработке тионилхлоридом (50 мл) при постоянном перемешивании и комнатной температуре в течение 24 ч. Непрореагировавший тионилхлорид отгоняют перегонкой под слабым вакуумом, к полученному порошку прибавляют абсолютированный бензол, который с остатками тионилхлорида отгоняют еще раз под вакуумом. Затем из полученных МСНТ с хлорацильными группами получают суспензию, используя 40 мл абсолютированного тетрагидрофурана, в которую вносят 200 мг (2,4,5-трийодфенил)-метанола с добавлением 100 мг гидрида натрия. Полученную смесь выдерживают при постоянном перемешивании и температуре 75°C в течение 40 ч. Полученный продукт промывают абсолютированным тетрагидрофураном, затем абсолютированным этанолом, центрифугируют и высушивают под вакуумом при 60°C в течение всей ночи. Выход целевого продукта 77,8 мг (77,8%).
Полученный продукт представляет собой черный порошок (Фиг.4) с содержанием йода 0,3% масс., и характеризующийся ИК-спектром в диапазоне 400-4000 см-1: широкая интенсивная полоса в области 3600-3000 см-1 с максимумом при 3400 см-1, полоса средней интенсивности с максимумом при 1630 см-1, две широких полосы средней интенсивности в области 1280-950 и 900-500 см-1 и три сигнала низкой интенсивности с максимумами при 2953, 2854, 1320 см-1 (Фиг.5).
Из порошка полученного конъюгата МСНТ с (2,4,5-трийодфенил)-метанолом приготавливают суспензию в изотоническом растворе. Для этого к 2,5 мг конъюгата добавляют 10 мл изотонического водного раствора и обрабатывают ультразвуком.
Полученную суспензию с концентрацией МСНТ 0,25 мг/мл вводят однократно внутривенно в хвостовую вену мыши (самец, массой 25 г) в объеме 0,5 мл и дозе 5 мг/кг веса. Через 1 ч производят декапитацию, изымают навески органов (табл.2), взвешивают и помещают в стеклянные пузырьки. Контрольным животным (самцы, массой 25-26 г, n=5) вводят физиологический раствор и аналогично проводят процедуру изъятия органов.
К навескам органов добавляют по 6 мл 1 М раствор NaOH и нагревают до температуры кипения в течение 30 мин до полного растворения органической фазы. Затем отбирают 3 мл раствора и разбавляют его дистиллированной водой до 15 мл. Непосредственно перед измерением раствор биологического образца подвергают ультразвуковой обработке УЗ-диспергатором до температуры 50°C.
Измерение содержания йода проводят на масс-спектрометре Perkin Elmer DRC-2, детектируя содержание изотопа 1271. Предел обнаружения составляет 0,008 мкг/л.
Калибровка прибора для проведения измерения проводится с использованием стандартных образцов, полученных разведением ГСО 7956-2001 в 1% p-pe NaOH до концентраций 10, 5, 1, 0,5, 0,1, 0,05 и 0,01 мкг/мл, соответственно. Содержание йода в образцах приведено в табл.2.
| Таблица 2. | ||||
| Содержание йода и МСНТ в органах мыши, полученное описываемым способом (C(127IMCHT)=0,3% масс.). | ||||
| Тип органаили ткани | Содержание йода,мкг/мл | СодержаниевведенногойодаC(127Iнано), мкг/мл | Содержание MCHT, мкг/мл,C(MCHT)=С(127Iнано)·(100-C(127IУНС)) | |
| В органе(127Iобразец) | Контроль(127Iконтроль) | |||
| Печень | 5,0 | 3,8±0,1 | 1,2 | 1,2·(100-0,3)=120 |
| Почка | 5,9 | 1,4±0,1 | 4,5 | 4,5·(100-0,3)=449 |
| Мозг | 5,5 | 2,8±0,1 | 2,7 | 2,7·(100-0,3)=269 |
Углеродные нанотрубки (одностенные или многостенные) представляют собой свернутые в цилиндр гексагональные графитовые плоскости, которые заканчиваются полусферической головкой, представляющей собой половину молекулы фуллерена [15]. Поэтому для фуллерена, других производных наноструктурных форм углерода, в том числе одномерного графита - графена, также полностью применим описываемый способ количественного определения углеродных наноструктур в организме.
Пример 3.
Изучение биораспределения наноалмаза в организме кролика.
Для изучения описываемым способом биораспределения наноалмаза использовался наноалмаз, модифицированный (2,4,5-трийодфенил)-метанолом, полученный по примеру 1, в количестве 1 г.
Из порошка конъюгата наноалмаза с (2,4,5-трийодфенил)-метанолом приготавливают суспензию в изотоническом растворе с концентрацией 10 мг/мл. Суспензию вводят однократно внутривенно в бедренную вену кроликов (m=2,6-4,9 кг, n=5 на каждую временную точку) в дозе 5 мг/кг веса. Через 1, 6, 24 ч, 15 и 30 сут. производят декапитацию, изымают навески органов, взвешивают и помещают в стеклянные пузырьки. Контрольным животным (масса 3,2-4,1 кг, n=6) вводят физиологический раствор и аналогично проводят процедуру изъятия органов.
К навескам органов добавляют по 6 мл 1 М раствор NaOH и нагревают до температуры кипения в течение 30 мин до полного растворения органической фазы. Затем отбирают 3 мл раствора и разбавляют его дистиллированной водой до 15 мл. Непосредственно перед измерением раствор биологического образца подвергают ультразвуковой обработке УЗ-диспергатором до температуры 50°C.
Измерение содержания йода проводят на масс-спектрометре Perkin Elmer DRC-2, детектируя содержание изотопа 127I. Предел обнаружения составляет 0,008 мкг/л.
Калибровка прибора для проведения измерения проводится с использованием стандартных образцов, полученных разведением ГСО 7956-2001 в 1% p-pe NaOH до концентраций 10, 5, 1, 0,5, 0,1, 0,05 и 0,01 мкг/мл, соответственно. Содержание йода и наноалмаза в образцах приведено на Фиг.6.
Показано, что достаточно быстрое (через 1 час после введения) и максимальное кумулирование наноалмаза происходит в легких (до 30 мкг/г, Фиг.6а) и в сселезенке (23 мкг/г, Фиг.6б) кролика. Предельное содержание наноалмаза в других органах достигается медленнее: в печени (Фиг.6в) и головном мозге (Фиг.6е) - через 1 сут., а в почках и сердце - на 15-е сут.(Фиг.6г,д). При этом в сердце и головном мозге животного наноалмаз накапливается в количестве 6,5 мкг/г. Выводится наноалмаз практически из всех органов в течение месяца (Фиг.6).
Список литературы
1. A.M. Schrand, S.A. Hens, O.A. Shendorova. Nanodiamond particles and perspective for bioapplications. Critical Reviews in Solid State and Mat. Sci // 2009. V. 34. Issie 1-2. P.18-74.
2. S. Chaudhary, J.H. Kim, K.V. Singh, M. Ozkan. Fluorescence Microscopy Visualization of Single-Walled Carbon Nanotubes Using Semiconductor Nanocrystals // Nano Lett. 2004 V. 4. №12. P.2415-2419.
3. Z. Xiaoyong, Y. Jilei, K. Cheng, L. Jing et al. Biodistribution and toxicity of nanodiamonds in mice after intratracheal instillation // Toxicol. Let. 2010. V. 198. P.237-243.
4. Z. Chen, L. Ma, Y. Liu, C. Chen. Applications of Functionalized Fullerenes in Tumor // Theranostics. 2012. V 2. №3. P.238-250.
5. H. Wang; J. Wang; X. Deng et al. Biodistribution of Carbon Single-Wall Carbon Nanotubes in Mice // J. of Nanosci. and Nanotech. 2004. V. 4. №8. P.1019-1024.
6. X. Zhanga, J. Yina, C. Penga et al. Distribution and biocompatibility studies of graphene oxide in mice after intravenous administration // Carbon. 2011. V. 49. №3.P.986-995.
7. Purtov K.V., Petunin A.I., Burov A.E., Puzyr A.P., Bondar V.S. Nanodiamonds as Carriers for Address Delivery of Biologically Active Substances //Nanoscale Res. Let. 2010. V. 5. P.631-636.
8. L.M. Manus, D.J. Mastarone, E.A. Waters et al. Gd(III)-nanodiamond conjugates for MR1 contrast enchancement // Nano Lett. 2010. V. 10. P.484-489.
9. Е. Toth, R.D. Bolskar, A. Borel et al. Water-Soluble Gadofullerenes: Toward High-Relaxivity, pH-Responsive MRI Contrast Agents //J. Am. Chem. Soc. 2005. V. 127. №2. P.799-805.
10. P. Schramel, S. Haase. Iodine determination in biological materials by ICP-MS // Mikrochim. Acta. 1994. V. 116. P.205-309.
ll.Yakovlev R.Yu., Badun G.A., Selezenev N.G. et al. Development and investigation of drug delivery system based on the detonation nanodiamonds. Int. Conf. «Advansed carbon nanostructures». Book of abst. St. Petersburg. 2011. P.205.
12. Долматов В.Ю. Детонационные наноалмазы / СПб.: Изд-во НПО «Профессионал», 2011. 534 с.
13. 2012. The use of ICP-MS for human biomonitoring [Biomonitoring Methods, 1999]. The МАК Collection for Occupational Health and Safety. V. 6. P.1-45.
14. М.Д. Машковский. Лекарственные средства. - 16-е изд., перераб., испр. и доп. М.: Новая Волна: Издатель Умеренков, 2012. с.1026-1032.
15. Елецкий А.В. Углеродные нанотрубки и их эмиссионные свойства // УФН. 2002. Т.172. №4. С.401-438.
1. Способ количественного определения углеродных наноструктур в биологических образцах и их распределения в организме ex vivo путем введения в организм экспериментального животного модифицированных йодсодержащим соединением углеродных наноструктур с последующим изъятием органов и тканей и определением в них содержания йода, отличающийся тем, что поверхность углеродных наноструктур модифицируют (2,4,5-трийодфенил)-метанолом, определяют количество йода в модифицированных углеродных наноструктурах, полученные модифицированные углеродные наноструктуры вводят в организм экспериментального животного с последующим изъятием органов и тканей, их гомогенизацией в 0,5-2 М растворе NaOH, отбором пробы гомогената, разбавлением ее водой, обработкой разбавленной пробы ультразвуком до температуры 40-70°C, определением в полученной пробе количества йода методом масс-спектрометрии с индуктивно-связанной плазмой и расчетом содержания углеродных наноструктур в пробе по полученному содержанию йода в образце.
2. Способ по п.1, где поверхность углеродных наноструктур модифицируют (2,4,5-трийодфенил)-метанолом путем растворения углеродных наноструктур, содержащих на поверхности хлорацильные группы, в абсолютированном тетрагидрофуране с последующим добавлением к полученной суспензии гидрида натрия и (2,4,5-трийодфенил)-метанола, перемешиванием при температуре 70-90°C, промывкой тетрагидрофураном, центрифугированием и сушкой.