Носитель лекарственного средства, обеспечивающий контрастное усиление при мрт
Иллюстрации
Показать всеИзобретение относится к носителю, приспособленному для местной доставки лекарственного средства. Лекарственное средство заключено в носителе, и носитель содержит оболочку, способную к высвобождению заключенного лекарственного средства в результате действия локального стимула. Оболочка дополнительно окружает контрастное средство МР 19F, которое претерпевает изменение в способности быть обнаруженным после высвобождения из носителя. Изобретение относится к способу доставки лекарственного средства субъекту, управляемому посредством МРТ, где способ включает введение субъекту указанного носителя, позволяя носителю высвобождать лекарственное средство, и получение изображения МР 19F, используя контраст, предоставляемый контрастным средством МР 19F. Изобретение обеспечивает возможность мониторинга начала высвобождения лекарственного средства из носителя. 2 н. и 16 з.п. ф-лы, 11 ил., 2 табл., 2 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к магнитно-резонансной томографии (МРТ). В частности, изобретение относится к применению МРТ и 19F МРТ в контролируемой или направленной доставке биологически активных средств, таких как терапевтические или диагностические средства (далее в настоящем документе обозначаемые как «лекарственные средства»). Более конкретно, изобретение относится к носителям лекарственного средства для применения в качестве контрастных средств при МРТ при такой контролируемой и направленной доставке.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Многие заболевания, главным образом те, которые локализованы в определенной ткани, подвергают лечению систематически вводимыми лекарственными средствами. Хорошо известным примером общепринятой терапии злокачественной опухоли является систематическая химиотерапия, которая вследствие нежелательного биораспределения и токсичности для организма пациента сопровождается значительными побочными эффектами. Терапевтическое окно этих лекарственных средств, с одной стороны, как правило, определяется минимальной терапевтической концентрацией, необходимой для воздействия на пораженную заболеванием ткань, а с другой стороны, токсическими эффектами в органах, не являющихся органами-мишенями, например в печени, селезенке. Местное лечение, например местным высвобождением цитостатических средств из наноносителей, предполагает, по сравнению с общепринятыми видами лечения, более эффективное лечение и большее терапевтическое окно. Местная доставка лекарственного средства важна также, если другие способы лечения, такие как хирургическое вмешательство, связаны с очень большим риском, как это часто происходит в случае злокачественных опухолей печени. Местная доставка лекарственного средства также может стать предпочтительным способом лечения многих признаков сердечно-сосудистого заболевания (CVD), такого как атеросклероз коронарных артерий.
Магнитно-резонансная томография, основанная, как правило, на 1H в качестве магнитного ядра, является важным диагностическим способом, который широко используется в больницах для диагностики заболевания. МРТ представляет возможность не инвазивного получения изображения мягкой ткани с высоким пространственным разрешением.
Магнитно-резонансная томография, разработанная на основе 19F вместо 1H, открывает новые диагностические возможности. Ядро 19F обладает высоким гиромагнитным отношением (40 МГц/T) и природным изотопным отношением 100%. В организме человека структуры на основе 19F присутствуют исключительно в форме твердых солей, например, в зубах и костях. Как следствие, время релаксации T 2 эндогенных атомов 19F является очень коротким, а сигнал МР трудно детектируемым. Другими словами, отсутствие эндогенных структур на основе 19F с относительно большим временем поперечной релаксации представляет очень низкий фоновый сигнал МР. Таким образом, экзогенные контрастные средства для МРТ на основе 19F позволяют получить изображение «горячей точки» в способе, сходном с другими способами, такими как PET (позитронно-эмиссионная томография).
В качестве полезного расширения применения МРТ в диагностике МРТ также предлагают применять для контроля доставки биоактивных средств, таких как терапевтические или диагностические средства. Т.е. МРТ можно использовать не только для планирования лечения, но также для контроля местной доставки лекарственного средства под визуальным контролем.
Вследствие указанной выше высокой специфичности было бы желательно использовать 19F МРТ не только в качестве средства диагностики, но также в доставке лекарственных или других биологически активных средств, связанной с МРТ. Подобная высокая специфичность при этом, однако, также создает фактическое ограничение для оптимального применения 19F МРТ. С одной стороны, добавление контрастного средства 19F к носителю лекарственного средства означало бы, что представлялось возможным определить местоположение такого носителя лекарственного средства в любой момент времени способами 19F МРТ, вследствие отсутствия источников природного сигнала 19F. С другой стороны, это будет означать, что обнаружение контрастного средства 19F не предоставляет информацию о высвобождении биологически активного средства, а только о наличии контрастного средства.
Ссылкой, относящейся к контролированию высвобождения лекарственного средства посредством МРТ, является Ponce et al., J Natl Cancer Inst 2007; 99: 53-63. В этом документе лекарственное средство, доксорубицин, заключают в термочувствительную липосому. При температуре организма доксорубицин остается внутри липосомы, тогда как при температуре 41-42°C цитостатическое лекарственное средство высвобождается из внутреннего пространства липосомы, заполненного водой. Таким образом, при применении нагревания можно способствовать высвобождению лекарственного средства, поскольку это приведет к вскрытию липосомы, при этом высвобождение лекарственного средства перестает обуславливаться диффузией (при наличии) через липосомальную оболочку. Для контролирования высвобождения лекарственного средства посредством МРТ к составу добавляли марганец в качестве контрастного средства МРТ.
Почти все современные изображения МРТ основаны на изображении суммарного сигнала молекул воды, которые в очень высокой концентрации присутствуют на всем протяжении всего организма во всех тканях. Если контраст между различными тканями является недостаточным для получения клинической информации, вводят контрастные средства МРТ (CA), такие как комплексы гадолиния с низкой молекулярной массой. Эти парамагнитные комплексы снижают время продольной (T1) и поперечной (T2) релаксации протонов в молекуле воды. Также действует марганец в качестве контрастного средства для T1.
Контрастное средство марганец в указанном выше носителе лекарственного средства будет действовать исходя из его влияния на суммарный сигнал молекул воды, определяемых МРТ, т.е. контрастное средство будет приводить к мгновенному усилению контраста МРТ в результате вскрытия липосомальной оболочки при температуре выше температуры фазового перехода (плавления) липидов, после применения нагревания.
Как описано, МРТ, которое используют в таком процессе высвобождения лекарственного средства, по существу используют для контроля проводимого высвобождения для подтверждения того, что липосомы, чувствительные к температуре, действительно выполняют свою функцию. Т.е. это лишь предоставляет информацию ех post facto.
Полезно было бы использовать 19F МРТ для управления и/или контроля местного высвобождения биологически активного средства, такого как лекарственное средство. Также полезно было бы контролировать путь носителя лекарственного средства, начиная с момента его введения. Также вместо подтверждения факта немедленного высвобождения лекарственного средства такой контроль необходим для заблаговременного определения того, когда и где должно происходить высвобождение лекарственного средства. В частности, для термочувствительных носителей лекарственного средства было бы полезно определять местоположение носителя лекарственного средства и применять нагревание, которое служит для облегчения высвобождения лекарственного средства в желаемом месте и в желаемый момент времени. Кроме того, необходимо обеспечить возможность контроля, необходимость в котором не обязательно исчезает с процессом высвобождения лекарственного средства и, предпочтительно, который можно использовать для количественного определения процесса высвобождения лекарственного средства и для оценки терапевтической эффективности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Для более эффективного выполнения указанных выше требований изобретение, в одном из аспектов, представляет носитель, подходящий для местной доставки биологически активного средства, такого как лекарственное средство, где носитель содержит оболочку, способную высвобождать заключенное биологически активное средство, лекарственное средство в результате действия локального стимула, например, поступления энергии, такого как нагревание, где оболочка содержит контрастное средство 19F МР.
В другом аспекте изобретение относится к комбинации МРТ 19F и CEST МРТ 1H и представляет носитель, подходящий для местной доставки биологически активного средства, такого как лекарственное средство, где носитель содержит оболочку, способную высвобождать заключенное биологически активное средство, лекарственное средство в результате действия локального стимула, например поступления энергии, такого как нагревание, где оболочка содержит средство химического сдвига для lipoCEST для МРТ 1H и контрастное средство для МРТ 19F.
В другом аспекте изобретение относится к носителю, подходящему для местной доставки биологически активного средства, такого как лекарственное средство, где носитель содержит контрастное средство и для МРТ 19F и для 1H. В частности, в дополнительном аспекте, контрастное средство для МРТ 1H выбрано из группы, состоящей из контрастных средств, увеличивающих T1 и/или T2, контрастных средств CEST МР и их комбинации.
В дополнительном аспекте, изобретение относится к носителю лекарственного средства, где носитель содержит термочувствительную, полупроницаемую оболочку, окружающую полость, где полость содержит контрастное средство 19F, парамагнитные реагенты для химического сдвига и совокупность анализируемых протонов и где оболочка представляет диффузию анализируемых протонов.
В еще одном аспекте изобретение относится к носителю для контролируемого местного высвобождения биоактивного средства, такого как терапевтическое или диагностическое средство, где носитель содержит термочувствительную, полупроницаемую оболочку, окружающую полость, где полость содержит контрастное средство 19F, парамагнитный реагент для определения химического сдвига и совокупность анализируемых протонов, где оболочка представляет диффузию анализируемых протонов, и где свойства оболочки можно изменять посредством нагревания для того, чтобы способствовать высвобождению биоактивного средства, заключенного в носителе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Изобретение будет проиллюстрировано со ссылкой к следующим далее неограничивающим примерам и сопроводительным неограничивающим фигурам.
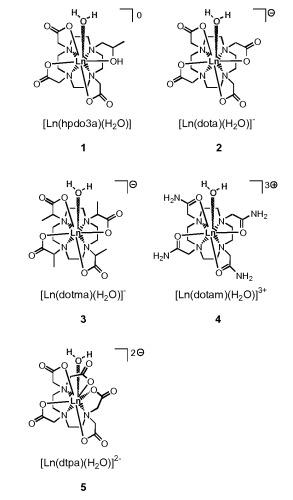
Фиг.1. Термочувствительная липосома для доставки молекул лекарственного средства под визуальным контролем. В схематическом виде представлено высвобождение средств химического сдвига (например, [Tm(hpdo3a)H2O)] и контрастных средств МРТ 19F (например, NH4PF6), происходящее в результате применения внешнего стимула (например, нагревание, ультразвук или RF).
Фиг.2. Примеры подходящих контрастных средств МРТ 19F.
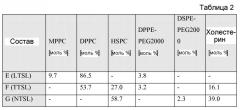
Фиг.3. Химические формулы дипальмитоил-sn-глицеро-3-фосфохолина (DPPC), гидрогенизированного sn-глицеро-3-фосфохолина из бобов сои (HSPC) и монопальмитоил-sn-глицеро-3-фосфохолина (MPPC).
Фиг.4. ЯМР 19F сигнал липосом с 50 мМ NH4PF6 в полости (состав A) при 7 T. В результате добавления Triton-X100, неионного поверхностно-активного вещества, 19F сигнал становится четче, что свидетельствует о высвобождении NH4PF6 из внутренней части липосомы.
Фиг.5. Спектры ЯМР 19F липосом с низкой чувствительностью к температуре (состав B), содержащих NH4PF6 и [Tm(hpdo3a)(H2O)], при различных температурах.
Фиг.6. Интенсивность сигнала ЯМР 19F липосом с низкой чувствительностью к температуре (LTSL) с различной концентрацией заключенного в них NH4PF6 (состав A-D) изображена в качестве функции от температуры при 7 T, показано увеличение интенсивности сигнала 19F при температуре фазового перехода (плавлении) в результате повышения температуры.
Фиг.7. Спектр Z (слева) и эффекты CEST (справа) липосом с низкой чувствительностью к температуре, загруженных 50 мМ [Tm(hpdo3a)(H2O)] и 50 мМ NH4PF6 (состав B), как функции от уровня мощности предварительного насыщения (2,9-10,6 мкT) при 298 K и 7,0 T. Эффект CEST рассчитали по уравнению: (1-MS/M0)*100%, где Ms представляет собой величину сигнала протона воды после избирательного насыщения водного пространства внутри липосомы и M0 представляет собой интенсивность сигнала протонов водного объема при контролируемом облучении относительно сдвига частоты.
Фиг.8. Интенсивность сигнала ЯМР контрастных средств липосом с низкой чувствительностью к температуре для CEST и 19F МРТ изображена как функция температуры (состав B).
Фиг.9. Изображения CEST контрастных средств МРТ (состав B) липосом с низкой чувствительностью к температуре, полученные с использованием одновременной двойной последовательности 19F/1H при 3T. Эффект CEST, наблюдаемый при 297 K, исчезал при 311 K, что свидетельствует о высвобождении o [Tm(hpdo3a)(H2O)] из внутреннего пространства липосом (слева). После нагревания средства сигнал МР 19F МР становится видимым (справа).
Фиг.10. Эффект CEST в зависимости от температуры для липосом с низкой чувствительностью к температуре (LTSL) (состав E), липосом с традиционной чувствительностью к температуре (TTSL) (состав F) и липосом, не чувствительных к температуре (NTSL) (состав G). Контрастные средства CEST МРТ липосом с низкой чувствительностью к температуре (состав E) демонстрируют четкое снижение эффекта CEST при 312 K, тогда как более медленное уменьшение эффекта CEST наблюдается при более высоких температурах для контрастных средств CEST МРТ, основанных или на TTSL, или на NTSL.
Фиг.11. 19F сигнал в зависимости от температуры для LTSL (состав E), TTSL (состав F) и NTSL (состав G).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТА ОСУЩЕСТВЛЕНИЯ
В широком смысле изобретение можно описать со ссылкой к носителю, подходящему для местной доставки биологически активного средства, такого как лекарственное средство, где носитель содержит контрастное средство 19F. При высвобождении из носителя контрастное средство 19F претерпевает изменения в способности быть обнаруженным. В частности, в состоянии, когда средство 19F заключено в носителе, сигнал МР контрастного средства 19F спектрально является очень широким. Таким образом, контрастное средство 19F является трудно детектируемым. Однако при высвобождении контрастное средство 19F становится детектируемым и дает чистый, предпочтительно узкий, сигнал в магнитном резонансе 19F.
В частности, изобретение можно описать со ссылкой к носителю, подходящему для местной доставки биологически активного средства, такого как лекарственное средство, где носитель содержит и контрастное средство 19F, и контрастное средство CEST.
Подходящий носитель для местной доставки биологически активного средства, такого как лекарственное средство (далее в настоящем документе коротко обозначаемого как «носитель лекарственного средства»), может иметь отношение ко множеству способов, в которых носитель, при загрузке лекарственным средством, может инициировать местное высвобождение лекарственного средства, например, в результате применения контролируемого внешнего фактора или доставки достаточного количества энергии. Это относится, например, к термочувствительным носителям лекарственного средства, которые могут инициировать местное высвобождение лекарственного средства в результате применения локального нагрева. Другие способы для местной доставки не обязательно подразумевают термочувствительные носители, а и носители, которые могут инициировать высвобождение лекарственного средства способом активации, который регулируется свойствами, отличными от термочувствительности, включая в качестве неограничивающих примеров pH, наличие газообразного ядра и/или слоев, и чувствительность к примененной извне частоты/длины волны и интенсивности ультразвука.
Контрастные средства 19 F МРТ
На основании объяснения, данного выше, будет понятно, что детектируемые МР 19F не встречаются в природе в организме и что МРТ 19F, таким образом, будет обязательно основано на использовании добавленных контрастных средств 19F.
Контрастные средства для МРТ 19F предпочтительно обладают большим количеством магнитно-эквивалентных групп фтора (чувствительность изменяется линейно с количеством магнитно-эквивалентных атомов F на молекулу). Для требуемой комбинации с CEST МРТ используемые контрастные средства МР 19F являются, предпочтительно, водорастворимыми и, в частности, предпочтительно изменяют заряд молекул, чтобы обеспечить, по возможности, высокую растворимость в воде. Для применения в фосфолипидных оболочках предпочтительные контрастные средства 19F несущественно связаны или не являются существенно связанными с фосфолипидами. Для высвобождения в организме человека или животного контрастные средства 19F предпочтительно являются низкотоксичными и обладают высокой биологической совместимостью.
Предпочтительные контрастные средства 19F выбирают из соединений, проиллюстрированных на фиг.2, и их смесей. Наиболее предпочтительно используют аналоги алифатических углеводородов с зарядом на F.
CEST МРТ
В предпочтительном варианте осуществления изобретение также относится к контрастному усилению CEST МРТ. Этот способ служит для создания контраста изображения посредством использования химического обменно-зависимого переноса насыщения (CEST) с определенных, предварительно магнитнонасыщенных протонов, в суммарный сигнал молекул воды, определяемый МРТ.
В предпочтительном варианте осуществления изобретение также относится к применению любого контрастного усиления типа CEST для термочувствительного высвобождения лекарственного средства, и предпочтительно использовать более новые современные способы CEST, как только они становятся доступными.
CEST в комбинации с парамагнитным реагентом для химического сдвига (ParaCEST) представляют собой способ, в котором намагниченность совокупности протонов контрастного средства CEST с парамагнитным сдвигом избирательно насыщают, применяя радиоизлучение (RF). Перенос этого насыщения в суммарный сигнал молекул воды посредством протонного обмена приводит к сниженному количеству возбудимых протонов воды, окружающих контрастное средство CEST. Таким образом, наблюдают снижение интенсивности суммарного сигнала воды, что можно использовать для создания (отрицательного) контрастного усиления в изображениях МРТ.
Способ получения высокоэффективного CEST основан на использовании большого количества молекул воды раствора, содержащего парамагнитный сдвигающий реагент (например, Na[Tm(dotma)(H2O)]), где «H4dotma» обозначает α,α',α'',α'''-тетраметил-1,4,7,10-тетрауксусную кислоту и dotma обозначает соответствующую четырехкратно депротонированную тетраанионную форму лиганда, для предоставления совокупности протонов с химическим сдвигом и которые, таким образом, можно избирательно насыщать посредством импульса RF. Если эту систему заключать в носитель, например в липосому, магнитное насыщение можно переносить в суммарный сигнал молекул воды за пределы носителей без химического сдвига (LipoCEST). Величину переноса намагниченности и, таким образом, степень контрастного усиления определяют посредством скорости диффузии воды через оболочку носителя, например фосфолипидную мембрану, а также количеством воды в пределах носителя.
Оптимальная скорость обмена воды прямо коррелирует с разностью химического сдвига между сигналом совокупности протонов в пределах носителя и сигналом суммарной воды за пределами носителя. Парамагнитный сдвиг, который воздействует на молекулы воды в пределах липосом, состоит из двух основных составляющих: химический сдвиг, возникающий вследствие прямого дипольного взаимодействия между молекулами воды и сдвигающим реагентом (δdip), и химический сдвиг, обусловленный эффектом суммарной магнитной восприимчивости (δbms). Суммарный парамагнитный сдвиг представляет собой сумму двух этих составляющих:
δ=δdip+δbms (1)
Для сферических частиц δbms составляет ноль, но для анизотропных частиц δbms может быть существенной. Несферические частицы в магнитном поле испытывают воздействие силы, которая заставляет их выстраиваться в соответствии с линиями магнитного поля. В случае липосом этот эффект дополнительно увеличен, если они несут парамагнитные молекулы, ассоциированные с фосфолипидной мембраной.
Ссылкой на CEST, в которой используют несферические липосомы, является Terreno, E. et al. Angew. Chem. Int. Ed. 46, 966-968 (2007).
19 F и МР 1 H комбинированное контрастное усиление
По изобретению подходящую комбинацию 19F и 1H МР можно осуществлять различными способами.
Так, двойное или множественное мечение контраста МР можно обеспечивать посредством использования механизма CEST и/или МР 19F. Альтернативно, множество видов контраста МР можно создать посредством модификации времени продольной релаксации (T 1) или поперечной релаксации (Т 2) изображаемого исследуемого образца (как правило, протонов воды) посредством содержащего металл соединения, присутствующего в носителе. Любые из этих механизмов контрастного усиления можно дополнительно использовать в любой их комбинации.
Контраст МРТ, дважды или множественно меченый, в зависимости от физического состояния носителя контролируют или способом последовательного или чередующегося контроля общепринятым устройством МР или одновременно используя комбинации последовательностей на спектрометрических системах с двойной настройкой, например, на резонансных частотах МР 1Н и 19F.
В этом аспекте изобретение также относится к использованию способа получения изображения МРТ одновременно на двух ядрах в контролировании и/или управлении доставкой лекарственного средства.
Комбинация CEST и контрастного средства 19F в термочувствительной липосоме предлагает возможность контролирования процесса высвобождения лекарственного средства независимо и одновременно, посредством способов CEST и МРТ 19F. Одновременный контроль двух различных сигналов МР опосредован соответствующими техниками МР с двойным мечением. Этот подход приводит к некоторым возможным преимуществам. Так, пространственное распределение частиц, нагруженных лекарственным средством, можно определять до высвобождения лекарственного средства способами CEST МРТ; сигналы CEST и МР 19F усиливаются с количеством высвобожденного лекарственного средства, что предусматривает количественный контроль дозы доставленного лекарственного средства in vivo, используя обратную связь; высвобождение лекарственных средств из носителя в участке, пораженном заболеванием, можно вызвать воздействием локального стимула, такого как нагревание, в случае термочувствительных липосом, используя, например, RF или ультразвук; контрастное усиление CEST МР можно применять или не применять по желанию.
Носитель
Выше делается ссылка на носитель, подходящий для местной доставки биологически активного средства, такого как лекарственное средство. Далее в настоящем документе термин «биологически активное средство» будем кратко называть как «лекарственное средство», а носитель как «носитель лекарственного средства».
Носитель лекарственного средства в контексте по настоящему изобретению относится к любому материалу, в котором или на котором может содержаться биоактивное средство, таким образом, с которым оно способно быть высвобожденным в организм субъекта.
Подходящие носители включают микроносителии, в частности наноносители, такие как липосомы, полимерсомы, нанокапсулы и другие лекарственные формы, размер или природа которых соразмерна использованию в качестве контрастного средства CEST.
Носитель лекарственного средства должен быть введен в организм субъекта, подвергаемого воздействию МРТ. Это можно осуществить, например, инъекцией в кровоток или другими способами введения носителя в жидкость организма.
Лекарственное средство представляет собой химическое вещество, используемое для лечения, устранения, предотвращения или диагностики заболевания или нарушения или, в других случаях, для улучшения физического или душевного самочувствия. Управляемая доставка, предусмотренная по настоящему изобретению, будет, главным образом, полезна для терапевтических средств (т.е. в строгом смысле лекарственным средствам, предназначенным для лечения или предотвращения заболевания или нарушения), а также для средств, которые вводят для диагностических целей. Хотя другие биоактивные средства, т.е. те, которые не являются терапевтическими или диагностическими, такие как функциональные продукты, не будут, как правило, подвергаться действию управляемой и/или контролируемой доставки, такое можно по желанию осуществить, используя настоящее изобретение.
Наиболее оптимального использования по изобретению достигают в случае адресных видов лечения, т.е. в случае лекарственных средств, которые предназначены для адресной доставки, поскольку по природе такая доставка извлекает наибольшую пользу из контролирования, предоставляемого по изобретению. Это касается, например, средств лечения опухолей, подлежащих доставке в место расположения опухоли, средств лечения или предотвращения сердечно-сосудистого нарушения, такого как атеросклероз коронарных артерий, или антитромботических средств (например, для местного растворения тромбов), или средств, которым требуется прохождение через гематоэнцефалический барьер, таких как нейромодуляторы, которые можно использовать при лечении состояний, относящихся к нервной системе, таких как эпилепсия, болезнь Альцгеймера, болезнь Паркинсона или инсульт. Преимущества управления и контролирования адресной доставки лекарственного средства также являются пригодными для адресных диагностических средств. Аналогично, как и в случае адресных видов лечения, и в данном случае злокачественная опухоль представляет собой область, где может быть важна сайт-специфическая доставка.
Биоактивные средства, пригодные для использования в настоящем изобретении, включают биологически активные средства, включающие терапевтические лекарственные средства, эндогенные молекулы и фармакологически активные средства, включающие антитела, молекулы питательных веществ; косметические средства, диагностические средства и дополнительные контрастные средства для получения изображения. Как применяют в настоящем документе, активное средство включает фармакологически приемлемые соли активных средств.
По настоящему изобретению носители лекарственного средства могут содержать или гидрофильные или гидрофобные биоактивные средства. Гидрофильное биоактивное средство может быть заключено в водное пространство носителя, тогда как гидрофобные биоактивные средства могут быть встроены в гидрофобные домены носителя, например в липидную двухслойную структуру липосом. Нуклеиновые кислоты, углеводы и в основном белки и пептиды являются водорастворимыми или гидрофильными. Например, также рассматривают биоактивные средства, которые представляют собой низкомолекулярные соединения, липиды, липополисахариды, полинуклеотиды и антисмысловые нуклеотиды (средства генной терапии). Такие биологически активные средства, которые можно встраивать, включают, таким образом, непептидные, небелковые лекарственные средства. В объем настоящего изобретения возможно включение лекарственных средств полимерной природы, а также включение лекарственных средств с относительно низкой молекулярной массой, менее чем 1500 г/мол или даже менее чем 500 г/моль.
Таким образом, соединения, предполагаемые для применения в качестве биоактивных средств в контексте по настоящему изобретению, включают любое соединение с терапевтическим или профилактическим действием. Это может быть соединение, которое влияет или принимает участие в тканевом росте, клеточном росте, клеточной дифференцировке, соединение, которое способно инициировать биологическое действие, такое как иммунный ответ или соединение, которое может участвовать в одном или нескольких биологических процессах. Перечень неограничивающих примеров включает противомикробные средства (включающие противобактериальные, противовирусные средства и противогрибковые средства), противовирусные средства, противоопухолевые средства, ингибиторы тромбина, противотромбозные средства, тромболитические средства, фибринолитические средства, ингибиторы ангиоспазма, блокаторы кальциевых каналов, сосудорасширяющие средства, антигипертензивные средства, противомикробные средства, антибиотики, ингибиторы поверхностных гликопротеиновых рецепторов, противотромбоцитарные средства, антимитотические средства, ингибиторы микротрубочек, антисекреторные средства, ингибиторы актина, ингибиторы ремоделирования, антиметаболиты, противопролиферативные средства (включающие антиангиогенные средства), химиотерапевтические средства против злокачественной опухоли, стероидные или нестероидные противовоспалительные средства, иммуносупрессирующие средства, антагонисты гормона роста, факторы роста, агонисты дофамина, радиотерапевтические средства, компоненты внеклеточного матрикса, ингибиторы ACE, акцепторы свободных радикалов, хелатирующие средства, антиоксиданты, средства, направленные против полимераз, и средства фотодинамической терапии.
Относительно небольшие пептиды могут быть названы по количеству аминокислот (например ди-, три-, тетрапептиды). Пептид с относительно небольшим количеством амидных связей можно также назвать олигопептидом (вплоть до 50 аминокислот), в то время как пептид с относительно большим количеством аминокислот (более чем 50 аминокислот) можно называть полипептидом или белком. В дополнение к существующему полимеру из аминокислотных остатков некоторые белки можно дополнительно описать посредством так называемой четвертичной структуры, конгломерата некоторого количества полипептидов, которые необязательно химически связаны посредством амидных связей, а связаны силами, как правило, известными специалистам в данной области, такими как электростатические и Вандерваальсовы силы. Как применяют в настоящем документе, термин «пептиды, белки или их смесь» представлен для включения всех перечисленных выше возможностей.
Как правило, белок и/или пептид отбирают исходя из его биологической активности. В зависимости от вида выбранного полимера продукт, получаемый посредством настоящего процесса, является наиболее подходящим для контролируемого высвобождения белков и пептидов. В конкретном варианте осуществления белок или пептид представляет собой фактор роста.
Другие примеры пептидов или белков или организмов, содержащих пептиды или белки, которые предпочтительно могут содержаться в загруженном полимере, включают, но не ограничивается ими, иммуногенные пептиды или иммуногенные белки, которые включают, но не ограничиваются ими, следующие:
токсины, такие как дифтерийный токсин и тетанотоксин.
Вирусные поверхностные антигены или части вирусов, таких как аденовирусы, вирус Эпштейна-Барр, вирус гепатита A, вирус гепатита B, вирусы герпеса, ВИЧ-1, ВИЧ-2, HTLV-III, вирусы гриппа, вирус японского энцефалита, вирус кори, вирус папиллом, парамиксовирусы, вирус полиомиелита, вирус бешенства, вирус краснухи, вирусы вакцинии (оспа) и вирус желтой лихорадки.
Бактериальные поверхностные антигены или части бактерий, таких как Bordetella pertussis, Helicobacter pylori, Clostridium tetani, Corynebacterium diphtheria, Escherichia coli, Haemophilus influenza, Klebsiella species, Legionella pneumophila, Mycobacterium bovis, Mycobacterium leprae, Mycobacterium tuberculosis, Neisseria gonorrhoeae, Neisseria meningitidis, Proteus species, Pseudomonas aeruginosa, Salmonella species, Shigella species, Staphylococcus aureus, Streptococcus pyogenes, Vibrio cholera и Yersinia pestis.
Поверхностные антигены паразитов, вызывающих заболевание или частей паразитов, таких как Plasmodium vivax (малярия), Plasmodium falciparum (малярия), Plasmodium ovale (малярия), Plasmodium malariae (малярия), Leishmania tropica (лейшманиоз), Leishmania donovani (лейшманиоз), Leishmania branziliensis (лейшманиоз), Trypanosoma rhodescense (африканский трипаносомоз), Trypanosoma gambiense (африканский трипаносомоз), Trypanosoma cruzi (заболевание Шагаса), Schistosoma mansoni (шистосомоз), Schistosomoma haematobium (шистосомоз), Schistosoma japonicum (шистосомоз), Trichinella spiralis (трихинеллез), Stronglyloides duodenale (анкилостомоз), Ancyclostoma duodenale (анкилостомоз), Necator americanus (анкилостомоз), Wucheria bancrofti (филяриоз), Brugia malaya (филяриоз), Loa loa (филяриоз), Dipetalonema perstaris (филяриоз), Dracuncula medinensis (филяриоз) и Onchocerca volvulus (филяриоз).
Иммуноглобулины, такие как IgG, IgA, IgM, антирабический иммуноглобулин и иммуноглобулин против вакцинии.
Антитоксин, такой как ботулиновый антитоксин, дифтерийный антитоксин, газово-гангренозный антитоксин, столбнячный антитоксин.
Антигены, которые вызывают иммунный ответ против заболеваний стоп и полости рта.
Гормоны и факторы роста, такие как фолликулостимулирующий гормон, пролактин, ангиогенин, эпидермальный фактор роста, кальцитонин, эритропоэтин, тиреотропин-высвобождающий гормон, инсулин, гормоны роста, инсулиноподобные факторы роста 1 и 2, фактор роста костной ткани, хорионический гонадотропин человека, лютеинизирующий гормон, фактор роста нервов, адренокортикотропный гормон (ACTH), гормон, высвобождающий лютеинизирующий гормон (LHRH), паратиреоидный гормон (PTH), гормон, высвобождающий тиротропин (TRH), вазопрессин, холецистокинин и гормон, высвобождающий кортикотропин; цитокины, такие как интерфероны, интерлейкины, колониестимулирующие факторы и фактор некроза опухолей: фибринолитические ферменты, такие как урокиназа, активатор плазминогена из почек; и факторы свертывания крови, такие как белок C, фактор VIII, фактор IX, фактор VII и антитромбин III.
Примеры других белков или пептидов представляют собой альбумин, натрийуретический фактор, ренин, супероксиддисмутазу, альфа-1-антитрипсин, белки легочного сурфактанта, бацитрацин, бестатин, цидоспорин, пептид дельта сна (DSIP), эндорфины, глюкагон, грамицидин, факторы, ингибирующие меланоциты, нейротензин, окситоцин, соматостатин, терпротид, тимический сывороточный фактор, тимозин, DDAVP, дерморфин, мет-энкефалин, пептидогликан, сатиетин, тимопентин, продукт разрушения фибрина, дезэнкефалин-альфа-эндорфин, гормон, высвобождающий гонадотропин, лейпролид, альфа-MSH и меткефамид.
Противоопухолевые средства, такие как алтретамин, фторурацил, амсакрин, гидроксикарбамид, аспарагиназа, ифосфамид, блеомицин, ломустин, бусульфан, мелфалан, хлорамбуцил, меркаптопурин, хлорметин, метотрексат, цисплатин, митомицин, циклофосфамид, прокарбазин, цитарабин, тенипозид, дакарбазин, тиотепа, дактиномицин, тиогуанин, даунорубицин, треосульфан, доксорубицин, тиофосфамид, эстрамуцин, винбластин, этоглуцид, винкристин, этопозид, виндезин и паклитаксел.
Противомикробные средства, содержащие:
Антибиотики, такие как ампициллин, нафциллин, амоксициллин, оксациллин, азлоциллин, пенициллин G, карбенициллин, пенициллин V, диклоксациллин, фенетициллин, флоксациллин, пиперациллин, мециллинам, сулбенициллин, метициллин, тикарциллин, мезлоциллин. Цефалоспорины: цефаклор, цефалотин, цефадроксил, цефапирин, цефамандол, цефрадин, цефатризин, цефсулодин, цефазолин, цефтазидим, цефоранид, цефтриаксон, цефокситин, цефуроксим, цефацетрил, латамоксеф и цефалексин. Аминогликозиды, такие как амикацин, неомицин, дибекацин, канамицин, гентамицин, нетилмицин, тобрамицин. Макролиды, такие как амфотерицин B, новобиоцин, бацитрацин, нистатин, клиндамицин, полимиксины, колистин, ровамицин, эритромицин, спектиномицин, линкомицин, ванкомицин. Тетрациклины, такие как хлортетрациклин, окситетрациклин, демеклоциклин, ролитетрациклин, доксициклин, тетрациклин и миноциклин. Другие антибиотики, такие как хлорамфеникол, рифамицин, рифампицин и тиамфеникол.
Химиотерапевтические средства, такие как сулфонамиды сульфадиазин, сульфам