Способ оценки чувствительности клеток рака легкого к доксорубицину на основании уровней экспрессии маркерных генов и набор для его осуществления
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ оценки чувствительности клеток рака легкого к доксорубицину (IC50), а также набор для осуществления данного способа. Способ основан на сравнении уровней экспрессии маркерных генов АВСС1, ERCC1, FTL, GSTP1, МТ2А, RRM1, TUBB3 в исследуемых клетках с уровнями экспрессии указанных генов в контрольных клетках NCI-H322. Способ включает гибридизацию флуоресцентно меченых препаратов нуклеиновых кислот, приготовленных из клеток или тканей человека, с массивом данных олигонуклеотидных зондов, иммобилизованных на твердой подложке. Отмывают подложку от неспецифически связавшихся препаратов. Сканируют подложку лазерным сканером и анализируют полученное изображение. При повышенной экспрессии генов ERCC1, МТ2А, RRM1 и TUBB3 и пониженной экспрессии генов АВСС1, GSTP1, FTL в исследуемых клетках по отношению к клеткам NCI-H322, IC50 доксорубицина для исследуемых клеток оценивают на уровне IC50≥0,54 мкМ, и клетки относят к устойчивым. При пониженной экспрессии генов ERCC1, МТ2А, RRM1 и TUBB3 и повышенной экспрессии генов АВСС1, GSTP1, FTL в исследуемых клетках по отношению к клеткам NCI-H322, IC50 доксорубицина для исследуемых клеток оценивают на уровне IC50≤0,073 мкМ, и клетки относят к чувствительным. Предложенное изобретение позволяет определять чувствительность клеток рака легкого к доксорубицину с высокой точностью. 2 н.п. ф-лы, 1 ил., 1 табл., 2 пр.
Реферат
Область техники
Изобретение относится к области молекулярной медицины, молекулярной биологии и биотехнологии, а именно к определению лекарственной устойчивости клеток и опухолей, к способам обнаружения специфических РНК-мишеней и биологическим микрочипам.
Рак легкого (РЛ) занимает одно из первых мест в мире по заболеваемости и смертности среди всех онкологических заболеваний. В ряде регионов России смертность от РЛ превышает самые высокие мировые показатели, местами достигая 44 случаев у женщин и 81 у мужчин на 100000 населения в год [Мукерия, А.Ф., Заридзе Д.Г., Эпидемиология и профилактика рака легкого. Вестник РОНЦ им. Н.Н. Блохина РАМН, 2010. 21 (3):3-13]. К основным способам лечения рака наряду с хирургическими и лучевыми способами относится химиотерапия. Известно, что клетки опухоли часто проявляют устойчивость к лекарственным препаратам (например, к доксорубицину), что препятствует эффективному лечению. Поэтому актуальной задачей современной экспериментальной онкологии является создание новых молекулярно-биологических тестов, которые позволяли бы изучать отдельные механизмы хеморезистентности опухолевой клетки и на этой основе разрабатывать оптимальные режимы химиотерапии для больных раковыми заболеваниями и, в частности, рака легкого. Существуют данные о корреляции устойчивости рака легкого к доксорубицину с уровнем экспрессии (количеством мРНК) ряда генов [Dan, S., M. Shirakawa, Y. Mukai, et al., Identification of candidate predictive markers of anticancer drug sensitivity using a panel of human cancer cell lines. Cancer Sci, 2003. 94(12):1074-82, Dan, S., T. Tsunoda, O. Kitahara, et al., An integrated database of chemosensitivity to 55 anticancer drugs and gene expression profiles of 39 human cancer cell lines. Cancer Res, 2002. 62 (4): 1139-47, Кашкин, К.Н., Е.А. Мусаткина, А.В. Комельков, et al. Экспрессионное профилирование и предполагаемые механизмы устойчивости к доксорубицину клеток рака легких человека. Доклады Академии Наук, 2010. 430(3):412-415]. Одним из наиболее употребимых способов определения уровней экспрессии генов являются способы, основанные на микрочипах - твердых подложках, на которых в определенном порядке ковалентно иммобилизованы фрагменты ДНК или химически синтезированные олигонуклеотиды. Настоящее изобретение представляет собой способ оценки чувствительности к доксорубицину (IC50, или концентрации 50%-ного ингибирования роста) для клеток рака легкого на основании уровней экспрессии маркерных генов АВСС1, ERCC1, FTL, GSTP1, МТ2А, RRM1, TUBB3, определяемых с помощью гибридизации флуоресцентно-меченных препаратов нуклеиновых кислот, комплементарных поли(A)-содержащей фракции РНК, выделенных из клеток, с иммобилизованными на твердой подложке олигонуклеотидами (олигонуклеотидными зондами), комплементарными мРНК указанных генов, а также набор олигонуклеотидов для осуществления данного способа.
Уровень техники
Известен способ прямого определения чувствительности клеток к цитостатикам способом МТТ [Alley, M.C., D.A. Scudiero, A. Monks, et al., Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Res, 1988. 48(3):589-601], в котором чувствительность клеток определяют по дозе цитостатика, при которой в живых остается 50% клеток в культуре (IC50). Для использования этого способа необходимо специальное оборудование (стерильные боксы, одноразовые стерильные планшеты и матрасы, оборудование для стерилизации многоразовых инструментов, CO2-инкубаторы, микроскопы, культуральные среды и другое) для культивирования эукариотических клеток. Такое оборудование есть не в каждой лаборатории.
Известно, что чувствительность клеток к доксорубицину коррелирует с уровнем экспрессии (количеством мРНК) целого ряда генов. В частности, были показаны корреляции для генов АВСС1, AKR1B1, DDB2, ERCC1, FTL, MLH1 [Dan, S., M. Shirakawa, Y. Mukai, et al., Identification of candidate predictive markers of anticancer drug sensitivity using a panel of human cancer cell lines. Cancer Sci, 2003. 94(12):1074-82, Dan, S., Т. Tsunoda, O. Kitahara, et al., An integrated database of chemosensitivity to 55 anticancer drugs and gene expression profiles of 39 human cancer cell lines. Cancer Res, 2002. 62(4):1139-47] [Gyorffy, В., Р. Surowiak, О. Kiesslich, et al., Gene expression profiling of 30 cancer cell lines predicts resistance towards 11 anticancer drugs at clinically achieved concentrations. Int J Cancer, 2006. 118(7):1699-712]. Однако в литературе не описаны способы расчета показателя IC50 доксорубицина в зависимости от уровня экспрессии генов АВСС1, ERCC1, FTL, GSTP1, МТ2А, RRM1, TUBB3. В настоящее время для определения количества мРНК в клетках используют ПЦР в реальном времени (ПЦР-РВ) и гибридизацию на микрочипах.
Известен способ определения экспрессии генов полимеразной цепной реакцией в реальном времени, сопряженной с обратной транскрипцией (ПЦР-РВ), в котором уровень экспрессии генов определяют по изменению флуоресценции в ходе накопления продукта реакции [Livak, K.J., S.J. Flood, J. Marmaro, et al., Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization. PCR Methods Appl, 1995. 4(6):357-62]. В зависимости от разновидности способа ПЦР-РВ (SYBR Green® I, TaqMan®, молекулярные биконсы, «скорпионные» пробы и др), в нем используется два или более олигонуклеотидов с определенной структурой на каждый ген [Vanguilder, H.D., K.E. Vrana and W.M. Freeman, Twenty-five years of quantitative PCR for gene expression analysis. Biotechniques, 2008. 44(5):619-26]. С помощью ПЦР-РВ показана корреляция чувствительности клеток рака легкого к доксорубицину с уровнями экспрессии отдельных генов [Kawabata, S., M. Oka, H. Soda, et al., Expression and functional analyses of breast cancer resistance protein in lung cancer. Clin Cancer Res, 2003. 9(8):3052-7, Yoshida, M., T. Suzuki, T. Komiya, et al., Induction of MRP5 and SMRP mRNA by adriamycin exposure and its overexpression in human lung cancer cells resistant to adriamycin. Int J Cancer, 2001. 94(3):432-7]. Общим существенным недостатком способов на основе ПЦР-РВ по сравнению с ДНК-микрочипами является ограниченная мультиплексность, то есть количество генов, тестируемых в одной реакции. Кроме того, для определения экспрессии одного гена требуется два или более специфических олигонуклеотида в зависимости от варианта ПЦР-РВ. Новые способы ПЦР-РВ, основанные на молекулярных биконсах и «скорпионных» пробах, требуют значительно более изощренного дизайна олигонуклеотидных проб и менее распространены.
Известен способ прогноза чувствительности клеток к цитостатикам на основе уровней экспрессии различных генов, определяемых с помощью полнотранскриптомных микрочипов [Dan, S., M. Shirakawa, Y. Mukai, et al., Identification of candidate predictive markers of anticancer drug sensitivity using a panel of human cancer cell lines. Cancer Sci, 2003. 94(12):1074-82, Dan, S., Т. Tsunoda, O. Kitahara, et al., An integrated database of chemosensitivity to 55 anticancer drugs and gene expression profiles of 39 human cancer cell lines. Cancer Res, 2002. 62(4):1139-47, Gyorffy, В., Р. Surowiak, О. Kiesslich, et al., Gene expression profiling of 30 cancer cell lines predicts resistance towards 11 anticancer drugs at clinically achieved concentrations. Int J Cancer, 2006. 118(7):1699-712] [Yatomi, M., Y. Takiguchi, Y. Asaka-Amano, et al., Altered gene expression by cisplatin in a human squamous cell lung carcinoma cell line. Anticancer Res, 2007. 27(5A):3235-43, Кашкин, K.H., E.A. Мусаткина, А.В. Комельков, et al., Экспрессионное профилирование и предполагаемые механизмы устойчивости к доксорубицину клеток рака легких человека. Доклады Академии Наук, 2010. 430(3):412-415]. Один экспрессионный микрочип может содержать множество различных зондов, перекрывающих весь транскриптом (совокупность всех РНК) организма. Так, микрочип Human Gene 1.1 ST Array фирмы Affymetrix (Santa Clara, CA) содержит более 750000 различных олигонуклеотидных зондов. Главными недостатками этого способа являются дороговизна, необходимость в высокотехнологичном оборудовании для изготовления и обработки микрочипов, сложность анализа результата и избыточность получаемой информации. Эти недостатки ограничивают практическое применение полнотранскриптомных микрочипов разных производителей, например фирм Affymetrix и Agilent. Фактически число генов, для которых экспериментально подтверждена корреляция экспрессии с лекарственной устойчивостью опухолей, исчисляется десятками. Для анализа такого числа генов используют микрочипы низкой плотности. Их преимущество перед полнотранскриптомными чипами состоит в том, что они могут быть изготовлены и проанализированы в небольшой диагностической лаборатории. Микрочипы низкой плотности позволяют исследовать экспрессию минимального и достаточного набора генов, соответствующего конкретной задаче. Несмотря на то, что корреляция экспрессии некоторых генов с чувствительностью к доксорубицину известна, в литературе не описаны способы расчета показателя IC50 доксорубицина в зависимости от уровня экспрессии генов, определяемого с помощью микрочипов низкой плотности.
Известны узкоспециализированные биочипы низкой плотности на основе гидрогеля, производимые в ИМБ РАН и компанией Биочип-ИМБ (патент 2157385 RU). Эти чипы используются для детекции нескольких клинически важных мутаций и полиморфизмов в геноме различных организмов, включая человека (см. патенты 2458131 RU, 2453606 RU, 2453605 RU), а также для определения ряда антигенов иммунологическими способами [Gryadunov, D., E. Dementieva, V. Mikhailovich, et al., Gel-based microarrays in clinical diagnostics in Russia. Expert Rev Mol Diagn, 2011. 11(8):839-53]. Однако для количественного исследования экспрессии нормальных генов гелевые биочипы не применяют. Принципиальный недостаток гелевых микрочипов состоит в том, что размер гелевых пор накладывает ограничения как на длину иммобилизованных олигонуклеотидных зондов, так и на способ подготовки анализируемого препарата. Все системы анализа нуклеиновых кислот на гелевых чипах требуют предварительной амплификации с помощью ПЦР строго ограниченных участков ДНК или РНК. Этот способ требует синтеза не менее трех олигонуклеотидов на каждый ген или мутацию: праймеров для ПЦР и зондов для гибридизации продукта ПЦР. Введение в систему анализа каждого дополнительного гена требует расчета не менее трех олигонуклеотидов, а в варианте с мультиплексной ПЦР - перерасчета всех олигонуклеотидов, задействованных в анализе. Все это лишает гелевые микрочипы преимуществ перед способами с использованием только ПЦР в различных вариациях. Кроме того, микрочипы, в которых олигонуклеотидные зонды иммобилизованы на поверхности твердой подложки (поверхностные микрочипы), позволяют использовать олигонуклеотидные зонды длиной 50-80 и более нуклеотидов с последовательностью, уникальной для генома человека. Таким образом, для анализа экспрессии любого гена может использоваться всего один олигонуклеотидный зонд.
Наиболее близкими аналогами способа подготовки материала, используемыми в настоящее время, являются два способа. Первый способ применяется в наборе Amino Allyl cDNA Labelling Kit, (Ambion; США, патенты США 5256555, 6586218, 6586219), который основан на способе двойной амплификации [Van Gelder, R.N., M.E. Von Zastrow, A. Yool, et al., Amplified RNA synthesized from limited quantities of heterogeneous cDNA. Proc Nati Acad Sci USA, 1990. 87(5):1663-7]. Этот способ не предусматривает этапа амплификации кДНК: в нем отдельно синтезируют кДНК, затем вторую цепь кДНК, после этого проводят амплификацию РНК с помощью Т7 РНК-полимеразы, получая аРНК. Для одного эксперимента требуется не менее 10 мкг РНК каждой линии клеток или ткани. Для меньших количеств мРНК применяют повторный цикл двойной амплификации с помощью того же набора, что вносит значительные отклонения в репрезентативность исходных молекул мРНК в конечном препарате. Второй способ, применяемый в MiniAmp mRNA amplification kit (Arrayit, США, патент US 8343721 B2), использует SMART-технологию для синтеза кДНК [Chenchik, A., Y.Y. Zhu, L. Diatchenko, et al., Gene Cloning and Analysis by RT-PCR, 1998. 305-319, Zhu, Y.Y., E.M. Machleder, A. Chenchik, et al., Reverse transcriptase template switching: a SMART approach for full-length cDNA library construction. Biotechniques, 2001. 30(4):892-7], промежуточную амплификацию кДНК с помощью ограниченной ПЦР, и синтез с помощью Т7 РНК-полимеразы аРНК, которая потом еще раз переводится в кДНК с введением аминоаллил-дНТФ для последующего мечения. Главный недостаток такого подхода состоит в лишнем этапе ферментативного копирования материала, который нарушает репрезентативность исходных молекул мРНК в конечном препарате.
Настоящее изобретение решает задачу оценки чувствительности (IC50) к доксорубицину (оценки IC50) клеток рака легкого. Изобретение позволяет отнести опухолевые клетки определенной линии к устойчивым (IC50≥0.54 мкМ) или чувствительным (IC50≤0.073 мкМ) к доксорубицину. Изобретение может быть использовано в тех случаях, когда нет возможности определить чувствительность клеток к доксорубицину классическим способом МТТ [Alley, М.С., D.A. Scudiero, A. Monks, et al., Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Res, 1988. 48(3):589-601] - например, в лабораториях, не имеющих оборудования для культивирования животных клеток. Поставленная задача решается за счет определения уровней экспрессии маркерных генов АВСС1, ERCC1, FTL, GSTP1, МТ2А, RRM1, TUBB3 в исследуемых клетках по отношению к уровням экспрессии указанных генов в клетках NCI-H322. Способ включает получение биологического материала, выделение из него суммарной РНК, приготовление флуоресцентно- меченных препаратов нуклеиновых кислот, комплементарных поли(A)-содержащей фракции РНК, выделенных из исследуемого материала и контрольных клеток NCI-H322, гибридизацию смеси полученных препаратов в соотношении 1:1 с набором уникальных олигонуклеотидных зондов, гомологичных мРНК указанных генов, иммобилизованных на твердой подложке, отмывку несвязавшихся препаратов аРНК, сканирование подложки лазерным сканером, обработку полученного изображения и проведение количественного анализа результата. В предлагаемом способе применяют SMART-синтез кДНК и ее ограниченную амплификацию методом ПЦР с использованием недорогого набора для амплификации кДНК фирмы Евроген (Россия) с последующей линейной амплификацией РНК с помощью Т7 РНК-полимеразы. Такой подход, с одной стороны, обеспечивает эффективный синтез полноразмерных кДНК, а с другой позволяет сократить стадии ферментативного копирования исходной мРНК при сохранении репрезентативности транскриптов. Еще одно преимущество данного способа состоит в том, что при необходимости можно неограниченно копировать промежуточный материал (кДНК) с помощью ПЦР. Для постановки экспериментов на микрочипах используется стандартное оборудование, имеющееся в каждой молекулярно-биологической лаборатории. Сами подложки с олигонуклеотидными зондами (микрочипы низкой плотности) могут быть изготовлены и проанализированы либо в той же лаборатории с использованием бюджетных принтеров (Xact XpressLine) и сканеров (DITABIS MaRS), либо на оборудовании для массовой печати микрочипов в специализированных технопарках - например, с использованием станций для печати ArrayIt NanoPrint™ Workstations и сканеров GenePix 4400A Microarray Scanner с автоматическим загрузчиком GenePix SL50.
Таким образом, предлагаемый способ оценки IC50 доксорубицина для клеток рака легкого на основе измерения уровней экспрессии (количества мРНК) маркерных генов объединяет следующие достоинства ПЦР-РВ, поверхностных полнотранскриптомных микрочипов и микрочипов низкой плотности:
1) минимальное количество стартового материала - 1-2 мкг суммарной РНК, выделенной из биологического материала;
2) универсальный способ подготовки из РНК по п.1 меченого препарата для гибридизации из суммарной РНК, основанный на недорогом отечественном наборе для амплификации кДНК фирмы Евроген. Способ подготовки не зависит от набора генов, подлежащих исследованию;
3) возможность неограниченного воспроизводства промежуточного материала по п.2 для анализа путем амплификации кДНК;
4) использование всего одного олигонуклеотида на каждый ген;
5) использование ограниченного набора олигонуклеотидных зондов, иммобилизованных на твердой подложке, достаточного для решения поставленной задачи, при необходимости набор может быть изменен или расширен;
6) относительно невысокая стоимость микрочипов из-за небольшого количества иммобилизованных зондов;
7) возможность печати, обработки и анализа микрочипов как на бюджетном оборудовании в исследовательской лаборатории, так и на оборудовании для массовой печати микрочипов в условиях специализированных технопарков;
8) удешевление анализа при массовом производстве микрочипов.
Сочетание используемых в данном изобретении генов, конкретных последовательностей олигонуклеотидов, способа подготовки материала для гибридизации и экспериментального подхода с использованием микрочипов низкой плотности для определения или оценки чувствительности клеток к доксорубицину в литературе не встречается и в практике не используется.
Технический результат
Техническим результатом изобретения является повышение достоверности оценки чувствительности клеток рака легкого к доксорубицину основе анализа экспрессии генов за счет новой комбинации маркерных генов и дополнительное подтверждение определения IC50 доксорубицина для клеток рака легкого другими методами.
Осуществление изобретения
Олигонуклеотиды (Таблица 1; SEQ NO:1-15) синтезируют с помощью олигонуклеотидного синтезатора Applied Biosystems ABI 3900 или аналогичного. Праймирующий олигонуклеотид (SEQ ID NO:1) служит для синтеза кДНК и представляет собой модифицированный 3′-праймер Mint (Евроген), в котором в положении 5′ дополнительно включен промотор РНК-полимеразы фага Т7, укорочен до 20 остатков 3′-олиго(Т)-участок и отсутствует 3′-концевой вариабельный нуклеотид (VN). Олигонуклеотиды с последовательностями SEQ NO: 2-15 гомологичны мРНК соответствующих генов (указаны названия). Эти олигонуклеотиды иммобилизуют на активированной твердой подложке в определенном порядке посредством концевой реактивной аминогруппы с помощью принтера для микрочипов (Xact Xpress Line, Arrayt Spotbot3 или другого) в соответствии с руководствами изготовителей подложки и принтера. Олигонуклеотид SEQ NO:2, гомологичный мРНК гена GAPDH, используют в качестве положительного контроля и «якоря» для позиционирования изображения. Олигонуклеотид SEQ NO:3 (GAPDH76) имеет 76% гомологии с зондом GAPDH и негомологичен другим генам человека; его используют для корректировки неспецифического сигнала и контроля отмывки. Олигонуклеотиды SEQ NO:11, 9, 10, 12, 13, 14, 15 гомологичны мРНК генов АВСС1, ERCC1, FTL, GSTP1, MT2A, RRM1, TUBB3, соответственно, которые используют в качестве маркерных. Олигонуклеотиды SEQ NO:4, 5, 6, 7, 8 гомологичны мРНК генов ACTB, ESD, PolR2A, YAP I, YWHAZ соответственно, которые используют в качестве контрольных генов для нормирования результатов.
Для осуществления изобретения выделяют суммарную РНК из клеток человека. РНК выделяют с использованием различных способов, например, с помощью хаотропных агентов [Chomczynski, P. and N. Sacchi, Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987. 162(1):156-9], с использованием реагента Trizol (Gibco/Life Technologies, США) либо коммерческих наборов для выделения РНК типа RNAEasy Kit (Quiagen, США) или ExtracrRNA (Евроген, Россия). Необходимое качество препарата РНК оценивают по соотношению фракций рибосомных РНК 28S к 18S близкому к 2, определяемому по электрофорезу суммарной РНК [Sambrook, J. and D.W. Russell, Molecular cloning: a laboratory manual. 3d Ed. 2001], либо по индексу RIN близкому к 10, определяемому приборами, аналогичными биоанализатору Agilent Bioanalyzer 2100. Из суммарной РНК клеток при помощи праймирующего олигонуклеотида, процесса обратной транскрипции и SMART-технологии готовят суммарные препараты комплементарной ДНК (к ДНК). Данную к ДНК амплифицируют с помощью полимеразной цепной реакции. Из препаратов амплифицированной кДНК с помощью Т7 РНК-полимеразы готовят препараты амплифицированной РНК (аРНК) с включением аминоаллил-УТФ. Полученные препараты аРНК метят конъюгацией с сукцинимидными эфирами флуоресцентных красителей, которые различаются спектрами поглощения и эмиссии - например, Су3 контрольную аРНК метят Су3, а исследуемую аРНК метят Су5, либо наоборот. Могут использоваться и другие флуоресцентные красители. Для получения контрольного препарата аРНК используют клетки аденокарциномы легкого NCI-Н322. Меченые двумя разными красителями контрольный и исследуемый препараты смешивают в равных соотношениях и проводят гибридизацию с ДНК-микрочипом, содержащим иммобилизованные олигонуклеотиды SEQ NO 2-15. Несвязавшуюся часть препаратов отмывают солевым раствором. После гибридизации и отмывки подложки сканируют с помощью сканера для микрочипов (Perkin Elmer ScanArray GL Plus, DITABIS MaRS или другого аналогичного) в двух длинах волн, соответствующих максимуму эмиссии использованных флуоресцентных красителей. Полученные изображения совмещают и обрабатывают с помощью программ для обработки изображений (Perkin Elmer ScanArray Express, Imaging Research Array Vision 7.0, Axon GenePix Pro или других). По соотношению сигналов флуоресценции двух красителей для каждого зонда определяют уровни экспрессии генов в исследуемых клетках относительно контрольных. По результатам гибридизации в зависимости от сигналов флуоресценции зондов определяют уровни экспрессии генов АВСС1, ERCC1, FTL, GSTP1, MT2A, RRM1, TUBB3 в исследуемых клетках относительно контрольных клеток NCI-H322. В качестве контрольных генов для нормирования результата используют гены АСТВ, ESD, PolR2A, YAP1, YWHAZ. В качестве положительного контроля используют ген GAPDH. По соотношению уровней экспрессии указанных маркерных генов оценивают чувствительность (IC50) исследуемых клеток к доксорубицину. При повышенной экспрессии генов ERCC1, MT2A, RRM1 и TUBB3 и пониженной экспрессии генов АВСС1, GSTP1, FTL в исследуемых клетках по отношению к экспрессии указанных генов в клетках NCI-H322, IC50 доксорубицина для исследуемых клеток оценивают на уровне IC50≥0.54 мкМ, и клетки относят к устойчивым. При пониженной экспрессии генов ERCC1, MT2A, RRM1 и TUBB3 и повышенной экспрессии генов АВСС1, GSTP1, FTL в исследуемых клетках по отношению к экспрессии указанных генов в клетках NCI-H322, IC50 доксорубицина для исследуемых клеток оценивают на уровне IC50≤0.073 мкМ, и клетки относят к чувствительным. Для зонда GSTP1 данная закономерность соблюдается полностью, а для других зондов - с вероятностью 83.3% (для пяти из шести клеточных линий).
Способ иллюстрируют следующие примеры
Пример 1
а) Синтез олигонуклеотидов проводят с использованием стандартной фосфоамитидной процедуры на автоматическом синтезаторе ABI 3900 (″Applied Biosystems″, США). На 3′-конце олигонуклеотидов SEQ NO:2-15, предназначенных для иммобилизации на твердой подложке, при синтезе вводят спейсер со свободной аминогруппой с помощью 3′-Amino-Link (″Glen Reseach″, США).
б) Для иммобилизации на твердых подложках олигонуклеотидных зондов, синтезированных по п.1а, используют принтер для контактной печати Xact Xpress Lane и подложки VALS-25 с активированной поверхностью (CEL Associates, Inc, США) в условиях, рекомендованных изготовителями подложки и принтера. Зонды наносят в определенном порядке в трех повторах.
в) Клетки рака легкого исследуемых линий (А549, NCI-H23, NCI-H292, NCI-H358, NCI-H1299, NCI-H460 или других) и контрольной линии NCI-H322, выращивают в 25 см2 флаконах в среде DMEM/F12 (1:1), содержащей 10% фетальной коровьей сывороткой с добавлением стрептомицина до концентрации 10 мкг/мл и пенициллина до концентрации 10 ед./мл при температуре 37°C в CO2-инкубаторе при относительной влажности 96%.
г) Суммарную РНК из клеток, выращенных по п.1в, выделяют стандартным способом с использованием гуанидин изотиоцианата и фенола [Chomczynski, P. and N. Sacchi, Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987. 162 (1):156-9], дополнительно очищают с помощью набора RNeasy Mini RNA Kit (Qiagen, Valencia, CA, USA) и обрабатывают ДНКазой I. Качество РНК оценивают с помощью электрофореза в агарозном геле с бромистым этидием [Sambrook, J. and D.W. Russell, Molecular cloning: a laboratory manual. 3d Ed. 2001]. Соотношение фракций 28S:18S рибосомной РНК близкое к 2 свидетельствует о высоком качестве препарата РНК, что является необходимым условием для определения экспрессии генов. Более надежным показателем хорошего качества является индекс RIN (RNA Integrity Number), близкий к 10. Индекс RIN определяют с помощью Agilent 2100 Bioanalyser.
д) Синтез меченых препаратов аРНК проводят следующим способом. кДНК синтезируют из 2 мкг суммарной РНК, полученной по п.1 г, с помощью набора Mint (Евроген, Россия) по рекомендациям изготовителя, используя праймирующий олигонуклеотид SEQ NO:1 и стандартный Plug-олигонуклеотид (Mint) для переключения цепи. Далее проводят 18-21 цикл ПНР с праймером M1 (Mint) для амплификации кДНК в условиях, рекомендованных Евроген для набора Mint. Препарат кДНК очищают на спин-колонках Clean-up (Евроген, Россия) или аналогичных по инструкции изготовителя. 100 нг амплифицированной кДНК используют для синтеза амплифицированной аминоаллил-РНК (аРНК) с помощью РНК-полимеразы бактериофага Т7 (Ambion, Austin, ТХ, США или Fermentas, Литва) в объеме 40 мкл в присутствии АТФ, ГТФ, ЦТФ (7.5 мМ), УТФ и аминоаллил-УТФ (Fermentas, Литва; 3.75 мМ). Реакцию проводят при 37°C в течение 4-8 часов, после чего останавливают разбавлением безнуклеазной водой до 100 мкл. Продукт синтеза (аРНК) очищают на спин-колонках RNAEasy Kit (Quiagen, США) или аналогичных по инструкции изготовителя. Полученную аРНК метят реакцией с сукцинимидными эфирами флуоресцентных красителей красителями Су3 или Су5. Для этого используют Amino Allyl MessageAmp II aRNA Amplification kit (Ambion, США, #1797), либо Cy-Dye Post-Labelling Reactive Dye Pack (Amersham/GE Healthcare, США, #RPN 5661) или аналогичные препараты других производителей. Один флакон красителя в расчете на 1 реакцию разводят в 11 мкл ДМСО. 10-20 мкг аРНК лиофилизируют и растворяют в 9 мкл буфера для конъюгации (Coupling buffer, Ambion, США), после чего смешивают с раствором красителя в ДМСО и осторожно перемешивают. Смесь инкубируют 30 минут в темноте, затем добавляют 4.5 мкл 4М гидроксиламина, перемешивают и инкубируют еще 15 минут в темноте. Объем реакции доводят до 30 мкл. Меченую аРНК очищают на спин-колонках для очистки от красителя Ambion из набора #1797, или с помощью RNAEasy Kit (Quiagen, США), либо аналогичных по инструкции изготовителя.
е) В качестве контрольного препарата используют аРНК из клеток NCI-Н322. Исследуемый и контрольный препараты аРНК, меченые флуоресцентными красителями Су3 и Су5 соответственно (либо наоборот), полученные по п.1д, смешивают в соотношении 1:1, фрагментируют с помощью буфера для фрагментации (АМ8740, Ambion) по рекомендациям изготовителя, добавляют буфер для гибридизации (RPK0325, GE Healthcare) и наносят на ДНК-микрочипы, полученные по п.1б, для гибридизации. Микрочипы инкубируют в течение ночи при 37°C, после чего отмывают цитратным буфером. Отмывку проводят в следующем режиме: 2×SSC, 2×15 мин при 20°, 1×SSC, 15 мин при 50°, 0.1×SSC, 5 мин при 20° с добавлением 0.1% Tween 20. Затем микрочипы ополаскивают 0.1×SSC без Tween 20 и высушивают в беспылевых условиях.
ж) Микрочипы, отмытые по п.1е, сканируют с помощью сканера ScanArray GL Plus (Perkin Elmer, США). Изображения анализируют с помощью программы ArrayVision 7.0 (Imaging Research, США). Коррекцию фона проводят по свободной от олигонуклеотидов области чипа и флуоресценции некомплементарного зонда SEQ NO:3, который служит для контроля качества отмывки по п.«1е». Результаты нормируют по сигналам контрольных зондов (SEQ NO:4-8). При анализе изображения с помощью программы ArrayVision 7.0 определяют показатели cnLogARMDens для каждого зонда по двум красителям. Дифференциальную экспрессию фиксируют в случаях не менее чем двукратного различия отношения нормализованных сигналов Су3/Су5 (Ratio (cnLogARMDens): Ctrl:Data>0.3 или Ratio (cnLogARMDens): Ctrl:Data<-0.3) при соотношении сигнал/шум S/N≥3.
з) На основании сигналов флуоресценции, определенных по п.1ж, оценивают уровень экспрессии маркерных генов и чувствительность клеток к доксорубицину (IC50). При повышенной экспрессии генов ERCC1, МТ2А, RRM1 и TUBB3 и пониженной экспрессии генов АВСС1, GSTP1, FTL в исследуемых клетках по отношению к клеткам NCI-H322, IC50 доксорубицина для исследуемых клеток оценивают на уровне IC50≥0.54 мкМ, и клетки относят к устойчивым. При пониженной экспрессии генов ERCC1, МТ2А, RRM1 и TUBB3 и повышенной экспрессии генов АВСС1, GSTP1, FTL в исследуемых клетках по отношению к клеткам NCI-H322, IC50 доксорубицина для исследуемых клеток оценивают на уровне IC50≤0.073 мкМ, и клетки относят к чувствительным.
Пример 2
Оценка чувствительности клеток линии NCI-H460 к доксорубицину при использовании в качестве контрольной линии клеток NCI-Н322.
При гибридизации смеси аРНК из клеток NCI-H460, меченой Су3, и аРНК из клеток NCI-H322, меченой Су5, получены следующие показатели «Ratio (cnLogARMDens): Ctrl:Data»:
| Зонд | Ratio (cnLogARMDens): Ctrl: Data Су3/Су5 |
| МТ2А | -1,22 |
| TUBB3 | -0,57 |
| ERCC1 | -0,58 |
| RRM1 | -0,34 |
| GSTP1 | 1,50 |
| FTL | 0,58 |
| АВСС1 | 0,57 |
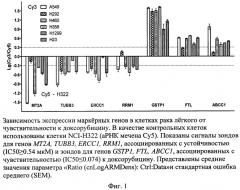
Из результатов следует, что экспрессия генов МТ2А, TUBB3, ERCC1, RRM1 в клетках NCI-H460 ниже, а генов АВСС1, GSTP1 и FTL выше, чем в клетках NCI-H322. Следовательно, IC50 доксорубицина клеток NCI-H460 менее 0.074 мкМ, и клетки относят к чувствительным к данному препарату. Этот результат подтверждается тем, что величина IC50 доксорубицина для клеток NCI-H460, определенная методом МТТ, составила 0.054 мкМ [Кашкин, К.Н., Е.А. Мусаткина, А.В. Комельков, et al., Экспрессионное профилирование и предполагаемые механизмы устойчивости к доксорубицину клеток рака легких человека. Доклады Академии Наук, 2010. 430 (3):412-415]. Аналогично могут быть оценены IC50 для других клеток (Фиг.1).
Изобретение иллюстрирует Фиг.1, которые демонстрирует зависимость экспрессии маркерных генов в клетках рака легкого от чувствительности к доксорубицину. В качестве контрольной использована аРНК из устойчивых к доксорубицину клеток NCI-H322, меченая красителем Су5; аРНК остальных (исследуемых) линий помечены Су3. Показаны сигналы олигонуклеотидных зондов, ассоциированные с устойчивостью (МТ2А, TUBB3, ERCC1, RRM1) и чувствительностью (GSTP1, FTL, АВСС1) к доксорубицину. Представлены средние значения и стандартная ошибка среднего (SEM). По оси ординат отложен параметр Ratio (cnLogARMDens): Ctrl: Data.
Промышленная применимость
Предлагаемый способ позволяет оценивать чувствительность клеток к доксорубицину в тех случаях, когда прямые методы определения чувствительности неприменимы. Метод может быть использован как альтернатива или дополнение к существующим методам.
1. Способ оценки чувствительности клеток рака легкого к доксорубицину (IC50) на основании сравнения уровней экспрессии маркерных генов АВСС1, ERCC1, FTL, GSTP1, МТ2А, RRM1, TUBB3 в исследуемых клетках с уровнями экспрессии указанных генов в контрольных клетках NCI-H322, включающий выделение из исследуемых и контрольных клеток суммарной РНК, приготовление из суммарной РНК флуоресцентно-меченных препаратов нуклеиновых кислот, комплементарных поли(A)-содержащей фракции РНК, выделенных из клеток, с помощью праймирующего олигонуклеотида SEQ ID NO:1, гибридизации указанных препаратов с олигонуклеотидами SEQ ID NO:2-15, иммобилизованными на твердой подложке, где олигонуклеотид SEQ ID NO:2, гомологичный мРНК гена GAPDH, используется как положительный контроль, олигонуклеотид SEQ ID NO:3 используется для контроля отмывки подложки, олигонуклеотиды SEQ ID NO: 4, 5, 6, 7, 8, гомологичные мРНК генов АСТВ, ESD, PolR2A, YAP1, YWHAZ соответственно, используются для нормирования результата гибридизации, и олигонуклеотиды SEQ ID NO: 11, 9, 10, 12, 13, 14, 15, гомологичные мРНК генов АВСС1, ERCC1, FTL, GSTP1, МТ2А, RRM1, TUBB3 соответственно, используются для анализа уровней экспрессии указанных генов, в результате чего при повышенной экспрессии генов ERCC1, МТ2А, RRM1 и TUBB3 и пониженной экспрессии генов АВСС1, GSTP1, FTL в исследуемых клетках по отношению к клеткам NCI-H322, IC50 доксорубицина для исследуемых клеток оценивают на уровне IC50≥0,54 мкМ, и клетки относят к устойчивым, а при пониженной экспрессии генов ERCC1, МТ2А, RRM1 и TUBB3 и повышенной экспрессии генов АВСС1, GSTP1, FTL в исследуемых клетках по отношению к клеткам NCI-H322, IC50 доксорубицина для исследуемых клеток оценивают на уровне IC50≤0,073 мкМ, и клетки относят к чувствительным.
2. Набор олигонуклеотидов SEQ ID NO:1-15 для осуществления способа по п.1.