Полинуклеотид, кодирующий гомолог ацил-соа-синтетазы, и его применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к белку, имеющему ацил-CoA-синтетазную активность, полученному из микроорганизма рода Mortierella и полинуклеотиду, кодирующему этот белок. Изобретение также относится к экспрессирующему вектору и трансформанту, не являющемся человеком, содержащим заявленные полинуклеотиды, а также к способу получения композиции липидов или жирных кислот с использованием этого трансформанта. Изобретение позволяет за счет использования нового гена увеличивать количество липидов или жирных кислот, а также изменять состав продуцируемых жирных кислот. 5 н. и 5 з.п. ф-лы, 28 ил., 14 табл., 2 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к полинуклеотиду, кодирующему гомолог ацил-СоА-синтетазы, и его применению.
УРОВЕНЬ ТЕХНИКИ
Жирные кислоты, содержащие две или более ненасыщенные связи, вместе называют полиненасыщенными жирными кислотами (PUFA), и известно, что они в частности включают в себя арахидоновую кислоту (ARA), дигомо-γ-линоленовую кислоту (DGLA), эйкозапентаеновую кислоту (EPA), докозагексаеновую кислоту (DHA) и т.д. Некоторые из этих полиненасыщенных жирных кислот не могут быть синтезированы в организме животного. Таким образом, необходимо компенсировать эти полиненасыщенные жирные кислоты в виде незаменимых аминокислот из пищи.
Полиненасыщенные жирные кислоты широко распространены; например, арахидоновая кислота может быть выделена из липидов, экстрагированных из надпочечников и печени животных. Однако полиненасыщенные жирные кислоты, содержащиеся в органах животных, составляют лишь малое количество и не могут быть получены в достаточном количестве для больших подач при простом экстрагировании или выделении из органов животных. По этой причине были разработаны микробиологические способы для получения полиненасыщенных жирных кислот культивированием различных микроорганизмов. Кроме того, известно, что микроорганизмы рода Mortierella продуцируют липиды, содержащие полиненасыщенные жирные кислоты, такие как арахидоновая кислота и т.п.
Были предприняты другие попытки получения полиненасыщенных жирных кислот в растениях. Полиненасыщенные жирные кислоты входят в состав запасных липидов, таких как триацилглицериды, и известно, что они накапливаются в мицелии микроорганизмов или семенах растений.
Ацил-СоА-синтетаза (ACS) является ферментом, катализирующим тиоэстерификацию жирных кислот, и кофермент А (CoA) катализирует следующую реакцию.
Жирная кислота+CoASH+АТФ→Ацил-CoA+АМФ+PPi
Ацил-СоА, продуцируемый ACS, участвует в различных явлениях живой природы, включающих в себя биосинтез и ремоделирование липидов, продуцирование энергии β-окислением, ацилирование белков, регуляцию экспрессии жирными кислотами и т.д. Кроме того, сообщалось, что ACS ассоциирована с внеклеточным поглощением жирных кислот, внутриклеточным транспортом жирных кислот и т.д. (Непатентные Документы 1 и 2). В связи с этим считается, что он регулирует активность ACS при продуцировании полиненасыщенных жирных кислот или т.п. утилизацией микроорганизмами или растениями.
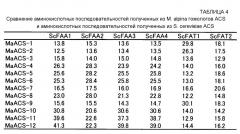
В дрожжах Saccharomyces cerevisiae, используемых в качестве эукариота-модели, известны шесть (6) генов ацил-CoA-синтетазы (ScFAA1, ScFAA2, ScFAA3, ScFAA4, ScFAT1 и ScFAT2) (Непатентный Документ 1). Белки, кодируемые этими генами, являются разными по субстратной специфичности, таймингу экспрессии, внутриклеточной локализации и функции.
Патентный Документ 1 описывает девять (9) генов ацил-CoA-синтетазы (ScACS), полученных из Schizochytrium sp. Патентный Документ 1 описывает также увеличенное продуцирование DPA (n-6) (докозапентановой кислоты (n-6)) или DHA при коэкспрессии гена, кодирующего систему PUFA-синтаз Schizochytrium sp., с ScACS, в сравнении со случаем, когда не участвует коэкспрессия с ScACS.
Кроме того, сообщалось также о генах ацил-CoA-синтетаз, полученных из животных и растений (Непатентный Документ 2 и Патентный документ 2).
[Патентный Документ 1] Japanese Unexamined Patent Application Publication (Translation of PCT Application) No. 2009-529890
[Патентный Документ 2] PCT International Publication Pamphlet WO 0209295
[Непатентный Документ 1] B. B. A. 1771, 286-298, 2007
[Непатентный Документ 2] Exp. Biol. Med., 233 (5), 507-521, 2008
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При описанных выше обстоятельствах было желательным выделение нового гена, который увеличивает количество жирных кислот, продуцируемых в клетке-хозяине, или изменяет состав продуцируемых жирных кислот, при экспрессии этого гена в этой клетке-хозяине.
В результате обширных исследований авторам данного изобретения удалось клонировать ген, кодирующий гомолог ACS липидпродуцирующего гриба Mortierella alpina (далее "M. alpina") (MaACS), и осуществить данное изобретение. То есть, данное изобретение обеспечивает следующие полинуклеотиды, белки, экспрессирующие векторы, трансформанты и способ получения липидов или липидных композиций и пищевых продуктов, и т.д. с использованием этих трансформантов, а также пищевые продукты, получаемые при помощи этого способа, и т.д.
Таким образом, данное изобретение характеризуется следующим образом.
[1] Полинуклеотид по любому из пунктов, выбранных из группы, состоящей из (a)-(e), ниже:
(a) полинуклеотид, содержащий любую нуклеотидную последовательность, выбранную из группы, состоящей из нуклеотидных последовательностей, представленных в SEQ ID NO: 1, 6, 11, 16, 21, 26, 31, 36, 41, 46, 51 и 56;
(b) полинуклеотид, кодирующий белок, состоящий из любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 2, 7, 12, 17, 22, 27, 32, 37, 42, 47, 52 и 57;
(c) полинуклеотид, кодирующий белок, состоящий из аминокислотной последовательности, где 1-100 аминокислот делетированы, заменены, инсертированы и/или добавлены в любую аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 2, 7, 12, 17, 22, 27, 32, 37, 42, 47, 52 и 57, и имеющий ацил-CoA-синтетазную активность или активность увеличения количества или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине;
(d) полинуклеотид, кодирующий белок, имеющий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 2, 7, 12, 17, 22, 27, 32, 37, 42, 47, 52 и 57, и имеющий ацил-CoA-синтетазную активность или активность увеличения количества или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине; и
(e) полинуклеотид, который гибридизуется с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной любой нуклеотидной последовательности, выбранной из группы, состоящей из нуклеотидных последовательностей, представленных в SEQ ID NO: 1, 6, 11, 16, 21, 26, 31, 36, 41, 46, 51 и 56, при строгих условиях, и который кодирует белок, имеющий ацил-CoA-синтетазную активность или активность увеличения количества или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине.
[2] Полинуклеотид по п. 1, который представляет собой полинуклеотид, определенный либо в (f), либо в (g) ниже:
(f) полинуклеотид, кодирующий белок, состоящий из аминокислотной последовательности, где 1-10 аминокислот делетированы, заменены, инсертированы и/или добавлены в любую из аминокислотных последовательностей, выбранных из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 2, 7, 12, 17, 22, 27, 32, 37, 42, 47, 52 и 57, и имеющий ацил-CoA-синтетазную активность или активность увеличения количества или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине; и
(g) полинуклеотид, кодирующий белок, имеющий аминокислотную последовательность, имеющую по меньшей мере 90% идентичность любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 2, 7, 12, 17, 22, 27, 32, 37, 42, 47, 52 и 57, и ацил-CoA-синтетазную активность или активность увеличения количества или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине.
[3] Полинуклеотид по [1] выше, содержащий любую нуклеотидную последовательность, выбранную из группы, состоящей из нуклеотидных последовательностей, представленных в SEQ ID NO: 1, 6, 11, 16, 21, 26, 31, 36, 41, 46, 51 и 56.
[4] Полинуклеотид по [1] выше, кодирующий белок, состоящий из любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей, представленных в SEQ ID NO: 2, 7, 12, 17, 22, 27, 32, 37, 42, 47, 52 и 57.
[5] Полинуклеотид по любому из [1]-[4] выше, который представляет собой ДНК.
[6] Белок, кодируемый полинуклеотидом по любому из [1]-[5] выше.
[7] Вектор, содержащий полинуклеотид по любому из [1]-[5] выше.
[8] Трансформант, не являющийся человеком, в который введен полинуклеотид по любому из [1]-[5] выше, или вектор по [7] выше.
[9] Способ получения композиции липидов или жирных кислот, который предусматривает сбор композиции липидов или жирных кислот из культуры трансформанта по [8] выше.
[10] Способ по [9] выше, где этим липидом является триацилглицерин.
[11] Способ по [9] выше, где этой жирной кислотой является полиненасыщенная жирная кислота, имеющая по меньшей мере 18 атомов углерода.
[12] Пищевой продукт, фармацевтический препарат, косметический препарат или мыло, содержащие композицию липидов или жирных кислот, полученную способом получения по [9] выше.
Полинуклеотид по данному изобретению может быть использован для трансформации подходящей клетки-хозяина. Полученный таким образом трансформант может быть использован для получения композиций жирных кислот, пищевых продуктов, косметических препаратов, фармацевтических препаратов, мыла и т.д.
Более конкретно, трансформант по этому изобретению обеспечивает чрезвычайно высокую эффективность продуцирования липидов и жирных кислот. Таким образом, данное изобретение может быть эффективно использовано для приготовления фармацевтических препаратов или диетических пищевых продуктов, которые требуют большого количества липидов или жирных кислот.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-1.
Фиг. 2A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-1.
Фиг. 2В является продолжением Фиг. 2А.
Фиг. 3A показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-2.
Фиг. 3В является продолжением Фиг. 3А.
Фиг. 4А показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-2.
Фиг. 4В является продолжением Фиг. 4А.
Фиг. 4С является продолжением Фиг. 4В.
Фиг. 5 показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-3.
Фиг. 6А показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-3.
Фиг. 6B является продолжением Фиг. 6A.
Фиг. 7A показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-4.
Фиг. 7B является продолжением Фиг. 7A.
Фиг. 8A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-4.
Фиг. 8B является продолжением Фиг. 8A.
Фиг. 8C является продолжением Фиг. 8B.
Фиг. 9А показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательность MaACS-5.
Фиг. 9B является продолжением Фиг. 9A.
Фиг. 10A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-5.
Фиг. 10B является продолжением Фиг. 10A.
Фиг. 11A показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-6.
Фиг. 11B является продолжением Фиг. 11A.
Фиг. 12A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-6.
Фиг. 12B является продолжением Фиг. 12A.
Фиг. 13 показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-7.
Фиг. 14A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-7.
Фиг. 14B является продолжением Фиг. 14A.
Фиг. 15A показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-8.
Фиг. 15B является продолжением Фиг 15A.
Фиг. 16A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-8.
Фиг. 16B является продолжением Фиг. 16A.
Фиг. 16C является продолжением Фиг. 16B.
Фиг. 17 показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-9.
Фиг. 18A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-9.
Фиг. 18B является продолжением Фиг. 18A.
Фиг. 19A показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-10.
Фиг. 19B является продолжением Фиг. 19A.
Фиг. 20A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-10.
Фиг. 20B является продолжением Фиг. 20A.
Фиг. 20C является продолжением Фиг. 20B.
Фиг. 21A показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-11.
Фиг. 21B является продолжением Фиг. 21A.
Фиг. 22A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-11.
Фиг. 22B является продолжением Фиг. 22A.
Фиг. 23A показывает соответствие между кДНК-последовательностью и предположительной аминокислотной последовательностью MaACS-12.
Фиг. 23B является продолжением Фиг. 23A.
Фиг. 24A показывает сопоставление между геномной последовательностью и последовательностью CDS MaACS-12.
Фиг. 24B является продолжением Фиг. 24A.
Фиг. 25A показывает сопоставление между MaACS, имеющими относительно высокую гомологию аминокислотной последовательности с полученным из S. cerevisiae FAA-белком (FAA: активация жирных кислот), и этим FAA-белком. Подчеркнутые одной линией и подчеркнутые двойной линией последовательности обозначают мотив АТФ-АМФ и мотив FACS/VLACS-FATP, соответственно.
Фиг. 25В является продолжением Фиг. 25A.
Фиг. 25C является продолжением Фиг. 25B.
Фиг. 26A показывает сопоставление между MaACS, имеющими относительно высокую гомологию последовательности с полученным из S. cerevisiae FAT-белком (FAT: трансфераза жирных кислот), и этим FAT-белком. Подчеркнутые одной линией и подчеркнутые двойной линией последовательности обозначают мотив АТФ-АМФ и мотив FACS/VLACS-FATP, соответственно.
Фиг. 26B является продолжением Фиг. 26A.
Фиг. 27 показывает изменения на протяжении времени в продуцировании липидов (Фиг. 27A) и продуцировании арахидоновой кислоты (Фиг. 27B) в расчете на мицелий в сверхэкспрессирующем MaACS-10 M. alpina.
Фиг. 28 показывает изменения на протяжении времени в продуцировании липидов (Фиг. 28A) и продуцировании арахидоновой кислоты (Фиг. 28B) в расчете на мицелий в сверхэкспрессирующем MaACS-11 M. alpina.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение подробно описывается далее. Предполагается, что описанные ниже варианты осуществления предназначены только для описания изобретения, но не для ограничения изобретения только следующими вариантами осуществления. Данное изобретение может осуществляться различными путями без отклонения от сущности этого изобретения.
Все публикации, опубликованные заявки на патент, патенты и другие патентные документы, цитируемые в этой заявке, включены здесь посредством ссылки в их полном объеме. Таким образом, эта заявка включает в себя ссылку на содержания описания и фигур в Японской заявке на патент (№ 2010-19967), поданной 1 февраля 2010 года, приоритет которой был заявлен.
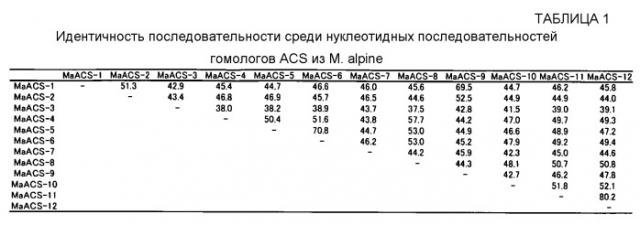
Как будет описано позднее подробно в ПРИМЕРАХ, приведенных ниже, авторам данного изобретения впервые удалось клонирование полноразмерной кДНК генов гомолога ACS продуцирующего липиды гриба M. alpina (MaACS-1~12). Авторы данного изобретения идентифицировали также нуклеотидные последовательности геномных ДНК MaACS-1~12 из M. alpina и их предположительные аминокислотные последовательности. ORF-последовательности, предположительные аминокислотные последовательности, CDS-последовательности, кДНК-последовательности и геномные последовательности MaACS-1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 и 12, представлены как последовательности SEQ ID NO: 1, 6, 11, 16, 21, 26, 31, 36, 41, 46, 51 и 56 (далее эти последовательности вместе называются "ORF-последовательностями MaACS-1~12"), SEQ ID NO: 2, 7, 12, 17, 22, 27, 32, 37, 42, 47, 52 и 57 (далее эти последовательности вместе называются "аминокислотными последовательностями MaACS-1~12"), SEQ ID NO: 3, 8, 13, 18, 23, 28, 33, 38, 43, 48, 53 и 58 (далее эти последовательности вместе называются "CDS-последовательностями MaACS-1~12"), SEQ ID NO: 4, 9, 14, 19, 24, 29, 34, 39, 44, 49, 54 и 59 (далее эти последовательности называются "кДНК-последовательностями MaACS-1~12") и SEQ ID NO: 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 и 60 (далее эти последовательности вместе называются "геномными последовательностиями MaACS-1~12"), соответственно. Эти полинуклеотиды и белки могут быть получены способами, описанными в ПРИМЕРАХ ниже, известными способами генной инженерии, известными способами синтеза и т.д.
1. Полинуклеотид по данному изобретению
Сначала данное изобретение обеспечивает полинуклеотид, описанный в любом полинуклеотиде, выбранном из группы, состоящей из (a)-(g), ниже:
(a) полинуклеотид, содержащий нуклеотидную последовательность, выбранную из группы, состоящей из ORF-последовательностей MaACS-1~12;
(b) полинуклеотид, содержащий любую нуклеотидную последовательность, выбранную из группы, состоящей из кДНК-последовательностей MaACS-1~12;
(c) полинуклеотид, кодирующий белок, состоящий из любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей MaACS-1~12;
(d) полинуклеотид, кодирующий белок, состоящий из аминокислотной последовательности, где 1-100 аминокислот делетированы, заменены, инсертированы и/или добавлены в любую аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей MaACS-1~12, и имеющий ацил-CoA-синтетазную активность или активность увеличения количества и/или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине;
(e) полинуклеотид, кодирующий белок, имеющий аминокислотную последовательность, имеющую по меньшей мере 60% идентичность любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей MaACS-1~12, и имеющий ацил-CoA-синтетазную активность или активность увеличения количества и/или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине; и
(f) полинуклеотид, который гибридизуется с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной любой нуклеотидной последовательности, выбранной из группы, состоящей из ORF-последовательностей MaACS-1~12, при строгих условиях, и который кодирует белок, имеющий ацил-CoA-синтетазную активность или активность увеличения количества и/или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине; и
(g) полинуклеотид, который гибридизуется с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной любой нуклеотидной последовательности, выбранной из группы, состоящей из кДНК-последовательностей MaACS-1~12, при строгих условиях, и который кодирует белок, имеющий ацил-CoA-синтетазную активность или активность увеличения количества и/или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине.
В данном контексте термин “полинуклеотид" обозначает ДНК или РНК.
В данном контексте термин "полинуклеотид, который гибридизуется при строгих условиях", относится к полинуклеотиду, полученному при помощи способа гибридизации колоний, способа гибридизации бляшек, способа гибридизации по Саузерну или т.п., с использованием в качестве зонда, например полинуклеотида, состоящего из нуклеотидной последовательности, комплементарной любой нуклеотидной последовательности, выбранной из группы, состоящей из ORF-последовательностей MaACS-1~12, или любой нуклеотидной последовательности, выбранной из группы, состоящей из кДНК-последовательностей MaACS-1~12, или целого или части полинуклеотида, состоящего из нуклеотидной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей MaACS-1~12. Для способов гибридизации используются способы, описанные, например, в "Sambrook & Russell, Molecular Cloning: A Laboratory Manual Vol. 3, Cold Spring Harbor, Laboratory Press 2001", "Ausubel, Current Protocols in Molecular Biology, John Wiley & Sons 1987-1997", и т.д.
В данном контексте термин "условия строгости" может обозначать любое из условий низкой строгости, условий средней строгости и условий высокой строгости. Термин “условия низкой строгости” обозначает, например, 5x SSC, 5x раствор Денхардта, 0,5% SDS, 50% формамид при 32°C. Термин "условия средней строгости" обозначает, например, 5x SSC, 5x раствор Денхардта, 0,5% SDS, 50% формамид при 42°C или 5x SSC, 1% SDS, 50 мМ Трис-HCl (pH 7,5), 50% формамид при 42°C. Термин "условия высокой строгости" обозначает, например, 5x SSC, 5x раствор Денхардта, 0,5% SDS, 50% формамид при 50°C или 0,2×SSC, 0,1% SDS при 65°C. При этих условиях ожидается, что ДНК с более высокой идентичностью получают эффективно при более высоких температурах, хотя в строгости гибридизации участвуют многие факторы, включающие в себя температуру, концентрацию зонда, длину зонда, ионную силу, время, концентрацию соли и другие, и специалист с квалификацией в этой области может удобным образом выбирать эти факторы для достижения подобной строгости.
При использовании коммерчески доступных наборов для гибридизации, может быть использована, например, система прямого мечения и детектирования Alkphos (GE Healthcare). В этом случае, согласно прилагаемому протоколу, после культивирования с меченым зондом в течение ночи, мембрану промывают первичным промывочным буфером, содержащим 0,1% (масс./об.) SDS (ДСН), при 55°C для детектирования гибридизованной ДНК. Альтернативно, в получении зонда на основе нуклеотидной последовательности, комплементарной любой нуклеотидной последовательности, выбранной из группы, состоящей из ORF-последовательностей MaACS-1~12, или любой нуклеотидной последовательности, выбранной из группы, состоящей из кДНК-последовательностей MaACS-1~12, или на основе всей или части нуклеотидной последовательности, кодирующей любую аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей MaACS-1~12, гибридизация может быть детектирована с набором детектирования нуклеиновых кислот DIG (Roche Diagnostics) при мечении этого зонда дигоксигенином (DIG) с использованием коммерчески доступного реагента (например, смеси для ПЦР-мечения (Roche Diagnostics) и т.д.).
Кроме полинуклеотидов, описанных выше, другие полинуклеотиды, которые могут быть гибридизованы, включают в себя ДНК, имеющую 50% или более высокую, 51% или более высокую, 52% или более высокую, 53% или более высокую, 54% или более высокую, 55% или более высокую, 56% или более высокую, 57% или более высокую, 58% или более высокую, 59% или более высокую, 60% или более высокую, 61% или более высокую, 62% или более высокую, 63% или более высокую, 64% или более высокую, 65% или более высокую, 66% или более высокую, 67% или более высокую, 68% или более высокую, 69% или более высокую, 70% или более высокую, 71% или более высокую, 72% или более высокую, 73% или более высокую, 74% или более высокую, 75% или более высокую, 76% или более высокую, 77% или более высокую, 78% или более высокую, 79% или более высокую, 80% или более высокую, 81% или более высокую, 82% или более высокую, 83% или более высокую, 84% или более высокую, 85% или более высокую, 86% или более высокую, 87% или более высокую, 88% или более высокую, 89% или более высокую, 90% или более высокую, 91% или более высокую, 92% или более высокую, 93% или более высокую, 94% или более высокую, 95% или более высокую, 96% или более высокую, 97% или более высокую, 98% или более высокую, 99% или более высокую, 99,1% или более высокую, 99,2% или более высокую, 99,3% или более высокую, 99,4% или более высокую, 99,5% или более высокую, 99,6% или более высокую, 99,7% или более высокую, 99,8% или более высокую или 99,9% или более высокую идентичность с ДНК для любой нуклеотидной последовательности, выбранной из группы, состоящей из ORF-последовательностей MaACS-1~12, или для любой нуклеотидной последовательности, выбранной из группы, состоящей из кДНК-последовательностей MaACS-1~12, или с ДНК, кодирующей любую аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей MaACS-1~12, как рассчитано программой поиска гомологии, такой как FASTA, BLAST и т.д., с использованием параметров по умолчанию.
Идентичность между аминокислотными последовательностями или нуклеотидными последовательностями может быть определена с использованием FASTA (Science 227 (4693): 1435-1441, (1985)), алгоритма BLAST (Basic Local Alignment Search Tool) согласно Karlin and Altschul (Proc. Natl. Acad. Sci. USA, 87: 2264-2268, 1990; Proc. Natl. Acad. Sci. USA, 90: 5873, 1993). Были разработаны программы, названные blastn, blastx, blastp, tblastn и tblastx, на основе алгоритма BLAST (Altschul S. F. et al., J. Mol. Biol. 215: 403, 1990). При секвенировании нуклеотидной последовательности с использованием blastn, параметрами являются, например, оценка (счет)=100 и длина слова=12. При секвенировании нуклеотидной последовательности с использованием blastp, параметрами являются, например, оценка (счет)=50 и длина слова=3. При использовании программ BLAST и Gapped BLAST, для каждой из этих программ используются параметры по умолчанию.
Полинуклеотиды по данному изобретению, описанные выше, могут быть получены известными способами генетической инженерии или известными способами синтеза.
2. Белок по данному изобретению
Данное изобретение обеспечивает белки, показанные ниже.
(i) Белок, кодируемый полинуклеотидом любого из (a)-(g) выше.
(ii) Белок, содержащий любую аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей MaACS-1~12.
(iii) Белок, состоящий из аминокислотной последовательности, в которой одна или несколько аминокислот делетированы, заменены, инсертированы и/или добавлены в любую аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей MaACS-1~12, и имеющий ацил-CoA-синтетазную активность или активность увеличения количества и/или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине.
(iv) Белок, имеющий аминокислотную последовательность, имеющую по меньшей мере 90% идентичность любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей MaACS-1~12, и имеющий ацил-CoA-синтетазную активность или активность увеличения количества и/или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине.
Белки, описанные в (iii) или (iv) выше, являются обычно природно-встречающимися мутантами белка, состоящего из любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей MaACS-1~12, и включают в себя белки, которые могут быть искусственно получены с использованием сайт-направленного мутагенеза, описанного, например, в "Sambrook & Russell, Molecular Cloning: A Laboratory Manual Vol. 3, Cold Spring Harbor Laboratory Press 2001", "Ausubel, Current Protocols in Molecular Biology, John Wiley & Sons 1987-1997", "Nuc. Acids. Res., 10, 6487 (1982)", "Proc. Natl. Acad. Sci. USA, 79, 6409 (1982)", "Gene, 34, 315 (1985)", "Nuc. Acids. Res., 13, 4431 (1985)", "Proc. Natl. Acad. Sci. USA, 82, 488 (1985)", и т.д.
В данном контексте "белок, состоящий из аминокислотной последовательности, в которой одна или несколько аминокислот делетированы, заменены, инсертированы и/или добавлены в любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей MaACS-1~12, и имеющий ацил-CoA-синтетазную активность или активность увеличения количества и/или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине" включает в себя белки, состоящие из аминокислотной последовательности, в которой, например, 1-100, 1-90, 1-80, 1-70, 1-60, 1-50, 1-40, 1-39, 1-38, 1-37, 1-36, 1-35, 1-34, 1-33, 1-32, 1-31, 1-30, 1-29, 1-28, 1-27, 1-26, 1-25, 1-24, 1-23, 1-22, 1-21, 1-20, 1-19, 1-18, 1-17, 1-16, 1-15, 1-14, 1-13, 1-12, 1-11, 1-10, 1-9 (1-несколько), 1-8, 1-7, 1-6, 1-5, 1-4, 1-3, 1-2 или одна аминокислота является/являются делетированными, замененными, инсертированными и/или добавленными в любую аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей MaACS-1~12, и имеющий ацил-CoA-синтетазную активность или активность увеличения количества и/или изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине. В общем, количество делеций, замен, инсерций и/или добавлений является предпочтительно меньшим.
Такие белки включают в себя белок, имеющий идентичность приблизительно 60% или более высокую, 61% или более высокую, 62% или более высокую, 63% или более высокую, 64% или более высокую, 65% или более высокую, 66% или более высокую, 67% или более высокую, 68% или более высокую, 69% или более высокую, 70% или более высокую, 71% или более высокую, 72% или более высокую, 73% или более высокую, 74% или более высокую, 75% или более высокую, 76% или более высокую, 77% или более высокую, 78% или более высокую, 79% или более высокую, 80% или более высокую, 81% или более высокую, 82% или более высокую, 83% или более высокую, 84% или более высокую, 85% или более высокую, 86% или более высокую, 87% или более высокую, 88% или более высокую, 89% или более высокую, 90% или более высокую, 91% или более высокую, 92% или более высокую, 93% или более высокую, 94% или более высокую, 95% или более высокую, 96% или более высокую, 97% или более высокую, 98% или более высокую, 99% или более высокую, 99,1% или более высокую, 99,2% или более высокую, 99,3% или более высокую, 99,4% или более высокую, 99,5% или более высокую, 99,6% или более высокую, 99,7% или более высокую, 99,8% или более высокую или 99,9% или более высокую относительно любой аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей MaACS-1~12, и имеющий диацилглицерол-ацилтрансферазную активность. Когда описанный выше процент идентичности является более высоким, этот белок является обычно предпочтительным.
Предполагается, что термин делеция, замена, инсерция и/или добавление одного или нескольких аминокислотных остатков в аминокислотной последовательности белка по данному изобретению означает, что один или несколько аминокислотных остатков делетированы, заменены, инсертированы и/или добавлены в произвольных и одном или нескольких положениях в одной и той же последовательности. Одновременно могут встречаться два или более типов делеций, замен, инсерций и добавлений.
Примеры аминокислотных остатков, которые являются взаимозаменяемыми, приведены ниже. Аминокислотные остатки в одной и той же группе являются взаимозаменяемыми. Группа А: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминобутановая кислота, метионин, о-метилсерин, трет-бутилглицин, трет-бутилаланин и циклогексилаланин; Группа B: аспарагиновая кислота, глутаминовая кислота, изоаспарагиновая кислота, изоглутаминовая кислота, 2-аминоадипиновая кислота и 2-аминосубериновая кислота; Группа C: аспарагин и глутамин; Группа D: лизин, аргинин, орнитин, 2,4-диаминобутановая кислота и 2,3-диаминопропионовая кислота; Группа E: пролин, 3-гидроксипролин и 4-гидроксипролин; Группа F: серин, треонин и гомосерин; и Группа G: фенилаланин и тирозин.
Белок по данному изобретению может быть также получен способами химического синтеза, такими как Fmoc-способ (фторенилметилоксикарбонильный способ), tBoc-способ (трет-бутилоксикарбонильный способ) и т.д. Кроме того, для химического синтеза могут быть также использованы пептидные синтезаторы, доступные из Advanced Automation Peptide Protein Technologies, Perkin Elmer, Protein Technologies, PerSeptive, Applied Biosystems, SHIMADZU Corp., etc.
Белок, кодируемый полинуклеотидом по этому изобретению, и белок по изобретению являются, оба, белками-гомологами ACS, и считается, что они имеют ацил-CoA-синтетазную активность, так как мотив АТР-АМР (АТФ-АТФ) и мотив FACS/VLACS-FATP, которые являются важными для ацил-CoA-синтетазной активности, являются сохраненными. Предполагается, что в данном контексте ATP, AMP, FACS, VLACS и FATP обозначают аденозинтрифосфат, аденозинмонофосфат, (ацил жирных кислот)-CoA-синтетазу, ацил-CoA синтетазу с очень длинной цепью и белок транспорта жирных кислот, соответственно. Конкретные аминокислотные последовательности мотива ATP-AMP и мотива FACS/VLACS-FATP, содержащихся в белке по данному изобретению, показаны на фиг. 25 и 26 в подчеркнутой одной линией и подчеркнутых двойной линией последовательностях, соответственно. Что касается репрезентативных аминокислотных последовательностей мотива ATP-AMP и мотива FACS/VLACS-FATP, может быть сделана ссылка на базы данных, включающие в себя pfam (http://pfam.sanger.ac.uk/), и т.д.
В данном контексте термин "ацил-CoA-синтетазная активность (ACS-активность)" предназначен для обозначения активности, стимулирующей реакцию образования ацил-СоА посредством образования тиоэфирной связи между жирной кислотой и коферментом А (уравнение химической реакции ниже).
Жирная кислота+Кофермент A→Ацил-CoA+H2O
Ацил-CoA-синтетазная активность может быть количественно подтверждена, например, культивированием в течение определенного периода времени клеток-хозяев, в которые введен полипептид по данному изобретению, получением лизата клеток-хозяев, смешиванием этого клеточного лизата с меченой жирной кислотой (например, полиненасыщенной жирной кислотой, меченной радиоактивным изотопом и т.д.) и кофермента А, реакцией их в течение некоторого периода времени, затем экстракцией свободных жирных кислот н-гептаном и определением количества (ацил жирной кислоты)-СоА, который образуется во время вышеописанной реакции и остается в водной фракции, с использованием сцинтилляционного счетчика. В отношении деталей этого способа для подтверждения ацил-CoA-синтетазной активности, может быть сделана ссылка на Black P. N., et al. (J. B. C., 272 (8), 4896-4903, 1997). Альтернативно, активность ацил-СоА-синтетазы может быть также определена способом, описанным в разделе "Оценивание активности ACS" ПРИМЕРА 2, который не включает в себя использование радиоактивной метки.
Термин "активность увеличения количества жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине" предназначен для обозначения активности, которая, при введении (трансформации) полинуклеотида по данному изобретению или полинуклеотида, кодирующего белок по данному изобретению, в клетку-хозяина и экспрессии в этой клетке-хозяине, увеличивает общую продукцию жирных кислот в сравнении со ссылочной клеткой (контролем), полученной из того же самого штамма, что и клетка-хозяин, в которую не вводят вышеописанный полинуклеотид.
Термин "активность изменения состава жирных кислот, продуцируемых в клетке-хозяине при экспрессии в этой клетке-хозяине" предназначен для обозначения активности, которая, при введении полинуклеотида по данному изобретению или полинуклеотида, кодирующего белок по данному изобретению, вводят (трансформируют) в клетку-хозяина и экспрессируют в этой клетке-хозяине, изменяет количество или соотношение различных продуцируемых жирных кислот в сравнении со ссылочной клеткой (контролем), полученной из того же самого штамма, что и клетка-хозяин, в которую не вводят вышеописанный полинуклеотид.
В данном контексте термин "жирная кислота" предназначен для обозначения алифатической монокарбоновой кислоты (карбоновой кислоты, имеющей один карбоксильный остаток и атомы углерода, соединенные друг с другом в цепи), представленной общей формулой RCOOH (где R обозначает алкил). Эта жирная кислота включает в себя насыщенную жирную кислоту, не имеющую двойной связи, и ненасыщенную жирную кислоту, содержащую двойную связь (двойные связи) в этой углеводородной цепи. Эта жирная кислота является предпочтительно ненасыщенной жирной кислотой и, более предпочтительно, полиненасыщенной жирной кислотой, содержащей множество двойных связей в этой углеводородной цепи. Эта полиненасыщенная жирная кислота включает в себя предпочтительно ненасыщенную жирную кислоту, имеющую атомы углерода в количестве 18 или более, например, ненасыщенную жирную кислоту, имеющую 18 или 20 атомов углерода, и примеры включают в себя, но не ограничиваются ими, олеиновую кислоту, линолевую кислоту, линоленовую кислоту (γ-линоленовую кислоту, дигомо-γ-линоленовую кислоту и т.д.), арахидоновую кислоту и т.п. Этими полиненасыщенными жирными кислотами являются особенно предпочтительно линолевая кислота, γ-линоленовая кислота, дигомо-γ-линоленовая кислота и арахидоновая кислота, более предпочтительно, линолевая кислота, дигомо-γ-линоленовая кислота и арахидоновая кислота и, наиболее предпочтительно, линолевая кислота, дигомо-γ-линоленовая кислота и арахидоновая кислот