Способ получения йодирующего агента
Иллюстрации
Показать всеИзобретение относится к способу, включающему в себя следующие стадии: a) электрохимическое окисление 1 моля исходного ICl в кислотном водном растворе с образованием промежуточного производного со степенью окисления йода, равной (III); b) реагирование упомянутого промежуточного производного с йодом и c) получение 3 молей ICl. Использование настоящего способа позволяет избежать отрицательных факторов, связанных с применением больших объемов хлора. 19 з.п. ф-лы, 7 пр., 3 ил.
Реферат
Настоящее изобретение в общем относится к способу получения йодирующего агента. Более конкретно, настоящее изобретение относится к способу электрохимического получения хлорида йода (ICl) - йодирующего агента, используемого при синтезе йодированных органических соединений, таких как производные 2,4,6-трийодфенила, применимых в качестве контрастных агентов или в качестве предшественников при их синтезе.
Предпосылки изобретения
Контрастные средства (или контрастные агенты) и их применение в области диагностики широко описано в литературе.
В частности, йодированные ароматические производные относятся к классам соединений, которые находят применение в качестве контрастных агентов в диагностических методах, основанных на поглощении рентгеновских лучей тканями или органами (т.е. радиография, томография). Среди этих ароматических йодированных производных заслуживают упоминания, среди прочего, йогексол (Iohexol; GB 1548594 - Nyegaard & Co. A/S), йоверсол (Ioversol; EP 83964 - Mallinckrodt Inc.), йопамидол (Iopamidol; GB 1472050 - Bracco) и йомепрол (Iomeprol; EP 365541 - Bracco). Эти йодированные контрастные агенты получают различными путями синтеза, описанными в литературе, причем некоторые из таких путей синтеза включают в себя полийодирование ароматического промежуточного соединения, в частности, промежуточного производного фенола или анилина, посредством различных йодирующих агентов. Более конкретно, EP773923 (Bracco) описывает йодирование 5-амино-1,3-бензолдикарбоновой кислоты хлоридом йода (ICl) в присутствии хлористоводородной кислоты с образованием соответствующего трийодного производного по следующей схеме:
.
Существенно схожий подход был также описан для йодирования 5-гидрокси-1,3-бензолдикарбоновой кислоты, о чем сообщается, например, в EP 782562 (Bracco). ICl можно получать известными специалисту в данной области способами, некоторые из которых предусматривают образование хлорированных форм трехвалентного йода I(III), обычно ICl3, и последующее преобразование полученного таким образом промежуточного соединения посредством добавления молекулярного I2, как схематически представлено ниже:
.
Среди возможных способов образования ICl3 можно назвать, например, применение KClO3 по реакции с I2 в присутствии хлористоводородной кислоты (Acta Chim. Slovo. 2000, 47, 89-90) или получение согласно JP 1141803 (Mitsui Toatsu Chemicals), которое требует применения газообразного хлора в качестве исходного реагента:
.
Хотя этот последний путь дает возможность производить ICl с большой степенью чистоты, использование газообразного хлора, особенно при применении в промышленном масштабе, вследствие токсичности и опасности этого газа сопряжено с необходимостью проведения строгих предохранительных мероприятий и применения специальных мер безопасности.
Благоприятным образом мы нашли способ получения ICl с большими выходами и с высокой чистотой, который не требует применения газообразного хлора, благодаря чему можно избежать вышеуказанных отрицательных факторов, обычно связанных с применением больших объемов хлора.
Сущность изобретения
Первый аспект настоящего изобретения представляет собой способ, включающий в себя следующие стадии:
a) электрохимическое окисление 1 моля исходного ICl в кислотном водном растворе с образованием промежуточного производного со степенью окисления йода, равной (III),
b) реагирование упомянутого промежуточного производного с йодом и
c) получение 3 молей ICl.
Электрохимическое окисление осуществляют в электролитической ячейке, в которой анодное и катодное отделения разделены ионопроницаемой перегородкой.
Предпочтительная разделительная перегородка представляет собой мембрану, проницаемую либо для анионов, либо для катионов, причем предпочтительные анионные мембраны изготовлены из полимерной основы, такой как полиамид, сложный полиэфир, полистирол, поливинилбензол и т.п. Предпочтительные катионные мембраны представляют собой, например, полимерные фторуглеродные мембраны, такие как политетрафторэтилен (PTFE), сополимеры тетрафторэтилена с перфторпропиленом (FEP), тетрафторэтилен-перфторалкоксильные сополимеры (PFА), сополимеры этилена с тетрафторэтиленом (ETFE) и поливинилиденфторид (PVDF) и т.п.
Электрод в катодном отделении выбирают из широко известных в данной области техники, как правило, это - графитовый электрод, тогда как анодное отделение предпочтительно изготавливают из платины, графита или, более предпочтительно, из модифицированного графита, или, еще более предпочтительно, стеклоуглерода, или стекловидного углерода.
В предпочтительном варианте осуществления изобретения процесс осуществляют посредством электролитической ячейки, в которой как анодное, так и катодное отделение изготовлены из одного и того же материала, такого как графит или модифицированный графит или стеклоуглерод.
На аноде раствор содержит начальное количество ICl, обычно присутствующего в виде раствора в хлористоводородной кислоте, в концентрациях, составляющих от примерно 5% до примерно 50%, предпочтительно, от примерно 18 до примерно 36%.
На катоде раствор содержит воду или линейный или разветвленный (C1-C4)-спирт в смеси с сильной неорганической кислотой, причем концентрация неорганической кислоты находится в диапазоне от 5% до 50% по массе относительно суммы кислоты и воды. Особо предпочтительны концентрации в диапазоне от 10% до 45%. Предпочтительными неорганическими кислотами являются хлористоводородная кислота и серная кислота, в то время как предпочтителен катодный раствор, содержащий воду и хлористоводородную кислоту, в частности, при концентрации хлористоводородной кислоты, находящейся в диапазоне от примерно 5% до примерно 40% по массе. Как указано выше, согласно настоящему изобретению анодное окисление исходного моля ICl ведет к преимущественному образованию в растворе промежуточного производного, в котором формальная степень окисления йода равна (III), а последующая реакция с молекулярным йодом дает возможность получить 3 моля ICl. Указанную последующую реакцию с молекулярным йодом можно проводить, добавляя твердый йод к промежуточному раствору, причем последний переносят во второй реактор или оставляют в том же реакторе.
Предпочтительно, раствор, содержащий йод в формальной степени окисления (III), перед осуществлением добавления молекулярного йода переносят в отдельный реактор.
Согласно следующему варианту осуществления настоящее изобретение также относится к способу получения ICl электрохимическим окислением раствора, содержащего исходное количество его же, причем аликвоту полученного ICl снова вводят в анодное отделение в качестве исходного реагента.
Кроме того и согласно следующему объекту, настоящее изобретение раскрывает способ, включающий в себя следующие стадии:
a) электрохимическое окисления 1 моля ICl в кислотном водном растворе с образованием промежуточного производного, в котором степень окисления йода равна (III);
b) реакция промежуточного производного I(III), полученного на стадии а, с молекулярным йодом;
c) получение 3 молей ICl и
d) дальнейшее йодирование соединения формулы (I)
где
R представляет собой -N(R')2 или -OH;
R1 независимо при каждом появлении представляет собой -COOR', -CON(R')2; и
R' независимо при каждом появлении представляет собой водород или линейный или разветвленный (C1-C4)-алкил, необязательно замещенный одной или более гидроксильными группами, присутствующими как таковые или в защищенной форме, с образованием соединения формулы (II)
.
В альтернативном варианте осуществления настоящее изобретение также относится к способу, в котором часть произведенного ICl повторно вводят в анодное отделение в качестве исходного реагента, а часть ICl используют в качестве йодирующего агента.
Краткое описание чертежей
Фиг.1 показывает кривую титрования раствора, загруженного в анодное отделение электрохимической ячейки. Ось х представляет значения потенциала, выраженные в мВ; ось у представляет количество KI (мл), добавленного при титровании (см. Пример 1 перед началом реакции).
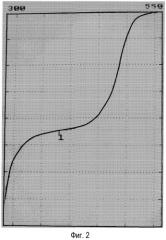
Фиг.2 показывает кривую титрования окисленного раствора в анодном отделении электрохимической ячейки. Ось х представляет значения потенциала, выраженные в мВ; ось у представляет количество KI (мл), добавленного при титровании (см. Пример 1 в конце реакции).
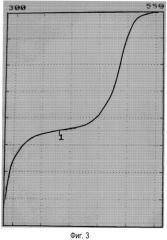
Фиг.3 показывает кривую титрования раствора, полученного после растворения I2 в электрохимически окисленном растворе и декантации избытка йода. Ось х представляет значения потенциала, выраженные в мВ; ось у представляет количество KI (мл), добавленного при титровании (см. Пример 3 в конце реакции).
Подробное описание изобретения
Настоящее изобретение в общем относится к способу получения ICl по реакции подходящего производного, в котором йод находится в формальной степени окисления (III) и которое далее здесь определено как «I(III)-производное», с молекулярным йодом, где I(III)-производное получено электрохимическим окислением исходного количества ICl в кислотном водном растворе. Промежуточное I(III)-производное представляет собой, например, межгалогенное соединение йода с хлором, такое как ICl3, ICl4 - или им подобное, или даже любую возможную их смесь.
Чтобы лучше проиллюстрировать изобретение, здесь указана стехиометрия реакции и общая схема синтеза (1), включающая в себя стадию «а», т.е. анодное окисление исходного количества ICl с образованием промежуточного I(III)-производного (далее в общем обозначаемого как ICl3), за которой следует реакция с твердым йодом согласно стадии «b»:
Следует отметить, что, как видно из стехиометрии вышеприведенной схемы синтеза (1), способ по изобретению благоприятным образом дает возможность получать 3 моля ICl из начального одного моля его же, практически без добавления газообразного хлора.
Как указано выше, начальная стадия «а» данного способа включает в себя анодное окисление ICl в электролитической ячейке. В этой последней анодное и катодное отделения обычно разделены подходящим разделителем, выбранным из известных в данной области техники, например, диафрагм, пористых или полупроницаемых мембран или т.п. Разделитель должен быть стойким к кислым условиям, и он проницаем для ионных частиц, а предпочтительно, проницаем либо для анионов, либо для катионов, например, только для анионов, таких как хлорид. Для этого предпочтительную мембрану изготавливают с полимерной основой, такой как полиамид, сложный полиэфир, полистирол, поливинилбензол и т.п. Многие из этих мембран имеются в продаже, такие как, например, Neosepta® AHA, Selemion® AMV, FUMASEP® или IONAC MA®.
Также предпочтительными являются те мембраны, которые образованы полимерной фторуглеродной основой, такие как мембрана Nafion® PSFA N115 (доступная у Du Pont SpA) или Selemion® HSF и Selemion® CMF (доступные у Asahi Glass Co).
Другой предпочтительный разделитель представляет собой мембрану, которая селективна для пропускания ионов по принципу стерического препятствия, что предполагает отбор по размеру иона.
Предпочтительно, электрохимическое окисление осуществляют в электролитической ячейке, в которой два отделения - катодное/анодное - разделены мембраной типа Fumasep FTAM-E®.
Примерами возможных электродов, которые можно применять в данном способе, являются электроды, традиционно принятые для применения в промышленности.
В катодном отделении электрод изготовлен, например, из графита, палладия, свинца, меди или стали, или их смесей, причем особо предпочтительным является электрод из графита.
В анодном отделении электрод изготовлен из металла, выбранного из тех металлов, которые обычно применяют в аналогичных электрохимических системах, например, из платины или других элементов VIII группы Периодической таблицы, предпочтительно, в сетчатой форме. Кроме того, электрод на аноде изготавливают также из материалов, подходящим образом покрытых устойчивыми к коррозии металлами, например, покрытых пленкой подходящей толщины из металлов, обычно выбираемых из восьмой группы Периодической таблицы (платины, родия, рутения, иридия), или их смесей.
Варианты осуществления, в которых анод изготовлен из неметаллических проводящих материалов, применимых в качестве электродов, таких как графит, проводящая керамика или стеклоуглерод (или стеклообразный углерод), также входят в объем настоящего изобретения, причем предпочтителен анод из графита.
Альтернативно, электрод на аноде изготавливают из «модифицированного графита», т.е. графита, специально переработанного или обработанного так, что его характеристики и срок службы в условиях сильной кислотности повышены. Согласно настоящему изобретению, примерами указанного модифицированного графита являются графиты, покрытые или импрегнированные полимерными матрицами, или специально произведенные сорта графита.
Подходящими в этом отношении полимерными матрицами являются, например, метакриловые смолы, фенольные смолы или т.п. Таким образом и согласно следующему предпочтительному варианту осуществления, электрод на аноде изготовлен из импрегнированного полимерной матрицей графита. Равным образом предпочтительна полимерная матрица, состоящая из метакриловой смолы или фенольной смолы.
Аналогично этому, еще более предпочтительный вариант осуществления состоит в том, что электрод на аноде изготавливают из стеклоуглерода (или стеклообразного углерода) - материала, демонстрирующего сочетание свойств стекла и керамики со свойствами графита (в качестве общей ссылки см.: Analytical Chemistry; Vol 37, No 2, 1965, pag 200-202).
Согласно варианту осуществления изобретения, катод и анод изготавливают из разных материалов, а более предпочтительно, электролитическая ячейка содержит катод из графита и анод из платины, а еще более предпочтительно, этот последний выполнен в виде сетки.
Альтернативно, и это является одинаково предпочтительным вариантом осуществления изобретения, и катод, и анод изготавливают из одного и того же материала, выбранного из графита, модифицированного графита или стеклоуглерода.
Как было указано выше, электрохимическую реакцию для образования I(III)-производного согласно настоящему изобретению осуществляют в подходящем растворителе в кислых условиях, предпочтительно, при pH ниже 4, более предпочтительно, при pH ниже 2 или, еще более предпочтительно, при pH ниже 1.
Как правило, указанные рабочие условия получают, работая в присутствии сильной неорганической кислоты на катоде, такой как хлористоводородная кислота или серная кислота, в системе растворителей, содержащей воду, низшие (C1-C4)-спирты или их смеси, при концентрации неорганической кислоты в диапазоне от 5% до 50% по массе относительно суммы кислоты и растворителя. Особо предпочтительны концентрации в диапазоне от примерно 10% до примерно 45%.
Термин «низшие (C1-C4)-спирты» означает любые линейные или разветвленные спирты с 1-4 атомами углерода, такие как метанол, этанол, пропанол, бутанол и т.п. Более предпочтительно, электрохимическую реакцию на катоде проводят в присутствии хлористоводородной кислоты и воды при концентрации хлористоводородной кислоты в диапазоне от 5% до 40% по массе.
Согласно фундаментальному принципу электрохимии будет понятно, что если на аноде происходит электрохимическое окисление с образованием I(III)-производного из ICl, то на катоде будет наблюдаться соответствующее восстановление; конкретно, в этом случае вследствие восстановления ионов Н+ будет происходить образование водорода (Н2). Произведенный таким образом газообразный водород (Н2) можно затем улавливать способами, традиционно используемыми в промышленных электрохимических процессах, например, посредством улавливающих мембран и т.п.
Поэтому и как подробно описано в экспериментальной части, в катодное отделение будет соответствующим образом загружен выбранный кислотный водный раствор, такой как раствор воды и хлористоводородной кислоты при концентрации хлористоводородной кислоты в диапазоне от 5% до 50% по массе, а в анодное отделение будет соответствующим образом загружено начальное количество ICl, обычно присутствующего в виде раствора в хлористоводородной кислоте, в концентрации от примерно 5% до примерно 50% по массе, предпочтительно, от 15% до 40% по массе.
Электрохимическая ячейка в способе по изобретению обычно функционирует в гальваностатическом или потенциостатическом режиме. Предпочтительным режимом является гальваностатический режим, работающий при значениях плотности тока, составляющих от примерно 50 до 500 мА·см-2, предпочтительно, от примерно 50 до примерно 150 мА·см-2. Соответственно, значения потенциала будут такими, чтобы поддерживать указанные плотности тока в электрохимических ячейках в течение времени, достаточного для достижения желаемой степени окисления анодного раствора. Желательные степени окисления составляют более 80%, предпочтительно, более 90%, достижимые при времени реакции, которое может варьироваться от нескольких часов (более 40 часов) до дней (даже 2 или более дней), в зависимости от соотношения между размером порции и поверхностью электрода. Протекание реакции можно контролировать подходящими традиционными аналитическими способами, включая, например, обнаружение изменения потенциала посредством платиновых комбинированных электродов, используя электрод Ag/AgCl в качестве стандарта сравнения.
Как указано выше, данный способ включает в себя образование промежуточного I(III)-производного, которое далее преобразовывают по реакции с молекулярным йодом для получения 3 молей ICl. Обнаружение образования указанного промежуточного соединения осуществляют традиционными способами, известными в данной области техники, включая, например, титрование анодного раствора йодидом калия (KI) в кислой среде в конце электролиза или аналогичные.
Более конкретно и согласно предпочтительному варианту осуществления изобретения, проводят реакцию анодного раствора с твердым йодом (предпочтительно, взятым в небольшом молярном избытке) во втором реакторе или, в качестве альтернативы, «in situ» (т.е. в том же реакторе). Реакция, проводимая при комнатной температуре и при перемешивании, ведет к образованию ICl в растворе с высоким выходом (почти количественным), при этом остаток твердого йода отделяют декантацией, фильтрованием или центрифугированием.
Практический предпочтительный вариант осуществления способа по изобретению осуществляют следующим образом: в электрохимическую ячейку, содержащую катодное и анодное отделения, разделенные подходящей ионопроницаемой мембраной, загружают водный раствор HCl в качестве катодного реагента и исходный раствор хлорида йода, HCl и воды в качестве анодного реагента. Ячейку запитывают постоянным электрическим током, работая при плотности тока примерно 100 мА·см-2 или при выбранном напряжении тока согласно принятому рабочему режиму. В конце электролитического процесса анодный раствор титруют для определения присутствия образованных таким образом соединений йода. В соответствии с вышеизложенным, по меньшей мере часть присутствующего йода имеет формальную степень окисления (III). Произведенный таким образом раствор, содержащий йод в формальной степени окисления (III), переносят во второй реактор и к нему добавляют соответствующее количество твердого йода, работая при комнатной температуре (т.е. 15°С-30°С) и при перемешивании. Твердый остаток отделяют от раствора декантацией, а во время растворения твердого иода потенциал анодного раствора контролируют комбинированным электродом, как указано ранее. Степень окисления практически всего йода, присутствующего в растворе, равна (I).
Полученный таким образом хлорид йода в растворе хлористоводородной кислоты или, как описано ниже, его часть в том случае, когда некоторую его долю собираются рециркулировать в исходную электрохимическую ячейку, может быть выгодно применен для йодирования органических молекул, например, для полийодирования ароматических субстратов.
Согласно особо предпочтительному варианту осуществления и с учетом стехиометрии реакции, характеризующей весь процесс, указанный начальный источник ICl может быть образован частью ICl, полученного в качестве продукта. Таким образом, в зависимости от конкретного случая, соответствующее количество водного кислотного раствора ICl, полученного в качестве продукта, можно рециркулировать и загружать в анодное отделение.
Поэтому следующим аспектом настоящего изобретения является электрохимический способ получения ICl, по существу такой же, как описано выше, при котором соответствующую часть полученного ICl повторно вводят в анодное отделение в качестве исходного реагента. Очевидно, для того чтобы предотвратить истощение или пересыщение анолитного источника, например, после нескольких циклов процесса и рециркулирования ICl, может оказаться целесообразным объединение с водой или с выбранной кислотой, такой как хлористоводородная кислота, или даже с аликвотами самого исходного ICl.
Хлорид йода, предназначенный здесь для использования в качестве исходного соединения данного способа, обычно применяют в виде раствора в хлористоводородной кислоте, как описано в литературе.
Как указано выше, ICl, полученный согласно данному способу, можно традиционно применять в качестве йодирующего агента, особенно при полийодировании ароматических субстратов для получения неионных йодированных контрастных средств.
В этом отношении, следующим объектом этого изобретения является способ, включающий в себя следующие стадии:
a) электрохимическое окисление 1 моля ICl в кислотном водном растворе с образованием промежуточного производного, в котором степень окисления йода равна (III);
b) реакция промежуточного производного I(III), полученного на стадии а, с молекулярным йодом;
c) получение 3 молей ICl и
d) дальнейшее йодирование соединения формулы (I)
где
R представляет собой -N(R')2 или -OH;
R1 независимо при каждом появлении представляет собой -COOR', -CON(R')2; а
R' независимо при каждом появлении представляет собой водород или линейный или разветвленный (C1-C4)-алкил, необязательно замещенный одной или более гидроксильными группами, присутствующими как таковые или в защищенной форме, с образованием соединения формулы (II)
Предпочтительно способ осуществляют исходя из соединений формулы I, где R представляет собой гидроксил (-OH) или аминогруппу (-NH2), а группы R1 являются одинаковыми и выбранными из -COOH или -CONHR'; где R' выбран из -CH(CH2OH)2 или -CH2(CHOH)CH2OH.
В более подробном изложении, следующим аспектом изобретения является способ, включающий в себя получение ICl, как подробно изложено выше, за которым следует его последующее добавление в качестве йодирующего агента к водному раствору соединения (I), причем последнее обычно присутствует в небольшом избытке, при перемешивании и температуре примерно 80-90°С. Значения рН устанавливают в диапазоне от 0 до примерно 2, необязательно, в присутствии подходящего основного буфера (см., например, патент США № 5013865). Полученную таким образом неочищенную реакционную смесь можно затем перерабатывать посредством известных методов, таких как фильтрация или хроматографическая очистка, получая желаемое трижды йодированное производное в чистой форме.
Согласно альтернативному варианту осуществления, описанному выше, данный способ предоставляет для повторного введения в анодное отделение в качестве исходного реагента некоторую часть произведенного ICl, при этом часть ICl используют в качестве йодирующего агента, как описано выше. Гидроксильные группы в классе соединений формулы I могут присутствовать в незащищенной форме или, альтернативно, во избежание нежелательных побочных реакций, в форме, подходящим образом защищенной посредством традиционных способов и защитных групп, известных в данной области техники (в качестве общей ссылки см.: T. W. Green, Protective Groups in Organic Synthesis (Wiley, N.Y. 1981)).
Субстраты формулы I и соответствующая реакция йодирования с ICl для образования соответствующих соединений формулы II хорошо известны в данной области техники и широко описаны в литературе, например для получения йопамидола или йомепрола, как уже было указано.
Следующие примеры представлены для лучшего иллюстрирования настоящего изобретения, без какого бы то ни было ограничения его объема.
Экспериментальная часть
Пример 1. Электрохимическое окисление ICl в присутствии платинового анода.
В электрохимическую ячейку, включавшую в себя катодное отделение, содержавшее в качестве катода цилиндрический стержень из графита с площадью поверхности 6 см2, и анодное отделение, содержавшее в качестве анода сетку из платины с геометрической площадью поверхности 24 см2, причем эти два отделения разделяла мембрана типа Fumasep® FTAM-E с анионной проводимостью, загружали 69,7 г 33%-ного раствора HCl в воде в качестве катодного реагента и 134,7 г раствора хлорида йода в качестве анодного реагента, имевшего следующий состав:
ICl 30,8%
HCl 22,8%
H2O 46,4%.
Ячейку в течение 21 ч питали непрерывным током 610 мА при напряжении примерно 6,5 В.
Во время электролиза потенциал анодного раствора определяли платиновым комбинированным электродом (Ag/AgCl в качестве сравнения). Начальный потенциал раствора перед электролизом оказался равным 691 мВ, тогда как в конце электролиза потенциал увеличивался до 975 мВ.
В конце реакции электролиза анодный раствор титровали KI в кислых условиях для определения присутствующих производных йода. Для достижения точки перегиба при потенциале 780 мВ по отношению к платиновому комбинированному электроду было израсходовано 1,73 мЭкв/г раствора KI, после чего потребовалось 5,30 мЭкв/г раствора KI для достижения второй точки перегиба при 493 мВ.
Соответственно, было подтверждено, что полученный таким образом йод был в формальной степени окисления (III). Измеренный выход по току составлял 90%.
Пример 2. Электрохимическое окисление ICl в присутствии графитового анода.
В электрохимическую ячейку, включавшую в себя катодное отделение, содержавшее в качестве катода цилиндрический стержень из графита с площадью поверхности 6 см2, и анодное отделение, содержавшее в качестве анода цилиндрический стержень из графита с площадью поверхности 8,5 см2, причем эти два отделения разделяла мембрана типа Fumasep® FTAM-E с анионной проводимостью, загружали 67,2 г 33%-ного раствора HCl в воде в качестве катодного реагента и 124,6 г раствора хлорида йода в качестве анодного реагента, имевшего следующий состав:
ICl 18,9%
HCl 27,2%
H2O 53,9%.
Ячейку в течение 17 ч питали током 500 мА при напряжении примерно 6 В.
Во время электролиза потенциал анодного раствора определяли платиновым комбинированным электродом (Ag/AgCl в качестве сравнения). Начальный потенциал раствора перед электролизом оказался равным 680 мВ, тогда как в конце электролиза потенциал увеличивался до 932 мВ.
После завершения реакции электролиза анодный раствор титровали KI в кислых условиях для определения присутствующих производных йода. Для достижения точки перегиба при значении потенциала 668 мВ по отношению к платиновому комбинированному электроду было израсходовано 1,12 мЭкв/г раствора KI, после чего для достижения второй точки перегиба при потенциале 405 мВ потребовалось 3,40 мЭкв/г раствора KI. Результирующая формальная степень окисления йода была равной III. Измеренный выход по току составлял 90%.
Пример 3. Окисление I 2 до ICl при контакте с электрохимически окисленными растворами ICl.
К окисленному раствору ICl, содержавшему йод в формальной степени окисления (III), произведенному согласно Примеру 2, добавляли 34,3 г твердого I2, работая при комнатной температуре и поддерживая смесь при перемешивании. Большая часть твердого вещества была израсходована в течение 390 минут, а остаток отделяли от раствора декантацией. Во время растворения твердого йода потенциал анодного раствора контролировали посредством платинового комбинированного электрода (Ag/AgCl в качестве сравнения). Начальный потенциал раствора перед добавлением I2 оказался равным 930 мВ, а после того, как произошло растворение йода, потенциал снижался до 701 мВ. Декантированный раствор титровали KI, обнаружив единственную точку перегиба при потенциале 381 мВ, по отношению к платиновому комбинированному электроду, после добавления KI (2,64 мЭкв на грамм окисленного раствора).
Было подтверждено, что практически весь йод, присутствовавший в растворе, находился в степени окисления (I).
Пример 4. Электрохимическое окисление ICl (в одном реакторе).
Раствор ICl в водной хлористоводородной кислоте (147,2 г), содержавший ICl (0,284 моль) и HCl (35,99 г, 0,99 моль), подвергали электролизу в течение 23 часов, как описано в Примере 1, питая ячейку током 630 мА при напряжении примерно 5 В. В конце электролиза из анодного отделения ячейки извлекали 141 г раствора, содержавшего 0,005 моля I(I) и 0,26 моля I(III). Затем к раствору добавляли I2 (0,27 моль), что приводило к образованию 209 г раствора, содержавшего 0,80 моля I(I) согласно результатам титрования. Затем к аликвоте этого раствора массой 69 г добавляли 68 г 33%-ного раствора HCl. Этот раствор, содержавший 0,26 моля I(I), повторно подвергали электролизу, получая при этом 138 г окисленного раствора, содержавшего 0,03 моля I(I) и 0,23 моля I(III) согласно расчетам по результатам титрования.
Пример 5. Электрохимическое окисление ICl с использованием анода из модифицированного графита.
В электрохимическую пластинчато-рамочную ячейку, состоявшую из катодного отделения, оснащенного компактным графитовым катодом, анодного отделения, оснащенного анодом из специального графита сорта R7510 от SGL Carbon, импрегнированного метакриловой смолой, и содержавшую анионную мембрану типа Fumasep® FTAM-E от FuMA-Tech, подавали следующие соединения: 1294,5 г 32,8%-ного раствора HCl в воде в качестве католита и 1301,5 г анолита, состоявшего из раствора хлорида йода со следующим составом:
ICl 30,8%,
HCl 21,1%
H2O 48,1%.
Ячейку в течение 20 часов питали током 6,4 А при напряжении примерно 3,2 В. Во время электролиза расходы электролитов составляли 2,1 л/мин для анолита и 0,5 л/мин для католита. После электролиза мы титровали анодный раствор KI при кислых условиях для определения присутствующих ионов йода. При титровании для достижения точки перегиба при потенциале 697 мВ по отношению к комбинированному платиновому электроду было израсходовано 1,51 мЭкв KI на один грамм анолитного раствора, после чего потребовалось 4,83 мЭкв KI на один грамм анолитного раствора для достижения второй точки перегиба при потенциале 439 мВ. Результирующая формальная степень окисления йода соответствовала +3. Выход по току составлял 86%.
Пример 6. Электрохимическое окисление ICl с использованием графитового анода.
В электрохимическую пластинчато-рамочную ячейку, состоявшую из катодного и анодного отделений, оснащенных катодом и анодом, изготовленными из графита от Carbone Lorraine (с высокой плотностью, ультратонкой зернистостью, пористостью менее 3% и рабочей температурой в кислороде ниже 600°С), разделенных анионной мембраной типа Fumasep FTAM-E от FuMA-Tech, подавали следующие соединения: 1203,6 г 32,7%-ного раствора HCl в воде в качестве католита и 2348,8 г анолита, состоявшего из раствора хлорида йода со следующим составом:
ICl 36,6%
HCl 8,4%
H2O 55,0%.
Ячейку в течение 42 часов питали током 6,4 А при напряжении примерно 2,8 В. Расходы электролитов при электролизе составляли 0,5 л/мин для анолита и 0,5 л/мин для католита. После электролиза титровали анодный раствор KI при кислых условиях для определения присутствующих ионов йода. При титровании для достижения точки перегиба при потенциале 659 мВ по отношению к комбинированному платиновому электроду было израсходовано 1,73 мЭкв KI на один грамм анолитного раствора, после чего потребовалось 5,51 мЭкв KI на один грамм анолитного раствора для достижения второй точки перегиба при потенциале 441 мВ. Результирующая формальная степень окисления йода соответствовала +3. Выход по току составлял 91%.
Пример 7. Электрохимическое окисление ICl с использованием стеклоуглеродного анода.
В электрохимическую пластинчато-рамочную ячейку, состоявшую из катодного и анодного отделений, оснащенных катодом и анодом, изготовленными из стеклоуглерода Sigradur® от HTW Gmbh, и разделенных анионной мембраной типа Neosepta AHA от Tokuyama, подавали следующие соединения: 1888,0 г 33,0%-ного раствора HCl в воде в качестве католита и 1885,0 г анолита, состоявшего из раствора хлорида йода со следующим составом:
ICl 31,4%
HCl 21,8%
H2О 46,8%.
Ячейку в течение 18 часов питали током 10,0 А при напряжении примерно 6,5 В. Расходы электролитов при электролизе составляли 5,0 л/мин для анолита и 0,5 л/мин для католита. После электролиза титровали анодный раствор KI при кислых условиях для определения присутствующих ионов йода. При титровании для достижения точки перегиба при потенциале 711 мВ по отношению к комбинированному платиновому электроду было израсходовано 1,59 мЭкв KI на один грамм анолитного раствора, после чего потребовалось 5,07 мЭкв KI на один грамм анолитного раствора для достижения второй точки перегиба при потенциале 440 мВ. Результирующая формальная степень окисления йода соответствовала +3. Выход по току составлял 91%.
1. Способ, включающий в себя следующие стадии:a) электрохимическое окисление 1 моля исходного ICl в кислотном водном растворе с образованием промежуточного производного со степенью окисления йода, равной (III);b) реагирование упомянутого промежуточного производного с йодом иc) получение 3 молей ICl.
2. Способ по п.1, причем упомянутое электрохимическое окисление осуществляют в электролитической ячейке, в которой анодное и катодное отделения разделены ионопроницаемой мембраной.
3. Способ по п.2, причем мембрана селективно проницаема для анионов или катионов.
4. Способ по п.2, причем электрод катодного отделения изготовлен из графита.
5. Способ по п.2, причем электрод анодного отделения изготовлен из платины, графита, модифицированного графита или стеклоуглерода.
6. Способ по п.1, в присутствии катодной системы растворителей, содержащей: сильную кислоту, смешанную с водой, C1-C4-спирт или их смесь.
7. Способ по п.5, в присутствии катодной системы растворителей, содержащей: сильную кислоту, смешанную с водой, C1-C4-спирт или их смесь.
8. Способ по п.6, причем упомянутая сильная кислота представляет собой хлористоводородную кислоту или серную кислоту.
9. Способ по п.6, причем упомянутая катодная система растворителей содержит смесь воды и хлористоводородной кислоты.
10. Способ по п.9, причем упомянутая хлористоводородная кислота имеет концентрацию, составляющую от 5% до 40% по массе.
11. Способ по п.1, причем исходный ICl в кислотном водном растворе имеет концентрацию, составляющую от 15% до 40% по массе.
12. Способ по п.1, причем часть полученного ICl повторно вводят в качестве исходного реагента в анодное отделение.
13. Способ по п.11, причем часть полученного ICl повторно вводят в качестве исходного реагента в анодное отделение.
14. Способ по п.1, причем электрохимическое окисление осуществляют в гальваностатическом или потенциостатическом режиме, работая при значениях плотности тока, составляющих от 50 до 150 мА·см-2.
15. Способ по п.1, включающий в себя перенос раствора, полученного на стадии а, в отдельный реактор перед осуществлением следующей стадии b.
16. Способ по п.1, дополнительно включающий в себя йодирование соединения формулы (I) гдеR пре