Хиназолиноны как ингибиторы пролилгидроксилазы
Иллюстрации
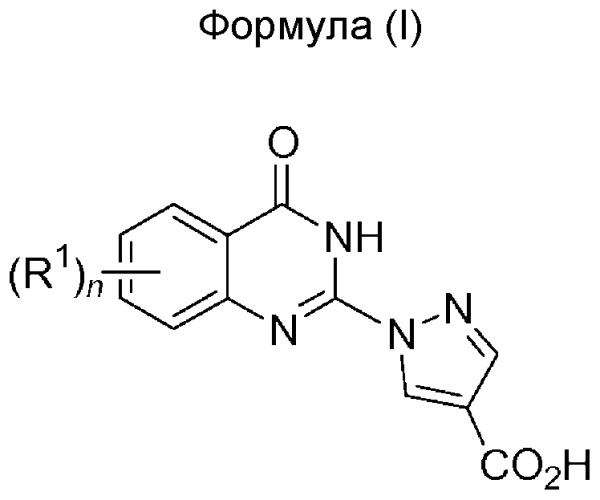
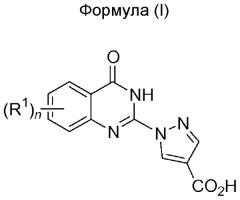
Показать всеИзобретение относится к хиназолиноновым соединениям формулы (I) и его фармацевтически приемлемым солям, в которой n равно от 0 до 3 и R1 имеет определения, указанные в формуле изобретения. Данные соединения являются ингибиторами пролилгидроксилазы и могут быть использованы в фармацевтических композициях и способах лечения патологических состояний, расстройств и состояний, опосредуемых активностью пролилгидроксилазы. Так, данные соединения могут вводиться пациенту для лечения, например, анемии, заболеваний сосудов, нарушений обмена веществ, а также для заживления ран. 9 н. и 13 з.п. ф-лы, 2 табл., 211 пр.
Реферат
Перекрестные ссылки на смежные изобретения
Настоящая заявка истребует приоритет по предварительной заявке на патент США за номером 61/151429, поданной 10 февраля 2009 года.
Область изобретения
Настоящее изобретение относится к некоторым производным хиназолинона, содержащим их фармацевтическим композициям и способам их использования для лечения патологических состояний, расстройств и состояний, опосредуемых активностью пролилгидроксилазы.
Предпосылки создания изобретения
Клетки реагируют на гипоксию активацией транскрипции генов, участвующих в выживании клетки, доставке и использовании кислорода, ангиогенезе, клеточном метаболизме, регулировании кровяного давления, гематопоэзе и сохранении ткани. Индуцированные гипоксией факторы (HIF) являются ключевыми транскрипционными регуляторами этих генов (Semenza et al., 1992, Mol Cell Biol., 12(12):5447-54; Wang et al., 1993, J Biol Chem., 268(29):21513-18; Wang et al., 1993, Proc Natl Acad Sci., 90:4304-08; Wang et al., 1995, J Biol Chem., 270(3):1230-37). Описаны три типа факторов HIF-a: HIF-1b, HIF-2a и HIF-3a (Scheuermann et al., 2007, Methods Enzymol., 435:3-24). Конъюгация субъединицы HIFa с HIF-1b образует функциональный гетеродимерный белок, который, в свою очередь, вовлекает другие транскрипционные факторы, такие как p300 и CBP (Semenza, 2001, Trends Mol Med., 7(8):345-50).
Семейство высококонсервативных кислород-, железо- и 2-оксоглутарат-зависимых энзимов пролилгидроксилазы (PHD) являются промежуточным звеном реакции клеток на гипоксию посредством посттрансляционной модификации HIF (Ivan et al., 2001, Science, 292:464-68; Jaakkola et al., 2001, Science, 292:468-72). В условиях нормального снабжения кислородом PHD катализирует гидроксилирование двух консервативных групп пролина в HIF. Белок фон Гиппеля-Линдау (VHL) избирательно связывается с гидроксилированным HIF. Связывание с VHL делает HIF мишенью для полиубиквитинилирования комплексом убиквитин-лигазы Е3 и его последующей деградации 26S-протеасомой (Ke et al., 2006, Mol Pharmacol. 70(5):1469-80; Semenza, Sci STKE., 2007, 407(cm8):1-3). Так как сродство PHD к кислороду находится в физиологическом диапазоне кислорода, а кислород является необходимым кофактором реакции, PHD инактивируется при снижении концентрации кислорода. Таким образом, HIF быстро распадается при нормальных условиях снабжения кислородом, но накапливается в клетках в условиях гипоксии или при ингибировании PHD.
Описаны четыре изотипа PHD: PHD1, PHD2, PHD3 и PHD4 (Epstein et al., 2001, Cell, 107:43-54; Kaelin, 2005, Annu Rev Biochem., 74:115-28; Schmid et al., 2004, J Cell Mol Med., 8:423-31). Различные изотипы экспрессируются повсюду, но регулируются различным образом и играют различные физиологические роли в клеточном ответе на гипоксию. Имеются данные, что различные изотипы обладают разной селективностью по отношению к трем разным подтипам HIFa (Epstein et al., см. выше). С точки зрения внутриклеточной локализации, PHD1 находится, главным образом, в ядре, PHD2 - в цитоплазме, а PHD3 распространен как в ядре, так и в цитоплазме (Metzen E, et al., 2003, J Cell Sci., 116(7):1319-26). PHD2 является преобладающей HIFα пролилгидроксилазой при гипоксических условиях (Ivan et al., 2002. Proc Natl Acad Sci. USA, 99(21):13459-64; Berra et al., 2003, EMBO J., 22:4082-90). Все три изотипа имеют высокую степень аминокислотной гомологии, а активный центр фермента является высококонсервативным.
Продукты целевого для HIF гена участвуют в ряде физиологических и патофизиологических процессов, включая, помимо прочего, следующие: эритро(цито)поэз, развитие кровеносных сосудов, регулирование энергетического обмена, вазомоторную функцию и апоптоз/пролиферацию клеток. Первым геном, описанным в качестве целевого для HIF, был ген, кодирующий эритропоэтин (ЭПО) (Wang et al., 1993, см. выше). Было показано, что снижение кислородопереносной функции крови воспринимается почками, и что почки и печень реагируют на это выработкой большего количества ЭПО - гормона, который стимулирует пролиферацию и созревание эритроцитов. ЭПО оказывает разностороннее воздействие на некроветворные типы клеток и выступает в роли основного защищающего ткани цитокина (Arcasoy, 2008, Br J Haematol., 141:14-31). Поэтому сегодня предполагается участие ЭПО в процессах заживления ран и ангиогенеза, а также в реакции тканей на ишемический инсульт. Большинство вовлеченных в анаэробный гликолиз ферментов кодированы целевыми генами HIF, в результате чего гликолиз усиливается в гипоксических тканях (Shaw, 2006, Curr Opin Cell Biol., 18(6):598-608). Известные продукты целевого для HIF гена в этом пути метаболизма включают, помимо прочего, следующие: переносчики глюкозы, такие как GLUT-1 (Ebert et al., 1995, J Biol Chem., 270(49):29083-89), ферменты, участвующие в расщеплении глюкозы до пируватов, такие как гексокиназа и фосфоглицераткиназа 1 (Firth et al., 1994, Proc Natl Acad Sci. USA91:6496-6500), а также лактатдегидрогеназа (Firth et al., см. выше). Продукты целевого гена HIF также участвуют в регулировании клеточного метаболизма. Например, киназа пируватдегидрогеназы 1 является продуктом целевого гена HIF и регулирует поступление пирувата в цикл Кребса, снижая активность пируватдегидрогеназы путем фосфорилирования (Kim et al., 2006, Cell Metab., 3:177-85; Papandreou et al., 2006, Cell Metab., 3:187-197). Продукты целевого гена HIF также участвуют в процессах ангиогенеза. Например, фактор роста эндотелия сосудов (VEGF) (Liu et al., 1995, Circ Res., 77(3):638-43) является известным регулятором процессов ангиогенеза и васкулогенеза. Продукты целевого гена HIF также участвуют в регулировании сосудистого тонуса и включают гемоксигеназу-1 (Lee et al., 1997, J Biol Chem., 272(9):5375-81). Ряд продуктов регулируемых HIF генов, такие как тромбоцитарный фактор роста (PDGF) (Yoshida et al., 2006, J Neurooncol., 76(1):13-21), сосудистый эндотелиальный фактор рост (Breen, 2007, J Cell Biochem., 102(6):1358-67) и ЭПО (Arcasoy, см. выше), также совместно участвуют в реакции при заживлении раны.
Направленное нарушение активности фермента пролилгидроксилазы (PHD) с помощью малых молекул может найти применение для лечения расстройств восприятия и распределения кислорода. Примеры последних включают, помимо прочего, следующее: анемия; менискоцитарная анемия; болезнь периферических сосудов; ишемическая болезнь сердца; сердечная недостаточность; защита тканей от ишемии в таких условиях, как ишемия миокарда, инфаркт миокарда и инсульт; консервация органов для трансплантации; лечение ишемии тканей посредством регулирования и (или) восстановления тока крови, доставки кислорода и (или) использования энергии; ускорение процесса заживления ран, в частности, у пожилых пациентов и пациентов, страдающих диабетом; лечение ожогов; лечение инфекционных заболеваний; срастание переломов и рост костей. Кроме того, предполагается, что направленное нарушение активности PHD может найти применение для лечения таких нарушений обмена веществ, как диабет, ожирение, неспецифический язвенный колит, воспалительное заболевание кишечника и родственных заболеваний, таких как болезнь Крона (Recent Patents on Inflammation & Allergy Drug Discovery, 2009, 3, 1-16).
Показано, что HIF является основным транскрипционным фактором, который приводит к повышению продуцирования эритропоэтина в условиях гипоксии (Wang et al., 1993, см. выше). Несмотря на то, что применение рекомбинантного человеческого эритропоэтина показало себя эффективным при лечении анемии, можно ожидать, что ингибирование PHD малыми молекулами будет иметь некоторые преимущества в сравнении с лечением эритропоэтином. В частности, функционирование других продуктов гена HIF необходимо для гемопоэза, а регулирование этих факторов повышает эффективность гемопоэза. Примеры продуктов, критически важных для гемопоэза целевого гена HIF, включают: трансферрин (Rolfs et al., 1997, J Biol Chem., 272(32):20055-62), трансферриновый рецептор (Lok et al., 1999, J Biol Chem., 274(34):24147-52; Tacchini et al., 1999, J Biol Chem., 274(34):24142-46) и церулоплазмин (Mukhopadhyay et al., 2000, J Biol Chem., 275(28):21048-54). Экспрессия гепсидина также подавляется HIF (Peyssonnaux et al., 2007, J Clin Invest., 117(7):1926-32), а ингибирующие PHD малые молекулы, как было показано, уменьшают выработку гепсидина (Braliou et al., 2008, J Hepatol., 48:801-10). Гепсидин является отрицательным фактором регулирования доступности железа, необходимого для гемопоэза, поэтому ожидается, что уменьшение выработки гепсидина будет благотворно сказываться на лечении анемии. Ингибирование PHD также может быть полезным в сочетании с другими терапиями анемии, включая введение железа и (или) экзогенного эритропоэтина. Исследования естественных мутаций гена PHD2 у человеческого населения дают еще одно основание для использования ингибиторов PHD при лечении анемии. В двух недавних работах было показано, что у пациентов с дисфункциональными мутациями в гене PHD2 наблюдается повышенный эритроцитоз и повышенный уровень гемоглобина в крови (Percy et al., 2007, PNAS, 103(3):654-59; Al-Sheikh et al., 2008, Blood Cells Mol Dis., 40:160-65). Кроме того, низкомолекулярный ингибитор PHD был испытан на здоровых добровольцах и на пациентах с хроническими заболеваниями почек (Заявка на патент США US2006/0276477, 07 декабря 2006 г.). У пациентов с хроническими заболеваниями почек содержание эритропоэтина в плазме увеличивалось в зависимости от дозы и повышалось содержание гемоглобина в крови.
Ишемия представляет опасность для метаболической адаптации и защиты тканей. Ингибиторы PHD повышают экспрессию генов, что приводит к изменениям в процессе обмена веществ, благотворным в условиях ишемии (Semenza, 2007, Biochem J., 405:1-9). Многие из генов, кодирующих участвующие в анаэробном гликолизе ферменты, регулируются HIF, и ингибирование PHD увеличивает гликолиз (Shaw, см. выше). Известные целевые гены HIF в этом пути метаболизма включают, помимо прочего, следующие: GLUT-1 (Ebert et al., см. выше), гексокиназу, фосфоглицераткиназу 1, лактатдегидрогеназу (Firth et al., см. выше), киназу пируватдегидрогеназы 1 (Kim et al., см. выше; Papandreou et al., см. выше). Киназа пируватдегидрогеназы 1 подавляет вхождение пируватов в цикл Кребса. HIF выступает в роли посредника в переключении экспрессии цитохромов, участвующих в процессе переноса электрона в митохондриях (Fukuda et al., 2007, Cell, 129(1):111-22). Это изменение состава цитохромов оптимизирует эффективность выработки АТФ в условиях гипоксии и снижает производство таких вредных побочных продуктов окислительного фосфорилирования, как перекись водорода и пероксид-анион. При продолжительном воздействии гипоксии HIF стимулирует аутофагию митохондрий, в результате чего их количество уменьшается (Zhang H et al., 2008, J Biol Chem. 283: 10892-10903). Эта адаптация к хронической гипоксии снижает производство перекиси водорода и пероксид-аниона, когда клетка в основном использует гликолиз для производства энергии. Еще одна адаптивная реакция, вызванная повышением экспрессии HIF, заключается в активации факторов выживаемости клеток. К этим факторам относятся следующие: инсулиноподобный фактор роста (IGF) 2, IGF-связывающие белки 2 и 3 (Feldser et al., 1999, Cancer Res.59:3915-18). Общее накопление HIF в условиях гипоксии управляет адаптивной активацией гликолиза, снижением окислительного фосфорилирования, что приводит к уменьшению производства перекиси водорода и супероксида, и оптимизацией окислительного фосфорилирования, защищая клетки от ишемического повреждения. Поэтому предполагается, что ингибиторы PHD могут найти применение для консервации органов и тканей для трансплантации (Bernhardt et al., 2007, Methods Enzymol., 435:221-45). Хотя положительный эффект может быть получен путем введения ингибиторов PHD до забора органов для трансплантации, введение ингибитора непосредственно в орган/ткань после забора, при хранении (например, кардиоплегический раствор) или после трансплантации, также может иметь терапевтический эффект.
Предполагается, что ингибиторы PHD окажутся эффективны для защиты тканей от локальной ишемии и (или) гипоксии, в том числе от ишемии/гипоксии, связанных, среди прочего, со следующим: ангина, ишемия миокарда, инсульт, ишемия скелетной мышцы. Существует целый ряд экспериментальных доказательств того, что ингибирование PHD и последующее повышение экспрессии HIF является возможным способом консервации ишемической ткани. Недавно было показано, что ишемическое прекондиционирование является HIF-зависимым явлением (Cai et al., 2008, Cardiovasc Res., 77(3):463-70). Ишемическое прекондиционирование - это известное явление, в соответствии с которым короткие периоды гипоксии и (или) ишемии защищают ткань от последующих более продолжительных периодов ишемии (Murry et al., 1986, Circulation, 1986 74(5):1124-36; Das et al., 2008, IUBMB Life, 60(4):199-203). Известно, что ишемическое прекондиционирование наблюдается у людей, а также у экспериментальных животных (Darling et al., 2007, Basic Res Cardiol., 102(3):274-8; Kojima I et al., 2007, J Am Soc Nephrol., 18:1218-26). Несмотря на то, что концепция прекондиционирования более всего известна благодаря своим защитным воздействиям на сердце, она также применима и к другим тканям, включая, помимо прочего, следующие: печень, скелетные мышцы, легкие, почки, кишечник и мозг (Pasupathy et al., 2005, Eur J Vasc Endovasc Surg., 29:106-15; Mallick et al., 2004, Dig Dis Sci., 49(9):1359-77). Экспериментальное подтверждение защитного действия на ткани ингибирования PHD и повышения HIF получено на ряде животных моделей, включая: нокаутирование зародышевой линии PHD1, что обеспечило защиту скелетной мышцы от ишемического инсульта (Aragones et al., 2008, Nat Genet., 40(2):170-80), выключение PHD2 путем применения миРНК, что обеспечило защиту сердца от ишемического инсульта (Natarajan et al., 2006, Circ Res., 98(1):133-40), ингибирование PHD путем введения моноксида углерода, что обеспечило защиту миокарда от ишемического поражения (Chin et al., 2007, Proc Natl Acad Sci. U.S.A., 104(12):5109-14), гипоксию в мозге, которая повышала переносимость ишемии (Bernaudin et al., 2002, J Cereb Blood Flow Metab., 22(4):393-403). Кроме того, низкомолекулярные ингибиторы PHD обеспечивают защиту мозга в экспериментальных моделях инсульта (Siddiq et al., 2005, J Biol Chem., 280(50):41732-43). Более того, было показано, что активация HIF защищает сердце мышей, страдающих диабетом, где результаты обычно хуже (Natarajan et al., 2008, J Cardiovasc Pharmacol., 51(2):178-187). Эффекты защиты тканей можно также наблюдать при облитерирующем тромбангиите (болезнь Бюргера), симметричной гангрене (болезнь Рейно) и акроцианозе.
Снижение зависимости от аэробного метаболизма цикла Кребса в митохондрии и повышение роли анаэробного гликолиза, вызванное ингибированием PHD, может оказывать благоприятное влияние на ткани с нормальным снабжением кислородом. Важно отметить, что ингибирование PHD, как было показано, повышает экспрессию HIF в условиях нормального снабжения кислородом. Таким образом, ингибирование PHD вызывает псевдогипоксию, обусловленную инициированным HIF гипоксическим откликом, но при этом насыщение тканей кислородом остается нормальным. Можно также ожидать, что вызванная ингибированием PHD перестройка метаболизма позволит реализовать способ лечения диабета, ожирения и связанных с ними расстройств, включая сопутствующие заболевания.
В целом, совокупность вызванных ингибированием PHD изменений экспрессии генов снижает количество энергии, производимой на единицу глюкозы, и будет стимулировать организм на сжигание большего количества жира для поддержания энергетического баланса. Механизмы интенсификации гликолиза рассматриваются выше. Другие исследования связывают гипоксический отклик с теми эффектами, которые могут оказаться полезными при лечении диабета и ожирения. Так, хорошо известно, что тренировки в условиях высокогорья снижают количество жира в организме (Armellini et al., 1997, Horm Metab Res., 29(9):458-61). Показано, что гипоксия и имитирующие гипоксию вещества, такие как десферриоксамин, предотвращают дифференцирование в адипоциты (Lin et al., 2006, J Biol Chem., 281(41):30678-83; Carriere et al., 2004, J Biol Chem., 279(39):40462-69). Этот эффект является обратимым по возвращении к нормальным условиям снабжения кислородом. Ингибирование активности PHD на начальных стадиях липогенеза подавляет образование новых адипоцитов (Floyd et al., 2007, J Cell Biochem., 101:1545-57). Гипоксия, хлорид кобальта и десферриоксамин повышают экспрессию HIF и ингибируют транскрипцию ядерных рецепторов гормонов PPAR гамма 2 (Yun et al., 2002, Dev Cell., 2:331-41). Так как PPAR гамма 2 является важным сигналом для дифференцировки в адипоцит, то следует ожидать, что ингибирование PHD будет подавлять дифференцировку в адипоциты. Было показано, что эти эффекты опосредуются регулируемым HIF геном DEC1/Stra13 (Yun et al., см. выше).
Показано, что низкомолекулярные ингибиторы PHD оказывают лечебное воздействие в животных моделях диабета и ожирения (Междунар. заявки на патент WO2004/052284, 24 июня 2004 г.; WO2004/052285, 24 июня 2004 г.). Эффекты, показанные для ингибиторов PHD на мышах с алиментарным ожирением, мышах линии db/db и крысах линии Zucker fa/fa, включали понижение следующего: концентрации глюкозы в крови, массы жира как в абдоминальном, так и в висцеральном скоплении жировой ткани, концентрации гемоглобина A1c, триглицеридов в плазме, массы тела, а также изменения концентраций известных биомаркеров заболевания, такие как повышение уровней адреномедуллина и лептина. Лептин является известным продуктом целевого гена HIF (Grosfeld et al., 2002, J Biol Chem., 277(45):42953-57). Продукты генов, участвующие в метаболизме жировых клеток, как было показано, должны регулироваться ингибированием PHD HIF-зависимым образом (Международная заявка на патент WO2004/052285, см. выше). К таким продуктам относятся: аполипопротеин A-IV, ацил-CoA-тиоэстераза, карнитинацетил-трансфераза и связывающий инсулиноподобный фактор роста белок (IGFBP)-1.
Ожидается, что ингибиторы PHD могут оказаться терапевтически эффективными как стимуляторы васкулогенеза, ангиогенеза и артериогенеза. Эти процессы создают или восстанавливают ток крови к тканям и их насыщение кислородом в условиях ишемии и (или) гипоксии (Semenza et al., 2007, J Cell Biochem., 102:840-47; Semenza, 2007, Exp Physiol., 92(6):988-91). Было показано, что физическая нагрузка повышает экспрессию HIF-1 и сосудистого эндотелиального фактора роста в экспериментальных животных моделях и у людей (Gustafsson et al. 2001, Front Biosci., 6:D75-89) и, соответственно, количество кровеносных сосудов в скелетной мышце. VEGF (фактор роста васкулярного эндотелия) представляет собой хорошо известный продукт целевого гена HIF, являющийся ключевым фактором ангиогенеза (Liu et al., см. выше). Несмотря на то, что введение различных форм активаторов рецептора VEGF является сильнодействующим стимулом ангиогенеза, формирующиеся в результате этого потенциального способа лечения кровеносные сосуды являются неплотными. Считается, что это ограничивает возможность использования VEGF для лечения расстройств доставки кислорода. Повышение экспрессии одного ангиогенного фактора может быть недостаточным для функциональной васкуляризации (Semenza, 2007, см. выше). Потенциальные преимущества ингибирования PHD в сравнении с другими подобными способами ангиогенной терапии состоят в стимулировании контролируемой экспрессии множества ангиогенных факторов роста HIF-зависимым образом, включая, помимо прочего, следующие: плацентарный фактор роста (PLGF), ангиопоэтин-1 (ANGPT1), ангиопоэтин-2 (ANGPT2), бета-фактор роста тромбоцитарный (PDGFB) (Carmeliet, 2004, J Intern Med., 255:538-61; Kelly et al., 2003, Circ Res., 93:1074-81) и фактор роста стромальных клеток-1 (SDF-1) (Ceradini et al., 2004, Nat Med., 10(8):858-64). Экспрессия ангиопоэтина-1 в процессе ангиогенеза приводит к образованию плотных кровеносных сосудов, в отличие от кровеносных сосудов, образующихся при введении только VEGF (Thurston et al., 1999, Science, 286:2511-14; Thurston et al., 2000, Nat Med., 6(4):460-3; Elson et al., 2001, Genes Dev., 15(19):2520-32). Было показано, что фактор роста стромальных клеток 1 (SDF-1) чрезвычайно важен для активации процесса притока предшественников эндотелиальных клеток к местам повреждения ткани. Экспрессия SDF-1 повышает адгезию, миграцию и хоуминг циркулирующих CXCR4-положительных клеток-предшественников к ишемической ткани. Более того, ингибирование SDF-1 в ишемической ткани или блокада CXCR4 на клетках, циркулирующих в периферической крови, предотвращает привлечение клеток-предшественников к местам повреждения (Ceradini et al., 2004, см. выше; Ceradini et al., 2005, Trends Cardiovasc Med., 15(2):57-63). Важно, что у взрослых мышей привлечение предшественников эндотелиальных клеток к местам повреждения снижается, и это может быть компенсировано вмешательствами, которые повышают активность HIF на месте раны (Chang et al., 2007, Circulation, 116(24):2818-29). Ингибирование PHD дает преимущества не только за счет увеличения экспрессии ряда ангиогенных факторов, но также за счет координации их экспрессии в течение всего процесса ангиогенеза и привлечения предшественников эндотелиальных клеток к ишемической ткани.
Свидетельства применимости ингибиторов PHD в проангиогенной терапии представлены в следующих исследованиях. Было показано, что опосредуемая аденовирусом повышенная экспрессия HIF индуцирует ангиогенез в неишемической ткани взрослого животного (Kelly et al., 2003, Circ Res., 93(11):1074-81), свидетельствуя о том, что терапии с повышением экспрессии HIF, например ингибирование PHD, будут вызывать развитие кровеносных сосудов. Было показано, что плацентарный фактор роста (PLGF), который также является целевым геном HIF, играет важную роль в ангиогенезе в ишемической ткани (Carmeliet, 2004, J Intern Med., 255(5):538-61; Luttun et al., 2002, Ann N Y Acad Sci., 979:80-93). Были продемонстрированы действенные проангиогенные эффекты терапии с повышением экспрессии HIF посредством повышения экспрессии HIF в скелетной мышце (Pajusola et al., 2005, FASEB J., 19(10):1365-7; Vincent et al., 2000, Circulation, 102:2255-61) и в миокарде (Shyu et al., 2002, Cardiovasc Res., 54:576-83). Было также показано привлечение предшественников эндотелиальных клеток к ишемическому миокарду продуктом целевого гена HIF SDF-1 (Abbott et al., 2004, Circulation, 110(21):3300-05). Эти результаты подтверждают общую концепцию, что ингибиторы PHD окажутся эффективны для стимулирования ангиогенеза в условиях ишемии тканей, в частности ишемии мышц. Ожидается, что вызванное ингибиторами PHD терапевтическое развитие кровеносных сосудов будет полезно для восстановления тока крови к тканям и, следовательно, для лечения заболеваний, включая, помимо прочего, следующие: стенокардия, ишемия и инфаркт миокарда, периферическая ишемическая болезнь, перемежающаяся хромота, язва желудка и двенадцатиперстной кишки, неспецифический язвенный колит и воспалительное заболевание кишечника.
PHD и HIF играют центральную роль в восстановлении и регенерации тканей, в том числе в заживлении ран и язв. Последние исследования показали повышенную экспрессию всех трех типов PHD на местах ран у взрослых мышей и, как результат, уменьшение аккумулирования HIF (Chang et al., см. выше). Таким образом, повышение экспрессии HIF у взрослых мышей путем назначения десферриоксамина повышает степень залечивания ран до уровня, наблюдаемого у молодых мышей. Аналогично у мышей, страдающих диабетом, повышение экспрессии HIF было подавлено по сравнению с мышами того же помета без диабета (Mace et al., 2007, Wound Repair Regen., 15(5):636-45). Местное применение имитатора гипоксии хлорида кобальта или повышение экспрессии мышиного HIF с отсутствующим кислородзависимым доменом деградации (ODD), который таким образом обеспечивает постоянно активную форму HIF, приводит к повышению активности HIF на месте раны, повышению экспрессии целевых генов HIF, таких как VEGF, Nos2 и Hmox1, и к ускорению заживления раны. Недавно было показано, что благоприятный эффект ингибирования PHD не ограничивается кожей и что низкомолекулярные ингибиторы PHD также дают положительный результат на моделях мышей с колитом (Robinson et al., 2008, Gastroenterology, 134(1):145-55).
Предполагается, что приводящее к аккумулированию HIF ингибирование PHD включает по меньшей мере четыре механизма действия, каждый из которых вносит свой вклад в ускоренное и более полное заживление ран: 1) защита ткани, подверженной опасности гипоксии и (или) ишемии, 2) стимулирование ангиогенеза для создания или восстановления надлежащего тока крови к месту поражения, 3) привлечение предшественников эндотелиальных клеток к местам поражения, 4) стимулирование выработки факторов роста, которые специфически стимулируют заживление и регенерацию.
Рекомбинантный человеческий фактор роста тромбоцитарный (PDGF) поступает в продажу под названием бекаплермин (Regranex™) и одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для «Лечения диабетических невропатических язв нижних конечностей, которые выходят в подкожную основу или далее и снабжаются кровью в достаточной степени». Было показано, что бекаплермин эффективно ускоряет заживление ран у пациентов, страдающих диабетом (Steed, 2006, Plast Reconstr Surg., 117(7 Suppl):143S-149S; Nagai et al., 2002, Expert Opin Biol Ther., 2(2):211-8). Поскольку PDGF является целевым геном HIF (Schultz et al., 2006, Am J Physiol Heart Circ Physiol., 290(6):H2528-34; Yoshida et al., 2006, J Neurooncol., 76(1):13-21), предполагается, что ингибирование PHD повысит экспрессию эндогенного PDGF и будет оказывать аналогичный или более выраженный благоприятный эффект по сравнению с эффектом приема только бекаплермина. Исследования на животных показали, что местное применение PDGF приводит к повышению количества ДНК, белка и гидроксипролина у раны, формированию более толстого слоя грануляционной и эпидермальной ткани, повышенному клеточному вторичному заселению мест повреждения. PDGF вызывает локальный эффект интенсификации образования новой соединительной ткани. Предполагается, что эффективность ингибирования PHD будет выше, чем эффективность ингибирования, вызванная бекаплермином, из-за дополнительного эффекта защиты ткани и проангиогенного эффекта, опосредуемых HIF.
Ожидается, что благоприятное воздействие ингибирования PHD распространится не только на ускорение заживления ран кожи и толстой кишки, но также на заживление других повреждений ткани, включая, помимо прочего, следующее: желудочно-кишечные язвы, реплантации трансплантата, ожоги, хронические язвы и обморожение.
Стволовые клетки и клетки-предшественники обнаружены в гипоксических нишах внутри тела, и гипоксия регулирует их дифференцирование и судьбу клетки (Simon et al., 2008, Nat Rev Mol Cell Biol., 9:285-96). Таким образом, ингибиторы PHD могут найти применение для поддержания стволовых клеток и клеток-предшественников в плюрипотентном состоянии и стимулирования дифференцировки в клетки требуемого типа. Стволовые клетки могут найти применение для культивирования и роста популяций стволовых клеток и могут удерживать клетки в плюрипотентном состоянии, в то время как в клетки вводятся гормоны и другие факторы для коррекции дифференцировки и судьбы клетки.
Дальнейшее использование ингибиторов PHD в области терапии стволовых клеток и клеток-предшественников связано с использованием ингибиторов PHD для кондиционирования этих клеток, с тем чтобы они выдерживали процесс имплантации в организм и чтобы генерировать соответствующую реакцию организма, в результате чего имплантация стволовой клетки и клетки-предшественника станет осуществимой (Hu et al., 2008, J Thorac Cardiovasc Surg., 135(4):799-808). Более конкретно, ингибиторы PHD могут способствовать интеграции стволовых клеток и привлечению соответствующего кровотока для поддержки стволовых клеток после их встраивания. Эти образованные кровеносные сосуды будут также выполнять функцию переноса гормонов и других высвобожденных этими клетками факторов в остальной организм.
Ингибиторы PHD также могут найти применение при лечении инфекции (Peyssonnaux et al., 2005, J Invest Dermatol., 115(7):1806-15; Peyssonnaux et al., 2008 J Invest Dermatol., август 2008 г.; 128(8):1964-8). Было показано, что повышение экспрессии HIF усиливает врожденную иммунную реакцию на инфекцию в фагоцитах и кератиноцитах. Фагоциты с увеличенным уровнем HIF демонстрируют повышенную бактерицидную активность, повышенную выработку оксида азота и повышенную экспрессию антибактериального пептида кателицидина. Эти эффекты могут быть также полезны для лечения ожоговых инфекций.
Было также показано, что HIF участвует в процессе роста кости и срастания перелома (Pfander D et al., 2003 J Cell Sci., 116(Pt 9):1819-26., Wang et al., 2007 J Clin Invest., 17(6):1616-26.) и, следовательно, может использоваться для лечения или профилактики переломов. HIF стимулирует гликолиз, обеспечивающий энергией синтез внеклеточного матрикса эпифизарных хондроцитов в условиях гипоксии. HIF также играет важную роль в стимуляции выделения VEGF и развитии кровеносных сосудов в процессе срастания перелома. Рост кровеносных сосудов в растущую или срастающуюся кость может быть фактором, ограничивающим скорость процесса восстановления кости.
В литературе описаны некоторые малые молекулы c антагонистической активностью в отношении пролилгидроксилазы. К таким молекулам относятся, помимо прочих, некоторые производные имидазо[1,2-a]пиридина (Warshakoon et al., 2006, Bioorg Med Chem Lett., 16(21):5598-601), замещенные производные пиридина (Warshakoon et al., 2006, Bioorg Med Chem Lett., 16(21):5616-20), некоторые пиразолпиридины (Warshakoon et al., 2006, Bioorg Med Chem Lett., 16(21):5687-90), некоторые бициклические гетероароматические N-замещенные производные глицина (Международная заявка на патент WO2007/103905, 13 сентября 2007 г.), соединения на основе хинолина (Международная заявка на патент WO2007/070359, 21 июня 2007 г.), некоторые барбитурат-N-замещенные производные глицина (Международная заявка на патент WO2007/150011, 27 декабря 2007 г.), замещенные арил- или гетероариламидные соединения (Заявка на патент США US 2007/0299086, 27 декабря 2007 г.) и замещенные 4-гидроксипиримидин-5-карбоксамиды (Международная заявка на патент WO2009/117269, 24 сентября 2009 г.).
Тем не менее, сохраняется необходимость в эффективных модуляторах пролилгидроксилазы с требуемыми фармацевтическими свойствами. Было обнаружено, что в контексте настоящего изобретения некоторые производные хиназолинона обладают модулирующей пролилгидроксилазу активностью.
Краткое описание изобретения
Настоящее изобретение относится к соединениям, которые могут быть использованы в качестве ингибиторов PHD. Соединения, составляющие предмет настоящего изобретения, имеют общую формулу (I),
где:
n=от 0 до 3,
R1 представляет собой заместитель, независимо выбираемый из группы, состоящей из галогена, -C1-4алкила, -C1-4алкинила, -C1-4алкенила, необязательно замещенного галогеном, -CF3, -OCF3, -SCF3, S(O)CF3, -C(O)-Rc, -C(O)N-Rc, -OH, -NO2, -CN, -OC1-4алкила, -SC1-4алкила, -S(O)-C1-4алкила, -SO2-C1-4алкила, -S-Rc, -S(O)-Rc, -SO2-Rc, -SO2N-Rc, -O-Rc, -NRaRb, 2,3-дигидробензо[1,4]диоксина, бенз[1,3]диоксола, 1H-индола, бензила, бифенила, необязательно замещенного одним или более Rd, бензилокси, необязательно замещенного одним или более Rd, фенила или моноциклического гетероарила, необязательно замещенного одним или более Rd, -C3-8циклоалкила, необязательно замещенного одним или более Rd, -C3-8гетероциклоалкила, необязательно замещенного одним или более Rc, причем две смежные группы R1 могут быть соединены в виде необязательно замещенного 3-8-членного цикла, необязательно замещенного одним или более O, S или N;
Ra и Rb независимо выбраны из группы, состоящей из H, C1-4алкила, -C(O)C1-4алкила, -C(O)-Rc, -C(O)NH-Rc, -SO2-Rc, -SO2-C1-4алкила, фенила, необязательно замещенного Rd, бензила, необязательно замещенного Rd, или моноциклического ароматического гетероцикла, необязательно замещенного Rd; или Ra и Rb вместе с несущим их атомом азота образуют необязательно замещенный моноциклический гетероциклоалкил, содержащий один или более O, S или N;
Rc представляет собой заместитель, независимо выбранный из группы, состоящей из -C3-8циклоалкила, -C3-8гетероциклоалкила, бифенила, фенила, необязательно замещенного одним или более Rd, бензила, необязательно замещенного одним или более Rd, нафтила, инданила, 5,6,7,8-тетрагидронафтила и пиридила, необязательно замещенного одним или более Rd;
Rd представляет собой заместитель, независимо выбранный из группы, состоящей из -H, галогена, -OH, -C1-4алкила, -SO2-C1-4алкила, -CN или -CF3, -OCF3, -OC1-4алкила, -C(O)NH2, -O-фенила и -O-бензила;
и их фармацевтически приемлемые соли.
Настоящее изобретение также включает изомерные формы соединений формулы (I) и их фармацевтически приемлемые соли, и ссылка в настоящей заявке на одну из таких изомерных форм означает ссылку на по крайней мере одну из таких изомерных форм. Специалист в данной области определит, что соединения в соответствии с данным изобретением могут существовать, например, в единственной изомерной форме, в то время как другие соединения могут существовать в форме региоизомерной смеси.
Настоящее изобретение также относится к фармацевтически приемлемым солям, фармацевтически приемлемым пролекарствам и фармацевтически активным метаболитам соединений формулы (I). В некоторых предпочтительных вариантах осуществления соединение формулы (I) представляет собой соединение, выбираемое из описанных или проиллюстрированных в приведенном ниже подробном описании.
В следующем общем аспекте настоящее изобретение относится к фармацевтическим композициям, каждая из которых включает: (a) эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого пролекарства или фармацевтически активного метаболита; и (b) фармацевтически приемлемый наполнитель.
В другом общем аспекте изобретение направлено на способ лечения пациента с имеющимся или диагностированным заболеванием, расстройством, или медицинским состоянием, опосредуемым активностью фермента пролилгидроксилазы, заключающийся во введении нуждающемуся в таком лечении пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого пролекарства или фармацевтически активного метаболита.
В некоторых предпочтительных вариантах осуществлениях способа, составляющего предмет настоящего изобретения, упомянутое заболевание, расстройство или медицинское состояние выбрано из: анемии, сосудистых заболеваний, нарушений обмена веществ и заживления раны.
Дополнительные варианты осуществления, особенности и достоинства изобретения станут понятны из следующего ниже подробного описания изобретения и при его практическом применении.
Подробное описание
Настоящее изобретение может быть более полно оценено из нижеследующего описания, включающего глоссарий терминов и заключительные примеры. Для краткости содержимое всех цитируемых в настоящей заявке публикаций, включая патенты, включено в настоящее описание посредством ссылки.
Термины «включающий», «содержащий», «состоящий» используются в настоящем документе в их открытом, неограниченном значении.
Используемый в настоящей заявке термин «алкил» относится к алкильной группе с линейной или разветвленной цепью, содержащей от 1 до 12 атомов углерода. Примеры алкильных групп включают метил (Me, который также может быть структурно обозначен символом «/»), этил (Et), н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил (tBu), пентил, изопентил, трет-пентил, гексил, изогексил и группы, которые в свете общепринятых знаний и изложенных в настоящей заявке представлений могут считаться эквивалентными одному из вышеприведенных примеров.
Используемый в настоящей заявке термин «алкенил» относится к алкенильной группе с линейной или разветвленной цепью, содержащей от 2 до 12 атомов углерода. (Двойная связь алкенильной группы образована между двумя sp2-гибридизированными атомами углерода.) Типичные примеры алкенильных групп включают проп-2-енил, бут-2-енил, бут-3-енил, 2-метилпроп-2-енил, гекс-2-енил и другие аналогичные группы.
Используемый в настоящей заявке термин «алкинил» относится к алкинильной группе с линейной или разветвленной цепью, содержащей от 2 до 12 атомов углерода. (Тройная связь алкинильной группы образована между двумя sp-гибридизированными атомами углерода.) Типичные примеры алкинильных групп включают проп-2-инил, бут-2-инил, бут-3-инил, 2-метилпроп-2-инил, гекс-2-инил и другие аналогичные группы.
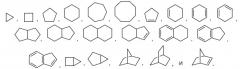
Используемый в настоящей заявке термин «циклоалкил» означает насыщенный или частично насыщенный моноциклический, конденсированный полициклический или спиро-полициклический карбоцикл, содержащий от 3 до 12 кольцевых атомов на карбоцикл. Типичные примеры циклоалкильных групп включают следующие группы в форме соответствующим образом связанных фрагментов:
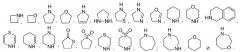
Используемый в настоящей заявке термин «гетероциклоалкил» относится к моноциклической кольцевой структуре, которая является насыщенной или частично насыщенной, или моноциклу конденсированной полициклической системы; гетероциклоалкил содержит в цикле от 3 до 8 атомов, представленных атомами углерода и не более чем двумя гетероатомами, такими как азот, кислород и сера. Кольцевая структура может также дополнительно содержать до двух оксогрупп, присоединенных к атомам серы кольца. Типичные примеры гетероциклоалкильных групп включают следующие группы в форме соответствующим образом связанных фрагментов:
Используемый в