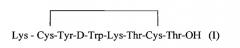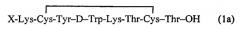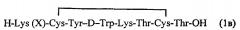Циклический октапептид, радиофармацевтическое средство на его основе и способ применения радиофармацевтического средства для получения лекарственных (фармацевтических) средств для лечения новообразований, экспрессирующих соматостатиновые рецепторы
Иллюстрации
Показать всеИзобретение относится к радиофармацевтическому средству формулы (Iа) или (Iв), представляющему собой комплекс циклического октапептида, содержащего хелатирующую группу, с радионуклидами 111In, 90Y, 177Lu. Радиофармацевтическое средство может быть использовано для получения лекарственных средств для радионуклидной терапии новообразований, экспрессирующих соматостатиновые рецепторы. 2 н.п. ф-лы, 1 ил., 2 табл., 6 пр.
Х= хелатирующий агент.
Реферат
Область техники
Изобретение относится к химико-фармацевтической промышленности и касается фармацевтических, радиофармацевтических (далее - РФП) препаратов, на основе пептидных носителей с адресной доставкой.
Настоящее изобретение относится к пептидным соединениям, а конкретно, к синтетическому октапептиду, регулирующему различные биологические процессы и используемые для получения различных лекарственных средств, радиофармацевтических препаратов для диагностики и лечения.
Пептиды - это семейство веществ, молекулы которых построены из остатков α-аминокислот, соединенных в цепь пептидными (амидными) связями.
Пептиды - это природные или синтетические соединения, содержащие десятки, сотни или тысячи мономерных звеньев - аминокислот. Полипептиды состоят из сотен аминокислот, олигопептиды состоят из небольшого числа аминокислот (не более 10-50), а простые пептиды содержат до 10 аминокислот.
Пептиды постоянно синтезируются во всех живых организмах для регулирования физиологических процессов. Свойства пептидов зависят, главным образом, от их первичной структуры - последовательности аминокислот, а также от строения молекулы и ее конфигурации в пространстве (вторичная структура).
Образование пептидов в организме происходит в течение нескольких минут, химический же синтез в условиях лаборатории - достаточно длительный процесс, который может занимать несколько дней, а разработка технологии синтеза - несколько лет. Однако, несмотря на это, существуют довольно весомые аргументы в пользу проведения работ по синтезу аналогов природных пептидов.
Во-первых, путем химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых, синтетические пептиды позволяют подробнее изучить связь между структурой аминокислотной последовательности и ее активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить ее направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих, благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов позволяет выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвертых, химический синтез пептидов экономически выгоден. Большинство терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
Зачастую активные пептиды в природе обнаруживаются лишь в нанограммовых количествах. Плюс к этому, методы очистки и выделения пептидов из природных источников не могут полностью разделить искомую аминокислотную последовательность с пептидами противоположного или же иного действия. А в случае специфических пептидов, синтезируемых организмом человека, получить их возможно лишь путем синтеза в лабораторных условиях.
Известен биологически активный октапептид Ангиотензин II, образующийся из крупного белка плазмы крови ангиотензиногена в результате действия двух протеолитических ферментов.
Первый протеолитический фермент ренин отщепляет от ангиотензиногена с N-конца пептид, содержащий 10 аминокислот, называемый ангиотензином I. Второй протеолитический фермент карбоксидипептидилпептидаза отщепляет от С-конца ангиотензина I 2 аминокислоты, в результате чего образуется биологически активный ангиотензин II, участвующий в регуляции АД и водно-солевого обмена в организме.
Октапептид Ангиотензин II имеет следующую аминокислотную последовательность:
Asp-Arg-Val-Tyr-Не-His-Pro-PHe
Функции пептидов зависят от их структуры. Ангиотензин I по структуре очень похож на ангиотензин II (имеет только две дополнительные аминокислоты с С-конца), но при этом не обладает биологической активностью.
Из уровня техники известен также другой октапептид - октреотид (циклический пептид), используемый в фармацевтической химии.
Октреотид является синтетическим аналогом соматостатина, который обладает сходным профилем фармакологической активности, но значительно превосходит природный пептид по силе и длительности действия. Подобно соматостатину он ингибирует секрецию соматотропин-рилизинг гормона в гипоталамусе и секрецию соматотропного и тиреотропного гормонов в передней доле гипофиза, а также подавляет секрецию различных гормонально активных пептидов (инсулина, глюкагона, гастрина, холецистокинина, вазоактивного интерстинального пептида, инсулиноподобного фактора роста - 1) и серотонина, продуцируемых органами желудочно-кишечного тракта (желудок, кишечник, печень и поджелудочная железа).
Октреотид применяется как лекарственное средство для лечения акромегалии, опухолей гастропанкреатической эндокринной системы, а также используется как действенное средство профилактики осложнений в панкреатической хирургии.
Октреотид представляет собой циклический октапептид следующей структуры:
Особенностями его структуры являются:
- наличие двух D-аминокислот;
- наличие дисульфидного цикла;
- восстановленный С-концевой остаток треонина (треонинол);
- высокое содержание гидрофобных ароматических аминокислот.
Существенным с точки зрения химического синтеза является также наличие неустойчивого к действию окислителей и сильных кислот остатка триптофана. Синтез октреотида может быть осуществлен как твердофазным методом, так и классическими методами пептидного синтеза в растворе.
Основные проблемы синтеза октреотида твердофазным методом связаны с наличием в его молекуле С-концевого остатка треонинола. Треонинол не содержит карбоксильной группы, что не дает возможности использовать традиционные методы присоединения первой (С-концевой) аминокислоты к полимерной матрице. В работе W.B. Edwards et al. (J. Med. Chem. 1994, 373749) синтез осуществляли, начиная с предпоследнего остатка Cys(Acm), присоединенного к полимеру сложноэфирной связью. После сборки пептид окисляли до дисульфида на полимере, затем получали защищенный [D-Trp(Boc)4, Lys(Boc)5, Thr(Bu1)6] - октреотид путем аминолиза пептидил-полимера избытком треонинола. Аминолиз протекал очень медленно, и общий выход защищенного пептида составил 14%.
Раскрытие изобретения
Задачей заявленного изобретения является получение другого октапептида, являющегося аналогом соматостатина, для получения новых радиофармацевтических препаратов с улучшенными свойствами, обеспечивающими терапию новообразований, экспрессирующих соматостатиновые рецепторы.
Таким образом, заявленное изобретение описывает группу изобретений, в которую входит новый октапептид, являющийся производным октреотида, радиофармацевтическое средство (РФП) на его основе и способ применения радиофармацевтического средства для получения лекарственных (фармацевтических) средств для радионуклидной терапии новообразований, экспрессирующих соматостатиновые рецепторы.
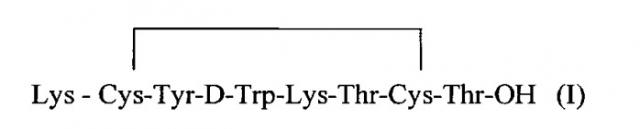
Одним из изобретений заявленной группы является октапептид общей формулы (I)
Представленный в изобретении циклический октапептид отличается от известных пептидных аналогов октреотида общей формулы D-PHe1-Tyr3 (октреотид) тем, что в нем D-PHe1 заменен на Lys1.
Циклический октапептид формулы 1 содержит концевую аминокислоту лизин (Lys), способную ковалентно присоединять хелатирующую группу и имеющий следующую структуру (Ia) и (Ib)
Х= хелатирующий агент
Таким образом, заявленный циклический октапептид имеет структуру, содержащую вышеуказанную последовательность из аминокислот, содержит N-концевую аминокислоту лизин (Lys), способную ковалентно присоединять хелатирующую группу, например, DOTA, и предназначен для получения радиофармацевтических препаратов с радионуклидами 111In, 90Y, 177Lu.
Изобретение также касается радиофармацевтического средства в виде комплекса соединения формулы (I) с радионуклидами 111In, 90Y, 177Lu. Это позволяет использовать РФП в качестве терапевтического радиофармацевтического средства для радионуклидной терапии новообразований, экспрессирующих соматостатиновые рецепторы.
При этом при получении радиофармпрепарата по изобретению в виде комплекса октапептида формулы (I) с радионуклидами 111In, 90Y, 177Lu используют различные хелатирующие агенты. В качестве хелаторов используют известные в данной области техники хелатирующие агенты.
В данной области техники, относящейся к получению радиофармацевтических и радиодиагностических препаратов на основе пептидных носителей с адресной доставкой, в качестве хелатирующих агентов могут быть использованы ДОТА (1,4,7,10-тетраазациклододекантетрауксусной кислоты), а также и другие известные в этой области хелатирующие агенты, такие как, например, полиаминополикислотные хелатирующие агенты NOTA, Охо, РСТА и другие, известные и широко применяемые для радиофармпрепаратов (см. например, RU 233557, RU 2010146497, RU 2006105644, US 4647447, US 5362475, EP 230893, WO 95/24225 и др.), а также статьи:
- Bioconjug Chem. 2011 Aug 17; 22(8): 1650-62. Epub 2011 Jul 26. Multivalent biflinctional chelator scaffolds for gallium-68 based positron emission tomograpHy imaging probe design: signal amplification via multivalency;
- Bioconjug Chem. 2010 {Fpub ahead of print};
- Evaluation of Bifunctional Chelates for the Development of Gallium - Based RadiopHarmaceuticals и др.
К ним, в частности, относятся полиаминополикислотные, бифункциональные хелатирующие группы: производные тетраацетоуксусной кислоты (приведены в латинице):
- HOTA (1,4,7-триазациклононан-1,4,7-триуксусной кислоты);
- Оксо-(1-окса-4,7,10-триазациклододекан-4,7,10-триуксусной кислоты);
- РСТА (3,6,9,15-тетраазабицикло{9.3.1}пентадека-1(15), 11,13-триен-3,6,9-триуксусной кислоты);
- Упомянутый ранее (ДОТА) 1,4,7,10-тетраазациклододекан-1,4,7-триацетат.
Итак, поставленная задача достигается новым октапептидом, имеющим структуру (I), как производного октреотида, обладающего биологической активностью и представляющего интерес при создании фармацевтических средств, используемых при диагностике и лечении, в том числе и для создания с его использованием различных радиофармацевтических средств в виде комплексов их с различными радионуклидами.
Предлагаемое изобретение иллюстрируются соответствующими примерами, не ограничивающими его.
Синтез октапептидов общей формулы I:
Список использованных сокращений:
DMF - диметилформамид
DIPEA - N, N -диизопропилэтиламин
НОВТ - N-гидроксибензотиазол
TBTU - тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония
TFA - трифторуксусная кислота
Fmoc - флуоренилоксикарбонил
DCC - дициклогексилкарбодиимид
Trt - тритил
Вое - третбутилоксикарбонил
But - третбутил
Р - полимер
В синтезе использованы защищенные производные фирмы Bachem (Швейцария). Синтез аналогов октапептидов формулы (I) проводили твердофазным методом.
Пример 1. Синтез пептида, имеющего следующую аминокислотную последовательность и отвечающего общей формуле октапептида формулы (I):
Синтез пептидил-полимера - предшественника октапептидов с комплексообразующей группой DOTA проводят твердофазным способом, исходя из 6.0 г Fmoc-Thr(But)-полимера Ванга фирмы Bachem с содержанием стартовой аминокислоты 0.61 ммоль/г. Реакции конденсации проводили дициклогексилкарбодиимидным методом в присутствии N-гидрокси-бензотриазола (DCC/HOBT) в DMF, с использованием двукратных избытков производных: Fmoc-Cys(Trt)-OH, Fmoc-Thr(But)-OH, Fmoc-Lys(Boc)-OH, Fmoc-D-Trp-OH, Fmoc-Tyr(But)-OH. Для деблокирования аминогруппы использовали 20% пиперидин в диметилформамиде. Все операции проводили в соответствии со следующим протоколом (таблица 1):
| Таблица 1 | |||
| Протокол синтеза | |||
| Количество обработок (раз) | Время данной обработки (мин) | ||
| № | Операция | ||
| 1 | Активация 0.0074 моль Fmoc аминокислоты в присутствии 0.0074 моль DCC и 0.0074 моль НОВТ в 30 мл DMF | 1 | 20 |
| 2 | Промывка пептидил-полимера 50 мл DMF перед деблокированием | 3 | 1 |
| 3 | Деблокирование 30 мл 20% пиперидина в | 1 | 5 |
| DMF | 1 | 15 | |
| 4 | Промывки 50 мл DMF | 5 | 1 |
| 5 | Конденсация | 1 | 120 |
| 6 | Промывки 50 мл DMF | 3 | 1 |
По окончании синтеза пептидил-полимер отфильтровывали, промывали DMF (3×80 мл), дихлорметаном (5×80 мл), сушили на воздухе. При наращивании пептидной цепи на последней стадии по протоколу, приведенному в таблице 1, с использованием на последней стадии синтеза Fmoc-Lys(Boc)-OH. 1.0 г (0.5 ммоль) защищенного октапептидил-полимера деблокировали 10 мл 20% пиперидина DMF и промывали DMF, как описано в пп.3 и 4 таблицы №1. Пептидил-полимер суспензировали в 30 мл DMF, добавляли 0.47 г (1.0 ммоль) соответствующего производного лизина, 0.15 г (1.0 ммоль) НОВТ, 0.32 г (1.0 ммоль) TBTU и 0.5 мл DIPEA. Реакционную смесь перемешивали 2 часа при комнатной температуре, растворитель удаляли фильтрованием, Fmoc-пептидил-полимер промывали, деблокировали и опять промывали в соответствии с пп.3 и 4 таблицы №1.
Пример 2. Синтез отвечающего общей формуле октапептида формулы (I)
Присоединяли DОТА(But)3OH с использованием тех же реагентов, что и в случае производных лизина. Пептидил-полимер отфильтровывали, промывали DMF (3×30 мл), дихлорметаном (5×30 мл), сушили на воздухе. 1.1 г пептидил-полимера суспендировали в 10.0 мл смеси TFA-тиоанизол-три-изобутилсилан-этандитиол-вода (8.5:0.5:0.5:0.25:0.25), перемешивали 4 часа при комнатной температуре. Смолу отфильтровывали, промывали TFA (2 раза по 0.5 мл). Прибавляли к фильтрату 50 мл диэтилового эфира, выпавший осадок отфильтровывали, промывали на фильтре эфиром (5×15 мл), этилацетатом (2×15 мл). Сырой продукт растворяли в 0.5 л воды, добавляли водный раствор аммиака до pH 9, оставляли на ночь при слабом перемешивании при комнатной температуре. К реакционной смеси добавляли 1 мл 5% раствора Н2О2, перемешивали 15 мин. Полноту образования дисульфидной связи проверяли при помощи реактива Элмана. Реакционную смесь упаривали, предварительно добавив 1 мл уксусной кислоты (pH 4-5). Продукт вычищали методом ВЭЖХ на Диасорбе-130 (25×250 мм), элюция в градиенте от 0 до 20% за 10 мин и от 20% до 60% за 40 мин буфера Б в буфере А (А - 0.1% TFA и Б - 80% ацетонитрил в А), скорость потока 12 мл/мин, детекция - при 226 нм. Фракции, соответствующие целевому веществу, объединяли и лиофилизировали. Выход соединения I - 0.108 г, что соответствует 15% в расчете на стартовую аминокислоту, m/z 1416.7 (вычислено 1416.0), Rt=13.32 мин (аналитическая ВЭЖХ на хроматографе Gilson, Франция, колонка Gromasil С 18, 4.6×250 мм, градиент концентрации буфера Б в буфере А от 20% до 80% за 30 мин, где А - 0.1% TFA и Б - 80% ацетонитрила в А, скорость потока 1 мл/мин).
Пример 3. Синтез отвечающего общей формуле октапептида формулы (I).
Соединение Ia получали аналогично I с тем отличием, что на последней стадии твердофазного синтеза использовали Вос-Lys(Fmoc)-OH. Выход (16) - 0.099 г, что соответствует 13% в расчете на стартовую аминокислоту, m/z 1416.7 (вычислено 1416.0), Rt=13.37 мин в условиях, алогичных для соединения (I).
Ниже представлен пример получения радиофармацевтического средства в виде комплекса соединений формулы (Ia) и (Ib) с радионуклидами 111In, 90Y, 177Lu, на примере с радионуклидом 177Lu.
Нижеследующие примеры 4-6 иллюстрируют получение радиофармацевтического средства (препарата) по изобретению и его свойства.
Пример 4. Получение РФП на основе DOTA-конъюгированных пептидов (Ia) и (Ib), меченных радионуклидами 111In, 90Y, 177Lu, на примере 177Lu.
Данная методика описывает проведение реакции мечения радионуклидом 177Lu DOTA-конъюгированных пептидов - аналогов октреотида (I) и (Ia), полученных в примерах 2 и 3.
Исходный пептид (в виде сухого вещества) растворяют в деионизованной воде (18 МОм), в концентрации 1 мг/мл. Полученный раствор пептида автоматическим дозатором фасуют по 50 мкл в полипропиленовые пробирки типа Eppendorf Safe-Lock Tubes (1,5 мл).
Расфасованный раствор пептида хранят в морозильной камере при температуре не выше - 18°С. Перед проведением реакции мечения раствор пептида размораживают при комнатной температуре в течение 1-2 минут. К размороженному пептиду в ту же пробирку дозатором добавляют ацетатный буфер 0,4 М (так чтобы кислотность (pH) реакционной среды составляла 4,0-5,0) и переносят за свинцовую защиту, где в пробирку добавляют раствор 177Lu (в 0,05 N HCl) с активностью 5-100 мКи. Реакционную смесь инкубируют при температуре 80°С в течение 20 минут. По истечении 20 мин реакция мечения считается завершенной.
Пример 5. Определение радиохимической чистоты DOTA-конъюгированных пептидов (Ia) и (Ib), меченных радионуклидами 111In, 90Y, 177Lu, на примере 177Lu.
Радиохимическую чистоту полученного продукта (РХЧ) определяли высокоэффективной жидкостной хроматографией (ВЭЖХ).
ВЭЖХ (UV-детектор, 220 нм; радиодетектор Radiomatic Flo-ONE/Beta, Packard) проводили с использованием колонки Acclaim;
при скорости потока элюента 1 мл/мин; для градиентного элюирования использовали следующие элюенты: А - ацетонитрил (ACN), В: 0,1% фторуксусная кислота (TFA).
Радиохимическая чистота составила более 98%. Хроматограмма представлена на чертеже.
Пример 6. Изучение накопления РФП на основе соединений (Ia) и (Ib), меченных радионуклидами 111In, 90Y, 177Lu, на примере 111In, у животных с перевитой опухолью (меланома), экспрессирующей рецепторы соматостатина.
Эксперименты in vivo проводились на лабораторных самках мышей (гибриды F1 СВАхС57В1 весом 18-20 г). Животные были получены из питомника Научного центра биомедицинских технологий РАМН "Андреевка". Мышам перевивали пигментированную меланому В16. В асептических условиях подкожно вводили взвесь клеток меланомы В16. Рост опухоли отмечали визуально. Животных включали в эксперимент спустя 9-12 суток после имплантации, при достижении размера опухоли 8-12 мм в диаметре.
Во время экспериментов животных содержали в стандартных условиях (специальное помещение, рекомендованный рацион, свободный доступ к питьевой воде, естественное освещение).
Растворы соединений (I) и (Ia), меченные 111In, вводили в хвостовую вену, через 20 и 60 минут животных декапитировали, отбирали пробы крови, мышечной и опухолевой тканей, а также основные органы и ткани: печень, почки, наполненный мочевой пузырь, кровь, опухоль. Наполнение мочевого пузыря выполняли путем наложения лигатуры на наружное отверстие мочевыделительного канала. Радиоактивность в выбранных органах и тканях измеряли методом прямой радиометрии. На каждую временную точку использовали не менее 3-х животных. Полученные данные представлены в таблице 2.
| Таблица 2 | ||
| Распределение активности в организме мышей С57В1 с перевитой меланомой В 16 (% от введенной дозы) | ||
| Орган/ткань | 20 минут | 60 минут |
| % от введенной дозы | ||
| Кровь | 3,5 | 1,6 |
| Печень | 2,9 | 3,4 |
| Почки | 4,4 | 5,1 |
| Мочевой пузырь | 53,3 | 73,2 |
| Мышцы, %/г | 1,7 | 1,2 |
| Опухоль, %/г | 5,2 | 2,6 |
| Опухоль/мышца | 3,1 | 2,2 |
| Опухоль/кровь | 1,5 | 1,6 |
Как видно из приведенных данных, полученное соединение показывает тропность к опухоли меланома В16 in vivo. Согласно полученным данным препарат практически полностью выводится через почки, умеренно накапливается в печени и имеет достаточно высокое соотношение опухоль/мышца и опухоль/кровь.
Совокупность результатов мечения, биологического поведения in vivo позволяют считать целесообразным применение соединений (I) и (Ia), меченных 111In, 177Lu, 90Y, а также другими радионуклидами, для радионуклидной терапии новообразований (опухолей), экспрессирующих соматостатиновые рецепторы.
1. Радиофармацевтическое средство в виде комплекса октапептида, содержащего хелатирующую группу, ковалентно присоединенную с концевой аминокислотой лизина (Lys), с радионуклидами 111In, 90Y, 177Lu, при этом октапептид, содержащий хелатирующую группу, отвечает следующим структурным формулам (1а) и (1в) или структуру (1в) где Х - хелатирующий агент.
2. Способ применения радиофармацевтического средства по п.1 для получения лекарственных (фармацевтических) средств для радионуклеидной терапии новообразований, экспрессирующих соматостатиновые рецепторы.