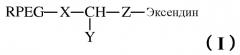Новый вариант эксендина и его конъюгат
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к конъюгату варианта эксендина с молекулой ПЭГ, и может быть использовано в медицине. Указанный конъюгат включает эксендин с аминокислотной последовательностью SEQ ID NO: 4 и одну молекулу ПЭГ с молекулярным весом от 21 кДа до 29 кДа, конъюгированную с остатком цистеина в эксендине. Изобретение относится также к способу получения конъюгата эксендина, фармацевтической композиции и набору для снижения уровня глюкозы в крови, предусматривающим использование конъюгата эксендина. Изобретение позволяет получить конъюгат эксендина с ПЭГ с активностью агониста рецептора GLP-1 и с сохранением максимального эффекта в отношении стимуляции продукции цАМФ (Emax) при ПЭГилировании. 4 н. и 3 з.п. ф-лы, 44 ил., 5 табл., 26 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым вариантам эксендина, его конъюгатам с полимерами и содержащей их фармацевтической композиции, а также к применению вариантов, конъюгатов и фармацевтических композиций эксендина для снижения уровня глюкозы в крови, особенно при лечении диабета (в частности, диабета II типа). Настоящее изобретение также относится к применению конъюгатов эксендина для снижения веса тела.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Во всем мире по мере социального развития, увеличения продолжительности жизни и изменения стиля жизни диабет стал одним из лидирующих проблем со здоровьем. Заболеваемость сахарным диабетом стремительно растет как в развитых, так и в развивающихся странах. В 2007 году в мире насчитывалось около 246 миллионов пациентов с диабетом, и каждые 10 секунд в мире один пациент умирает от диабета. Прогнозируется, что популяция пациентов с диабетом в мире вырастет до 333 миллионов в 2025 году. Китай является проблемным регионом по диабету. На сегодняшний день в Китае популяция пациентов с диабетом составляет 40 миллионов, по числу больных диабетом Китай с заболеваемостью, составляющий около 5%, находится на втором месте в мире (после Индии). Сахарный диабет бывает двух типов: один является инсулинзависимым сахарным диабетом (диабет 1 типа), а второй является инсулиннезависимым сахарным диабетом (диабет 2 типа). Из них диабет 2 типа составляет более 90% от всех случаев заболеваний диабетом. Диабет 2 типа отличается неконтролируемой секрецией или функцией инсулина, а также нарушением функций β-клеток, что приводит к нарушениям в метаболизме липидов, углеводов и белков. Это может привести к хронической гипергликемии и со временем вызвать осложнения в микро- и макрососудистой системе и различных органах. В настоящий момент существуют два класса лекарственных соединений для контроля сахарного диабета: 1) усилители секреции инсулина, такие как сульфонилмочевина, меглитиниды и ингибиторы дипептидил-пептидазы, аналоги GLP-1; и 2) усилители секреции других соединений, помимо инсулина, такие как инсулин, ингибиторы α-гликозидазы, бигуаниды, тиазолидиндионы и аналоги инсулина. В настоящий момент большинство противодиабетических лекарственных средств, обычно используемых в клинической практике, менее эффективны в отношении диабета 2 типа. Они не способны ни остановить прогрессирующие повреждения β-клеток, ни понизить уровень HbA1c в крови, ни предупредить осложнения, вызываемые диабетом, такие как сердечные заболевания и почечную недостаточность. Кроме того, они имеют до известной степени выраженные токсичные побочные эффекты. Соответственно, существует необходимость в исследованиях новых лекарственных средств для лечения диабета 2 типа.
В 1985 году был открыт гормон желудочно-кишечного тракта, глюкагоноподобный пептид-1 (GLP-1). GLP-1 является продуктом экспрессии гена проглюкагона после еды и в основном секретируется L-клетками слизистой желудочно-кишечного тракта. GLP-1 стимулирует секрецию инсулина островковыми β-клетками поджелудочной железы (J. Med. Chem., 47, 4128-4134, 2004) и играет важную роль в стабилизации уровня глюкозы в крови. У пациентов с сахарным диабетом 2 типа введение GLP-1 может стабилизировать содержание глюкозы в крови на нормальном уровне (Diabetes Care, 15, 270-276, 1992; Lancet, 359, 824-830, 2002; Endoer. Rev, 16, 390-410, 1996; Diabetologia, 28, 565-573, 1985). В организме GLP-1 выполняет следующие функции: глюкозозависимо действует на островковые β-клетки поджелудочной железы, усиливая транскрипцию гена инсулина и биосинтез и секрецию инсулина; стимулирует пролиферацию и дифференцировку β-клеток и ингибирует апоптоз β-клеток, увеличивая количество островковых β-клеткок поджелудочной железы; ингибирует секрецию глюкагонов; увеличивает чувствительность инсулиновых рецепторов в периферических клетках; снижает уровень HbA1c; подавляет аппетит и уменьшает количество потребляемой пищи; задерживает ощущение пустоты в желудке (Diabetic Med., 18, 144-149, 2001; Diabetes, 51, 1443-1452, 2002; Diabetologia, 45, 1263-1273, 2002; Diabetes, 50, 525-529, 2001; Diabetes, 50, 725, 2001; Diabetes, 52, 365-371, 2003; Recent Prog. Hormne Res. 56, 377-399, 2001; Disbetologia, 39, 1546-1553, 1996; Am. J. Physic. Endocrinol. Metab, 281, E242-247, 2001; U.S. patent 477967, 478017, 478425; Diabetes Care, 22, 403-408, 1999; J. Clin. Endocrinology and Metabolism, 88, 3082-3089, 2003; Diabetes, 44, 1295, 1995). Однако в организме GLP-1 быстро разрушается под действием дипептидилпептидазы (DPP IV), а его время полужизни составляет меньше 2 минут, и поэтому GLP-1 невозможно использовать в качестве эффективного противодиабетического лекарственного средства.
Эксендин-4 представляет собой полипептид, найденный в слюне аризонского ядозуба, ядовитой ящерицы, обитающей в штатах Аризоне и Нью-Мексико США (J. Biol. Chem., 265, 20259-20262, 1990; J. Biol. Chem., 267, 7402-7405, 1992). Эксендин-4 имеет высокую степень гомологии с GLP-1 (7-36) (53%). Опубликовано, что эксендин-4 может связывать рецептор GLP-1 и проявлять фармакологический агонистический эффект, аналогичный эффекту GLP-1, например, увеличивая синтез инсулина, усиливая глюкозозависимую секрецию инсулина; стимулируя пролиферацию и регенерацию, а также ингибируя апоптоз β-клеток, тем самым увеличивая их количество; ингибируя секрецию глюкагонов; ингибируя образование гликогена, не вызывая при этом острую гипогликемию; угнетая моторику и секрецию желудочно-кишечного тракта после еды; снижая аппетит и количество потребляемой пищи; защищая нервные клетки (Nat. Biotech, 23, 857-861, 2005; J. Biol. Chem., 266, 2897-2902, 1991; J. Biol. Chem., 266, 21432-21437, 1992; Diabetes, 44, 16-19, 1995; Nature, 379, 69-72, 1996). Способность эксендина-4 усиливать секрецию инсулина и ингибировать секрецию глюкагона после еды зависит от уровня глюкозы в крови, что предпочтительно по сравнению с используемыми на текущий момент сульфонилмочевинами, и, в частности, эксендин-4 в меньшей степени вызывает гипогликемию и значительно снижает частоту проверок уровня глюкозы в крови, а также снижает вес тела. Препарат эксендина-4 для приема дважды в сутки (Эксенатид, продаваемый под наименованием Баетта), разработанный совместно Amylin и Eli Lilly, допущен к продаже в Соединенных Штатах и Европе (патенты США № 5424286, 6858576, 6872700, 6902744, 6956026, 7297761). Соответственно, этот тип лекарственных препаратов широко используется для лечения диабета и ожирения во всем мире.
Фармацевтические пептиды требуют многократных инъекций в течение дня, поскольку эти фармакологические препараты имеют короткое время полужизни в организме и плохую физическую и химическую стабильность, а также они подвержены деградации различными протеазами. Экзанатид вводится дважды в день с помощью подкожных инъекций, что приводит к тяжелой нагрузке на организм, психику и финансовое состояние пациента, и поэтому пациенты плохо соблюдают режим лечения. Соответственно, современные исследования в области противодиабетических лекарственных средств сосредоточены на структурной модификации эксендина-4 и разработке новых лекарственных форм для увеличения времени полужизни эксендина-4 в плазме крови и увеличения системной доступности лекарственного соединения.
Модификация полимерами является многообещающей методикой, разработанной в 1970 годы, причем типичной модификацией является ПЭГилирование (модификация молекулами полиэтиленгликоля, ПЭГ). Эта методика представляет собой химическую конъюгацию ПЭГ и фармакологического белка для модификации поверхности белка. После ПЭГ-модификации увеличивается молекулярный вес белка, а скорость его выведения почками снижается. Кроме того, конъюгированные цепи ПЭГ стерически затрудняют доступ к поверхности молекулы белка, что приводит к уменьшению его гидролиза протеазами крови. Поэтому это эффективно увеличивает срок жизни белка в кровотоке и приводит к увеличению времени полужизни в плазме крови и системной доступности лекарственного соединения, повышая его эффективность.
На настоящий момент уже разработано второе поколение методик ПЭГилирования - сайт-направленное ПЭГилирование. Сайт-направленное ПЭГилирование можно использовать для специфичной модификации некоторых аминокислот в белках, предупреждая, таким образом, неспецифичную модификацию. Фактически в меньшей степени затрагивается структура активного центра белков, а некоторые антигенные сайты нарушаются избирательно, что уменьшает ряд недостатков, таких как снижение биологической активности и увеличение гетерогенности вследствие неспецифичного ПЭГилирования.
Учеными были проведены некоторые исследования по модификации эксендина-4 полимерами. Young и Prickett (CN1372570A) доказали, что метаболизм эксендина-4 в основном осуществляется через почки. Поэтому они модифицировали эксендин-4, используя ПЭГ с молекулярным весом в диапазоне от 500 до 20000 дальтон (Да). Wenchao Bao, Hongjing Xu, Gang Yu, Yajun Zuo (CN 101125207 A) провели модификацию аминокислот эксендина-4, используя ПЭГ с молекулярным весом в диапазоне от 20 кДа до 50 кДа.
Однако у существующих на сегодняшний день эксендина-4 и его вариантов и различных модифицированных форм имеются недостатки, в том числе высокая частота введения, что приводит к тяжелой нагрузке на организм, психику и финансовое состояние пациента. Поэтому пациенты плохо соблюдают режим лечения и невозможно широко использовать эти лекарственные средства. Соответственно, до сих пор существует необходимость в новых вариантах эксендина-4 и вариантах, модифицированных полимерами.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к варианту эксендина, имеющему активность агониста рецептора GLP-1, в котором один или несколько аминокислотных остатков замещены цистеином по сравнению с последовательностью эксендина дикого типа. Необязательно, в варианте эксендина одна или несколько аминокислот дополнительно могут быть удалены, вставлены и/или замещены, причем вставляемые или замещающие аминокислоты могут представлять собой природные аминокислоты или аналоги аминокислот.
В варианте осуществления изобретения вариант эксендина имеет аминокислотную последовательность, в которой один или несколько аминокислотных остатков замещены цистеином, и, необязательно, другой аминокислотой, по сравнению с последовательностью эксендина-4 дикого типа
His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ ID NO: 1)
Или последовательностью эксендина-3 дикого типа
His-Ser-Asp-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ ID NO: 2), или аналогичной им последовательностью. Аминокислотные замены, каждая независимо, расположены в N-концевой, С-концевой и/или во внутренней части аминокислотной последовательности дикого типа.
В предпочтительном варианте осуществления изобретения вариант эксендина имеет цистеиновую замену по меньшей мере на С-конце варианта. Кроме того, предпочтительно, чтобы последняя аминокислота С-конца варианта эксендина была замещена цистеином. Кроме того, вариант эксендина, предпочтительно, имеет цистеиновую замену по меньшей мере по одной или нескольким позициям, выбранным из группы, состоящей из позиций, соответствующих Arg в позиции 20, Trp в позиции 25, Ala в позиции 35 и Ser в позиции 39 эксендина-4 или эксендина-3.
В дополнительном аспекте настоящее изобретение относится к конъюгату варианта эксендина, в котором одна или несколько молекул полимера (предпочтительно, физиологически приемлемого полимера, такого как полиалкиленгликоль, более конкретно, ПЭГ) конъюгированы с вариантом эксендина. В варианте осуществления изобретения конъюгат содержит данные многочисленные молекулы полимера, причем молекулы полимера могут быть одинаковыми или нет. Предпочтительно, чтобы молекула полимера была конъюгирована с вариантом эксендина через один или несколько цистеинов. В варианте осуществления изобретения молекула полимера конъюгирована с вариантом эксендина через тиоэфирную связь.
Опытному специалисту известно, что при конъюгации молекулы полимера с биомолекулой биологическая активность конъюгированной биомолекулы снижается экспоненциально при увеличении молекулярного веса конъюгирующей молекулы (например, начиная с 4 кДа) (Bailon et al. Rational design of potent, long-lasting form of interferon: A 40 kDa branched polyethylene glycol-conjugated interferon α-2a for the treatment of hepatitis C. Bioconjugate Chem., 2001, 12: 195-202; Bowen et al. Relationship between molecular weight and duration of activity of polyethylene glycol conjugated granulocyte colony-stimulating factor mutein. Experimental Hematology 1999, 27:425-32; Bailon et al. PEG-modified biopharmaceuticals. Expert Opin. Deliv., 2009, 6: 1-16). Опытному специалисту также известно, что биологический период полужизни и/или период полужизни в плазме, а также системная доступность конъюгированной молекулы удлиняется или увеличивается постепенно по мере увеличения молекулярного веса конъюгирующей молекулы.
Однако авторы изобретения неожиданно обнаружили, что по сравнению с неконъюгированным вариантом эксендина молекула конъюгата варианта эксендина по настоящему изобретению все еще сохраняет большую часть активности агониста рецептора GLP-1 даже при увеличении молекулярного веса полимерной молекулы до 30 кДа. Даже при увеличении молекулярного веса молекулы ПЭГ до 40 кДа или выше конъюгат варианта эксендина по настоящему изобретению все еще сохраняет существенную активность агониста рецептора GLP-1. В частности, при увеличении молекулярного веса полимерной молекулы с 5 кДа до 27 кДа, активность конъюгата варианта эксендина как агониста рецептора GLP-1, по существу, не меняется по сравнению с неконъюгированным вариантом эксендина.
Поэтому в предпочтительном варианте осуществления настоящее изобретение относится к конъюгату варианта эксендина с увеличенным биологическим периодом полужизни и/или периодом полужизни в плазме и существенной активностью агониста рецептора GLP-1.
В варианте осуществления изобретения полимером является полиалкиленгликоль и включает inter alia, например, полиэтиленгликоль, полипропиленгликоль. Одна или несколько молекул полимера могут иметь любой подходящий молекулярный вес, например, от 2 кДа до 50 кДа, предпочтительно, от 5 кДа до 30 кДа, более предпочтительно, от 20 кДа до 30 кДа, например, 21 кДа, 22 кДа, 23 кДа, 24 кДа, 25 кДа, 26 кДа, 27 кДа, 28 кДа, 29 кДа и 30 кДа, а также любое значение между вышеуказанными значениями молекулярного веса.
Необязательно, конъюгат варианта эксендина может также быть конъюгирован с одним или несколькими из вышеуказанных полимеров, одинаковыми или нет, по одному или нескольким другим аминокислотным остаткам. Один или несколько аминокислотных остатков могут, каждый независимо, располагаться в N-концевой, С-концевой и/или во внутренней части варианта эксендина.
В настоящем изобретении полимер для конъюгации может находиться в любой соответствующей конфигурации, в том числе, например, однолучевой, двухлучевой, многолучевой и/или разветвленной, в которой каждый из лучей или ответвлений могут быть одинаковыми или нет.
Настоящее изобретение дополнительно относится к способу получения конъюгата варианта эксендина, описанного выше, включающему контактирование варианта эксендина с полимером; для конъюгации активированного полимера с одним или несколькими остатками цистеина в варианте эксендина предпочтительно, чтобы на момент контакта к полимеру была присоединена реакционноспособная группа или он был активирован. В варианте осуществления изобретения цистеины в варианте эксендина специфично модифицированы ПЭГ с различной длиной полимерной цепи и структурой полимера в результате подбора специфичных активирующих групп и соответствующего рН. В конкретном варианте осуществления изобретения специфичной активирующей группой является малеимид.
Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей вариант эксендина и/или конъюгат варианта эксендина по настоящему изобретению, а также, необязательно, фармацевтически приемлемый носитель.
Настоящее изобретение дополнительно относится к способу лечения заболеваний, включающему введение терапевтически эффективного количества варианта эксендина, и/или конъюгата варианта эксендина, и/или фармацевтической композиции по настоящему изобретению, нуждающемуся в этом субъекту. Аналогичным образом настоящее изобретение также относится к применению варианта эксендина, и/или конъюгата варианта эксендина, и/или фармацевтической композиции по настоящему изобретению в изготовлении лекарственного препарата для лечения заболеваний. Заболевания могут быть выбраны из группы, состоящей из постпрандиального демпинг-синдрома, постпрандиальной гипергликемии, непереносимости глюкозы, расстройств или заболеваний, течение которых может облегчить ингибирование секреции глюкагона, регулирование уровня триглицеридов и/или снижение количества потребляемой пищи, ожирения, расстройств питания, синдрома инсулинорезистентности, диабета, гипергликемии и гипогликемии. Предпочтительным заболеванием является диабет. Более предпочтительно заболеванием является диабет 1 типа или диабет 2 типа, в особенности диабет 2 типа.
Хорошо известно, что эксендин снижает вес тела у пациентов с ожирением и вызывает тошноту и рвоту, механизм возникновения которых ассоциирован с ингибированием пищевого центра и активацией рвотного центра в центральной нервной системе (Larsen. Mechanisms behind GLP-1 induced weight loss. Br J Diabetes Vasc Dis 2008; 8: S34-S41; Schick et al. Glucagon like peptide 1 (7-36)-amide acts at lateral and medial hypothalamic sites to suppress feeding in rats. Am J Physiol Regul Integr Comp Physiol 2003; 284:R1427-35). Благодаря своему увеличившемуся весу конъюгат эксендина или его варианта не может пересечь гематоэнцефалический барьер и поэтому меньше вызывает рвоту по сравнению с эксендином. Соответственно, перед выполнением настоящего изобретения авторы естественно ожидали, что конъюгат эксендина или его варианта также будет проявлять более слабые эффекты в отношении снижения потребления пищи и уменьшения веса тела, опосредованные центральной нервной системой. Однако авторы неожиданно обнаружили, что конъюгат эксендина или его варианта значительно усиливал эффекты снижения веса тела и уменьшения потребления пищи, хотя эксендин дикого типа и неконъюгированный вариант эксендина, оба снижали вес тела и потребление пищи.
Поэтому в другом аспекте настоящее изобретение относится к способу снижения веса тела путем введения конъюгата эксендина, или его варианта, и/или содержащей их фармацевтической композиции. Кроме того, настоящее изобретение также относится к применению конъюгата эксендина, или его варианта, и/или содержащей их фармацевтической композиции в изготовлении лекарственного препарата для снижения веса тела. В варианте осуществления изобретения конъюгат эксендина или его варианта представляет собой конъюгат варианта эксендина по настоящему изобретению, описанный выше.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показан масс-спектр соединения РВ-105, полученного в примере 1.
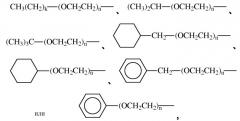
На фиг.2 показана молекулярная структура ПЭГ.
На фиг.3 показан результат ВЭЖХ-анализа чистоты РВ-110 (ПЭГ5000-РВ-105), полученного в примере 2.
На фиг.4 показана молекулярная структура ПЭГ5000b.
На фиг.5 показана молекулярная структура ПЭГ5000с.
На фиг.6 показано (А) изображение, полученное окрашиванием йодом, и (В) изображение, полученное окрашиванием Кумасси бриллиантовым синим, ПЭГилированного конъюгата РВ-105; в соответствующих дорожках нанесены: 1) стандарты молекулярного веса; 2) РВ-106 (ПЭГ20000-PB-105); 3) PB-107 (ПЭГ30000-PB-105); 4) PB-108 (ПЭГ40000-PB-105); и 5) PB-109 (ПЭГ20000×2-PB-105).
На фиг.7 показан результат ВЭЖХ-анализа чистоты РВ-106 (ПЭГ20000-РВ-105), полученного в примере 3.
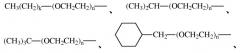
На фиг.8 показана молекулярная структура ПЭГ20000b.
На фиг.9 показана молекулярная структура ПЭГ20000с.
На фиг.10 показана молекулярная структура ПЭГ20000d.
На фиг.11 показана молекулярная структура ПЭГ20000e.
На фиг.12 показан результат ВЭЖХ-анализа чистоты РВ-112 (ПЭГ20000-РВ-111), полученного в примере 3.
На фиг.13 показан результат ВЭЖХ-анализа чистоты РВ-107 (ПЭГ30000-РВ-105), полученного в примере 4.
На фиг.14 показан результат ВЭЖХ-анализа чистоты РВ-108 (ПЭГ40000-РВ-105), полученного в примере 5.
На фиг.15 показан результат ВЭЖХ-анализа чистоты РВ-114 (ПЭГ40000-РВ-113), полученного в примере 5.
На фиг.16 показана молекулярная структура ПЭГ20000×2.
На фиг.17 показан результат ВЭЖХ-анализа чистоты РВ-109 (ПЭГ20000×2-РВ-105), полученного в примере 6.
На фиг.18 показана молекулярная структура ПЭГ20000×2b.
На фиг.19 показана молекулярная структура ПЭГ20000×2c.
На фиг.20 показана молекулярная структура ПЭГ20000×2d.
На фиг.21 показан результат ВЭЖХ-анализа чистоты РВ-119 (ПЭГ23000-РВ-105), полученного в примере 7.
На фиг.22 показан результат ВЭЖХ-анализа чистоты РВ-120 (ПЭГ27000-РВ-105), полученного в примере 8.
На фиг.23А показан результат ВЭЖХ-анализа РВ-106 (ПЭГ20000-РВ-105) после хранения при рН 4,5, -20°С в течение 60 дней.
На фиг.23В показан результат ВЭЖХ-анализа РВ-106 (ПЭГ20000-РВ-105) после хранения при рН 7,0, 4°С в течение 60 дней.
На фиг.23С показан результат ВЭЖХ-анализа РВ-106 (ПЭГ20000-РВ-105) после хранения при рН 7,0, -20°С в течение 60 дней.
На фиг.24 показана зависимость от дозы эффектов РВ-101 и РВ-105 на внутриклеточный уровень цАМФ в клетках РС12.
На фиг.25 показаны эффекты РВ-105 и его ПЭГилированного конъюгата на внутриклеточный уровень цАМФ in vitro.
На фиг.26А показана взаимосвязь между молекулярным весом (MW) ПЭГ в ПЭГилированном конъюгате и фармакологической активностью in vitro (Log EC50).
На фиг.26В показана взаимосвязь между молекулярным весом (MW) ПЭГ в ПЭГилированном конъюгате и максимальной фармакологической активностью (Emax).
На фиг.27 показан эффект РВ-105 и его ПЭГилированного конъюгата на внутриклеточный уровень цАМФ in vitro.
На фиг.28 показана зависимость от времени эффекта снижения уровня глюкозы в крови для РВ-101 и РВ-105.
На фиг.29 показана зависимость от дозы эффекта снижения уровня глюкозы в крови для РВ-101 и РВ-105.
На фиг.30 показана зависимость от дозы эффекта снижения уровня глюкозы в крови для РВ-101 и его варианта РВ-102.
На фиг.31 показана зависимость от времени эффекта снижения уровня глюкозы в крови для РВ-105 и его ПЭГилированного конъюгата.
На фиг.32А показана зависимость между молекулярным весом ПЭГ в ПЭГилированном варианте эксендина и биологическим периодом полужизни (Т1/2).
На фиг.32В показана зависимость между молекулярным весом ПЭГ в ПЭГилированном варианте эксендина и максимальным эффектом снижения уровня глюкозы в крови (в % от концентрации глюкозы в крови до введения дозы соединения).
На фиг.32С показана зависимость между молекулярным весом ПЭГ в ПЭГилированном варианте эксендина и площади над кривой (ААС) для кривой снижения уровня глюкозы в крови.
На фиг.33 показана зависимость от времени эквивалентного эффекта снижения уровня глюкозы в крови для РВ-105 и его ПЭГилированного (ПЭГ30000) конъюгата, РВ-107.
На фиг.34 показана зависимость от дозы эффекта снижения уровня глюкозы в крови для РВ-105 и его ПЭГилированного (ПЭГ20000) конъюгата, РВ-106.
На фиг.35 показана зависимость от времени эквивалентного эффекта снижения уровня глюкозы в крови для РВ-105, РВ-111 и их ПЭГилированных конъюгатов. Экспериментальные данные представлены как среднее ± SEM (стандартная ошибка среднего).
На фиг.36 показана зависимость от времени эффекта снижения уровня глюкозы в крови для РВ-101, его вариантов РВ-105, РВ-111 и РВ-113, а также ПЭГилированных конъюгатов, РВ-106, РВ-112 и РВ-114. Экспериментальные данные представлены как среднее ± SEM.
На фиг.37 показана зависимость от времени эквивалентного эффекта снижения уровня глюкозы в крови для РВ-105 и его ПЭГилированного конъюгата. Экспериментальные данные представлены как среднее ± SEM. * представляет статистически достоверную разницу по сравнению с группой РВ-105 (р<0,05).
На фиг.38 показаны эффекты РВ-101, РВ-105, РВ-106 и РВ-120, соответственно, на задержку рвоты (А) и время рвоты (В) у голубей. Экспериментальные данные представлены как среднее ± SEM, a) представляет статистически достоверную разницу в дозировке 3 мг/кг по сравнению с группой РВ-105 (р<0,05); b) представляет статистически достоверную разницу в дозировке 6 мг/кг как по сравнению с группой РВ-101, так и с группой РВ-105 (р<0,05).
На фиг.39 показаны эффекты РВ-101, РВ-105 и РВ-106 на аллергический ответ у системно иммунизированных морских свинок. Экспериментальные данные представлены как среднее ± SEM, a) представляет статистически достоверную разницу по сравнению с группой, которой вводили физиологический раствор (р<0,05); b) представляет статистически достоверную разницу по сравнению с группой РВ-101 или с группой РВ-105 (р<0,05).
На фиг.40 показаны эффекты на увеличение веса тела у морских свинок в течение (А) 0-18 дней и (В) 0-4 дней после введения РВ-101, РВ-105 и РВ-106. Экспериментальные данные представлены как среднее ± SEM, a) представляет статистически достоверную разницу по сравнению с группой, которой вводили физиологический раствор (р<0,05); b) представляет статистически достоверную разницу по сравнению с Экзенатидом или с группой РВ-105 (р<0,05).
На фиг.41 показаны эффекты на (А) вес тела и на (С) потребление пищи у крыс после введения РВ-105, РВ-106, РВ-119 и РВ-120. На В и D показана площадь под кривой для кривой зависимости веса тела от времени и кривой зависимости потребления пищи от времени для соответствующих групп после введения соединений. Экспериментальные данные представлены как среднее ± SEM, a) представляет статистически достоверную разницу по сравнению с группой, которой вводили физиологический раствор (р<0,05); b) представляет статистически достоверную разницу по сравнению с группой РВ-105 (р<0,05).
На фиг.42 показана кривая зависимости концентрации от времени при болюсной инъекции Эксенатида и РВ-105.
На фиг.43 показана кривая зависимости концентрации от времени при болюсной инъекции РВ-105 и ПЭГилированного конъюгата эксендина.
На фиг.44А показана взаимосвязь между MW ПЭГ в ПЭГилированном варианте эксендина и периодом полужизни в плазме.
На фиг.44В показана взаимосвязь между MW ПЭГ в ПЭГилированном варианте эксендина и площадью под кривой (AUC) для кривой зависимости концентрации от времени.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Определения
Используемый в настоящем документе термин «аминокислота» включает природные аминокислоты, неприродные аминокислоты и аналоги аминокислот, а также все их D- и L-стереоизомеры. Неприродные аминокислоты включают, но не ограничены этим, азетидинкарбоновую кислоту, 2-аминоадипиновую кислоту, 3-аминоадипиновую кислоту, β-аланин, аланин, 2-аминомасляную кислоту, 4-аминомасляную кислоту, 6-аминокапроновую кислоту, 2-аминогептановую кислоту, 2-аминоизомасляную кислоту, 3-аминоизомасляную кислоту, 2-аминогептандионовую кислоту, трет-бутилглицин, 2,4-аминоизомасляную кислоту, 2,2'-диаминогептандионовую кислоту, 2,3-диаминопропионовую кислоту, N-этилглицин, N-этиласпарагин, гомопролин, гидроксилизин, аллогидроксилизин, 3-гидроксипролин, 4-гидроксипролин, изодесмозин, аллоизолейцин, N-метилаланин, N-метилглицин, N-метилизолейцин, N-метиламилглицин, N-метилвалин, аланиннафталин, норвалин, норлейцин, орнитин, глицинамил, 2-пиперидиновая кислота и тиопролин. Аналоги аминокислот включают природные аминокислоты и неприродные аминокислоты, в которых карбоксильная группа на С-конце, аминогруппа на N-конце или боковая группа обратимо или необратимо химически блокированы или химически модифицированы до другой функциональной группы, такой как, например, метионинсульфоксид, метионинсульфон, S-(карбоксиметил)цистеин, S-(карбоксиметил)цистеинсульфоксид и S-(карбоксиметил)цистеинсульфоксид.
Используемый в настоящем документе термин «полипептид» или «белок» взаимозаменяемо означает цепочку по меньшей мере из двух аминокислотных остатков, соединенных друг с другом ковалентными связями (такими как пептидная связь), которая может представлять собой рекомбинантный полипептид, природный полипептид или синтетический полипептид.
Используемый в настоящем документе термин «цистеиновая замена» означает замещение одного или нескольких других аминокислотных остатков в природном полипептиде (таком как эксендин-4) остатком цистеина с помощью генной инженерии или химического синтеза.
Используемые в настоящем документе термины «вариант полипептида», «вариант» или «аналог» означают полипептид, в котором аминокислотная последовательность отличается вследствие наличия одной или нескольких замен, делеций, вставок, слияний, укорочений или любой их комбинации. Вариант полипептида может быть полностью функциональным, или у него может отсутствовать одна или несколько функций. Полностью функциональный вариант может содержать изменения, например, только консервативные изменения либо по незначимым остаткам, либо в незначимой области. Функциональный вариант может содержать замену аналогичной аминокислотой, не приводящей или приводящей к несущественному изменению функций. Функционально важные аминокислоты можно идентифицировать способами, известными в данной области, такими как сайт-направленный мутагенез или глицин-сканирующий мутагенез (Cunningham Β. and Wells J., Science, 244: 1081-1085, 1989). Позицию, ключевую для активности полипептидов, можно определить, например, с помощью структурного анализа, такого как кристаллизация, ЯМР или фотоаффинное мечение (Smith L. et al., J. Mol. Biol., 224: 899-904, 1992; de Vos, A. et al., Science, 255: 306-312, 1992). Термин «тиольный вариант» означает варианты полипептида, в которых тиол присутствует в аминокислотной последовательности в результате замены, вставки, слияния или любой их комбинации.
Используемый в настоящем документе термин «конъюгат» означает продукт, образующийся в результате ковалентного или нековалентного соединения полипептида или варианта полипептида и модифицирующей группы по настоящему изобретению. Модифицирующая группа включает, но не ограничена этим, вышеуказанные примеры.
Используемый в настоящем документе термин «модифицированный полипептид» или «модифицированный вариант полипептида» означает полипептид или вариант полипептида, в котором одна или несколько аминокислот химически модифицированы, причем модификация представляет собой ковалентную или нековалентную модификации различных групп, включая, но не ограниченные этим, фосфорилирование, гликозилирование, метилирование, ПЭГилирование, биотинилирование, SUMOилирование (присоединение молекулы SUMO), ацетилирование и т.п.
Используемый в настоящем документе термин «алкил» означает замещенный или незамещенный, неразветвленный или разветвленный алкил, такой как С1-С30-алкил, С1-С20-алкил, С2-С15-алкил или С3-С10-алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей, например, из галогеногруппы, аминогруппы, нитрогруппы и т.п.
Используемый в настоящем документе термин «циклоалкил» означает замещенный или незамещенный С3-С8-циклоалкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей, например, из С1-С10-алкила, С2-С10-алкенила, С2-С10-алкинила, галогеногруппы, аминогруппы и нитрогруппы.
Используемый в настоящем документе термин «алкенил» означает замещенный или незамещенный, неразветвленный или разветвленный алкенил, имеющий одну углерод-углеродную двойную связь, который может состоять, например, из 2-20, 3-15, 4-10 атомов углерода, и который, необязательно, может быть замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей, например, из галогеногруппы, аминогруппы и нитрогруппы.
Используемый в настоящем документе термин «арил» означает С6-С10-арил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей, например, из С1-С10-алкила, С2-С10-алкенила, С2-С10-алкинила, галогеногруппы, аминогруппы и нитрогруппы.
Используемый в настоящем документе термин «линкер» означает органическую группу, которая присоединяет ПЭГ к эксендину. В настоящем изобретении линкер может быть алкилом, простым эфиром, амидом, сложным эфиром, тиолом и т.п., а линкер может содержать, например, до 30 атомов углерода, например, 1-25, 2-20, 3-15 или 3-10 атомов углерода.
В общем, используемый в настоящем документе термин «полиэтиленгликоль» имеет значение, которое обычно понимает под этим термином опытный специалист в данной области, и, если не указано иное, включает как полиэтиленгликоль per se, так и его производные с модификациями на концах.
Кроме того, для полимера, такого как полиэтиленгликоль, существует набор способов определения молекулярного веса. Для представления молекулярного веса полимера обычно используется средний молекулярный вес (в частности, среднечисловой молекулярный вес или средневесовой молекулярный вес), поскольку полимер состоит из молекул с различной степенью полимеризации в диапазоне распределения. Среднечисловой молекулярный вес и средневесовой молекулярный вес обычно бывают равны для полимеров с узким диапазоном распределения, хотя они могут до некоторой степени отличаться при больших различиях степени полимеризации в полимерах. Для полимеров, таких как полиэтиленгликоль, упомянутых в настоящем документе, указанный молекулярный вес может быть либо среднечисловым молекулярным весом, либо средневесовым молекулярным весом.
Варианты эксендина
В одном аспекте настоящее изобретение относится к варианту эксендина с активностью агониста рецептора GLP-1, в котором один или несколько (например, 1, 2, 3, 4, 5 или больше) аминокислотных остатков замещены цистеином по сравнению с последовательностью эксендина дикого типа. Цистеиновые замены, каждая независимо, находятся в N-концевой, С-концевой и/или во внутренней части последовательности варианта эксендина. В некоторых вариантах осуществления изобретения в варианте эксендина по меньшей мере 1, 2, 3 или 4 аминокислотных остатка его С-концевой части замещены цистеинами. Предпочтительно, чтобы вариант эксендина имел цистеиновую замену последней аминокислоты С-конца. В некоторых других вариантах осуществления изобретения предпочтительно, чтобы эксендин имел цистеиновую замену 1, 2, 3, 4 или больше аминокислотных остатков С-концевой, N-концевой и/или во внутренней части последовательности варианта эксендина.
Последовательность эксендина дикого типа или аналогичная последовательность, описанные в настоящем изобретении, могут быть любой известной последовательностью в данной области, включая их различные варианты или аналоги, или последовательности их агонистов. Информацию по эксендину можно найти, например, в материалах Eng J. et al., J. Biol. Chem., 265: 20259-62, 1990; Eng J. et al., J. Biol. Chem., 267: 7402-05, 1992; WO 00/66629 и WO 00/41546, каждый из которых полностью включен в настоящий документ путем ссылки.
Вариант эксендина, необязательно, также может иметь одну или несколько (например, 1, 2, 3, 4, 5 или более) дополнительных модификаций аминокислот, включая, например, замену, делецию, вставку и/или добавление аминокислот. Аналогичным образом дополнительная аминокислотная модификация может независимо находиться в N-концевой, С-концевой и/или во внутренней части последовательности эксендина. Замещающей, вставленной и/или добавленной аминокислотой может быть любая природная аминокислота, неприродная аминокислота или аналог аминокислоты, или D- или L-стереоизомер аминокислоты. В некоторых вариантах осуществления изобретения дополнительная аминокислотная модификация представляет собой консервативную аминокислотную замену, например, замену между Ala/Gly, Ser/Thr, Glu/Asp, Gln/Asn, Ala/Val/Ile/Leu, Arg/Lys, Phe/Tyr и т.п. Относительно консервативных аминокислотных замены большое количество информации присутствует в прототипах, например, см. WO/2006/083301, который полностью включен в настоящий документ путем ссылки.
В настоящем изобретении эксендином дикого типа могут быть эксендин-3 или эксендин-4. Поэтому в некоторых вариантах осуществления настоящее изобретение относится к таким вариантам эксендина, в которых один или несколько (например, 1, 2, 3, 4, 5 или более) аминокислотных остатков замещены цистеином, по сравнению с
His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ ID NO: 1; эксендин-4) или
His-Ser-Asp-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ ID NO: 2; эксендин-3) или аналогичной последовательностью. Предпочтительно, чтобы вариант эксендина имел цистеиновую замену по меньшей мере одной или нескольких позиций, выбранных из группы, состоящей из позиций, соответствующих Arg (аргинину) в позиции 20, Trp (триптофану) в позиции 25, Ala (аланину) в позиции 35 и Ser (серину) в позиции 39 последовательностей SEQ ID NO: 1 или SEQ ID NO: 2.
В предпочтительном в