Антитела, узнающие углеводсодержащий эпитоп на cd43 и сеа, экспрессируемых на раковых клетках и способы их применения
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложено антитело, специфически связывающееся с эпитопом на CD43 и CEA и имеющее модификации в константной области тяжелой и/или легкой цепи. Рассмотрены полинуклеотиды, вектор, клетка-хозяин и способы получения антитела по изобретению, а также фармацевтическая композиция, набор и способ лечения рака негемопоэтического происхождения. Данное изобретение может найти дальнейшее применение в терапии и диагностике заболеваний, опосредованных CD43 или CEA. 13 н. и 22 з.п. ф-лы , 15 табл., 5 пр., 4 ил.
Реферат
Перекрестная ссылка на родственные заявки
Данная заявка притязает на приоритет предварительной заявки на патент США № 61/014716, поданной 18 декабря 2007 г., которая полностью включена в настоящее описание изобретения ссылкой.
Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам (таким как химерные и гуманизированные антитела), которые узнают углеводсодержащий эпитоп на CD43 и карциноэмбриональном антигене (СЕА), экспрессируемых на негемопоэтических опухолевых или раковых клетках. Указанные антитела способны индуцировать гибель (например, апоптоз) негемопоэтических опухолевых или раковых клеток при отсутствии конъюгации с цитотоксином и иммунной эффекторной функции. Указанные антитела могут быть использованы в качестве диагностических и терапевтических средств.
Уровень техники
CD43 (именуемый также сиалофорином или лейкосиалином) представляет собой сильно сиалилированную молекулу, экспрессированную в большом количестве на большинстве лейкоцитов человека, включая все Т-клетки и тромбоциты с молекулярной массой в пределах от 115000 до 135000. Экспрессия CD43 нарушена на Т-клетках мужчин, страдающих синдромом Вискота-Олдрича, который является сцепленным с Х-хромосомой рецессивным иммунодефицитом (Remold-O'Donnell et al. (1987) Blood 70(1):104-9; Remold-O'Donnel et al. (1984) J. Exp. Med. 159:1705-23).
Функциональные исследования показали, что моноклональное антитело против CD43 стимулирует пролиферацию Т-лимфоцитов в периферической крови (Mentzer et al. (1987) J. Exp. Med. 1; 165 (5):1383-92; Park et al. (1991) Nature, 350:706-9) и активацию моноцитов (Nong et al. (1989) J. Exp. Med. 1:170(1):259-67). Моноклональное антитело L11 против CD43 блокирует связывание Т-клеток с лимфатическим узлом и образование пейеровых бляшек. Антитело L11 ингибирует проникновение Т-клеток из крови в организованные вторичные лимфоидные ткани (McEvoy et al. (1997) J. Exp. Med. 185:1493-8). Моноклональное антитело, узнающее молекулу CD43, вызывает апоптоз гемопоэтических клеток-предшественников (НРС) костного мозга с отрицательной реакцией на маркер линии дифференцировки, которые экспрессируют CD34 с высокой степенью плотности (Bazil et al. (1996) Blood, 87(4):1271-81), и Т-лимфобластоидных клеток человека (Brown et al. (1996) J. Biol. Chem. 271:27686-95). Недавно выполненные исследования показали, что CD43 действует в качестве лиганда для Е-селектина на Т-клетках человека (Matsumoto et al. (2005) J. Immunol. 175:8042-50; Fuhlbrigge et al. (2006) Blood, 107:1421-6).
Кроме того, было установлено, что определенные негемопоэтические опухолевые клетки, в частности клетки колоректальной аденокарциномы, также экспрессируют молекулы CD43 на поверхности клеток. Santamaria et al. (1996) Cancer Research, 56:3526-9; Baeckstrom et al. (1995) J. Biol. Chem. 270:13688-92; Baeckstrom et al. (1997) J. Biol. Chem. 272:11503-9; Sikut et al. (1997) Biochem. Biophy. Res. Commun. 238:612-6. Было установлено, что гликаны на CD43, экспрессированном в линии клеток рака ободочной кишки (COLO205), отличаются от гликанов CD43 лейкоцитов (Baeckstrom et al. (1997) J. Biol. Chem. 272:11503-9). Хотя было высказано предположение, что сверхэкспрессия CD43 активирует белок-супрессор опухоли р53 (Kadaja et al. (2004) Oncogene 23:2523-30) и, таким образом, подавляет субпопуляцию генов-мишеней NF-каппа-В, частично путем ингибирования транскрипционной активности р65 (Laos et al. (2006) Int. J. Oncol. 28:695-704), по-прежнему отсутствуют прямые свидетельства участия CD43 в онкогенезе рака ободочной кишки. Стандартное антитело против CD43 не нашло практического применения в качестве терапевтического средства против негемопоэтических опухолевых клеток из-за сильного связывания данного антитела как с опухолевыми клетками, так и с иммунокомпетентными Т-клетками. Поэтому существует потребность в создании антител, которые специфически связываются с CD43, экспрессированным на негемопоэтических опухолевых или раковых клетках, но не связываются с CD43, экспрессированным на лейкоцитах или других гемопоэтических клетках. Такие антитела могут быть полезны в качестве терапевтических средств для лечения CD43-экспрессирующего рака негемопоэтического происхождения.
СЕА обычно экспрессирован в разных тканях железистого эпителия (таких как желудочно-кишечный тракт, дыхательные пути и мочеполовые пути), где указанный антиген локализован на апикальной поверхности клеток (Hammarstrom, S. (1999) Semin. Cancer Biol. 9, 67-81). В опухолях, образующихся из указанных тканей, имеет место повышенный уровень экспрессии СЕА, распространяющегося от апикальной мембранной области по всей поверхности клетки при одновременной секреции белка в кровь (Hammarstrom, S. (1999) Semin. Cancer. Biol. 9, 67-81). Чрезмерная экспрессия СЕА была отмечена во многих типах рака, включая колоректальный рак, рак поджелудочной железы, рак легкого, рак желудка, гепатоцеллюлярный рак, рак молочной железы и рак щитовидной железы. Поэтому СЕА служит в качестве маркера опухоли, и иммунологические анализы, позволяющие измерить повышенное содержание СЕА в крови субъектов, больных раком, уже давно используются в клинической практике для прогнозирования и лечения рака (Gold P., et al. (1965) J. Expl. Med. 122:467-81; Chevinsky, A.H. (1991) Semin. Surg. Oncol. 7, 162-166; Shively, J.E. et al. (1985) Crit. Rev. Oncol. Hematol. 2, 355-399).
Гораздо важнее то, что СЕА стал потенциально полезным опухолеассоциированным антигеном для целенаправленной терапии (Kuroki M., et al. (2002) Anticancer Res. 22:4255-64). Были разработаны две основные стратегии использования СЕА в качестве мишени для иммунотерапии рака. Один метод состоит в направленном воздействии на гены-самоубийцы (ген синтазы оксида азота (iNOS)) (Kuroki M. et al., (2000) Anticancer Res. 20(6A):4067-71) или изотопы (Wilkinson R.W. et al., (2001) PNAS USA 98, 10256-60, Goldenberg, D.M. (1991) Am. J. Gastroenterol., 86:1392-1403, Olafsen T. et al., Protein Engineering, Design & Selection, 17, 21-27, 2004) к СЕА-экспрессирующим опухолевым клеткам при помощи антител против СЕА. Указанный метод был также расширен до использования антитела или фрагмента антитела, конъюгированного с терапевтическими агентами, такими как лекарственные средства, токсины, радиоактивные изотопы, иммуномодуляторы или цитокины. Другой метод состоит в использовании иммунологической цитолитической активности, в частности, антителозависимой клеточноопосредованной цитотоксичности (ADCC) или комплементзависимой цитотоксичности (CDC), для устранения СЕА-экспрессирующих опухолевых клеток (Imakiire T. et al., (2004) Int. J. Cancer. 108, 564-570). При осуществлении указанных методов часто происходит высвобождение цитокинов, что вызывает системные побочные эффекты.
Антитела, узнающие углеводсодержащий эпитоп на CD43 и СЕА, экспрессируемых на негемопоэтических раковых клетках, описаны в публикации заявки на патент США № 2008/0171043 и РСТ WO 07/146172. Указанные антитела могут индуцировать апоптоз негемопоэтических раковых клеток при отсутствии конъюгации с цитотоксином и иммунной эффекторной функции.
Все ссылки, публикации и заявки на патенты, приведенные в настоящем изобретении, полностью включены в настоящее описание изобретения в виде ссылки.
Сущность изобретения
Настоящее изобретение относится к антителам (таким как химерные и гуманизированные антитела), которые специфически связываются с эпитопом на CD43 и/или СЕА, экспрессируемых негемопоэтической раковой клеткой, но специфически не связываются с CD43, экспрессируемым лейкоцитом или клеткой Джурката, и могут индуцировать апоптоз негемопоэтической раковой клетки после связывания с эпитопом, экспрессированным на поверхности негемопоэтической раковой клетки при отсутствии конъюгации с цитотоксином и иммунной эффекторной функции, при этом указанный эпитоп содержит углевод и связывание антитела с данным эпитопом ингибируется углеводом, имеющим структуру Lea, структуру Lea-лактозы, структуру LNDFH II или структуру LNT. В некоторых вариантах осуществления изобретения эпитоп, с которым связываются указанные антитела, чувствителен к фукозе.
В некоторых вариантах осуществления изобретения указанные антитела являются химерными или гуманизированными антителами, полученными из мышиного антитела m5F1, имеющего инсерцию, делецию или замену по меньшей мере одной аминокислоты в шарнирной области константной области тяжелой цепи.
Некоторые варианты осуществления изобретения относятся к выделенным антителам, включающим тяжелую цепь и легкую цепь, где (а) тяжелая цепь содержит вариабельную область тяжелой цепи, включающую три области, определяющие комплементарность, из аминокислотной последовательности SEQ ID NO:1, и константную область тяжелой цепи IgG1 человека, при этом шарнирная область константной области тяжелой цепи содержит инсерцию, делецию или замену по меньшей мере одной аминокислоты; и (b) легкая цепь содержит вариабельную область легкой цепи, включающую три области, определяющие комплементарность, из аминокислотной последовательности SEQ ID NO:2, и константную область легкой цепи из легкой каппа-цепи человека или константную область легкой цепи из легкой каппа-цепи человека, включающую инсерцию, делецию или замену по меньшей мере одной аминокислоты. В некоторых вариантах осуществления изобретения константная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:27 или SEQ ID NO:29.
В некоторых вариантах осуществления изобретения со стороны N-конца аминокислоты К218 в шарнирной области IgG1 человека вставлены одна, две, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислот, при этом нумерация остатков соответствует системе нумерации EU. См. публикацию Burton, Mol. Immunol. 22:161-206, 1985. В некоторых вариантах осуществления изобретения со стороны N-конца аминокислоты К218 вставлены аминокислотные остатки KSD.
В некоторых вариантах осуществления изобретения антитела включают: (а) вариабельную область тяжелой цепи, содержащую три CDR-области из аминокислотной последовательности SEQ ID NO:1, и константную область тяжелой цепи, содержащую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:11-30; и (b) вариабельную область легкой цепи, содержащую три CDR-области из аминокислотной последовательности SEQ ID NO:2, и константную область легкой цепи, содержащую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:10 и 31-37. В некоторых вариантах осуществления изобретения указанное антитело является гуманизированным антителом. В некоторых вариантах осуществления изобретения указанное антитело является химерным антителом. В некоторых вариантах осуществления изобретения вариабельная область тяжелой цепи включает аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:1, 3 и 87-91. В некоторых вариантах осуществления изобретения вариабельная область легкой цепи включает аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:2, 4 и 92-96. В некоторых вариантах осуществления изобретения вариабельная область тяжелой цепи антитела включает аминокислотную последовательность остатков 20-137 SEQ ID NO:1 или SEQ ID NO:3 или аминокислотную последовательность вариабельной области из SEQ ID NO:1 или SEQ ID NO:3. В некоторых вариантах осуществления изобретения вариабельная область легкой цепи антитела включает аминокислотную последовательность остатков 20-131 SEQ ID NO:2, аминокислотную последовательность вариабельной области из SEQ ID NO:2, аминокислотную последовательность остатков 21-132 SEQ ID NO:4 или аминокислотную последовательность вариабельной области из SEQ ID NO:4.
В некоторых вариантах осуществления изобретения антитело по настоящему изобретению включает тяжелую цепь и легкую цепь, при этом тяжелая цепь содержит вариабельную область тяжелой цепи, включающую аминокислотную последовательность остатков 20-137 SEQ ID NO:1 или аминокислотную последовательность вариабельной области из SEQ ID NO:1, и константную область тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:27, и легкая цепь содержит вариабельную область легкой цепи, включающую аминокислотную последовательность остатков 20-131 SEQ ID NO:2 или аминокислотную последовательность вариабельной области из SEQ ID NO:2, и константную область легкой цепи, включающую аминокислотную последовательность SEQ ID NO:10.
В некоторых вариантах осуществления изобретения антитело по настоящему изобретению включает тяжелую цепь и легкую цепь, при этом тяжелая цепь содержит вариабельную область тяжелой цепи, включающую аминокислотную последовательность остатков 20-137 SEQ ID NO:1 или аминокислотную последовательность вариабельной области из SEQ ID NO:1, и константную область тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:29, и легкая цепь содержит вариабельную область легкой цепи, включающую аминокислотную последовательность остатков 20-131 SEQ ID NO:2 или аминокислотную последовательность вариабельной области из SEQ ID NO:2, и константную область легкой цепи, включающую аминокислотную последовательность SEQ ID NO:34.
В некоторых вариантах осуществления изобретения антитело по настоящему изобретению включает тяжелую цепь и легкую цепь, при этом тяжелая цепь содержит вариабельную область тяжелой цепи, включающую аминокислотную последовательность остатков 20-137 SEQ ID NO:1 или аминокислотную последовательность вариабельной области из SEQ ID NO:1, и константную область тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:29, и легкая цепь содержит вариабельную область легкой цепи, включающую аминокислотную последовательность остатков 20-131 SEQ ID NO:2 или аминокислотную последовательность вариабельной области из SEQ ID NO:2, и константную область легкой цепи, включающую аминокислотную последовательность SEQ ID NO:35.
Настоящее изобретение относится также к антигенсвязывающим фрагментам антител, раскрытых в настоящем описании изобретения.
Настоящее изобретение относится также к фармацевтическим композициям, включающим одно или несколько антител по настоящему изобретению или их антигенсвязывающие фрагменты и фармацевтически приемлемый носитель.
Настоящее изобретение относится к полинуклеотидам и векторам, включающим последовательность нуклеиновой кислоты, кодирующую тяжелую цепь антитела по настоящему изобретению и/или легкую цепь антитела по настоящему изобретению или его фрагмента. В некоторых вариантах осуществления изобретения полинуклеотиды и векторы включают последовательность нуклеиновой кислоты, кодирующую тяжелую цепь, содержащую вариабельную область тяжелой цепи, включающую три CDR-области из аминокислотной последовательности SEQ ID NO:1, и константную область тяжелой цепи, включающую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:11-30. В некоторых вариантах осуществления изобретения полинуклеотиды и векторы включают последовательность нуклеиновой кислоты, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, включающую три CDR-области из аминокислотной последовательности SEQ ID NO:2, и константную область легкой цепи, включающую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:10 и 31-37.
Настоящее изобретение относится также к клеткам-хозяевам, содержащим полинуклеотиды и векторы, раскрытые в настоящем описании изобретения.
Настоящее изобретение далее относится к способам получения любых антител или их антигенсвязывающих фрагментов, рассмотренных в настоящем описании изобретения. Указанные способы могут включать стадию экспрессии одного или нескольких полинуклеотидов, кодирующих антитела (которые могут быть экспрессированы отдельно в виде единичной тяжелой или легкой цепи, либо в одном векторе могут быть экспрессированы как тяжелая цепь, так и легкая цепь) или их антигенсвязывающие фрагменты в приемлемой клетке-хозяине. В некоторых вариантах осуществления изобретения экспрессированные антитела или их антигенсвязывающие фрагменты отделяют и/или выделяют. Настоящее изобретение относится также к антителам или антигенсвязывающим фрагментам, полученным указанными способами.
Настоящее изобретение относится к способу лечения рака негемопоэтического происхождения у субъекта, который включает введение указанному субъекту эффективного количества композиции, содержащей одно или несколько антител по настоящему изобретению, которые связываются с раковыми клетками в организме субъекта. В некоторых вариантах осуществления изобретения рак негемопоэтического происхождения является колоректальным раком, раком поджелудочной железы или раком желудка. В некоторых вариантах осуществления изобретения антитело конъюгировано с цитотоксином.
Настоящее изобретение относится к способу замедления развития рака негемопоэтического происхождения (в частности, к замедлению и/или торможению развития рака) у субъекта, который включает введение указанному субъекту эффективного количества композиции, содержащей одно или несколько антител по настоящему изобретению, которые связываются с раковыми клетками в организме субъекта. В некоторых вариантах осуществления изобретения рак негемопоэтического происхождения является колоректальным раком, раком поджелудочной железы или раком желудка. В некоторых вариантах осуществления изобретения антитело конъюгировано с цитотоксином.
Настоящее изобретение относится также к способу лечения рака негемопоэтического происхождения у субъекта, который включает введение указанному субъекту определенного количества одного или нескольких антител по настоящему изобретению и определенного количества другого противоракового средства, при этом одно или несколько антител связываются с раковыми клетками в организме субъекта, благодаря чему одно или несколько антител совместно с противораковым средством обеспечивают эффективное лечение рака у указанного субъекта. В некоторых вариантах осуществления изобретения рак негемопоэтического происхождения является колоректальным раком, раком поджелудочной железы или раком желудка. В некоторых вариантах осуществления изобретения противораковое средство является химиотерапевтическим средством.
Настоящее изобретение далее относится к наборам, включающим фармацевтическую композицию, содержащую одно или несколько антител по настоящему изобретению. В некоторых вариантах осуществления изобретения наборы дополнительно включают инструкции по введению субъекту эффективного количества фармацевтической композиции для лечения рака негемопоэтического происхождения. В некоторых вариантах осуществления изобретения наборы включают инструкции по введению фармацевтической композиции совместно с другим противораковым средством. В некоторых вариантах осуществления изобретения антитело включает (а) вариабельную область тяжелой цепи, включающую три CDR-области из аминокислотной последовательности SEQ ID NO:1, и константную область тяжелой цепи, включающую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:11-30; и (b) вариабельную область легкой цепи, включающую три CDR-области из аминокислотной последовательности SEQ ID NO:2, и константную область, включающую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:10 и 31-37.
Настоящее изобретение относится также к наборам, включающим первую фармацевтическую композицию, содержащую антитело или антигенсвязывающий фрагмент по настоящему изобретению, вторую фармацевтическую композицию, содержащую другое противораковое средство, и инструкции по совместному введению субъекту первой фармацевтической композиции и второй фармацевтической композиции для лечения рака негемопоэтического происхождения.
Следует отметить, что некоторые или все признаки разных вариантов осуществления изобретения могут быть объединены с образованием других вариантов осуществления настоящего изобретения. Специалисту в данной области должны быть очевидны вышеуказанные и другие цели настоящего изобретения.
Краткое описание фигур
На фиг.1 показан сравнительный анализ аминокислотных последовательностей константной области тяжелой цепи IgG3 мыши (SEQ ID NO:138) и константной области тяжелой цепи IgG1 человека (SEQ ID NO:139). Шарнирная область подчеркнута. Как показано на данной фигуре, идентичность аминокислот составляет 214/333 (64,3%), сходство составляет 261/333 (78,4%) и разрывы составляют 6/333 (1,8%).
На фиг.2(А-Е) показан сравнительный анализ аминокислотных последовательностей немодифицированных и модифицированных константных областей тяжелой цепи IgG1 человека, и на фигуре 2F показан сравнительный анализ аминокислотных последовательностей немодифицированных и модифицированных константных областей легкой каппа-цепи IgG1 человека.
На фиг.3 показано связывание антител m5F1, c5F1v0, c5F1v15 и c5F1v16 с клетками Colo205 по результатам проточного цитометрического анализа при использовании антител в разных концентрациях от 0,125 мкг/мл до 4 мкг/мл. Фоновыми сигналами (MFI) для контрольных антител являются: вторичное антитело против мыши: 3; вторичное антитело против человека: 3; IgG мыши: 4; IgG человека: 5. Все антитела, m5F1, c5F1v0, c5F1v15 и c5F1v16, характеризуются значительным связыванием с клетками Colo205 по сравнению с фоновыми сигналами.
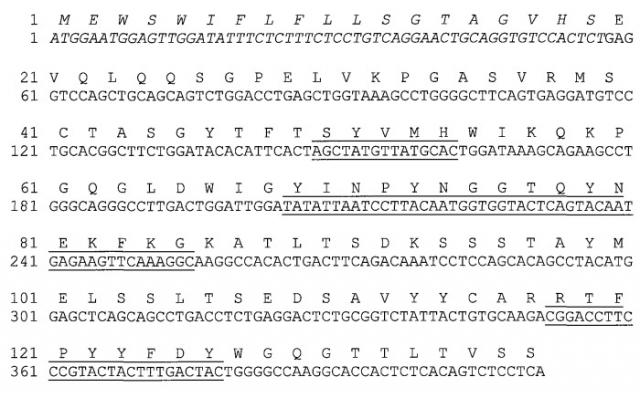
На фиг.4(А и В) показан сравнительный анализ аминокислотных последовательности VH(a) и VL(b) антител h5F1M, h5F1A Va, h5F1A Vs, h5F1M Va и h5F1M Vs.
Подробное описание изобретения
Определения терминов
Термин “антитело” означает молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., при помощи по меньшей мере одного сайта узнавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. В использованном здесь значении указанный термин означает не только интактные поликлональные или моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечный фрагмент (ScFv), их мутанты, слитые белки, включающие антитело, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая включает сайт узнавания антигена. Антитело является антителом любого класса, таким как IgG, IgA или IgM (или их подкласса), при этом указанное антитело не обязательно должно относиться к любому определенному классу. В зависимости от аминокислотной последовательности константной области тяжелых цепей антитела иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из указанных классов могут быть далее разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют другим классам иммуноглобулинов, именуются соответственно альфа, дельта, эпсилон, гамма и мю. Хорошо известны субъединичные структуры и трехмерные конфигурации разных классов иммуноглобулинов.
Антитело по настоящему изобретению дополнительно включает биспецифические, полиспецифические, одноцепочечные, химерные и гуманизированные молекулы, обладающие сродством к полипептиду, сообщаемым по меньшей мере одной областью, определяющей комплементарность, (CDR) антитела. Антитела по настоящему изобретению включают также антитела с одной областью, которая является или вариабельной областью тяжелой цепи антитела, или вариабельной областью легкой цепи антитела. Holt et al., (2003), Trends Biotechnol. 21:484-490. В данной области хорошо известны способы получения антител с одной областью, содержащих или вариабельную область тяжелой цепи антитела, или вариабельную область легкой цепи антитела, включающую три из шести естественных областей, определяющих комплементарность, антитела. См., например, публикацию Muyldermans, Rev. Mol. Biotechnol. 74:277-302, 2001.
В использованном здесь значении термин “моноклональное антитело” означает антитело из популяции по существу гомогенных антител, то есть отдельные антитела, образующие популяцию, являются идентичными, за исключением возможных естественных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела обычно являются высоко специфичными, направленно воздействующими на одну область детерминанты в молекуле антигена. Кроме того, в отличие от препаратов на основе поликлональных антител, которые обычно включают разные антитела, направленно воздействующие на разные детерминанты (эпитопы), каждое моноклональное антитело направленно воздействует на одну детерминанту антигена. Определение “моноклональное” служит для обозначения характера антитела, получаемого из по существу гомологичной популяции антител, и не ограничивает получение данного антитела любым конкретным способом. Например, моноклональные антитела, предназначенные для использования в соответствии с настоящим изобретением, могут быть получены способом гибридом, впервые описанным в публикации Kohler and Milstein, (1975), Nature, 256:495, или способами рекомбинантных ДНК, описанными в патенте США № 4816567. Моноклональные антитела могут быть также выделены из библиотек фагов, созданных методами, описанными, например, в публикации McCafferty et al., (1990), Nature, 348:552-554.
В использованном здесь значении термин “химерное антитело” означает антитело, содержащее вариабельную область или часть вариабельной области первого вида и константную область второго вида. Интактное химерное антитело включает две копии химерной легкой цепи и две копии химерной тяжелой цепи. В данной области известно получение химерных антител (Cabilly et al. (1984), Proc. Natl. Acad. Sci. USA, 81:3273-3277; Harlow and Lane (1988), Antibodies: a Laboratory Manual, Cold Spring Harbor Laboratory). В указанных химерных антителах вариабельная область как легкой, так и тяжелой цепей обычно имитирует вариабельные области антител, полученных у одного вида млекопитающих, в то время как константные области гомологичны последовательностям в антителах, выделенных у другого вида. В некоторых вариантах осуществления изобретения в вариабельной области и/или константной области могут быть модифицированы аминокислоты.
“Выделенное” антитело является антителом, которое было идентифицировано и выделено из естественного окружения.
В использованном здесь значении термин “по существу чистый” означает вещество, которое является чистым (то есть свободным от загрязняющих примесей) по меньшей мере на 50%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 98%, еще предпочтительнее по меньшей мере на 99%.
В использованном здесь значении “гуманизированные” антитела означают формы антител, отличных от человеческих (например, мышиных), которые являются специфичными химерными иммуноглобулинами, цепями иммуноглобулинов или их фрагментами (такими как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител) и содержат минимальную последовательность, выделенную из иммуноглобулина, отличного от человеческого. В большинстве случаев гуманизированные антитела являются иммуноглобулинами человека (реципиентное антитело), в которых остатки из области, определяющей комплементарность, (CDR) реципиента заменены остатками из CDR вида, отличного от человека (донорное антитело), такого как мышь, крыса или кролик, обладающего требуемой специфичностью, сродством и антигенсвязывающей способностью. В некоторых случаях остатки каркасной области (FR) Fv-фрагмента иммуноглобулина человека заменены соответствующими остатками, отличными от человеческих. Кроме того, гуманизированное антитело может включать остатки, отсутствующие как в реципиентном антителе, так и во введенных последовательностях CDR или каркасной области, но включенные для дальнейшего улучшения и оптимизации характеристик антитела. Как правило, гуманизированное антитело включает по существу все вариабельные области, по меньшей мере одну и обычно две, в которых все или по существу все CDR-области соответствуют указанным областям иммуноглобулина, отличного от человеческого, и все или по существу все каркасные области являются каркасными областями консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело оптимально также включает по меньшей мере часть константной области или домена (Fc) иммуноглобулина, обычно иммуноглобулина человека. Антитела могут иметь Fc-области, модифицированные в соответствии с описанием, приведенным в публикации WO 99/58572. Другие формы гуманизированных антител содержат одну или несколько CDR-областей (одну, две, три, четыре, пять, шесть), измененных по сравнению с первоначальным антителом, которые также именуются одной или несколькими CDR-областями, “выделенными из” одной или нескольких CDR-областей первоначального антитела.
В использованном здесь значении термин “человеческое антитело” означает антитело, содержащее аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, продуцированного человеком и/или полученного любыми методами получения человеческих антител, известными в данной области или рассмотренными в настоящем описании изобретения. В данное определение человеческого антитела входят антитела, включающие по меньшей мере один полипептид тяжелой цепи человека или по меньшей мере один полипептид легкой цепи человека. В качестве одного такого примера можно привести антитело, включающее полипептиды легкой цепи мыши и тяжелой цепи человека. Человеческие антитела могут быть получены разными методами, известными в данной области. В одном варианте осуществления изобретения человеческое антитело выбирают из библиотеки фагов, экспрессирующей человеческие антитела (Vaughan et al., 1996, Nature Biotechnology, 14:309-314; Sheets et al., (1998), PNAS, (USA) 95:6157-6162; Hoogenboom and Winter, 1991, J. Mol. Biol., 227:381; Marks et al., (1991), J. Mol. Biol., 222:581). Человеческие антитела могут быть также получены путем введения локусов иммуноглобулина человека трансгенным животным, например, мышам, у которых были частично или полностью инактивированы гены эндогенного иммуноглобулина. Данный метод описан в патентах США №№ 5545807, 5545806, 5569825, 5625126, 5633425 и 5661016. Альтернативно человеческое антитело может быть получено путем иммортализации В-лимфоцитов человека, продуцирующих антитело против антигена-мишени (такие В-лимфоциты могут быть выделены у субъекта или могут быть иммунизированы in vitro). См., например, публикации Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); Boerner et al., (1991), J. Immunol., 147(1):86-95; и патент США № 5750373.
Термин “вариабельная область” антитела означает вариабельную область легкой цепи антитела или вариабельную область тяжелой цепи антитела, рассматриваемые отдельно или в комбинации. Вариабельные области тяжелой и легкой цепей состоят из четырех каркасных областей (FR), соединенных тремя областями, определяющими комплементарность (CDR), известными также как гипервариабельные участки. CDR-области в каждой цепи удерживаются в непосредственной близости друг от друга каркасными областями (FR) и вместе с CDR-областями из другой цепи способствуют образованию антигенсвязывающего центра антител. Существуют по меньшей мере два метода определения CDR-областей: (1) метод на основе вариабельности последовательностей в разных видах (Kabat et al., Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda, MD)); и (2) метод на основе кристаллографического исследования комплексов антиген-антитело (Al-lazikani et al., (1997) J. Molec. Biol. 273:927-948)). В использованном здесь значении CDR может означать CDR-области, выявленные любым методом или комбинацией обоих методов.
Термин “константная область” антитела означает константную область легкой цепи антитела или константную область тяжелой цепи антитела, рассматриваемые отдельно или в комбинации. Константная область антитела обычно обеспечивает устойчивость структуры и выполняет другие биологические функции, такие как сборка цепи антитела, секреция, трансплацентарная подвижность и связывание комплемента, но не участвует в связывании с антигеном. Аминокислотная последовательность и последовательности соответствующих экзонов в генах константной области зависят от вида, из которого они выделены; однако изменения аминокислотной последовательности, ведущие к образованию аллотипов, весьма ограничены для конкретных константных областей определенного вида. Вариабельная область каждой цепи присоединена к константной области при помощи линкерной полипептидной последовательности. Линкерная последовательность обозначена как последовательность “J” в гене легкой цепи и как комбинация последовательности “D” и последовательности “J” в гене тяжелой цепи.
В использованном здесь значении термины “антителозависимая клеточноопосредованная цитотоксичность” и “ADCC” означают клеточноопосредованную реакцию, в соответствии с которой неспецифические цитотоксические клетки, экспрессирующие Fc-рецепторы (FcR) (например, естественные клетки-киллеры (NK-клетки), нейтрофилы и макрофаги) узнают связанное антитело на клетке-мишени и вызывают лизис такой клетки-мишени. Активность ADCC представляющей интерес молекулы можно оценить при помощи анализа ADCC in vitro, аналогичного описанному в патенте США № 5500362 или 5821337. Эффекторные клетки, пригодные для выполнения таких анализов, включают мононуклеарные клетки (РВМС) и NK-клетки периферической крови. Альтернативно или дополнительно активность ADCC представляющей интерес молекулы можно определить in vivo, например, в животной модели, аналогичной описанной в публикации Clynes et al., 1998, PNAS (USA), 95:652-656.
Термины “комплементзависимая цитотоксичность” и “CDC” означают лизис мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплементов (C1q) с молекулой (например, антителом), образующей комплекс с родственным антигеном. Для оценки активации комплемента может быть выполнен анализ CDC, например, аналогичный описанному в публикации Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996).
Термины “полипептид”, “олигопептид”, “пептид” и “белок” имеют взаимозаменяемые значения в настоящем описании изобретения и означают полимеры аминокислот любой длины. Полимер может быть линейным или разветвленным, он может включать модифицированные аминокислоты и может прерываться кислотами, отличными от аминокислот. В определение указанных терминов входит также полимер аминокислоты, модифицированный естественным или искусственным путем, например, в результате образования дисульфидной связи, гликозилирования, липидирования, ацетилирования, фосфорилирования или любых других манипуляций или модификаций, таких как конъюгация с компонентом, используемым в качестве метки. В определение указанных терминов также входят, например, полипептиды, содержащие один или несколько аналогов аминокислоты (включающие, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области. Следует отметить, что поскольку полипептиды по настоящему изобретению созданы на основе антитела, то указанные полипептиды могут существовать в виде отдельных цепей или связанных цепей.
Термины “полинуклеотид” или “нуклеиновая кислоты” имеют взаимозаменяемые значения в настоящем описании изобретения, означают полимеры нуклеотидов любой длины и включают ДНК и РНК. Указанные нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами либо любым субстратом, который может быть введен в полимер ДНК- или РНК-полимеразой. Полинуклеотид может включать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. При наличии модификации структура нуклеотида может быть изменена до или после сборки полимера. Последовательность нуклеотидов может прерываться компонентами, не являющимися нуклеотидами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, путем конъюгации с компонентом, используемым в качестве метки. Другие типы модификаций включают, например, “кэпы”, замены одного или нескольких естественных нуклеотидов аналогом, межнуклеотидные модификации, например, замены с неполяризованными связями (такие как, например, метилфосфонаты, сложные фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и замены с поляризованными связями (такие как, например, фосфортиоаты, фосфордитиоаты и т.д.), замены, содержащие боковые цепи, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, ply-L-лизин и т.д.), замены с интеркаляторами (такие как, например, акридин, псорален и т.д.), замены, содержащие хелаторы (такие как, например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), замены, содержащие алкилаторы, замены с модифицированными связями (такие как, например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотидов. Кроме того, любые гидроксильные группы, обычно присутс