Способ размножения и дифференцирования плюрипотентных клеток
Иллюстрации
Показать всеНастоящее изобретение касается способа размножения и дифференцирования плюрипотентных клеток. Описанный способ включает стадии: культивирование плюрипотентных клеток и обработку плюрипотентных клеток ингибитором активности фермента GSK-3B, где указанный ингибитор представляет собой 3-[1-(2-гидроксиэтил)-1H-индол-3-ил]-4-(1-пиридин-3-ил-1H-индол-3-ил)-пиррол-2,5-дион. Представленное изобретение позволяет получить достаточное количество клеточного материала с сохранением способности к дифференцированию для последующего использования в клинических целях. 9 з.п. ф-лы, 15 ил., 11 табл., 11 пр.
Реферат
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу обработки плюрипотентных клеток, позволяющему эффективно размножать плюрипотентные клетки в культуре и дифференцировать их путем обработки ингибитором активности фермента GSK-3B.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Последние достижения в области заместительной клеточной терапии для лечения сахарного диабета I типа и нехватка островков Лангеранса для трансплантации заставили обратить внимание на разработку источников инсулинопродуцирующих клеток или β-клеток, которые могли бы использоваться для трансплантации. Одним из возможных подходов является генерация функциональных β-клеток из плюрипотентных клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки дают начало группе клеток, формирующих три зародышевых листка (эктодерму, мезодерму и эндодерму) в ходе процесса, именуемого гаструляцией. Такие ткани, как, например, щитовидная железа, тимус, поджелудочная железа, кишечник и печень, будут развиваться из эндодермы через промежуточную стадию. Промежуточной стадией данного процесса является образование сформированной эндодермы. Клетки сформированной эндодермы экспрессируют ряд маркеров, таких как HNF-3 beta, GATA-4, Mixl1, CXCR4 и SOX-17.
Формирование поджелудочной железы происходит при дифференцировании сформированной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют ген панкреатическо-дуоденального гомеобокса, PDX-1. В отсутствие PDX-1 развитие поджелудочной железы не идет дальше формирования вентрального и дорсального зачатков. Таким образом, экспрессия PDX-1 характеризует критическую стадию органогенеза поджелудочной железы. Зрелая поджелудочная железа содержит, помимо других типов клеток, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани образуются при дифференцировании панкреатической эндодермы.
Для получения достаточного количества клеточного материала для трансплантации необходим источник требуемого клеточного материала, который можно было бы эффективно размножать в культуре, а затем эффективно дифференцировать в требуемые ткани, например в функциональные β-клетки.
Известные на сегодняшний день способы культивации эмбриональных стволовых клеток человека достаточно сложны и требуют применения экзогенных факторов или культуральной среды химически определенного состава для поддержания пролиферации клеток без потери их плюрипотентности. Кроме того, дифференцирование эмбриональных стволовых клеток часто приводит к сокращению количества клеток, доступных для дальнейшего размножения в культуре.
В одном примере, в работе Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870, October 19, 2005), описывается не содержащая питающих клеток и сыворотки культуральная система, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной заменяющей сыворотку среде (SR) с добавлением различных факторов роста, способных запускать самообновление эмбриональных стволовых клеток.
В другом примере, US 20050233446, описывается среда с определенным составом, которая может быть использована при культивировании стволовых клеток, включая недифференцированные зародышевые стволовые клетки приматов. В растворе данная среда является существенно изотонической относительно культивируемых стволовых клеток. При культивировании клеток указанная среда содержит основную среду и количества bFGF, инсулина и аскорбиновой кислоты, достаточные для поддержания роста зародышевых стволовых клеток без их существенного дифференцирования.
В другом примере, WO 2005086845, описывается способ поддержания недифференцированных стволовых клеток, где упомянутый способ включает воздействие на стволовые клетки одним из членов семейства белков трансформирующего ростового фактора-бета (TGFβ), одним из членов семейства белков фактора роста фибробластов (FGF) или никотинамидом (NIC) в количестве, достаточном для поддержания клеток в недифференцированном состоянии в течение периода времени, достаточного для получения желаемого результата.
Известно, что ингибиторы гликогенсинтазы киназы-3 (GSK-3) стимулируют пролиферацию и размножение стволовых клеток взрослой особи. В одном примере, Tateishi et al. (Biochemical and Biophysical Research Communications (2007) 352: 635), показано, что ингибирование GSK-3 повышает эффективность роста и выживаемость сердечных стволовых клеток человека (hCSCs), выделенных из сердца новорожденного или взрослого человека и обладающих мезенхимальными признаками.
Например, в работе Rulifson et al. (PNAS 144, 6247-6252, (2007)) утверждается, что активация каскада передачи сигнала Wnt стимулирует пролиферацию островковых β-клеток.
В другом примере, WO 2007016485, утверждается, что добавление ингибиторов GSK-3 к культуре неэмбриональных стволовых клеток, включая мультипотентные клетки-предшественники взрослых особей, приводит к поддержанию плюрипотентного фенотипа в процессе размножения и позволяет получить более четко выраженный дифференцировочный отклик.
В другом примере, US 2006030042, используется способ ингибирования GSK-3 путем добавления либо Wnt, либо низкомолекулярного ингибитора активности фермента GSK-3 для поддержания эмбриональных стволовых клеток без использования слоя питающих клеток.
В другом примере, WO 2006026473, сообщается о добавлении ингибитора GSK-3B для стабилизации плюрипотентных клеток через транскрибционную активацию c-myc и стабилизации белка c-myc.
В другом примере, WO 2006100490, сообщается об использовании культуральной среды для стволовых клеток, содержащей ингибитор GSK-3 и агонист gp130, для поддержания самовозобновляющейся популяции плюрипотентных стволовых клеток, включая эмбриональные стволовые клетки мыши или человека.
В другом примере, Sato et al. (Nature Medicine (2004) 10:55-63), показано, что ингибирование GSK-3 специфическим фармакологическим препаратом может сохранять недифференцированный фенотип эмбриональных стволовых клеток и поддерживать уровень экспрессии специфичных для плюрипотентного состояния факторов транскрипции, таких как Oct-3/4, Rex-1 и Nanog.
В другом примере, Maurer et al. (Journal of Proteome Research (2007) 6:1198-1208), показано, что обработанные ингибитором GSK-3 нервные стволовые клетки взрослой особи демонстрируют более высокую эффективность нейронального дифференцирования, в особенности путем стимулирования транскрипции целевых генов β-катенина и торможения апоптоза.
В другом примере, Gregory et al. (Annals of the New York Academy of Sciences (2005) 1049:97-106), сообщается, что ингибиторы GSK-3B повышают эффективность остеогенеза in vitro.
В другом примере, Feng et al. (Biochemical and Biophysical Research Communcations (2004) 324:1333-1339), показано, что гемопоэтическое дифференцирование эмбриональных стволовых клеток связано с понижением эффективности каскада Wnt/β-катенин, где Wnt представляет собой естественный ингибитор GSK3.
Поэтому сохраняется значительная потребность в разработке способов обработки плюрипотентных стволовых клеток для их размножения с последующим использованием в клинических целях и при этом с сохранением их способности к дифференцированию в панкреатические эндокринные клетки, панкреатические экспрессирующие гормоны клетки или панкреатические секретирующие гормоны клетки.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает способ размножения и дифференцирования плюрипотентных клеток путем обработки упомянутых плюрипотентных клеток ингибитором активности фермента GSK-3B.
В одном из вариантов осуществления настоящее изобретение предлагает способ размножения и дифференцирования плюрипотентных клеток, включающий:
а. культивирование плюрипотентных клеток, и
b. обработку плюрипотентных клеток ингибитором активности фермента GSK-3B.
В одном из вариантов осуществления настоящего изобретения упомянутые плюрипотентные клетки дифференцируются в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы.
Упомянутые плюрипотентные клетки могут представлять собой эмбриональные стволовые клетки человека или могут быть экспрессирующими маркеры плюрипотентности производными от эмбриональных стволовых клеток человека клетками в соответствии со способами, раскрытыми в публикации 60/913475.
В одном из вариантов осуществления настоящего изобретения упомянутый ингибитор активности фермента GSK-3B представляет собой соединение формулы (I):
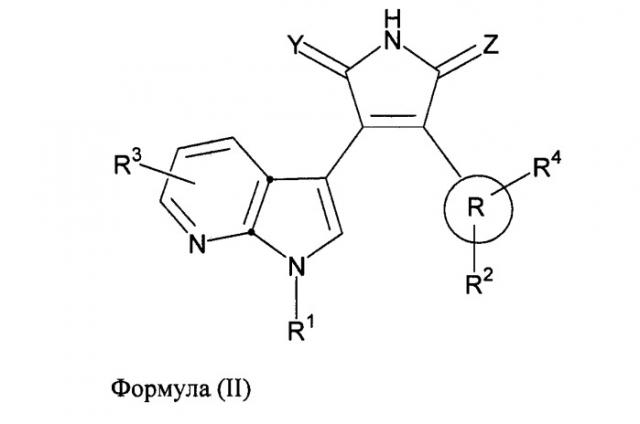
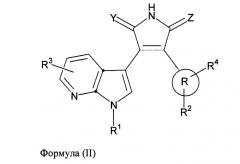
В одном из вариантов осуществления настоящего изобретения упомянутый ингибитор активности фермента GSK-3B представляет собой соединение формулы (II):
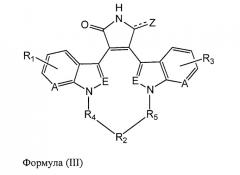
В одном из вариантов осуществления настоящего изобретения упомянутый ингибитор активности фермента GSK-3B представляет собой соединение формулы (III):
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 показан эффект добавления соединения JNJ 17189731 в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии Sox-17, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Приведенные результаты были получены для эмбриональных стволовых клеток человека линии H1 (белые столбики) или эмбриональных стволовых клеток человека линии H9 (черные столбики) на анализаторе IN Cell Analyzer 1000 (GE Healthcare).
На фиг. 2 показан эффект добавления соединения JNJ 17163796 в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии Sox-17, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Приведенные результаты были получены для эмбриональных стволовых клеток человека линии H1 (белые столбики) или эмбриональных стволовых клеток человека линии H9 (черные столбики) на анализаторе IN Cell Analyzer 1000 (GE Healthcare).
На фиг. 3 показан эффект добавления соединения JNJ 17223375 в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии Sox-17, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Приведенные результаты были получены для эмбриональных стволовых клеток человека линии H1 (белые столбики) или эмбриональных стволовых клеток человека линии H9 (черные столбики) на анализаторе IN Cell Analyzer 1000 (GE Healthcare).
На фиг. 4 показан эффект добавления соединения JNJ 18157698 в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии Sox-17, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Приведенные результаты были получены для эмбриональных стволовых клеток человека линии H1 (белые столбики) или эмбриональных стволовых клеток человека линии H9 (черные столбики) на анализаторе IN Cell Analyzer 1000 (GE Healthcare).
На фиг. 5 показан эффект добавления соединения JNJ 26158015 в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии Sox-17, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Приведенные результаты были получены для эмбриональных стволовых клеток человека линии H1 (белые столбики) или эмбриональных стволовых клеток человека линии H9 (черные столбики) на анализаторе IN Cell Analyzer 1000 (GE Healthcare).
На фиг. 6 показан эффект добавления соединения JNJ 26483197 в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии Sox-17, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Приведенные результаты были получены для эмбриональных стволовых клеток человека линии H1 (белые столбики) или эмбриональных стволовых клеток человека линии H9 (черные столбики) на анализаторе IN Cell Analyzer 1000 (GE Healthcare).
На фиг. 7 показан эффект добавления соединения JNJ 26483249 в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии Sox-17, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Приведенные результаты были получены для эмбриональных стволовых клеток человека линии H1 (белые столбики) или эмбриональных стволовых клеток человека линии H9 (черные столбики) на анализаторе IN Cell Analyzer 1000 (GE Healthcare).
На фиг. 8 показан эффект добавления соединения JNJ 10220067 в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии Sox-17, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Приведенные результаты были получены для эмбриональных стволовых клеток человека линии H1 (белые столбики) или эмбриональных стволовых клеток человека линии H9 (черные столбики) на анализаторе IN Cell Analyzer 1000 (GE Healthcare).
На фиг. 9 приведены уровни экспрессии CXCR4 на поверхности клеток, определенные способами иммунофлюоресцентного окрашивания и проточной цитометрии, для клеток, обработанных указанными соединениями согласно способам, описанным в примере 8.
На фиг. 10 приведены уровни экспрессии CXCR4 (часть A), HNF-3 beta (часть B) и Sox-17 (часть C), определенные методом ПЦР в реальном времени, для клеток, обработанных указанными соединениями согласно способам, описанным в примере 8.
На фиг. 11 показан эффект добавления указанных соединений в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии Pdx-1, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Измерения проводились на анализаторе IN Cell Analyzer 1000 (GE Healthcare). Клетки обрабатывали согласно способам, описанным в примере 9.
На фиг. 12 показан эффект добавления указанных соединений в различной концентрации на уровень экспрессии Pdx-1 (белые столбики) и HNF-6 (черные столбики), определенные методом ПЦР в реальном времени. Клетки обрабатывали согласно способам, описанным в примере 9.
На фиг. 13 показан эффект добавления указанных соединений в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии инсулина, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Измерения проводили на анализаторе IN Cell Analyzer 1000 (GE Healthcare). Клетки обрабатывали согласно способам, описанным в примере 10.
На фиг. 14 показан эффект добавления указанных соединений в различной концентрации на уровень экспрессии Pdx-1 (белые столбики) и инсулина (черные столбики), определенные методом ПЦР в реальном времени. Клетки обрабатывали согласно способам, описанным в примере 10.
На фиг. 15 показан эффект добавления указанных соединений в различной концентрации на численность клеток, определенную по числу наблюдаемых ядер (часть A), и на уровень экспрессии инсулина, определенный по интенсивности иммунофлюоресцентной окраски (часть B). Измерения проводили на анализаторе IN Cell Analyzer 1000 (GE Healthcare). Клетки обрабатывали согласно способам, описанным в примере 11.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не в ограничение изобретения, приведенное ниже подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые по их способности на уровне единичной клетки как самообновляться, так и дифференцироваться с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцирования из нескольких зародышевых листков (эндодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от нескольких зародышевых листков, и вносить существенный вклад в формирование большинства, если не всех, тканей после инъекции в бластоцисты.
По потенциалу развития стволовые клетки классифицируются следующим образом: (1) тотипотентные, т.е. способные давать начало всем эмбриональным и внеэмбриональным типам клеток; (2) плюрипотентные, т.е. способные давать начало всем эмбриональным типам клеток; (3) мультипотентные, т.е. способные давать начало группе клеточных линий дифференцирования в пределах конкретной ткани, органа или физиологической системы (например, гематопоэтические стволовые клетки (HSC) могут давать таких потомков, как HSC (самообновление), олигопотентные предшественники, ограниченные клетками крови, и все типы клеток и клеточных элементов (таких как тромбоциты), являющиеся нормальными компонентами крови); (4) олигопотентные, т.е. способные давать начало более ограниченному набору клеточных линий дифференцирования, чем мультипотентные стволовые клетки; и (5) унипотентные, т.е. способные давать начало единственной клеточной линии дифференцирования (например, сперматогенные стволовые клетки).
Дифференцирование представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например нервной или мышечной клетки. Дифференцированная клетка или клетка с индуцированным дифференцированием представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцирования клетки. Термин «коммитированная» применительно к процессу дифференцирования обозначает клетку, дошедшую в ходе процесса дифференцирования до стадии, от которой в нормальных условиях она продолжит дифференцироваться до определенного типа клеток или набора типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться обратно к менее дифференцированному типу. Дедифференцированием называется процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцирования клетки. Используемый в настоящей заявке термин «линия дифференцирования клетки» определяет наследственность клетки, то есть определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В линии дифференцирования клетка помещается в наследственную схему развития и дифференцирования. Маркером, специфичным для линии дифференцирования, называется характерная особенность, специфически ассоциированная с фенотипом клеток конкретной линии дифференцирования, которая может использоваться для оценки дифференцирования некоммитированных клеток в клетки данной линии дифференцирования.
Используемый в настоящей заявке термин «β-клеточная линия дифференцирования» относится к клеткам, положительным по экспрессии гена транскрипционного фактора PDX-1 и как минимум одного из следующих транскрипционных факторов: NGN-3, Nkx2.2, Nkx6.1, NeuroD, Isl-1, HNF-3 beta, MAFA, Pax4 и Pax6. Клетки с экспрессией маркеров, характерных для β-клеточной линии дифференцирования, включают β-клетки.
Используемый в настоящей заявке термин «клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы» относится к клеткам с экспрессией по меньшей мере одного из следующих маркеров: SOX-17, GATA-4, HNF-3 beta, GSC, Cer1, Nodal, FGF8, Brachyury, гомеобоксный белок Mix-like, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA-6, CXCR4, C-Kit, CD99 и OTX2. Клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, включают клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезоэндодермы и клетки сформированной эндодермы.
Используемый в настоящей заявке термин «клетки с экспрессией маркеров, характерных для линии дифференцирования в клетки панкреатической эндодермы» относится к клеткам с экспрессией по меньшей мере одного из следующих маркеров: PDX-1, HNF-1 beta, PTF-1 alpha, HNF-6 и HB9. Клетки с экспрессией маркеров, характерных для линии дифференцирования в клетки панкреатической эндодермы, включают клетки панкреатической эндодермы.
Используемый в настоящей заявке термин «клетки с экспрессией маркеров, характерных для линии дифференцирования в панкреатические эндокринные клетки» относится к клеткам с экспрессией по меньшей мере одного из следующих маркеров: NGN-3, NeuroD, Islet-1, PDX-1, NKX6.1, Pax-4, Ngn-3 и PTF-1 alpha. Клетки с экспрессией маркеров, характерных для линии дифференцирования в панкреатические эндокринные клетки, включают панкреатические эндокринные клетки, панкреатические экспрессирующие гормоны клетки и панкреатические секретирующие гормоны клетки, а также клетки β-клеточной линии дифференцирования.
Используемый в настоящей заявке термин «сформированная эндодерма» относится к клеткам, обладающим характерными особенностями клеток, происходящих в ходе гаструляции от эпибласта, и формирующим желудочно-кишечный тракт и его производные. Клетки сформированной эндодермы экспрессируют следующие маркеры: HNF-3 beta, GATA-4, SOX-17, церберус, OTX2, гузекоид, C-Kit, CD99 и Mixl1.
Используемый в настоящей заявке термин «внеэмбриональная эндодерма» относится к популяции клеток, экспрессирующих по меньшей мере один из следующих маркеров: SOX-7, AFP и SPARC.
Используемый в настоящей заявке термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в интересующих клетках. В данном контексте под дифференциальной экспрессией подразумевается повышение уровня экспрессии для положительного маркера и понижение уровня экспрессии для отрицательного маркера. Поддающийся обнаружению уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличить ее от других клеток с помощью любого из множества известных в данной области способов.
Используемый в настоящей заявке термин «клетка мезэндодермы» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: CD48, эомезодермин (EOMES), SOX-17, DKK4, HNF-3 beta, GSC, FGF17, GATA-6.
Используемый в настоящей заявке термин «панкреатическая эндокринная клетка» или «панкреатическая экспрессирующая гормоны клетка» относится к клеткам, способным к экспрессии по меньшей мере одного из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
Используемый в настоящей заявке термин «панкреатическая секретирующая гормоны клетка» относится к клеткам, способным к секреции по меньшей мере одного из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
Используемый в настоящей заявке термин «клетка-предшественник клетки первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Nodal и FGF8
Используемый в настоящей заявке термин «клетка первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Brachyury, гомеобоксный белок Mix-like или FGF4.
В одном из вариантов осуществления настоящее изобретение предлагает способ размножения и дифференцирования плюрипотентных клеток, заключающийся в обработке упомянутых плюрипотентных клеток ингибитором активности фермента GSK-3B.
В одном из вариантов осуществления настоящее изобретение предлагает способ размножения и дифференцирования плюрипотентных клеток, включающий:
c. культивирование плюрипотентных клеток, и
d. обработку плюрипотентных клеток ингибитором активности фермента GSK-3B.
В одном из вариантов осуществления упомянутые плюрипотентные клетки дифференцируются в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы.
Маркеры, характерные для линии сформированной эндодермы, выбраны из группы, включающей следующие маркеры: SOX17, GATA4, Hnf-3beta, GSC, Cer1, Nodal, FGF8, Brachyury, гомеобоксный белок Mix-like, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и OTX2. В рамках настоящего изобретения возможно использование клеток - производных плюрипотентных клеток, которые экспрессируют по меньшей мере один из маркеров, характерных для линии сформированной эндодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой клетку-предшественник первичной полоски. В другом аспекте настоящего изобретения клетка с экспрессией маркеров, характерных для линии сформированной эндодермы, представляет собой мезэндодермальную клетку. В другом аспекте настоящего изобретения клетка с экспрессией маркеров, характерных для линии сформированной эндодермы, представляет собой клетку сформированной эндодермы.
Упомянутые плюрипотентные клетки могут быть обработаны ингибитором активности фермента GSK-3B в течение от приблизительно одного до приблизительно 72 часов. В качестве альтернативы упомянутые плюрипотентные клетки могут быть обработаны ингибитором активности фермента GSK-3B в течение от приблизительно 12 до приблизительно 48 часов. В качестве альтернативы упомянутые плюрипотентные клетки могут быть обработаны ингибитором активности фермента GSK-3B в течение приблизительно 48 часов.
В одном из вариантов осуществления настоящего изобретения упомянутый ингибитор активности фермента GSK-3B используется в концентрации от приблизительно 100 нМ до приблизительно 100 мкМ. В качестве альтернативы упомянутый ингибитор активности фермента GSK-3B используется в концентрации от приблизительно 1 мкМ до приблизительно 10 мкМ. В качестве альтернативы упомянутый ингибитор активности фермента GSK-3B используется в концентрации приблизительно 10 мкМ.
Соединения, пригодные для применения в способах, составляющих предмет настоящего изобретения
В одном из вариантов осуществления настоящего изобретения упомянутый ингибитор активности фермента GSK-3B представляет собой соединение формулы (I):
,
где:
R1 представляет собой фенил, замещенный фенил, где заместители для фенила выбраны из следующей группы заместителей: C1-5алкила, галогена, нитро, трифторметила и нитрила; или пиримидинила;
R2 представляет собой фенил, замещенный фенил, где заместители для фенила выбраны из следующей группы заместителей: C1-5алкила, галогена, нитро, трифторметила и нитрила; или пиримидинила, который необязательно несет в качестве заместителя C1-4алкил, и по меньшей мере один из заместителей R1 и R2 представляет собой пиримидинил;
R3 представляет собой водород, 2-(триметилсилил)этоксиметил, C1-5алкоксикарбонил, арилоксикарбонил, арил-C1-5алкилоксикарбонил, арил-C1-5алкил, замещенный арил-C1-5алкил, где упомянутые один или несколько заместителей для арильного фрагмента каждый независимо выбран из следующей группы заместителей: C1-5алкил, C1-5алкокси, галоген, амино, C1-5алкиламино и ди-C1-5алкиламино, фталимидо-C1-5алкил, амино-C1-5алкил, диаминоC1-5алкил, сукцинимидо-C1-5алкил, C1-5алкилкарбонил, арилкарбонил, C1-5алкилкарбонил-C1-5алкил и арилоксикарбонил-C1-5алкил;
R4 представляет собой фрагмент -(A)-(CH2)q-X;
A представляет собой винилен, этинилен или ;
R5 выбран из следующей группы заместителей: водорода, C1-5алкила, фенила и фенил-C1-5алкила;
q равен 0-9;
X выбран из следующей группы заместителей: водорода, гидрокси, винила, замещенного винила, где один или несколько заместителей для винильной группы выбраны из следующей группы заместителей: фтора, брома, хлора и йода, этинила, замещенного этинила, где заместители для этинильной группы выбраны из следующей группы заместителей: фтора, брома, хлора и йода, C1-5алкила, замещенного C1-5алкила, где упомянутые один или несколько заместителей для алкильной группы выбраны из следующей группы заместителей: C1-5алкокси, тригалоалкила, фталимидо и амино, C3-7циклоалкила, C1-5алкокси, замещенного C1-5алкокси, где заместители для алкильной группы выбраны из следующей группы заместителей: фталимидо и амино, фталимидоокси, фенокси, замещенный фенокси, где упомянутые один или несколько заместителей для фенильной группы выбраны из следующей группы заместителей: C1-5алкила, галогена и C1-5алкокси, фенила, замещенного фенила, где упомянутые один или несколько заместителей для фенильной группы выбраны из следующей группы заместителей: C1-5алкила, галогена и C1-5алкокси, арил-C1-5алкила, замещенного арил-C1-5алкила, где упомянутые один или несколько заместителей для арильной группы выбраны из следующей группы заместителей: C1-5алкила, галогена и C1-5алкокси, арилокси-C1-5алкиламино, C1-5алкиламино, ди-C1-5алкиламино, нитрила, оксима, бензилоксиимино, C1-5алкилоксиимино, фталимидо, сукцинимидо, C1-5алкилкарбонилокси, фенилкарбонилокси, замещенного фенилкарбонилокси, где упомянутые один или несколько заместителей для фенильной группы выбраны из следующей группы заместителей: C1-5алкила, галогена и C1-5алкокси, фенил-C1-5алкилкарбонилокси, где упомянутые один или несколько заместителей для фенильной группы выбраны из следующей группы заместителей: C1-5алкила, галогена и C1-5алкокси, аминокарбонилокси, C1-5алкиламинокарбонилокси, ди-C1-5алкиламинокарбонилокси, C1-5алкоксикарбонилокси, замещенного C1-5алкоксикарбонилокси, где упомянутые один или несколько заместителей для алкильной группы выбраны из следующей группы заместителей: метила, этила, изопропила и гексила, феноксикарбонилокси, замещенного феноксикарбонилокси, где упомянутые один или несколько заместителей для фенильной группы выбраны из следующей группы заместителей: C1-5алкила, C1-5алкокси и галогена, C1-5алкилтио, замещенного C1-5алкилтио, где заместители для алкильной группы выбраны из следующей группы заместителей: гидрокси и фталимидо, C1-5алкилсульфонила, фенилсульфонила, замещенного фенилсульфонила, где упомянутые один или несколько заместителей для фенильной группы выбраны из следующей группы заместителей: брома, фтора, хлора, C1-5алкокси и трифторметила; с тем условием, что если A представляет собой , q равен 0, и X представляет собой H, то R3 не может представлять собой 2-(триметилсилил)этоксиметил; а также их фармацевтически приемлемые соли.
Пример варианта осуществления настоящего изобретения включает соединение формулы (I), где R1 представляет собой замещенный фенил и R2 представляет собой пиримидин-3-ил.
Пример варианта осуществления настоящего изобретения включает соединение формулы (I), где R1 представляет собой 4-фторфенил.
Пример варианта осуществления настоящего изобретения включает соединение формулы (I), где R3 представляет собой водород, арил-C1-5алкил или замещенный арил-C1-5алкил.
Пример варианта осуществления настоящего изобретения включает соединение формулы (I), где R3 представляет собой водород или фенил-C1-5алкил.
Пример варианта осуществления настоящего изобретения включает соединение формулы (I), где A представляет собой этинилен и q равен 0-5.
Пример варианта осуществления настоящего изобретения включает соединение формулы (I), где X представляет собой сукцинимидо, гидрокси, метил, фенил, C1-5алкилсульфонил, C3-6циклоалкил, C1-5алкилкарбонилокси, C1-5алкокси, фенилкарбонилокси, C1-5алкиламино, ди-C1-5алкиламино или нитрил.
Соединения формулы (I) раскрыты в выданном авторам настоящего изобретения патенте США за номером 6214830, полностью включенном в настоящую заявку путем ссылки.
Пример варианта осуществления настоящего изобретения включает соединение формулы (I), где упомянутое соединение выбрано из следующей группы соединений:
| Соединение | Название |
| 1 | 5(4)-(4-фторфенил)-4(5)-(4-пиридил)имидазол, |
| 2 | 4-(4-фторфенил)-1-(3-фенилпропил)-5-(4-пиридил)имидазол, |
| 3 | 5-(4-фторфенил)-1-(3-фенилпропил)-4-(4-пиридил)имидазол, |
| 4 | 4-(4-фторфенил)-2-йод-1-(3-фенилпропил)-5-(4-пиридил)имидазол, |
| 5 | 4-(4-фторфенил)-2-(4-гидроксибутин-1-ил)-1-(3-фенилпропил)-5-(4-пиридил)имидазол, |
| 6 | 4-(4-фторфенил)-5-(4-пиридил)-1-[2-(триметилсилил)этоксиметил]имидазол, |
| 7 | 5-(4-фторфенил)-4-(4-пиридил)-1-[2-(триметилсилил)этоксиметил]имидазол, |
| 8 | 5-(4-фторфенил)-2-йод-4-(4-пиридил)-1-[2-(триметилсилил)этоксиметил]имидазол, |
| 9 | 5-(4-фторфенил)-4-(4-пиридил)-2-(триметилсилил)этинил-1-[2-(триметилсилил)этоксиметил]имидазол, |
| 10 | 2-(2-хлорвинил)-5-(4-фторфенил)-4-(4-пиридил)имидазол, |
| 11 | 5-(4-фторфенил)-4-(4-пиридил)-1-[2-(триметилсилил)этоксиметил]-имидазол-2-карбоксальдегид, |
| 12 | 2-[2,2-дибромэтилен-1-ил]-5-(4-фторфенил)-4-(4-пиридил)-1-[2-(триметилсилил)этоксиметил]-имидазол-2-карбоксальдегид, |
| 13 | 5(4)-(4-фторфенил)-2-(3-гидрокси-3-фенилпропин-1-ил)-4(5)-(4-пиридил)имидазол, |
| 14 | 5-(4-фторфенил)-4-(4-пиридил)-1-[2-(триметилсилил)этоксиметил]-2-оксиминоимидазол, |
| 15 | 5-(4-фторфенил)-4-(4-пиридил)-2-имидазола оксим, |
| 16 | 2-(5-хлорпентин-1-ил)-4-(4-фторфенил)-1-(3-фенилпропил)-5-(4-пиридил)имидазол, |
| 17 | 4-(4-фторфенил)-2-(4-N-фенилкарбамоилоксибутин-1-ил)-1-(3-фенилпропил)-5-(4-пиридил)имидазол, |
| 18 | 2-(4-хлорбутин-1-ил)-4-(4-фторфенил)-1-(3-фенилпропил)-5-(4-пиридил)имидазол и |
| 19 | 2-(4-диметиламинобутин-1-ил)-4-(4-фторфенил)-1-(3-фенилпропил)-5-(4-пиридил)имидазол. |
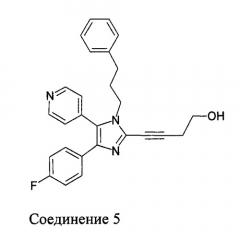
Пример варианта осуществления настоящего изобретения включает соединение формулы (I), где упомянутое соединение представляет собой соединение 5 формулы:
В одном из вариантов осуществления настоящего изобретения упомянутый ингибитор активности фермента GSK-3B представляет собой соединение формулы (II):
,
где:
R выбран из следующей группы заместителей: Ra, -C1-8алкил-Ra, -C2-8алкенил-Ra, -C2-8алкинил-Ra и циано;
Ra выбран из следующей группы заместителей: циклоалкила, гетероциклила, арила и гетероарила;
R1 выбран из следующей группы заместителей: водорода, -C1-8алкил-R5, -C2-8алкенил-R5, -C2-8алкинил-R5, -C(O)-(C1-8)алкил-R9, -C(O)-арил-R8, -C(O)-O-(C1-8)алкил-R9, -C(O)-O-арил-R8, -C(O)-NH(C1-8алкил-R9), -C(O)-NH(арил-R8), -C(O)-N(C1-8алкил-R9)2, -SO2-(C1-8)алкил-R9, -SO2-арил-R8, -циклоалкил-R6, -гетероциклил-R6, -арил-R6 и -гетероарил-R6; где гетероциклил и гетероарил присоединены к атому азота в первом положении азаиндольного ядра через кольцевой атом углерода гетероциклильного или гетероарильного фрагмента;
R5 представляет собой от 1 до 2 заместителей, независимо выбранных из следующей группы заместителей: водорода, -O-(C1-8)алкила, -O-(C1-8)алкил-OH, -O-(C1-8)алкил-O-(C1-8)алкил, -O-(C1-8)алкил-NH2, -O-(C1-8)алкил-NH(C1-8алкил), -O-(C1-8)алкил-N(C1-8алкил)2, -O-(C1-8)алкил-S-(C1-8)алкил, -O-(C1-8)алкил-SO2-(C1-8)алкил, -O-(C1-8)алкил-SO2-NH2, -O-(C1-8)алкил-SO2-NH(C1-8алкил), -O-(C1-8)алкил-SO2-N(C1-8алкил)2, -O-C(O)H, -O-C(O)-(C1-8)алкил, -O-C(O)-NH2, -O-C(O)-NH(C1-8алкил), -O-C(O)-N(C1-8алкил)2, -O-(C1-8)алкил-C(O)H, -O-(C1-8)алкил-C(O)-(C1-8)алкил, -O-(C1-8)алкил-CO2H, -O-(C1-8)алкил-C(O)-O-(C1-8)алкил, -O-(C1-8)алкил-C(O)-NH2, -O-(C1-8)алкил-C(O)-NH(C1-8алкил), -O-(C1-8)алкил-C(O)-N(C1-8алкил)2, -C(O)H, -C(O)-(C1-8)алкил, -CO2H, -C(O)-O-(C1-8)алкил, -C(O)-NH2, -C(NH)-NH2, -C(O)-NH(C1-8алкил), -C(O)-N(C1-8алкил)2, -SH, -S-(C1-8)алкил, -S-(C1-8)алкил-S-(C1-8)алкил, -S-(C1-8)алкил-O-(C1-8)алкил, -S-(C1-8)алкил-O-(C1-8)алкил-OH, -S-(C1-8)алкил-O-(C1-8)алкил-NH2, -S-(C1-8)алкил-O-(C1-8)алкил-NH(C1-8алкил), -S-(C1-8)алкил-O-(C1-8)алкил-N(C1-8алкил)2, -S-(C1-8)алкил-NH(C1-8алкил), -SO2-(C1-8)алкил, -SO2-NH2, -SO2-NH(C1-8алкил), -SO2-N(C1-8алкил)2, -N-R7, циано, (гало)1-3, ги