Изолированный штамм (варианты), обеспечивающий улучшение состояния здоровья жвачных животных, способ его получения, и способ его введения жвачным животным
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Предложены штамм Enterococcus faecium 8G-1 (NRRL В-50173), штамм Enterococcus faecium 8G-73 (NRRL B-50172) и штамм Bacillus pumilus 8G-134 (NRRL B-50174), обеспечивающие улучшение состояния здоровья жвачных животных. На основе любого из указанных штаммов или их комбинации в сочетании с монензином получают состав, обеспечивающий улучшение состояния здоровья жвачных животных. Предложены также варианты способа улучшения состояния здоровья жвачных животных, включающего введение указанных штаммов самих по себе или в комбинации в том числе с монензином. Предусмотрен также способ получения вводимого жвачным животным микроорганизма. Группа изобретений может быть использована для лечения или профилактики ацидоза, для улучшения показателей здоровья жвачных животных и/или повышения их продуктивности. 8 н. и 10 з.п. ф-лы, 8 ил., 11 табл., 4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к штаммам и способам контроля ацидоза. Более конкретно, данное изобретение относится к бактериальным штаммам, пригодным для улучшения здоровья жвачных животных и/или повышения их продуктивности и к способам получения и применения штаммов.
ОПИСАНИЕ УРОВНЯ ТЕХНИКИ
Применение высоких концентраций способных к ферментации углеводов в рационе жвачных животных стало широко практиковаться в мясной и молочной промышленности в течение последних 50 лет. Необходимость в повышении продуктивности и улучшении качества мяса привела к указанной тенденции. Повышение продуктивности происходило не без некоторых трудностей. Увеличение потребления способных к ферментации углеводов жвачными животными за счет потребления больших количеств зерна хлебных злаков привело к возрастанию случаев метаболических расстройств, таких как ацидоз. Взаимосвязь между потреблением больших количеств зерна и ацидозом у жвачных животных подробно описана в обзорах (Dunlop, 1972; Slyter, 1976). Многие исследователи выявили уменьшение рН в организме жвачных животных после потребления скотом больших количеств углеводов, способных к ферментации (RFC), и последующего разрушения рубцовой микробиоты и физиологических изменений, происходящих в организме животных (Allison et al., 1975; Hungate et al., 1952; Elam, 1976). Большая часть исследователей приписывает это уменьшение чрезмерному продуцированию органических кислот Рубцовыми бактериями, такими как Streptococcus bovis. Однако влияние избыточного количества углевода на рубцовую микробиоту, которое инициирует такой ответ, до сих пор подробно не описано.
В прошлом эффективное управление составом рациона было единственным способом борьбы с ацидозом. Более конкретно, зерно разбавляли грубым кормом и увеличивали количество пищевого концентрата, тщательно контролируя это увеличение постепенно, чтобы обеспечить равный переход к большим количествам концентрата в течение 14-21 дней. Большинство промышленных площадок для откорма скота используют получение и доставку нескольких "адаптационных" кормов, которые содержат зерно и кормовые растения в различных соотношениях.
Хотя составление кормовых рационов обычно является довольно эффективным при контроле ацидоза, оно является очень дорогостоящим для производителя из-за высокой стоимости получения, транспортировки, измельчения кормовых растений, утилизации увеличившихся отходов и низкой производительности. Производители кормов и менеджеры на площадках для откорма скота должны применять такие подходы, которые позволят осуществить эффективное получение рационов с высоким содержанием концентратов.
Другие подходы пытались объединить применение адаптационных кормов с питательными антимикробными компонентами, такими как ионофоры. Ионофоры ингибируют поглощение и уменьшают образование молочной кислоты в рубце путем снижения руминальных популяций грамположительных организмов, продуцирующих молочную кислоту, таких как Streptococcus bovis и Lactobacillus spp. (Muir et al., 1981).
Хотя применение ионофоров снизило возможность возникновения острого ацидоза на площадках для откорма скота, нежелание производителей использовать антибиотики в производстве мяса и необходимость в непрерывном поиске путей уменьшения расходов при повышении продуктивности животных и улучшении качества туш животных привели к изучению альтернативных способов уменьшения случаев ацидоза и повышения продуктивности скота на площадках для откорма.
Применение непосредственно вводимых микробов (DFM) как метода модулирования функции рубца (первого отдела желудка) и повышения продуктивности животных получило все большее распространение в течение последних 10 лет. Существуют две основных технологии непосредственного введения микробов, которые доступны в настоящее время в мясной промышленности для контроля ацидоза в рубцовом содержимом: (1) применение технологии DFM, продуцирующих молочную кислоту, и (2) добавление специфических видов бактерий, способных использовать молочную кислоту в рубцовом содержимом. Хотя описанный механизм действия указанных двух технологий является различным, обе эти технологии пытаются решить проблему с накоплением молочной кислоты в рубцовом содержимом.
Первый подход, а именно применение DFM, продуцирующих молочную кислоту, предусматривает повышение скорости утилизации молочной кислоты в рубцовом содержимом путем стимулирования нативной руминальной флоры. Как сообщалось, добавление сравнительно медленно растущих бактерий, продуцирующих молочную кислоту, таких как виды Enterococcus, приводит к образованию слегка повышенной концентрации молочной кислоты в рубцовом содержимом. Постепенное увеличение приводит к адаптации микрофлоры в рубце к большему количеству утилизирующих молочную кислоту компонентов. Однако эти штаммы Enterococcus не обеспечили адекватного контроля и предотвращения ацидоза.
Второй подход, а именно добавление специфических видов бактерий, способных к утилизации молочной кислоты в рубцовом содержимом, основан на обнаружении того факта, что вид Propionibacterium значительно минимизирует накопление молочной кислоты в рубцовом содержимом во время вспышки ацидоза с большим количеством легко поддающегося ферментации углевода (RFC). Propionibacterium являются природными компонентами рубцового содержимого у молочных и мясных животных и функционируют в рубце с использованием молочной кислоты для продуцирования важных летучих жирных кислот, таких как уксусная и пропионовая.
Современные технологии с применением DFM, появившиеся к настоящему времени, основаны на устаревшем понимании причин возникновения ацидоза в рубце. До настоящего времени методы изучения микробной экологии рубца основывались на методике культивирования. Эти методики были ограничены из-за неизвестности требований к росту бактерий и неподходящих анаэробных условий для многих микроорганизмов в рубцовом содержимом. Таким образом, экологические исследования, основанные на этих методиках культивированные, полагались на ограниченное понимание природы руминальной микробиоты.
Используемые в настоящее время DFMs, применяемые в отдельности или с дрожжами для минимизации риска ацидоза в рубце и улучшения утилизации корма, даваемого на площадках для откорма скота, содержащего концентрат в большом количестве, обеспечили получение неоднозначных результатов. Однако изучение штаммов DFMs Propionibacterium H15 и Enterococcus faecium EF212 и E.faecium EF212, добавляемых в отдельности или в комбинации с дрожжами, Saccharomyces cerevisiae, показало, что добавление DFM вместе с дрожжами или без них не оказывает влияния на предотвращение ацидоза в рубце (Yang W., 2004).
С учетом сказанного выше, было бы желательно обеспечить создание одного или более штаммов для профилактики и/или лечения ацидоза. Было бы предпочтительно, если один или более штаммов привели к улучшению здоровья жвачных животных и/или к повышению их продуктивности. Было бы также желательно разработать способы получения и применения этих штаммов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение, объем которого определен формулой изобретения, приведенного в конце данного описания, предусматривает решение по меньшей мере некоторых проблем, указанных выше. Предусмотрены изолированные штаммы, включая штамм 8G-1 Enterococcus faecium (NRRL В-50173), который обладает всеми идентифицирующими признаками штамма 8G-1 Enterococcus faecium (NRRL B-50173), штамм 8G-73 Enterococcus faecium (NRRL B-50172), штамм, имеющий все идентифицирующие признаки штамма 8G-73 Enterococcus faecium (NRRL B-50172), штамм 8G-134 Bacillus pumilus (NRRL B-50174), штамм, имеющий все идентифицирующие характеристики штамма 8G-134 Bacillus pumilus (NRRL B-50174), и их комбинации.
Кроме того, предусмотрена комбинация, включающая один или более штаммов, указанных выше, и монензин.
Предусмотрен также способ введения эффективного количества одного или более штаммов, перечисленных выше, животному и способ введения комбинации, включающей эффективное количество одного или более штаммов, перечисленных выше, и монензин, животному.
Согласно по меньшей мере некоторым вариантам введение одного или более штаммов животному обеспечивает наличие по меньшей мере одного из следующих преимуществ для животного, по сравнению с животным, которому не вводили штамм: (а) уменьшение ацидоза, (б) стабилизация метаболизма в рубце, о чем свидетельствует замедленное накопление молочной кислоты и пролонгирование продуцирования летучих жирных кислот, (в) более быстрое восстановление после вспышки ацидоза, о чем свидетельствует восстановление величины рН и уменьшение содержания молочной кислоты, (г) уменьшение проявления клинических симптомов, связанных с ацидозом, (д) увеличение образования молока у дойных коров, (е) повышение содержания жира в молоке у дойных коров, (ж) снижение количества соматических клеток (SCC) у дойных коров, (з) улучшение иммунологического отклика и здоровья, о чем свидетельствует снижение SCC, и (и) повышение продуктивности дойных коров,
Предусмотрен также способ получения непосредственно вводимых микробных препаратов. В этом способе штамм, выбранный из группы, состоящей из штамма 8G-1 Enterococcus faecium (NRRL В-50173), штамма 8G-73 Enterococcus faecium (NRRL B-50172) и штамма 8G-134 Bacillus pumilus (NRRL B-50174), выращивают в жидком питательном бульоне. Штамм выделяют из жидкого питательного бульона с получением микробного препарата для непосредственного введения (скармливания). Согласно по меньшей мере некоторым вариантам этого метода штамм высушивают при замораживании.
Дополнительно предусмотрен способ получения непосредственно скармливаемого микробного препарата. В этом способе штамм, выбранный из группы, состоящей из штамма 8G-1 Enterococcus faecium (NRRL В-50173), штамма 8G-73 Enterococcus faecium (NRRL B-50172) и штамма 8G-134 Bacillus pumilus (NRRL B-50174), выращивают в жидком питательном бульоне. К этому микробному препарату для непосредственного скармливания добавляют монензин.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Предпочтительные примерные варианты изобретения, описанные в данной заявке, иллюстрируются прилагаемыми рисунками, на которых имеется одинаковая нумерация одних и тех же позиций и которые представляют собой следующие Фигуры.
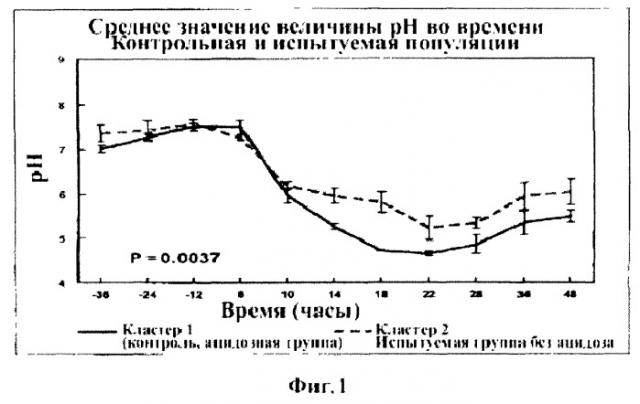
На Фигуре 1 приведен график, показывающий разницу в величине рН у испытуемой популяции (неацидозной; кластер 2) и контрольной (ацидозной; кластер 1) популяции.
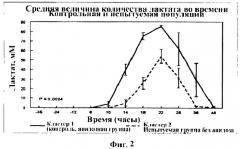
На Фигуре 2 приведен график, показывающий различия накопления молочной кислоты у испытуемой популяции (неацидозной; кластер 2) и контрольной (ацидозной; кластер 1) популяции.
На Фигуре 3 показан график, показывающий зависимость величины концентрации глюкозы in vitro от времени лечения,
На Фигуре 4 показан график, показывающий зависимость величины концентрации молочной кислоты in vitro от времени лечения.
На Фигуре 5 приведен график зависимости величины концентрации VFA (ацетат + пропионат + бутират) от времени.
На Фигуре 6 приведен график зависимости средней величины рН рубцового содержимого от времени у контрольных животных и животных с DFM.
На Фигуре 7 показан график зависимости средней величины лактата в рубцовом содержимом от времени у контрольных животных и животных с DFM.
Фигура 8 показывает график зависимости величин концентрации VFA в зависимости от времени лечения (общее содержание VFA = ацетат + пропионат + бутират).
Прежде чем ниже будут описаны подробно варианты изобретения, следует уяснить, что данное изобретение не ограничивается деталями и компонентами, описанными в описании и показанными на рисунках. Данное изобретение может иметь и другие варианты и может быть осуществлено другими путями. Следует также иметь в виду, что фразеология и терминология, применяемые в данной заявке, служат для описания изобретения и не следует их рассматривать как ограничивающие изобретение.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение предусматривает штаммы. Предусмотрены также способы получения и применения этих штаммов.
Согласно по меньшей мере некоторым вариантам непосредственно скармливаемые микробные препараты (DFM), получаемые при помощи одного или более штаммов, предусмотренных изобретением, дают возможность производителям мяса и молока продолжать применять схемы питания для оптимизации роста и продуктивности без ухудшения здоровья животных, вызванного расстройством пищеварения, связанным с ацидозом в рубце. По меньшей мере некоторые варианты DFM выбраны на основании регулирования концентраций лактата в рубцовом содержимом путем утилизации лактата или сенсибилизации рубца для поддержания микрофлоры, утилизирующей лактат. Созданы по меньшей мере некоторые варианты DFMs для поддержания необходимой энергии в рубце. В отличие от DFMs, имеющихся на рынке в настоящее время для облегчения ацидоза, по меньшей мере некоторые варианты изобретения не были созданы для решения проблемы после ее возникновения, а скорее предназначены для предотвращения возникновения этой проблемы.
Штаммы:
Согласно данному изобретению предусмотрены штаммы, которые включают штамм 8G-1 Enterococcus faecium, штамм 8G-73 Enterococcus faecium и штамм 8G-134 Bacillus pumilus, которые в данной заявке обозначаются как 8G-1, 8G-73 и 8G-134, соответственно.
Штаммы Enterococcus faecium 8G-1, Enterococcus faecium 8G-73 и Bacillus pumilus 8G-134 были депонированы 29 августа 2008 г в Agricultural Research Service Culture Collection (NRRL), 1815 North University Street, Peoria, Illinois, 61604 и получили номера доступа В-50173, В-50172 и В-50174, соответственно. Депонирование было осуществлено в соответствии с условиями Будапештского Договора о международном признании депонирования микроорганизмов для целей патентной процедуры. Один или более штаммов, указанных выше, может быть использован в качестве непосредственно скармливаемого микроорганизма (DFM).
Для целей данного изобретения термин "биологически чистый штамм" означает штамм, не содержащий никаких других бактериальных штаммов в количествах, достаточных для воздействия на процесс репликации штамма или для обнаружения их обычными бактериологическими методами. Термин "изолят" в отношении организмов и культур, описанных в данной заявке, включает не только биологически чистый штамм, но также любую культуру организмов, которая выращена или выделена из натурального сырья. Согласно некоторым вариантам штаммы представляют собой мутанты, варианты или производные штаммов 8G-1, 8G-73 или 8G-134, которые также имеют преимущества по сравнению со штаммами 8G-1, 8G-73 и 8G-134. Согласно некоторым вариантам штаммы представляют собой штаммы, обладающие всеми идентифицирующими признаками штаммов 8G-1, 8G-73 или 8G-134. Кроме того, каждый индивидуальный штамм (8G-1, 8G-73 или 8G-134) или любая комбинация этих штаммов могут также обеспечить одно или более преимуществ, описанных в данной заявке. Очевидно также, что добавление других штаммов микроорганизмов, носителей, добавок, ферментов, дрожжей и т.п. также обеспечит осуществление контроля за ацидозом и не приведет к получению существенно отличающегося DFM.
Штаммы Bacillus имеют много качеств, которые делают их полезными для применения в качестве DFM. Например, некоторые виды Bacillus имеют статус GRAS (обычно признаваемые как безопасные), то есть они обычно признаны как безопасные US Food and Drug Administration и одобрены также для применения в кормах для животных Association of American Feed Control Officials (AAFCO). Штаммы Bacillus, описанные в данной заявке, являются аэробными и факультативными спорообразующими и, таким образом, являются стабильными. Виды Bacillus представляют собой единственные спорообразующие штаммы со статусом GRAS. Штамм Bacillus, который, как было обнаружено, предотвращает или лечит ацидоз, представляет собой штамм 8G-134 Bacillus pumilus.
Штаммы Enterococcus также имеют много свойств, которые делают их пригодными для применения в качестве DFM.
Как известно, штаммы Enterococcus находятся в желудочно-кишечном тракте моногастрических животных и жвачных животных и выживают в этой среде. Было показано, что Enterococcus являются факультативными анаэробными организмами, что придает им стабильность и активность как в аэробных условиях, так и в условиях кислородного голодания. Штамм 8G-1 Enterococcus faecium и штамм 8G-73 Enterococcus faecium были идентифицированы изобретателями как полезные для этих целей.
Получение штаммов:
В соответствии с по меньшей мере одним вариантом каждый из штаммов, описанных в данной заявке, культивируется в отдельности с использованием обычных методов жидкофазной или твердофазной ферментации. Согласно по меньшей мере одному варианту штамм Bacillus и штаммы Enterococcus выращивают в жидкой питательной среде, в случае Bacillus - до образования самого большого количества спор. Штамм Bacillus получают путем ферментации штамма бактерий, этот процесс начинается с масштабирования посеянной культуры. Он включает повторяющуюся в асептических условиях передачу культуры во все увеличивающийся объем, где она служит в качестве инокулята для ферментации, которая может быть осуществлена в больших ферментерах из нержавеющей стали в среде, содержащей белки, углеводы и минералы, которые необходимы для оптимального роста. Неограничивающими примерами сред являются MRS или TSB. Однако можно использовать и другие среды. После добавления инокулята в ферментер для достижения максимального роста контролируют температуру и скорость перемешивания. По одному из вариантов штаммы выращивают при температуре от 32°С до 37°С при перемешивании. Как только достигается максимальная плотность популяции, культуру собирают путем отделения клеток от среды для ферментации. Обычно это осуществляют путем центрифугирования.
Согласно одному из вариантов при получении штамма Bacillus ферментацию штамма Bacillus проводят до плотности от 5×108 кое/мл до примерно 4×109 кое/мл. Согласно по меньшей мере одному варианту величина плотности популяции составляет 2×109 кое/мл. Бактерии собирают путем центрифугирования и удаляют надосад очную жидкость. Затем пеллетированные бактерии можно применять для получения DFM. Согласно по меньшей мере некоторым вариантам пеллетированные бактерии сушат при замораживании и затем используют для получения DFM. Однако нет необходимости высушивать Bacillus замораживанием перед их применением. Штаммы можно также использовать с консервантами или без них в концентрированном, неконцентрированном или в разбавленном виде.
Затем может быть определено количество микробов, образующих колонии, Кое, или колониеобразующая единица, обозначает количество жизнеспособных клеток в образце, полученных стандартными методами микробиологического посева. Термин произошел от того, что одна клетка, посеянная в подходящей среде, будет расти и образовывать жизнеспособную колонию на агаре. Поскольку многие клетки образуют одну видимую колонию, термин "колониеобразующая единица" является более полезной единицей измерения, чем количество клеток.
Применение штаммов:
Согласно по меньшей мере некоторым вариантам для образования DFM применяют один или более штаммов. К штамму могут быть добавлены один или более носителей, включая, но без ограничения, сахарозу, мальтодекстрин, известняк и рисовую шелуху.
Для смешения штамма (-ов) и носителей (когда они используются) их добавляют в ленточный или лопастный смеситель и перемешивают в течение примерно 15 мин, хотя это время можно увеличить или уменьшить. Компоненты перемешивают до получения однородной смеси культур и носителей. Конечный продукт преимущественно представляет собой сухой текучий порошок, на его основе может быть получен продукт с желательной конечной концентрацией DFM.
Согласно по меньшей мере одному варианту данного способа получения DFM, штамм, описанный в данной заявке, выращивают в такой среде, как жидкий питательный бульон. Штамм отделяют от жидкой питательной среды для получения непосредственно скармливаемого препарата. Штамм после отделения от бульона может быть высушен замораживанием.
Один или более штаммов, выбранных из штамма 8G-1 Enterococcus faecium, штамма 8G-73 Enterococcus faecium и штамма 8G-134 Bacillus pumilus, можно скармливать животным для уменьшения или даже устранения случаев возникновения ацидоза. Для этой цели животным вводят эффективное количество одного или более штаммов. После введения животным штамм (штаммы) обеспечивает (-ют) по меньшей мере одно из следующих преимуществ для животных: (а) уменьшает (-ют) ацидоз у животных, (б) стабилизирует (-ют) метаболизм в рубце, о чем свидетельствует замедленное накопление молочной кислоты и пролонгированное образование летучих жирных кислот, (в) обеспечивает (-ют) более быстрое восстановление животных после вспышки ацидоза, что показывают величина рН и уменьшение количества молочной кислоты, и (г) не вызывает (-ют) проявления клинических признаков, связанных с ацидозом.
В качестве животных используют скот, включая мясных и молочных животных, то есть одного или более животных из быков, бычков-кастратов, телок, телят или коров; козлов, овец, лам, альпак; других животных с четырехкамерным желудком и жвачных животных, у которых может быть дисбаланс в рубце, когда их питают легко ферментирующимся углеводом (RFC).
Согласно по меньшей мере одному из вариантов, когда животным скармливают штамм 8G-1 Enterococcus faecium или штамм 8G-73 Enterococcus faecium, этот штамм вводят в таком количестве, что животные ежедневно получают от примерно 5×108 кое/голову/день до примерно 5×1010 кое/голову/день. Согласно по меньшей мере одному варианту, когда животным скармливают штамм 8G-134 Bacillus pumilus, этот штамм вводят в таком количестве, чтобы животные ежедневно получали от примерно 5×108 кое/голову/день до примерно 5×1010 кое/голову/день. В соответствии с по меньшей мере одним вариантом в случае введения двух и более штаммов из штамма 8G-1 Enterococcus faecium, штамма 8G-73 Enterococcus faecium и штамма 8G-134 bacillus pumilus эти штаммы вводят животным в таком количестве, что они ежедневно получали от примерно 5×108 кое/голову/день до примерно 5×1010 кое/голову/день в виде общей дозы штаммов. Штамм может вводиться животным в возрасте от 30 дней в течение всей продуктивной жизни взрослых жвачных животных или в течение других промежутков времени.
Согласно по меньшей мере одному варианту штамм скармливают как непосредственно скармливаемый микробный препарат (DFM), и DFM используется в виде подкормки к дневному рациону. Кроме того, штамм может скармливаться в составе общего смешанного рациона, гранулированного корма, смешанного с жидким кормом, в виде штамма, смешанного с белковым премиксом, в составе витаминного и минерального премикса.
Согласно по меньшей мере одному варианту штамм вводится как DFM и DFM скармливается в сочетании с лекарственным монензином типа A (Rumensin®) в дневной дозе, равной примерно 50-660 мг/животное. Монензин скармливают для повышения эффективности питания, так как ионофор обеспечивает проницаемость мембраны бактериальной клетки, создающей дисбаланс ионов между внутриклеточным и внеклеточным пространством. Этот отклик влияет на популяции микробиот в рубце и ферментацию корма для улучшения эффективности питания животных.
Согласно по меньшей мере одному варианту штамм вводится как DFM и DFM скармливают в сочетании с лекарственным тилозинфосфатом типа A (Tylan®) в дневной дозе, равной примерно 60-90 мг/голову. Тилозинфосфат скармливают мясным животным для уменьшения абсцессов в печени, вызванных Fusobacterium necrophorum и Actinomyces pyogenes.
ПРИМЕРЫ
Следующие ниже примеры приведены только с целью иллюстрации. Эти примеры включены только для более полного понимания описанного изобретения. Примеры не ограничивают объем изобретения, описанного и заявленного в данной заявке.
Пример 1
Экспериментальная модель ацидоза:
Десять кроссбредных бычков-кастратов распределяли по весу в два загона. Дневной рацион всех испытуемых животных до их отбора состоял из 45% грубого корма и 55% концентрата в расчете на сухую основу. Скоту давали рацион один раз утром (15 ф/голову/день), а остальной корм помещали ближе к стойловой раме поздно вечером. Животных в обоих загонах выдерживали на голодной диете в течение 24 ч до выбора и затем давали кормовой концентрат. Кормовой концентрат состоял из быстро ферментирующихся источников углеводов, обработанных паром кукурузных хлопьев (90% основы). После голодной диеты в течение 24 ч концентрат давали в неограниченном количестве, загружая 100 ф/загон во все загоны (0ч). Потребление выбранного стимулирующего корма отслеживали визуально и, если это было необходимо, загружали дополнительное количество корма.
Образцы жидкости из рубца получали от отдельных животных путем оральной интубации с применением трубки, соединенной с вакуумной колбой. Разные колбы и трубки для отбора проб применяли для каждого загона для того, чтобы свести к минимуму перекрестное загрязнение микробиоты. Жидкость из рубца, отобранную в вакуумную колбу, декантировали в стерильные трубки Falcon объемом 50 мл и прикрепляли к ним этикетки с указанием времени отбора пробы и номера животного (метки в ухе). Образцы содержимого рубца отбирали у животных в обоих загонах в моменты времени -36 ч, -24 ч и -12 ч. Образцы, отобранные в моменты времени -36 ч и -24 ч, представляли исходные физиологические данные для каждого животного. Образцы, отобранные в момент времени -12 ч, отражали показатели жидкого содержимого рубца натощак для каждого животного. Момент времени 0ч означает начало подачи корма. Пробы жидкого содержимого рубца отбирали от всех животных каждые 4 ч, начиная от +6 ч до +22 ч. Образцы из всех загонов отбирали в моменты времени +28, +36 и +48 ч. Величину рН образцов содержимого рубца определяли сразу же после взятия пробы. Все образцы замораживали и подготавливали для отправки в Agtech Products. Inc. (Waukesha, WI) для дальнейшего анализа.
Содержание летучих жирных кислот и углеводов определяли в каждой пробе содержимого рубца в отдельности. Для проведения анализа методом HPLC из жидкого содержимого рубца, отобранного у каждого животного в определенный момент времени, отбирали дубликаты образцов объемом 1,0 мл. Образцы помещали в трубку (1,5 мл) микроцентрифуги и центрифугировали (10 мин, 12500 об/мин) с получением осадка. Надосадочную жидкость (750 мкл) помещали в чистую пробирку и подкисляли равным объемом 5 мМ H2SO4. Подкисленную жидкость тщательно перемешивали и отфильтровывали через 0,2 мкм фильтр в пробирку (2 мл) для автоматического отбора образцов HPLC и закрывали ее. Образцы анализировали при помощи системы Waters 2690 HPLC (Waters Inc., Milford, MA). Образцы впрыскивали в мобильную фазу (5 мМ H2SO4), нагретую до 65°С, и разделяли, применяя колонку BioRad HPX-87H (Bio-Rad Laboratories, Inc., Hercules, CA). Стандартизацию метода HPLC проводили, применяя ряд концентраций для каждого тестируемого соединения. В качестве стандартов использовали декстрозу (глюкозу) лактат, метилглиоксаль, бутират, пропионат и ацетат.
Определение бактериальных генов в неацидозной микрофлоре жвачных животных
Супрессивная субтрактивная гибридизация
Для определения разницы в популяциях микробов в двух наборах отобранных образцов содержимого рубца применяли набор Genome Subtraction Kit (Klontech, Palo Alto, CA). Проводили иерархический кластерный анализ для определения сходства и различия между животными, измеряли величины рН и профили молочной кислоты во времени. Кластерный анализ позволил выявить животных 2069, 2071, 2078, 2113 и 2127 в кластере 1 и животных 2107, 2115, 2088, 2133 и 2124 в кластере 2. Проводили повторный анализ для сравнения величин рН и профилей молочной кислоты для кластера 1 и кластера 2. Все переменные анализировали по отдельности. Кластер 1 характеризовался значительно более высоким средним значением профиля молочной кислоты по сравнению с кластером 2 (Р=0,0004) и меньшим средним значением величины рН (Р=0,037) в течение всего периода потребления стимулирующего корма (Фигуры 1 и 2). Жидкое содержимое рубца собирали в кластере от каждого отдельного животного для осуществления метода супрессивной субтрактивной гибридизации.
Стратегия проведения супрессивной субтрактивиой гибридизации (SSH) была выбрана для того, чтобы сравнить образцы ДНК содержимого рубца у скота в кластере 1 с образцами в кластере 2, время отбора образцов составляло: +6 ч, +10 ч, +14 ч и +18 ч. Супрессивную субтрактивную гибридизацию осуществляли, используя животных в кластере 2 в качестве испытуемых (неацидозный скот) и животных в кластере 1 в качестве контрольной (драйвер) популяции. SSH гипотетически должна была привести к получению уникальных фрагментов ДНК из организмов, которые обеспечивают низкое содержание молочной кислоты и более высокие величины рН (энергия в рубце стимулирует организм). Осуществив субтракции с использованием образцов, отобранных в момент времени +10 ч, получили фрагменты (гены) ДНК из организмов, которые были способны модулировать утилизацию избытка энергии в содержимом рубца в виде RFC и ослаблять возможное действие ацидоза.
Клонирование и скрининг библиотеки уникальных испытуемых последовательностей
Специфические последовательности ДНК штаммов, выделенные после субтракции, клонировали для дальнейшего анализа. Последовательности ДНК вставляли в вектор pCR2.1 (Invitrogen) и трансформировали в клетки компетентной культуры штамма Е.coli TOP-10. Смесь для трансформации помещали в чашки Петри 22×22 см с агаром LB, содержащие 50 мкг/мл канамицина, и сверху наносили Х-gal в DMF (40 мг/мл). Чашки Петри инкубировали при температуре 37°С в течение 24 ч. Рекомбинантные колонии (белые колонии) собирали в стерильные микротитрационные планшеты, содержащие среду LB и канамицин (50 мкг/мл). Содержимое всех лунок, содержащее продукты рекомбинантной ПЦР, разделяли на Аликвоты, равные 1 мл. Одну аликвоту очищали, используя набор Qiaquick PCR Purification Kit (Qiagen), вторую аликвоту гранулировали путем центрифугирования, вновь суспендировали в среде LB + Kan + 10% глицерина и хранили при температуре -80°С.
Саузерн-гибридизация
Проводили слот-блот гибридизацию, используя стандартные протоколы. Для подтверждения специфичности клонированных вставок ДНК положительно заряженные блоттирующие мембраны Zeta-Probe® Blotting Membranes (Bio-Rad Laboratories; Hercules, CA) подвергали гибридизации при помощи проб из исходных тестер-ДНК и драйвер-ДНК, расщепленных при помощи AluI и меченных дигоксигенином с применением набора DIG High Prime DNA labeling Kit (Roche Diagnostics Corporation Indianapolis, IN). Рекомбинантные вставки, характеризующиеся гомологичностью последовательностей тест-ДНК, но не драйвер-ДНК, были выбраны для анализа последовательностей осуществляли гибридизацию клонированных вставок. В каждый промежуток времени осуществляли субтракцию, 6, 10, 14 и 18. Из SSH 6, 10, 14 и 18 клонированные вставки 12, 29, 105 и 29, соответственно, были тестер-специфическими.
Была определена ДНК последовательность из каждой тестер-положительной вставки (Lark Technologies; Houston, TX). Последовательность из каждой вставки сравнивали с последовательностями в базе данных NCBI с использованием функции blastX. Осуществляли трансляцию нуклеотидных последовательностей и путем сравнения последовательностей с последовательностями в базе данных NCBI с применением функции blastX определяли функцию генов. Функцию генов относили к категории генов, используя веб-сайт Clusters of Orthologous Groups (COG), где представлены ортологичные гены. Идентифицированные гены COG использовали для получения конструкта олигонуклеотидных проб для гибридизации колоний и слот-блот гибридизации. Четыре гена из 29 были выбраны из SSH 10 для гибридизации колоний на основе функциональных атрибутов при выборе животных из числа, не страдающих от ацидоза. Гены, выбранные из клонов 79, 84, 94 и 110, идентифицировали при помощи программы NCBI blastX с функциями бета-ксилозидазы, транспортера глюкозы/галактозы, 4-альфа-глюканотрасферазы и 4-альфа-глюканотрансферазы, соответственно. Все гены, выбранные для проведения гибридизации колоний, имели определенные свойства, идентифицированные согласно COG как функции метаболизма и переноса углеводов, которые обеспечат полученным бактериям, содержащим эти гены, преимущество в метаболизме избытка энергии, который обнаруживается в рубце, сенсибилизированном при помощи RFC.
Гибридизация колоний
Жидкое содержимое рубца, собранное во время определения ацидоза у животных в моменты времени +10 ч, +14 ч и +18 ч, использовали для осуществления гибридизации. Во время каждого из указанных периодов были выбраны животные 2107, 2124, 2115, 2088 и 2133. Эти экземпляры являются представителями животных, которых отобрали ранее для "тестер-популяции" или группы, не страдающей от ацидоза. Отдельные образцы содержимого рубца отбирали при -20°С и давали им разморозиться при комнатной температуре. Размороженные образцы содержимого рубца высевали в отдельности в трех раздельных средах (используя дупликаты). Используемые среды состояли из агара с лактатом натрия (NLA), лактатного агара для селективного выделения Propionibacterium (LPSA) и модифицированной среды для Clostridial усиленной (RCS). RCS была похожа на коммерчески доступную среду для клостридий усиленную и не содержащую глюкозы. Таким образом, основным источником углеводов в RCS является крахмал.
Таблица 1, приведенная ниже, показывает условия инкубации и разбавления жидкого содержимого рубца, посеянного в каждой среде.
| Таблица 1. | ||||
| Условия инкубации и разбавления в каждой среде | ||||
| Условия инкубации | ||||
| Среда | Условия О2 | Время инкубации | Температура инкубации | Разбавление |
| LPSA | анаэробные | 7 дн | 32°С | 10-1, 10-2 |
| NLA | анаэробные | 5 дн | 37°С | 10-2, 10-3 |
| RCS | анаэробные | 48 ч | 37°С | 10-1, 10-2 |
После инкубации собирали отдельные колонии и инокулировали в пробирках с 10 мл бульона, состоящего из соответствующей среды, кроме LPSA, который инокулировали в NLB. В каждый момент времени от каждого животного выбирали колонии (пять животных × три момента времени). В случае RCS от каждого животного в определенный период времени собирали пять колоний. В среде LPSA наблюдались образование меньшего числа колоний и разнообразие видов и количества колоний в чашках Петри для каждой пары животное - момент времени. Из среды NLA были выбраны две колонии/животное - момент времени, исключено было животное 2107 в момент времени 18 ч. Для этого случая были собраны шесть колоний из-за видимого их разнообразия. Не во всех инокулированных пробирках наблюдался рост бактерий после инкубации.
Содержимое пробирок, в которых наблюдался рост, делили на две отдельные Аликвоты 9 мл и 1 мл. Аликвоту 1 мл использовали для выделения ДНК при помощи набора High Pure PCR Template Preparation Kit (Roche Molecular Biochemicals, Mannheim, Germany). Аликвоту 9 мл помещали в стерильную пробирку (15 мл) Falcon и центрифугировали до образования твердой гранулы. Затем эту гранулу воссоздавали в средах NLB или RCS, содержащих 10% глицерина. Воссозданный образец хранили до использования при температуре, равной -80°С. Экстрагированную ДНК затем использовали для анализа изолятов методом RAPD-PCR с целью определения филогенетических взаимосвязей. Анализ проводили с помощью базы данных Bio-Numerics (Applied Maths Inc., Austin, TX) для определения сходства изолятов, используя характер исчерченности RAPD DNA. Коэффициент подобия изолятов определяли при помощи коэффициента Дайса и метода невзвешенных парных групп. Для того, чтобы сгруппировать 109 изолятов в 65 отдельных кластеров, применяли коэффициент подобия равный 80% или больше. Из 65 кластеров 23 росли только в RCS, 11 росли только в среде LPSA, 14 росли только в среде NLA, 4 кластера росли и в RCS, и в LPSA, 6 кластеров росли и в RCS, и в NLA, 3 кластера росли и в LPSA, и в NLA и 4 кластера находились во всех трех средах.
Проводил слот-блот-гибридизацию с помощью прибора Bio-Dot SF Microfiltration Apparatus (BIO-RAD; Hercules, CA). Выбирали геномную ДНК одного изолята в кластере как представляющую этот кластер и блоттировали на мембранах. Пробы для гибридизации готовили с помощью набора PCR DIG Probe Synthesis Kit (Roche Molecular Biochemicals; Mannheim, Germany). Пробы выбирали на основе анализа клонированных вставок, они состояли из четырех клонированных вставок (клоны 79, 84, 94 и 110) из SSH 10. До проведения гибридизации собирали меченые пробы. Гибридизацию проводили при температуре 45°С в течение 5 ч. В течение ночи давали развиться колориметрическим реакциям на мембранах. В тридцати из 37 изолятов (кластеров) на RCS мембране происходила гибридизация, о чем свидетельствовала колориметрическая реакция, в 25 из 28 изолятов гибридизация происходила на LPSA/NLA мембране.
Изоляты, в которых происходила гибридизация, подготавливали для секвенирования гена 16S рРНК. Вкратце, ген 16S рРНК каждого из 55 изолятов амплифицировали методом GWH (PCR) с применением праймеров 8F (AGAGTTTGATYMTGGCTCAG) и 1406R (ACGGGCGGTGTGTRC). Продукт ПЦР очищали при по