Способ выявления микобактерий туберкулеза генотипа веijing в режиме реального времени
Иллюстрации
Показать всеИзобретение относится к медицине и микробиологии. Предложен способ определения микобактерий туберкулеза генотипа Beijing в режиме реального времени путем определения вставки элемента IS6110 в локусе генома dnaA-dnaN, отличающийся тем, что применяют ПЦР в режиме реального времени с использованием двух специфических праймеров 5`-AGATCAGAGAGTCTCCGGACTCA и 5`-CGCCGGGACTGTATGAGTCT и флуоресцентно-меченого зонда R6G-5`-TGTGCACAGCGACACTCACAGCCA-3`-BHQ2, оценку результата производят путем регистрации сигнала флуоресценции по каналу R6G с длиной волны 555нм, причем при наличии в образце ДНК штамма микобактерий туберкулеза генотипа Beijing экспоненциальный рост сигнала флуоресценции ПЦР при анализе чистой ДНК происходит между 10-15 циклами, а при анализе клеточных лизатов - между 15 и 20 циклами. Изобретение может быть использовано для лабораторного определения микобактерий туберкулеза генотипа Beijing. 3 ил., 2 пр.
Реферат
Изобретение относится к медицине, а именно к фтизиатрии, и может быть использовано для лабораторного определения микобактерий туберкулеза, относящихся к генотипу Beijing.
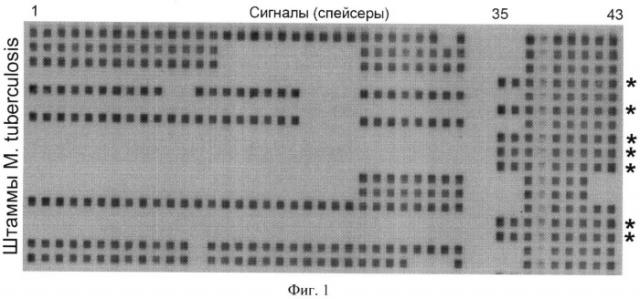
Возбудитель туберкулеза человека - Mycobacterium tuberculosis имеет клональную структуру популяции, представленную отдельными генетическими семействами. При этом генетическое семейство (далее - генотип) Beijing характеризуется достаточной однородностью по многим генетическим маркерам и широким географическим распространением (Bifani et al., 2002; Mokrousov, 2008). Впервые этот генотип был выявлен у штаммов, выделенных в Пекинском регионе Китая, что и объясняет его название (van Soolingen et al., 1995). Последующие исследования показали эндемичность генотипа Beijing в странах бывшего СССР, Южной Африке и Восточной Азии (Нарвская и др., 2002, Шемякин и др., 2003; Bifani et al., 2002; Marais et al., 2006; Millet et al., 2007) и его нарастающее проникновение в новые удаленные регионы (Glynn et al., 2005; Lavender et al., 2005; Garcia de Viedma et al., 2006). В отличие от многих других генетических семейств М. tuberculosis, для идентификации которых необходимо применение достаточно сложных и не всегда очевидных биоинформационных алгоритмов (Sebban et al., 2002; Ferdinand et al., 2002), генотип Beijing имеет характерную особенность генома, а именно «усеченный» локус DR (локус прямых повторов), состоящий из девяти спейсеров (с 35 по 43) и легко выявляемый при стандартном сполиготипировании (англ. spoligotyping [spacer oligonuceleotide typing]) в виде характерного профиля гибридизации (Kremer et al., 2004) (Фиг.1). У штаммов генотипа Beijing большинство спейсеров в локусе DR, вероятно, было утрачено в результате малого количества делеционных событий, по крайней мере, одно их которых было связано с рекомбинацией и транспозицией IS 6110.
Генотип Beijing привлекает внимание и с клинической точки зрения, поскольку его штаммы демонстрируют патогенные свойства: повышенную вирулентность на мышиной модели (Вишневский и др., 2002; Lopez et al., 2003) и на модели макрофагов (Zhang et al., 1999; Черноусова и др., 2008; Lasunskaia et al., 2010), ассоциацию с лекарственной устойчивостью (Нарвская, 2003; Toungoussova et al., 2002; Сох et al., 2005; Mokrousov et al., 2009) и высокую трансмиссивность (Андреевская и др., 2006; Caminero et al., 2001; Narvskaya et al., 2002). Неблагоприятная ситуация по туберкулезу в России в значительной степени связана с распространением мультирезистентных штаммов генотипа Beijing в популяции иммунизированных БЦЖ (Bifani et al., 2002). Таким образом, наблюдаемое сейчас широкое распространение штаммов Beijing представляет серьезную угрозу успешной реализации национальных программ борьбы с туберкулезом.
Учитывая клиническую и эпидемиологическую значимость генотипа Beijing М. tuberculosis, необходимо наличие простого метода его детекции. Стандартным методом определения штаммов Beijing является сполиготипирование, которое основано на анализе структуры хромосомы М. tuberculosis в области прямых повторов (DR-локус), разделенных вариабельными спейсерами (Kamerbeek et al., 1997). Метод требует проведения полимеразной цепной реакции (ПЦР) и последующей ДНК-гибридизации с иммобилизованными на мембране 43 зондами в специальном приборе (миниблоттере) и выявления сигналов хемилюминесценции на светочувствительной пленке (Фиг.1).
Являясь «золотым стандартом» выявления принадлежности изолята М. tuberculosis к генотипу Beijing, метод неприменим для использования в практических бактериологических лабораториях. Кроме того, формат этого метода подразумевает одновременный анализ 40 штаммов, что не всегда экономично при необходимости анализа единичных изолятов. Сполиготипирование не требует получения очищенной ДНК М. tuberculosis, но тем не менее этот метод требует специального оборудования и достаточно сложной процедуры выявления профилей гибридизации. Другие методы, основанные на компьютерном сравнении профилей IS6770-RFLP с референс-профилями и повторной гибридизации мембраны с Beijing-специфическими пробами на локусы NTF и dnaA-dnaN (Kurepina et al., 2005), еще более трудоемки, чем классический анализ IS6770-RFLP. Кроме того, эти методы требуют проведение дополнительных экспериментов для исследования только штаммов Beijing.
Особенностью структуры генома штаммов генотипа Beijing является наличие вставки элемента IS6110 в локусе dnaA-dnaN, расположенном вблизи от oriC (Bifani et al., 2002). Выявление этой характерной вставки IS 6110 методом ПЦР в формате «реального времени» составляет основу предложенного нами способа детекции штаммов М. tuberculosis генотипа Beijing.
В качестве прототипа предлагается метод блот-гибридизации хромосомной ДНК М. tuberculosis с мечеными зондами на основе элемента IS6110 и локуса dnaA-dnaN (van Embden et al., 1993; Kurepina et al., 2005). Фрагменты гидролиза ДНК рестриктазой PvuII, разделенные при электрофорезе в агарозном геле, переносят на нейлоновую мембрану и подвергают последовательной гибридизации со специфическими зондами: меченым фрагментом инсерционного элемента IS6110 (van Embden et al., 1993) и dnaA-dnaN (Kurepina et al., 2005). Профили гибридизации выявляют колориметрически или хемилюминесценцией и подвергают компьютерной обработке. Метод требует выделения большого количества очищенной ДНК и длительных процедур рестрикции ДНК, разделения в агарозном геле, переноса на мембрану по Саузерну и собственно гибридизации. В целом процедура занимает не менее 5-6 дней. Кроме того, метод требует использования соответствующих компьютерных программ для обработки и анализа сканированных профилей гибридизации.
Задачей предлагаемого изобретения является разработка способа быстрой и надежной детекции микобактерий туберкулеза генотипа Beijing посредством амплификации и флуоресцентно-гибридизационного выявления специфической для штаммов этого генотипа инсерции IS6110 в участке генома dnaA-dnaN.
Задача реализуется за счет того, что применяют ПЦР в режиме реального времени с использованием двух специфических праймеров и флуоресцентно-меченого зонда, и при экспоненциальном накоплении сигнала флуоресценции между 10-15 циклами ПЦР при анализе чистой ДНК и 15-20 циклами при анализе клеточных лизатов судят о принадлежности М. tuberculosis к генотипу Beijing.
Преимущества предлагаемого способа:
- быстрота (один день от момента выделения ДНК);
- простая и однозначная интерпретация результатов;
- возможность быстрого анализа больших коллекций штаммов М. tuberculosis для оценки их принадлежности к генотипу Beijing с целью диагностики и при популяционных исследованиях;
- возможность использования неочищенных препаратов ДНК (клеточных лизатов) для быстрой диагностики.
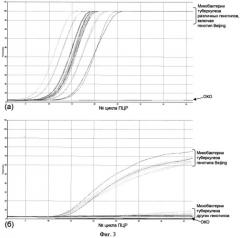
Изобретение поясняется чертежами, где Фиг.1 - Примеры профилей сполиготипирова-ния микобактерий туберкулеза (генотип Beijing отмечен звездочкой). Фиг.2 - Схема ПЦР (не в масштабе). Крупная стрелка показывает ориентацию элемента IS6110, короткие стрелки - позиции праймеров и зондов. Фиг.3 - Профили - накопление сигнала флуоресценции: (а) по контрольному (FAM/Green) каналу детекции, на М. tuberculosis complex и (б) специфическому (R6G/Yellow) каналу детекции, на генотип Beijing. ОКО - отрицательный контрольный образец (вода).
Способ осуществляется следующим образом.
Выделение и очистку ДНК из культуры М. tuberculosis, выращенной на среде Левенштейна-Йенсена, проводят по van Embden et al. (1993). Суспендируют 1 стандартную бактериологическую петлю культуры в 400 мкл буфера ТЕ x1 и инкубируют 20 мин при 85°С. Дальнейшую обработку проводят с использованием лизоцима, протеиназы К, додецилсульфата натрия и цетилтриметиламмонийбромида. Полученный лизат обрабатывают смесью фенол-хлороформ-изоамиловый спирт (25:24:1), центрифугируют, осаждают изопропанолом, промывают 70% этанолом, осадок высушивают и растворяют в 30-50 мкл ТЕ х0.5. При получении грубого препарата ДНК (клеточного лизата) 1 петлю культуры суспендируют в 100 мкл буфера ТЕ x1, кипятят 20 мин на водяной бане, центрифугируют 15 мин (12000 об/мин) и полученный супернатант используют для ПЦР.
Материалом для ПЦР служит чистая ДНК или клеточный лизат. ПЦР проводят в мультиплексном формате в режиме реального времени. Во-первых, амплификацию специфического для генотипа Beijing фрагмента ДНК, расположенного между элементом IS6110 и прилегающим к нему участком локуса dnaA-dnaN, проводят методом ПЦР с использованием двух праймеров (Фиг.2). Продукты амплификации выявляют с использованием флуоресцентно-меченного олигонуклеотиднного зонда в ПЦР в формате реального времени. Во-вторых, для контроля качества ДНК одновременно используют специфические праймеры, для амплификации внутреннего фрагмента элемента IS6110, присутствующего во всех штаммах микобактерий туберкулезного комплекса (М. tuberculosis complex); продукты амплификации также выявляют в режиме реального времени по другому каналу детекции флуоресценции (Фиг.3а). В качестве контрольных используют: ДНК известного штамма Beijing и ДНК штамма H37R.V (не-Beijing). Накопление сигнала флуоресценции определенной длины волны специфического олигонуклеотидного зонда свидетельствует о принадлежности изучаемых ДНК к генотипу Beijing (Фиг.36).
Были использованы следующие сконструированные нами праймеры и зонды для ПЦР в реальном времени (Фиг.2). Для детекции генотипа Beijing использовали праймеры BGF (5'-AGATCAGAGAGTCTCCGGACTCA) и BGR (5'-CGCCGGGACTGTATGAGTCT) и зонд BGP (R6G-5'-TGTGCACAGCGACАСТСACAGCCA-3'-BHQ2). Зонд BGP мечен флуорофром R6G по 5'-концу и гасителем флуоресценции BHQ2 по 3'-концу; детекцию сигнала проводили по «желтому» (R6G/Yellow) каналу детекции в термоциклере Ro-torGene6000 (длина волны 555 нм).
Для детекции М. tuberculosis complex использовали праймеры MTF (5'-CCATCGACCTACTACGACCACAT), MTR (5'-CGGCTGATGTGCTCCTTGAGT) и зонд МТР (FAM-5' CAGCCGCCGCGAGCTGC-3'-RTQ-1). Зонд МТР мечен флуорофором FAM по 5'-концу и гасителем флуоресценции RTQ-1 (Синтол, Москва) по 3'-концу; детекцию сигнала проводили по «зеленому» (FAM/Green) каналу (длина волны 510 нм) (Фиг.3).
Очищенная ДНК (0.1-0.5 мкл) или клеточный лизат (супернатант, 4 мкл) добавляется к смеси ПЦР (конечный объем 30 мкл), содержащей 1,5 mM MgCl2, 1 U Tag ДНК полимеразы для ПЦР в реальном времени (Синтол, Москва), 200 µМ каждого из дНТФ, праймеры BGF, BGR, MTF и MTR (по 10 пмоль), зонды МТР и BGP (по 3 пмоль). Добавляли: чистой ДНК - 0.1 мкл, лизата - 4 мкл. ПЦР проводили в термоциклере Rotorgene6000 (Corbette Research) в следующих условиях: 95°С, 8 мин; далее 40 циклов 94°С, 15 с, 60°С, 50 с. Считывание флуоресценции - при 60°С.
Оценка результатов.
Полученные данные - кривые накопления флуоресцентного сигнала по двум каналам - анализируют с помощью программного обеспечения прибора, используемого для проведения ПЦР в формате реального времени. По каналу FAM/Green - регистрируется накопление продукта амплификации фрагмента ДНК, специфического для М. tuberculosis complex (Фиг.3а), по каналу R6G/Yellow - фрагмента ДНК, специфического для генотипа Beijing М. tuberculosis (Фиг.3b). Результаты интерпретируют по наличию (отсутствию) пересечения нормализованной кривой флуоресценции с установленной на заданном уровне (как правило, 0,1) пороговой линией, что соответствует наличию (отсутствию) значению порогового цикла Ct.
При наличии в образце ДНК штамма Beijing экспоненциальный рост сигнала флуоресценции начинается на 10-15 циклах ПЦР при анализе чистой ДНК и на 15-20 циклах при анализе клеточных лизатов («желтый» канал). При отсутствии сигнала флуоресценции по обоим каналам (т.е. и по контрольному «зеленому» каналу) делается вывод о недостаточном количестве и/или качестве ДНК или ингибировании реакции ПЦР и невозможности какого-либо вывода о наличии или отсутствии ДНК штамма Beijing в образце.
Пример 1. Анализ 265 проб ДНК штаммов микобактерий туберкулеза, выделенных в 1997-2007 гг. в России, Китае и Вьетнаме, был проведен методами сполиготипирования (использован в качестве «золотого» стандарта идентификации генотипа Beijing) и методом ПЦР в реальном времени, предлагаемым в настоящей заявке в качестве способа быстрой детекции М. tuberculosis генотипа Beijing. Была определена принадлежность 143 штаммов М. tuberculosis к генотипу Beijing. При этом результаты анализа обоими методами полностью совпали. Таким образом, предлагаемый способ обеспечивает высокую чувствительность определения штаммов микобактерий туберкулеза генотипа Beijing.
Пример 2. Анализ проб из 70 клеточных лизатов штаммов микобактерий туберкулеза, выделенных в Санкт-Петербурге и ранее отнесенных к генотипу Beijing в результате сполиготипирования. В результате применения метода ПЦР в реальном времени для 67 образцов был получен специфический сигнал микобактерий туберкулеза генотипа Beijing. Отсутствие сигнала для 3 лизатов может быть связано с ингибированием ПЦР и/или недостаточным количеством ДНК, поэтому эффективность метода применительно к клеточным лизатам составила 95,7%.
Литература:
1. Андреевская С.Н., Черноусова Л.Н., Смирнова Т.Г., Ларионова Е.Е., Кузьмин А.В. Трансмиссия штаммов микобактерий туберкулеза, обусловленная миграционными процессами в Российской Федерации (на примере миграции населения из Кавказского региона в Москву и Московскую область) // Пробл. туб. и болезней легких. - 2006. - №1. - С.29-35.
2. Вишневский Б.И., Нарвская О.В., Васильева С.Н., Сапожникова Н.В., Мокроусов И.В., Оттен Т.Ф. Вирулентность микобактерий туберкулеза // Пробл. туб. - 2002. -№10. - С.33-36.
3. Нарвская О.В. Геномный полиморфизм Mycobacterium tuberculosis и его роль в эпидемическом процессе: Дис. д-ра мед. наук. - СПб., 2003.
4. Нарвская О.В., И.В. Мокроусов, Е.В. Лимещенко, Л.Н. Стеклова, Т.Ф. Оттен, Б.И.Вишневский. 2002. Характеристика циркулирующих на Северо-Западе России штаммов Mycobacterium tuberculosis с использованием сполиготипирования // Пробл. туб. - №4. - С.44-47.
5. Черноусова Л.Н., Андреевская С.Н., Смирнова Т.Г., Земскова З.С., Ларионова Е.Е. Биологические свойства штаммов М. tuberculosis кластера W // Пробл. туб. и болезней легких. - 2008. - №10. - С.45-50.
6. Шемякин И.Г., Степаншина В.Н., Иванов И.Ю., Липин М.Ю., Коробова О.В., Анисимова В.А. Характеристика клинических изолятов Mycobacterium tuberculosis с использованием молекулярно-биологических методов // Молекулярная генетика микробиология и вирусология. - 2003. - №1. - С.32-40.
7. Bifani P.J., Mathema В., Kurepina N.E., Kreiswirth B.N. Global dissemination of the Mycobacterium tuberculosis W-Beijing family strains // Trends Microbiol. - 2002. - Vol.10. - P. 45-52.
8. Caminero J.A., Pena M.J., Campos-Herrero M.I., Rodriguez J.C., Garcia I., Cabrera P., Lafoz C., Samper S., Takiff H., Afonso O., Pavon J.M., Torres M.J., van Soolingen D., Enarson D.A., Martin C. Epidemiological evidence of the spread of a Mycobacterium tuberculosis strain of the Beijing genotype on Gran Canaria Island // Am. J. Respir. Crit. Care Med. - 2001. - Vol.164. - P. 1165-1170.
9. Сох Н.S., Kubica Т., Doshetov D., Kebede Y., Riisch-Gerdess S., Niemann S. The Beijing genotype and drug resistant tuberculosis in the Aral Sea region of Central Asia // Respir. Res. - 2005. - Vol.6. - P. 134.
10. Ferdinand S., Valetudie G., Sola C, Rastogi N. Data mining of Mycobacterium tuberculosis complex genotyping results using mycobacterial interspersed repetitive units validates the clonal structure of spoligotyping-defined families // Res. Microbiol. - 2004. - Vol.155. - N8.- P. 647-654.
11. Gagneux S. Small P.M. Global phylogeography of Mycobacterium tuberculosis and implications for tuberculosis product development // Lancet Infect. Dis. - 2007. - Vol.7. -P. 328-337.
12. Garcia de Viedma D., Chaves F., Inigo J. New route of importation of Mycobacterium tuberculosis Beijing genotype // Emerg. Infect. Dis. - 2006. - Vol.12. - P. 169-170.
13. Kamerbeek J., Schouls L., Kolk A., van Agterveld M., van Soolingen D., Kuijper S., Bunschoten A., Molhuizen H., Shaw R., Goyal M., van Embden J.D.A. Simultaneous detection and strain differentiation of Mycobacterium tuberculosis for diagnosis and epidemiology // J. Clin. Microbiol. - 1997. - Vol.35. - P. 907-914.
14. Kremer K., Glynn J.R., Lillebaek Т., Niemann S., Kurepina N.E., Kreiswirth B.N., Bifani P.J., van Soolingen D. Definition of the Beijing / W lineage of Mycobacterium tuberculosis on the basis of genetic markers // J. Clin. Microbiol. - 2004.- Vol.42. - P.4040-4049.
15. Kurepina N., Likhoshvay E., Shashkina E., Mathema В., Kremer K., van Soolingen D., Bifani P., Kreiswirth B.N. Targeted hybridization of IS6110 fingerprints identifies the W-Beijing Mycobacterium tuberculosis strains among clinical isolates // J. Clin. Microbiol. - 2005. - Vol.43(5). - P. 2148-54.
16. Lasunskaia E., Ribeiro S.C., Manicheva O., Gomes L.L., Suffys P.N., Mokrousov I., Fer-razoli L., Andrade M.R., Kritski A., Otten Т., Kipnis T.L., da Silva W.D., Vishnevsky В., Gomes H.M., Baptista I.F., Narvskaya O. Emerging multi-drug resistant Mycobacterium tuberculosis strains of the Beijing genotype circulating in Russia express a pattern of biological properties associated with enhanced virulence // Microbes Infect. - 2010. - Mar 6.
17. Lavender C., Globan M., Sievers A., Billman-Jacobe H., Fyfe J. Molecular characterization of isoniazid-resistant Mycobacterium tuberculosis isolates collected in Australia // Antimicrob. Agents Chemother. - 2005. - Vol.49. - P. 4068-4074.
18. Lopez В., Aguilar D., Orozco H., Burger M., Espitia C, Ritacco V., Barrera L., Kremer K., Hernandez-Pando R., Huygen K., van Soolingen D. A marked difference in pathogenesis and immune response induced by different Mycobacterium tuberculosis genotypes // Clin. Exp.Immunol. - 2003. - Vol.133. - P. 30-37.
19. Marais B.J., Victor T.C., Hesseling A.C., Barnard M, Jordaan A., Brittle W., Reuter H., Beyers N., van Helden P.D., Warren R.M., Schaaf H.S. Beijing and Haarlem genotypes are overrepresented among children with drug-resistant tuberculosis in the Western Cape Province of South Africa // J. Clin. Microbiol. - 2006. - Vol.44. - P. 3539-3543.
20. Millet J., Miyagi-Shiohira C., Yamane N., Sola C, Rastogi N. Assessment of mycobacterial interspersed repetitive unit-QUB markers to further discriminate the Beijing genotype in a population-based study of the genetic diversity of Mycobacterium tuberculosis clinical isolates from Okinawa, Ryukyu Islands, Japan // J. Clin. Microbiol. - 2007. - Vol.45. - P. 3606-3615.
21. Mokrousov I. Genetic geography of Mycobacterium tuberculosis Beijing genotype: a multifacet mirror of human history // Infect. Genet. Evol. - 2008. -Vol.8. - P. 777-785.
22. Mokrousov I., Otten Т., Zozio Т., Turkin E., Nazemtseva V., Sheremet A., Vishnevsky В., Narvskaya O., Rastogi N. At Baltic crossroads: a molecular snapshot of Mycobacterium tuberculosis population diversity in Kaliningrad, Russia // FEMS Immunol Med Microbiol. - 2009. - Vol.55. - P. 13-22.
23. Narvskaya O., Otten Т., Limeschenko E., Sapozhnikova N., Graschenkova O., Steklova L., Nikonova A., Filipenko M.L., Mokrousov I., Vyshnevskiy B. Nosocomial outbreak of multidrug-resistant tuberculosis caused by a strain of Mycobacterium tuberculosis W-Beijing family in St. Petersburg, Russia // Eur. J. Clin. Microbiol. Infect. Dis. - 2002. -Vol.21. - P. 596-602.
24. Sebban M., Mokrousov I., Rastogi N., Sola C. A data-mining approach to spacer oligonucleotide typing of Mycobacterium tuberculosis II Bioinformatics. - 2002. - Vol.18. - N2. - P. 235-243.
25. Sola C., Filliol I., Legrand E., Mokrousov I., Rastogi N. Mycobacterium tuberculosis phylogeny reconstruction based on combined numerical analysis with IS/087, IS6//0, VNTR, and DR-based spoligotyping suggests the existence of two new phylogeographical clades // J. Mol. Evol. - 2001. - Vol.53. - P. 680-689.
26. Toungoussova O., Sandven P., Mariandyshev A., Nizovtseva N., Bjune G., Caugant D.A. Spread of drug-resistant Mycobacterium tuberculosis strains of the Beijing genotype in the Archangel Oblast, Russia // J. Clin. Microbiol. - 2002. - Vol.40. - P. 1930-1937.
27. Van Embden J.D.A., Cave M.D., Crawford J.T., Dale J.W., Eisenach K.D., Gicquel В., Hermans P., Martin C., McAdam R., Shinnik T.M., Small P.M. Strain identification of Mycobacterium tuberculosis by DNA fingerprinting: recommendations for a standardized methodology // J. Clin. Microbiol. - 1993. - Vol.31. - P. 406-409.
28. Van Soolingen D., Qian L., de Haas P.E.W., Douglas J.Т., Traore H., Portaels F., Quing Z., Enkhasaikan D., Nymadawa P., van Embden J.D.A. Predominance of a single genotype of Mycobacterium tuberculosis in countries of East Asia // J. Clin. Microbiol. -1995. - Vol.33. - P. 3234-3238.
29. Zhang M., Cong J., Yang Z., Samten В., Barnes P.F. Enhanced capacity of a widespread strain of Mycobacterium tuberculosis to grow in human macrophages // J. Infect. Dis. - 1999. - Vol.179. - P. 1213-1217.
Способ определения микобактерий туберкулеза генотипа Beijing в режиме реального времени путем определения вставки элемента IS6110 в локусе генома dnaA-dnaN, отличающийся тем, что применяют ПЦР в режиме реального времени с использованием двух специфических праймеров 5`-AGATCAGAGAGTCTCCGGACTCA и 5`-CGCCGGGACTGTATGAGTCT и флуоресцентно-меченого зонда R6G-5`-TGTGCACAGCGACACTCACAGCCA-3`-BHQ2, оценку результата производят путем регистрации сигнала флуоресценции по каналу R6G с длиной волны 555нм, причем при наличии в образце ДНК штамма микобактерий туберкулеза генотипа Beijing экспоненциальный рост сигнала флуоресценции ПЦР при анализе чистой ДНК происходит между 10-15 циклами, а при анализе клеточных лизатов между 15 и 20 циклами.