Способ оценки выживаемости бифидо- и лактобактерий в желудочно-кишечном тракте экспериментальных животных
Иллюстрации
Показать всеСпособ оценки выживаемости бифидо- и лактобактерий в желудочно-кишечном тракте экспериментальных животных включает получение мутантов указанных бактерий на плотных питательных средах с повышающимися концентрациями рифампицина, начиная от 10 мкг·мл-1. Выросшие спонтанные мутанты отбирают и повторно высевают на плотную питательную среду с рифампицином в концентрации до 160 мкг·мл-1. Для введения экспериментальным животным отбирают мутанты с наследственно закрепленными признаками устойчивости к рифампицину в концентрации 150-160 мкг·мл-1 в питательной среде. Количество вводимых мутантов подсчитывают. После выдерживания животных отобранные фекалии суспендируют в изотоническом растворе хлорида натрия. Отбирают надосадочную жидкость, которую высевают на поверхность плотной питательной среды в чашках Петри, содержащей 110 мкг·мл-1 рифампицина. Инкубируют в течение 72 ч в микроаэрофильных условиях при 37°С. Определяют число выросших колоний, пересчитывают количество жизнеспособных бактерий на 1 г фекалий. Определяют долю выживших микроорганизмов от числа введенных, по величине которой судят об их выживаемости. Изобретение позволяет эффективно определить долю выживших бифидобактерий и лактобактерий, прошедших через ЖКТ животных. 2 ил., 3 табл., 3 пр.
Реферат
Изобретение относится к области экспериментальной медицины и микробиологии и может быть использовано для обнаружения и изучения выживаемости пробиотических микроорганизмов в микробном сообществе кишечника экспериментальных животных.
Проблема дисбактериозов привлекает пристальное внимание ученых и клиницистов, заставляя искать новые эффективные подходы к коррекции нарушений микробиоценоза кишечника. При этом крайне важно восстановить собственную микрофлору кишечника, в первую очередь бифидобактерии и лактобактерии [Ардатская М.Д. Клиническое значение короткоцепочечных жирных кислот при патологии желудочно-кишечного тракта: дис… д-ра мед. наук: защищена 2003 г. / М.Д. Ардатская. - М.: ФБУ «Учебно-научный медицинский центр» Управления делами Президента Российской Федерации, 2003. - 299 с; Ардатская М.Д. Дисбактериоз кишечника: эволюция взглядов. Современные принципы диагностики и фармакологической коррекции / М.Д. Ардатская, О.Н. Минушкин // Consilium medicum. Гастроэнтерология. - 2006. - №2. - С.4-18].
Для коррекции и восстановления численности и качественного состава кишечной микрофлоры особое место на протяжении довольно длительного промежутка времени занимают пробиотики - живые микроорганизмы и вещества микробного происхождения, оказывающие при естественном способе введения благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма через оптимизацию его микроэкологического статуса. Однако, как отмечено Ю.А. Малаховым [Малахов Ю.А. Пробиотики и пробиотические продукты в профилактике и лечении наиболее распространенных заболеваний человека / Ю.А. Малахов // Матер. Всерос. конф. с междунар. участием 21-23 апреля 1999 г. - Москва, 1999. - С.110], выявилось явное несоответствие между сложившимся представлением о высокой эффективности пробиотиков и растущим распространением дисбактериозов [Покровский В.И. Инфекционные болезни в конце XX века и санитарно-эпидемиологическое благополучие в России в XXI веке / В.И. Покровский, Г.Г. Онищенко, Б.Л. Черкасский // Журн. микробиол. - 2002. - №3. - С.16-23]. Более того, даже использование сертифицированного пробиотика может не только не дать положительного результата, но и вызвать ухудшение состояния больного [Кузнецова Г.Г. Пробиотикограмма - новый подход к коррекции дисбиотических отклонений в микробиоценозе толстой кишки / Г.Г. Кузнецова, С.А. Шевелева // Здоровое питание населения России: матер. VII Всерос. конгр. 12-14 ноября 2003 г.; гл ред. В.А. Тутельян. - Москва, 2003. - С.270-273].
На возможные причины недостаточной эффективности пробиотической коррекции дисбиотических нарушений кишечной микрофлоры указано в диссертации Н.А. Глушановой [Глушанова Н.А. Экспериментальное обоснование новых подходов к коррекции микробиоценоза кишечника: дис… д-ра мед. наук: защищена 2006 г. / Н.А. Глушанова. - ФГУН «Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского», 2006. - 260 с]. В частности, со ссылкой на работу А.И. Хавкина и Н.С. Жихаревой [Хавкин А.И. Коррекция дисбиотических изменений кишечника у детей на современном этапе / А.И. Хавкин, Н.С.Жихарева // Русский мед. журн. - 2004. - Т. 12. - №16. - С.960-963], отмечено, что под действием желудочного сока и желчи пробиотические микроорганизмы теряют до 90% своей активности к моменту поступления в кишечник.
Нами впервые в опытах in vitro с использованием модельных сред, имитирующих процесс пищеварения в желудочно-кишечном тракте человека, было доказано, что происходит заметное снижение числа жизнеспособных бифидобактерий и лактобактерий [Дармов И.В. Выживаемость микроорганизмов пробиотиков в условиях in vitro, имитирующих процесс пищеварения у человека / И.В. Дармов, И.Ю. Чичерин, И.П. Погорельский и др. // Эксперимент и клин. гастроэнтерол. - 2011. - №3. - С.6-11; Дармов И.В. Сравнительная оценка выживаемости микроорганизмов пробиотиков в составе коммерческих препаратов в условиях in vitro / И.В. Дармов, И.Ю. Чичерин, А.С. Ердякова и др. // Эксперимент и клин. гастроэнтерол. - 2011. - №9. - С.96-101].
С практической точки зрения актуальными являются исследования по оценке выживаемости пробиотических микроорганизмов бифидобактерий и лактобактерий в желудочно-кишечном тракте экспериментальных животных, особенно с учетом данных, представленных в работах [Коршунов В.М. Рациональные подходы к проблеме коррекции микрофлоры кишечника / В.М. Коршунов, В.В. Смеянов, Б.А. Ефимов // Вест. РАМН. - 1996. - №2. - С.60-65; Lin J.Y.C. Genetic transformation of rifampicin resistance in Lactobacillus acidophilus / J.Y.C. Lin, D.C. Savage // J. Gen. Microbiol. - 1986. -Vol.132. - №8. - P.2107-2111] о неспособности пробиотических микроорганизмов к длительному существованию в кишечнике конкретного человека. В результате таких исследований можно будет точно знать то количество пробиотических микроорганизмов, которое достигло толстой кишки. Это позволит охарактеризовать биотический потенциал пробиотических микроорганизмов, назначаемых с лечебной и профилактической целью людям, который, в свою очередь, всецело зависит от критической численности их популяции, гарантирующей колонизацию биопленки кишечника и их приживление.
Как известно, общее количество микробных клеток в организме человека превышает 100 триллионов, из них в толстой кишке обитает до 1 триллиона в 1 мл содержимого [Hooper L.V. How host-microbial interactions shape the nutrient environment of the mammalian intestine / L.V. Hooper, T. Midvedt, J.L. Gordon // Annu. Rev. Nutr. - 2002. - Vol.22. - P.283-307; Backhed F. Host-bacterial mutualism in the human intestine / F. Backhed, R.F. Ley, J.L. Sonnenburg et al. // Science. - 2005. - Vol.307. - P.1915-1920]. Сдерживающим фактором в плане реализации исследований по оценке выживаемости пробиотических микроорганизмов в пищеварительном тракте человека и экспериментальных животных является отсутствие методического подхода, позволяющего обнаруживать в фекалиях пробиотические микроорганизмы, принятые per os с профилактической или лечебной целью. Поэтому весьма проблематично выявить среди множества микробов в кишечном содержимом пробиотические микроорганизмы и идентифицировать их, а тем более отличить их от собственных микроорганизмов нормальной микрофлоры, в частности бифидобактерий и лактобактерий, морфологические, биохимические и генетические особенности которых практически идентичны.
В настоящее время для выявления и идентификации микроорганизмов различных биологических видов в исследуемых биологических средах используют встречный иммуноэлектрофорез, реакцию агглютинации, радиоиммунологические исследования, иммуноферментные исследования, скрининговое исследование мочи (бактериурии) - биолюминесценция, фильтрация - колориметрия, или химические реакции, методы гибридизации ДНК, ПЦР-диагностика, газовая хроматография и другие методы [Выявление микробных антигенов, побочных продуктов и геномов. http//www.rusmedserver.ru/razdel11/9.html]. Существуют сертифицированные методы определения молочнокислых микроорганизмов в пищевых и кисломолочных продуктах, заквасках, бактерийных препаратах и концентратах [ГОСТ 10444.11-89. Продукты пищевые. Методы определения молочнокислых микроорганизмов. Утв. Госстандартом СССР 28.11.1989 г. Статус действует. Ограничение срока действия снято: протокол №5-94 МГС от 17.05.1994 (ИУС №11-94)]. Этими методами устанавливается единый подход к определению жизнеспособных молочнокислых микроорганизмов бактериальных родов Lactobacillus, Leuconostoc, стрептококков группы N рода Streptococcus, Pediococcus, S. thermophilus. Однако, несмотря на значительный арсенал существующих методов, используемых в микробиологической практике, применить их для обнаружения и количественной оценки пробиотических микроорганизмов, принятых внутрь с лечебной и профилактической целью, в содержимом кишечника не представляется возможным. В этой связи весьма важно приблизить процесс обнаружения жизнеспособных пробиотических микроорганизмов к естественным условиям, в частности осуществить маркировку пробиотических микроорганизмов, которая была бы наследственно закреплена и сохранялась бы во время их пребывания и размножения в кишечнике.
Техническим результатом заявленного изобретения является разработка методического подхода, позволяющего дать количественную оценку выживших бифидо- и лактобактерий, которые достигли толстой кишки, путем прямого подсчета выросших колоний. Это позволит охарактеризовать биотический потенциал бифидо- и лактобактерий, назначаемых с лечебной и профилактической целью, который, в свою очередь, всецело зависит от критической численности их популяции, гарантирующей колонизацию биопленки кишечника и их приживление. Достижение технического результата обусловлено предложенными в изобретении приемами получения генетически стабильных маркированных производных пробиотических микроорганизмов, устойчивых к рифампицину, которые способны, в отличие от микроорганизмов нормальной кишечной микрофлоры, расти на селективной плотной питательной среде с рифампицином.
Этот технический результат достигается тем, что в заявляемом способе оценки выживаемости бифидо- и лактобактерий в желудочно-кишечном тракте экспериментальных животных осуществляют получение мутантов этих микроорганизмов путем их выращивания на плотных питательных средах с повышенной концентрацией рифампицина, пероральное введение полученных мутантов бактерий экспериментальным животным, выдерживание животных, отбор фекалий, подсчет в них микроорганизмов и вынесение суждения на основании полученных данных. Для получения мутантов микроорганизмов выращивание бифидобактерий и лактобактерий осуществляют на плотных питательных средах с повышающимися концентрациями рифампицина, начиная от 10 мкг·мл-1, выросшие спонтанные мутанты, сохраняющие видовые признаки, отбирают и повторно высевают на плотную питательную среду с рифампицином в более высокой концентрации вплоть до 160 мкг·мл-1, а для введения экспериментальным животным отбирают мутанты с наследственно закрепленными признаками устойчивости к рифампицину в концентрации 150-160 мкг·мл-1. Количество вводимых мутантов подсчитывают, а после выдерживания животных отобранные фекалии животных суспендируют в изотоническом растворе хлорида натрия, отбирают надосадочную жидкость, которую высевают на поверхность плотной питательной среды в чашках Петри, содержащей 110 мкг·мл-1 рифампицина, и инкубируют в течение 72 часов в микроаэрофильных условиях при температуре 37°С, далее определяют число выросших колоний, пересчитывают количество жизнеспособных бактерий на 1 г фекалий экспериментальных животных, определяют долю выживших микроорганизмов от числа введенных перорально животным, по величине которой выносят суждение об их выживаемости.
Для получения маркированных производных пробиотических бифидобактерий и лактобактерий микроорганизмы выращивают на плотных питательных средах с повышающимися концентрациями рифампицина, начиная от 10 мкг·мл-1 [Миллер Дж. Эксперименты в молекулярной генетике / Дж. Миллер: пер. с англ. Ю.Н. Зографа, Т.С. Ильиной, В.Г. Никифорова. - М.: Мир, 1976. - 436 с]. Выросшие спонтанные мутанты, сохраняющие видовые признаки, отбирают и повторно высевают на плотную питательную среду с рифампицином в более высокой концентрации вплоть до 160 мкг·мл-1. Экспериментально установлено, что представители кишечной микрофлоры (кишечная палочка, индигенные бифидобактерии и лактобактерии) практически не растут в микроаэрофильных условиях на селективной плотной питательной среде с рифампицином при его концентрации 110 мкг·мл-1. С учетом этих данных, мутанты бифидобактерий и лактобактерий получают путем высева регидратированных сертифицированных пробиотических препаратов Бифидумбактерин и Лактобактерий на плотные питательные среды с повышающимися концентрациями рифампицина от 10 мкг·мл-1 до 160 мкг·мл-1. Отбор спонтанных мутантов на плотной селективной питательной среде с повышающимися концентрациями рифампицина проводят до тех пор, пока уровень антибиотико-устойчивости не достигнет 160 мкг·мл-1.
Отобранные мутанты бифидобактерии и лактобактерий, устойчивые к рифампицину (Rifr-мутанты), стабильно сохраняют признак антибиотико-резистентности. Изучение популяционного состава мутантных бактерий по признаку антибиотико-резистентности на плотных питательных средах, содержащих рифампицин в концентрациях 150 мкг·мл-1, свидетельствует о сохранении бифидобактериями и лактобактериями наследственно закрепленного признака устойчивости к рифампицину (Rifr-признака).
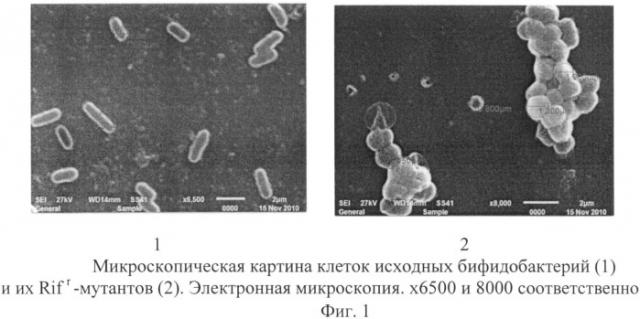
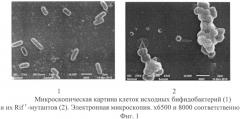
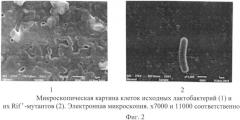
Мутантные бактерии, как и исходные бифидобактерии и лактобактерии, являются грамположительными. Размеры и форма микробных клеток представлены на электронных микрофотографиях (фиг.1, 2), полученных с помощью сканирующего электронного микроскопа JEOL JSM-6510LV (Япония) при следующих контролируемых параметрах: ускоряющее напряжение - 30 кВ; рабочее расстояние - 10 мм; размер фокусного пятна - 30%; режим вакуума - глубокий вакуум.
Размеры исходных бактерий и их Rifr-мутантных производных соответствуют размерам микробных клеток бифидобактерий и лактобактерий, указанным в руководстве Берджи [Определитель бактерий Берджи: в 2 т. / Под ред. Дж. Хоулта, Н. Крига, П. Снита и др.: пер. с англ. под ред. Г.А. Заварзина. - М.: Мир. - Т. 2. - 368 с].
Изучение свойств мутантных бактерий свидетельствует о сохранении ими своих видовых признаков: способности к росту на богатых питательных средах в микроаэрофильных условиях; морфологической особенности колоний (нежная зернистость, коническая форма, которая более выражена у лактобактерий); бактерии каталазоотрицательные, активно сбраживают углеводы, желатину не разжижают (видовой признак лактобактерий).
Пример 1 (получение устойчивых к рифампицину мутантов).
Рифампициноустойчивые мутанты получают в результате выделения выросших колоний бифидо- и лактобактерий на плотных питательных средах с повышающимися концентрациями рифампицина от 10 до 160 мкг·мл-1 с последующим посевом выросших культур на питательные среды с более высоким содержанием антибиотика.
Как следует из таблицы №1, в эксперименте нами было найдено, что только концентрация антибиотика (150-160 мкг в 1 мл) позволяет получать мутанты с устойчиво наследуемыми генетическими признаками, которые сохраняются после энтерального введения мутантов в желудочно-кишечный тракт, а в последующем при выделении из фекалий экспериментальных животных после транзита через желудочно-кишечный тракт.
Пример 2.
Готовят суспензию устойчивых к рифампицину бифидобактерий и лактобактерий на изотоническом растворе хлорида натрия. Белым мышам вводят перорально с помощью туберкулинового шприца с иглой, имеющей оливу на конце для предупреждения травматизации слизистой ротоглотки, суточную дозу пробиотических микроорганизмов в 2 приема: по 130 тыс. бифидобактерий и по 26 млн лактобактерий. Суточную дозу бактерий рассчитывают исходя из инструкций по медицинскому применению препаратов Бифидумбактерина сухого и Лактобактерина сухого для взрослых, с учетом соотношения доз для различных видов животных в пересчете на единицу поверхности тела. Каждое из экспериментальных животных помещают в отдельный кювет и содержат согласно рекомендациям К.Л. Ковалевского [Ковалевский К.Л. Содержание мелких лабораторных животных в вивариях / К.Л. Ковалевский. - М.: ОГИЗ СЕЛЬХОЗГИЗ, 1949. - 80 с]. Отбор фекалий для бактериологического анализа осуществляют ежедневно на протяжении всего срока экспериментов, составляющего 14 суток.
Отобранные фекалии суспендируют в изотоническом растворе хлорида натрия, помещают в центрифужные пробирки с крышками и после центрифугирования и осаждения непереваренных остатков пищи отбирают надосадочную жидкость, которую высевают на поверхность плотной питательной среды в чашках Петри, содержащей 110 мкг·мл-1 рифампицина. После инкубации чашек Петри с посевом суспензий фекальных масс в течение 72 часов в микроаэрофильных условиях при температуре 37°С определяют число выросших колоний и в последующем пересчитывают количество жизнеспособных бактерий на 1 г фекалий экспериментальных животных. Результаты бактериологического изучения фекалий белых мышей и морских свинок после перорального введения Rifr-пробиотических микроорганизмов представлены в таблице 2.
Заявленный способ позволяет установить долю выживших маркированных (Rifr) пробиотических микроорганизмов, введенных перорально белым мышам и прошедших через желудочно-кишечный тракт животных, которая составляет для бифидобактерии 0,029%, а для лактобактерий - 0,00038%. Такой низкий процент выживания бифидо- или лактобактерий свидетельствует о том, что указанные пробиотические микроорганизмы не способны преодолеть кислотно-щелочной барьер желудочно-кишечного тракта. Резкое снижение численности популяции пробиотических микроорганизмов не обеспечивает их приживление в биопленке слизистой оболочки кишечника и, соответственно, положительного влияния на дисбиотические изменения кишечной микробиоты.
Пример 3.
Готовят суспензию устойчивых к рифампицину бифидобактерий и лактобактерий на изотоническом растворе хлорида натрия. Морским свинкам вводят перорально с помощью туберкулинового шприца с иглой, имеющей оливу на конце для предупреждения травматизации слизистой ротоглотки, суточную дозу пробиотических микроорганизмов в 2 приема: по 1,3 млн бифидобактерий и по 265 млн лактобактерий. Суточную дозу бактерий рассчитываютисходя из инструкций по медицинскому применению препаратов Бифидумбактерина сухого и Лактобактерина сухого для взрослых, с учетом соотношения доз для различных видов животных в пересчете на единицу поверхности тела. Каждое из экспериментальных животных помещают в отдельный кювет и содержат согласно рекомендациям К.Л. Ковалевского. Отбор фекалий для бактериологического анализа осуществляют ежедневно на протяжении всего срока экспериментов, составляющего 14 суток.
Отобранные фекалии суспендируют в изотоническом растворе хлорида натрия, помещают в центрифужные пробирки с крышками и после центрифугирования и осаждения непереваренных остатков пищи отбирают надосадочную жидкость, которую высевают на поверхность плотной питательной среды в чашках Петри, содержащей 110 мкг·мл-1 рифампицина. После инкубации чашек Петри с посевом суспензий фекальных масс в течение 72 часов в микроаэрофильных условиях при температуре 37°С определяют число выросших колоний и в последующем пересчитывают количество жизнеспособных бактерий на 1 г фекалий экспериментальных животных. Результаты бактериологического изучения фекалий белых мышей и морских свинок после перорального введения Rifr-пробиотических микроорганизмов представлены в таблице 3.
Заявленный способ позволяет установить долю выживших маркированных (Rifr) пробиотических микроорганизмов, введенных перорально морским свинкам и прошедших через желудочно-кишечный тракт животных, которая составляет для бифидобактерии 0,0022%, а для лактобактерий - 0,0000098%. Низкий процент выживших пробиотических микроорганизмов, выделенных из фекалий морских свинок, свидетельствуют о резком снижении численности их популяции, ниже критической, и прогнозируемом отсутствии пробиотикотерапии.
| Таблица 1 | |||
| - получение устойчивых к рифампицину мутантов | |||
| Наивысшая концентрация рифампицина в среде, мкг·мл-1 | Устойчивость признака рифампициноустойчивости, % | Устойчивость признака каталазной активности | Устойчивость признака роста на богатых питательных средах в микроаэрофильных условиях |
| 100 | 60-70 | Каталазная активность отсутствует | Признак стабилен |
| 110 | 70-75 | Каталазная активность отсутствует | Признак стабилен |
| 120 | 80-85 | Каталазная активность отсутствует | Признак стабилен |
| 130 | 90-95 | Каталазная активность отсутствует | Признак стабилен |
| 140 | 95-100 | Каталазная активность отсутствует | Признак стабилен |
| 150 | 100 | Каталазная активность отсутствует | Признак стабилен |
| 160 | 100 | Каталазная активность отсутствует | Признак стабилен |
| Таблица 2 | ||||||
| - Содержание Rifr-микроорганизмов в желудочно-кишечном тракте белых мышей при пероральном введении (Х±I95, n=5) | ||||||
| Микроорганизмы | Содержание живых бактерий в 1 г фекалий на … сутки эксперимента,КОЕ-г1 | |||||
| 1 | 2 | 7 | 12 | 16 | 17 | |
| Бифидобактерии | 0 | 93±4 | 86±8 | 69±7 | 12±7 | 0 |
| Лактобактерии | 0 | 156±6 | 424±7 | 210±12 | 13±6 | 0 |
| Таблица 3 | ||||||
| - Содержание Rifr-микроорганизмов в желудочно-кишечном тракте морских свинок при пероральном введении (Х±I95, n=5) | ||||||
| Микроорганизмы | Содержание живых бактерий в 1 г фекалий на … сутки эксперимента, КОЕ·г-1 | |||||
| 1 | 2 | 7 | 12 | 16 | 17 | |
| Бифидобактерии | 0 | 105±2 | 82±8 | 29±7 | 13±7 | 0 |
| Лактобактерий | 0 | 89±6 | 76±7 | 21±8 | 12±6 | 0 |
Способ оценки выживаемости бифидо- и лактобактерий в желудочно-кишечном тракте экспериментальных животных, включающий получение мутантов этих микроорганизмов путем их выращивания на плотных питательных средах с повышенной концентрацией рифампицина, пероральное введение полученных мутантов бактерий экспериментальным животным, выдерживание животных, отбор фекалий, подсчет в них микроорганизмов и вынесение суждения на основании полученных данных, отличающийся тем, что для получения мутантов микроорганизмов выращивание бифидобактерий и лактобактерий осуществляют на плотных питательных средах с повышающимися концентрациями рифампицина, начиная от 10 мкг·мл-1, выросшие спонтанные мутанты, сохраняющие видовые признаки, отбирают и повторно высевают на плотную питательную среду с рифампицином в более высокой концентрации вплоть до 160 мкг·мл-1, а для введения экспериментальным животным отбирают мутанты с наследственно закрепленными признаками устойчивости к рифампицину в концентрации 150-160 мкг·мл-1 в питательной среде, количество вводимых мутантов подсчитывают, а после выдерживания животных отобранные фекалии животных суспендируют в изотоническом растворе хлорида натрия, отбирают надосадочную жидкость, которую высевают на поверхность плотной питательной среды в чашках Петри, содержащей 110 мкг·мл-1 рифампицина, и инкубируют в течение 72 ч в микроаэрофильных условиях при температуре 37°С, далее определяют число выросших колоний, пересчитывают количество жизнеспособных бактерий на 1 г фекалий экспериментальных животных, определяют долю выживших микроорганизмов от числа введенных перорально животным, по величине которой выносят суждение об их выживаемости.