Способ идентификации нанодисперсных частиц диоксида кремния в цельной крови
Иллюстрации
Показать всеИзобретение относится к области гигиены, санитарии и медицины, в частности, к способам лабораторной диагностики содержания нанодисперсных частиц диоксида кремния в организме работающих, к факторам риска в воздухе рабочей зоны которых относится диоксид кремния, и может быть использован для обоснования санитарно-гигиенических мероприятий по предупреждению и устранению воздействия нанодисперсных соединений. У работника, к факторам риска в воздухе рабочей зоны которого относится диоксид кремния, отбирают венозную цельную кровь и делят ее на две исследуемые пробы. Первую пробу подвергают исследованию рентгеновским энергодисперсионным микроанализом, устанавливая при этом наличие в пробе кремния на уровне порога обнаружения. Вторую пробу крови, смешанную в объемном соотношении 1:1 с раствором гепарина в концентрации 5000 МЕ/мл, подвергают исследованию методом динамического светорассеяния с фотонной корреляционной спектроскопией, определяя при этом размер выявленных частиц диоксида кремния и выполняя графическое построение первой гистограммы распределения их размеров. Затем также методом динамического светорассеяния с фотонной корреляционной спектроскопией исследуют первый контрольный образец, представляющий собой водную суспензию нанодисперсного диоксида кремния, с построением второй гистограммы распределения размеров частиц и второй контрольный образец, представляющий собой смешанную в объемном соотношении 1:1 с раствором гепарина в концентрации 5000 МЕ/мл венозную цельную кровь индивида, не подвергавшегося воздействию диоксида кремния, с построением третьей гистограммы распределения размеров частиц. Производят графическое наложение первой, второй и третьей гистограмм и при совпадении хотя бы части пиков по показателю распределения частиц первой гистограммы с пиками на второй и третьей указанных гистограммах при одновременном установлении наличия в пробе крови кремния на уровне порога обнаружения рентгеновским энергодисперсионным микроанализом считают наличие нанодисперсных частиц диоксида кремния в цельной крови доказанным. Способ обеспечивает возможность определения пространственного распределения наночастиц в объеме, а также динамики поведения наночастиц при исследовании процессов диффузии или агрегации и оседания. 1 з.п. ф-лы, 1 табл., 5 ил.
Реферат
Изобретение относится к области гигиены, санитарии и медицины, в частности к способам лабораторной диагностики содержания нанодисперсных частиц диоксида кремния в организме работающих, к факторам риска в воздухе рабочей зоны которых относится диоксид кремния, и может быть использован для обоснования санитарно-гигиенических мероприятий по предупреждению и устранению воздействия нанодисперсных соединений, обуславливающих формирование неинфекционной патологии.
Одним из распространенных факторов, присутствующих в воздухе рабочей зоны предприятий металлургического и машиностроительного профиля, является нанодисперсный диоксид кремния, который при ингаляционном поступлении обуславливает не только прямой цитотоксический эффект на паренхиму дыхательных путей работающего, но и активирует перекисное окисление липидов при резорбтивном действии на системном уровне при альвеолярно-капиллярной диффузии. Это может привести к формированию каскада патогенных реакций, которые обуславливают риск развития неинфекционной патологии дыхательных путей.
При этом следует отметить, что диоксид кремния присутствует во всех тканях человеческого организма крови человека и его норма в крови составляет до 1 мг/см3 (Комитет по пищевым добавкам ВОЗ, 1973). Данное значение установлено для кремния традиционной дисперсности. Для нанодисперсного кремния норматива не установлено.
Из уровня техники известны технические решения, которые позволяют определять концентрацию диоксида кремния в растворах (авт. свид. СССР №1503006; патенты РФ №2006849; 2082964).
Так согласно авт. свид. СССР №1503006 способ включает перевод кремния в гетерокомплексное соединение с молибдатом аммония, восстановление, подщелачивание раствора до рH 7,5-10,5, затем подкисление раствора до рH 1,0-2,5 и фотометрирование. Способ позволяет повысить чувствительность и точность анализа.
По патенту РФ №2006849 известен способ определения следовых количеств кремния в очищенных водах. Его сущность заключается в следующем: к пробе добавляют метилэтилкетон, растворы молибдата аммония и соляной кислоты, облучают раствор излучением с частотой 100±10 МГц и проводят вольт-амперометрическое определение искомого компонента. Преимущественная область использования известного изобретения на тепловых электростанциях для экспрессного и чувствительного определения следовых количеств кремния в очищенных водах.
Согласно патенту РФ №2082964 изобретение «Способ определения кремния в растворах» относится к области аналитической химии, а именно к электрохимическим методам определения кремния, и может быть использовано на предприятиях химической промышленности для прямого определения кремния в растворах. Способ заключается в добавлении к анализируемой пробе 10-15%-ного раствора сульфата натрия, метилэтилкетона, растворов соляной кислоты и молибдена аммония и вольтамперометрическом детектировании молибдокремниевой гетерополикислоты на угольном пастовом электроде.
Однако все известные технические решения неприменимы для исследования цельной крови, а кроме того, не предназначены для установления наличия диоксида кремния наноразмерной дисперсности.
Также из патента РФ №2361190 известен способ определения концентрации наночастиц в растворе или биоткани. Это изобретение относится к области нано- и биомедицинских технологий. Известный способ включает зондирование объемной среды, содержащей наночастицы, оптическим излучением с помощью низкокогерентного оптического томографа, измерение размера фокального пятна зондирующего пучка D, длины продольной когерентности ΔLc, определение объема когерентности ΔVc=πD2ΔLc/4, получение цифрового двумерного изображения, каждый пиксел которого пропорционален интенсивности обратно-отраженного излучения из объема когерентности, путем сканирования зондирующего пучка по двум поперечным координатам при фиксированной продольной оптической длине в опорном плече интерферометра томографа либо одной из поперечных координат зондирующего пучка и продольной координаты в опорном плече. Добиваются дискретного изображения путем фиксированного разведения раствора с наночастицами, выделяют площадь на двумерном изображении S и определяют концентрацию наночастиц в единице объема V по числу отражающих пикселей с интенсивностью, превышающей уровень шума из выделенной площади.
Техническим результатом известного способа является возможность определения пространственного распределения наночастиц в объеме, а также динамики поведения наночастиц при исследовании процессов диффузии или агрегации и оседания.
Однако указанный известный способ не позволяет идентифицировать элементный состав частиц, что не позволяет установить наличие частиц кремния среди белковых компонентов биосреды нанодисперсного диапазона.
Из уровня техники известен Способ идентификации и контроля концентрации нанообъектов в дисперсных средах (Патент РФ №2411513), согласно которому изготавливают резонансно-туннельную структуру, включающую два инжекционных слоя, между которыми располагаются два барьерных слоя и квантово-размерный слой, формирующий потенциальную яму, отличающемся тем, что предварительно изготавливают структуру, включающую инжекционный слой в виде пластины из металла или полупроводника, на одной из поверхности которой формируют первый барьерный слой в виде оксида или нитрида материала инжекционного слоя, далее из исследуемой дисперсной среды отбирают часть массой mn, смешивают ее с легко испаряемой жидкостью (спирт, ацетон и т.д.) и путем ультрацентрифугирования отделяют смесь жидкости с частицами менее 10 нм, при этом оставшуюся часть дисперсной среды с частицами более 10 нм отделяют от жидкости и определяют ее массу mc, затем для формирования потенциальной ямы смесь с частицами менее 10 нм диспергируют в закрытом объеме и осаждают на поверхность первого барьерного слоя ранее подготовленной структуры, в процессе осаждения смеси температуру структуры устанавливают на уровне 5-10°C ниже температуры кипения используемой жидкости и заканчивают осаждение исследуемой дисперсной среды, когда толщина сплошного слоя достигнет значения, при котором проявляется квантово-размерный эффект (10-30 нм), затем осуществляют сушку при температуре 300°C в течение 10-15 минут, далее на полученном слое из исследуемой дисперсной среды методом магнетронного напыления формируют второй барьерный слой из диэлектрического материала и следующий за ним второй инжекционный слой из проводящего материала, затем полученную в результате вышеописанных операций резонансно-туннельную структуру подключают к схеме, состоящей из последовательно соединенных блока питания, регистратора тока, переменного резистора и параллельно подключенного к резонансно-туннельной структуре регистратора напряжения, меняют с помощью переменного резистора напряжение на туннельно-резонансной структуре от 0 B до 10 B, при этом на регистраторах тока и напряжения измеряют значения тока и напряжения, по которым строят вольтамперную характеристику, далее на графике вольтамперной характеристики определяют локальные максимумы тока и фиксируют соответствующие им значения резонансных потенциалов, по которым идентифицируют находящиеся в слое исследуемой дисперсной среды нанообъекты, используя базу данных резонансных потенциалов, полученную при проведении экспериментов на среде, содержащей известные нанообъекты с установленной концентрацией, далее по значениям тока для соответствующих резонансных потенциалов, массам mn, mc и полученному аналитическому выражению определяют концентрацию нанообъектов.
Однако этот способ является очень сложным в реализации и не позволяет идентифицировать частицы по химическому составу, определяя их концентрацию.
Также из уровня техники известны Методические рекомендации МР 1.2.2641-10 «Определение приоритетных видов наноматериалов в. объектах окружающей среды, живых организмах и пищевых продуктах», утвержденных Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 24 мая 2010 г. Указанные Методические рекомендации определяют методы исследования содержания наночастиц и наноматериалов искусственного происхождения в некоторых видах пищевых продуктов и компонентах биоты.
В указанных МР представлено два основных способа анализа химического состава наноматериалов в составе биологических объектов.
1. Атомно-эмиссионная спектрофотометрия. При реализации данного способа описана обработка биопроб концентрированной азотной кислотой при открытом автоклавном разложении. Но для определения кремния этот способ не подходит, т.к. кремний нерастворим в азотной кислоте.
2. Масс-спектрометрия с индуктивно связанной плазмой с применением электротермической атомизации или лазерной абляции.
Однако указанный известный способ имеет следующие недостатки:
- оба указанных в МР способа анализа не позволяют установить размерность частиц, а только химический состав;
- невозможность идентифицировать диоксид кремния, т.к. кремний не растворим в азотной кислоте;
- невозможность идентифицировать диоксид кремния в цельной крови, т.к. известный способ предназначен для исследования только гистологических объектов - биотканей, и все операции пробоподготовки рассчитаны на исследования именно такого объекта;
Технический результат, достигаемый предлагаемым изобретением, заключается в обеспечении установления наличия наночастиц диоксида кремния в пробе цельной крови.
Указанный технический результат обеспечивается предлагаемым способом идентификации нанодисперсных частиц диоксида кремния в цельной крови, согласно которому у работника, к факторам риска в воздухе рабочей зоны которого относится диоксид кремния, отбирают венозную цельную кровь и делят ее на две исследуемые пробы, первую пробу подвергают исследованию рентгеновским энергодисперсионным микроанализом, устанавливая при этом наличие в пробе кремния на уровне порога обнаружения, вторую пробу крови, смешанную в объемном соотношении 1:1 с раствором гепарина в концентрации 5000 МЕ/мл, подвергают исследованию методом динамического светорассеяния с фотонной корреляционной спектроскопией, определяя при этом размер выявленных частиц диоксида кремния и выполняя графическое построение первой гистограммы распределения их размеров, далее также методом динамического светорассеяния с фотонной корреляционной спектроскопией исследуют первый контрольный образец, представляющий собой водную суспензию нанодисперсного диоксида кремния, с построением второй гистограммы распределения размеров частиц и затем исследуют второй контрольный образец, представляющий собой смешанную в объемном соотношении 1:1 с раствором гепарина в концентрации 5000 МЕ/мл венозную цельную кровь индивида, не подвергавшегося воздействию диоксида кремния, с построением третьей гистограммы распределения размеров частиц, производят графическое наложение первой, второй и третьей гистограмм и при совпадении хотя бы части пиков по показателю распределения частиц первой гистограммы с пиками на второй и третьей указанных гистограммах при одновременном установлении наличия в пробе крови кремния на уровне порога обнаружения рентгеновским энергодисперсионным микроанализом считают наличие нанодисперсных частиц диоксида кремния в цельной крови доказанным.
Первый контрольный образец представляет собой водную суспензию нанодисперсного диоксида кремния, синтезированного методом жидкокристаллического темплатирования.
Поставленный технический результат достигается за счет следующего.
Благодаря тому что в предлагаемом способе используют два метода исследования: рентгеновский энергодисперсионный микроанализ и метод динамического светорассеяния с фотонной корреляционной спектроскопией, повышается информативность.
Причем при рентгеновском энергодисперсионном микроанализе для визуализации используется сканирующий микроскоп, что дешевле, но с рентгено-спектральной приставкой, что позволяет установить в цельной крови наличие исследуемого химического элемента без проведения длительной пробоподготовки, которая может привести к агрегации наночастиц и, следовательно, к потере точности определения. При этом следует пояснить, что этим методом возможно определение в крови кремния как элемента. Соединения кремния идентифицируются в виде отдельных элементов.
Метод динамического светорассеяния с фотонной корреляционной спектроскопией, с помощью которого исследуют вторую пробу крови, позволяет определять размеры выявленных частиц диоксида кремния, т.к. именно по этому показателю судят о наличии наночастиц в пробе.
Первый контрольный образец, представляющий собой водную суспензию нанодисперсного диоксида кремния и использованный при реализации предлагаемого способа, выполняет своего рода роль стандартной пробы, с сопоставлением с которой в исследуемой пробе идентифицируют как кремний, так и размеры диоксида кремния.
Второй контрольный образец, представляющий собой смешанную в объемном соотношении 1:1 с раствором гепарина в концентрации 5000 МЕ/мл венозную цельную кровь индивида, не подвергавшегося воздействию диоксида кремния, предназначен для установления пиков распределения размерности частиц в «нормальной» крови.
Заявленные условия пробоподготовки второй пробы крови и второго контрольного образца были установлены экспериментальным путем, и отступление от указанных условий (понижение или повышение концентраций гепарина, изменение объемов смешения его с цельной кровью) не обеспечит не только точность в идентификации диоксида кремния в крови, но и приведет к невозможности реализации назначения заявляемого способа.
При проведении предлагаемого способа достоверные данные по идентификации диоксида кремния в цельной крови были получены только при выполнении одновременно двух условий: по результатам рентгеновского энергодисперсионного микроанализа содержание кремния в исследуемой пробе должно быть на уровне порога обнаружения, и одновременно должно быть установлено наличие в исследуемой пробе крови частиц размером от 1 до 100 нм.
На первом этапе можно сказать, что кремний в пробе имеется или отсутствует (следует отметить, что у «чистых» людей, не контактирующих с промышленным кремнием, способом рентгеновского энергодисперсионного микроанализа он не находится). Но задача состоит в определении (идентификации) в пробе крови именно нанодисперсного диоксида кремния. Поэтому дальше необходимо установить, находится ли он в виде наночастиц или максимально приближен к нанодиапазону. Величина от 1 до 100 нм и является размерностью наночастиц (Тутельян В.А., Гмошинский И.В. Методические рекомендации по выявлению наноматериалов, представляющих потенциальную опасность для здоровья человека, 2009).
Таким образом, предлагаемый способ позволяет идентифицировать в крови именно нанодисперсные частицы диоксида кремния. Это позволит повысить эффективность планирования санитарно-гигиенических мероприятий по предупреждению и устранению развития патологии дыхательных путей, обусловленной аэрогенным воздействием нанодисперсных частиц диоксида кремния у работающих в зоне риска.
При реализации предлагаемого способа осуществляют следующие операции в нижеуказанной последовательности:
1. Устанавливают предприятие, в воздухе рабочей зоны которого присутствует диоксид кремния в количестве выше предельно допустимой нормы (т.е. более 1 мг/дм3 ПДК среднесуточной).
2. У работника этого предприятия отбирается венозная кровь примерно в количестве 3 мл в две пробирки.
3. Одну пробу крови используют для исследования с помощью электронной микроскопии на сканирующем микроскопе высокого разрешения (например, S-3400N «HITACHI» (Япония) с приставкой для рентгеновского энергодисперсионного микроанализа (например, фирмы «Bruker» - Германия), устанавливая при этом наличие в пробе крови кремния. При этом пробоподготовку осуществляют нанесением мазка цельной крови на обезжиренную алюминиевую подложку толщиной 1 мм с последующим высушиванием в эксикаторе.
4. Вторая проба крови предназначена для исследования методом динамического светорассеяния с фотонной корреляционной спектроскопией с использованием технологии NIBS (это технология неинвазивного обратного рассеяния определяет высокую чувствительность, широкий размерный и концентрационный диапазоны при измерении размеров частиц и молекул) на анализаторе, например Zetasizer Nano «Malvern Instruments limited» (Великобритания). Пробоподготовка осуществляется разведением 1 мл цельной крови 1 мл гепарина в концентрации 5000 МЕ/мл. При этом определяют размеры частиц диоксида кремния с последующим графическим построением гистограммы распределения частиц по их размерам.
5. Также исследованию методом динамического светорассеяния с фотонной корреляционной спектроскопией подвергают два контрольных образца, первый из которых представляет собой водную суспензию нанодисперсного диоксида кремния, в преимущественном варианте синтезированного методом жидкокристаллического темплатирования, а второй - смешанную в объемном соотношении 1:1 с раствором гепарина в концентрации 5000 МЕ/мл венозную цельную кровь взрослого человека, не подвергавшегося воздействию диоксида кремния. Полученные при этом результаты отображают графически в виде второй и третьей гистограмм соответственно.
6. Производят сравнение первой гистограммы исследованной пробы цельной крови с гистограммами контрольных образцов. Совпадение пиков первой гистограммы со второй гистограммой первого контрольного образца будет свидетельствовать о наличии в исследуемой пробе цельной крови частиц нанодиапазона. Также обязательно должно быть совпадение (по высоте и ширине) пиков первой гистограммы с пиками третьей гистограммы второго контрольного образца, что будет свидетельствовать о корректном проведении пробоподготовки.
9. При установлении по результатам рентгеновского энергодисперсионного микроанализа содержания кремния в исследуемой пробе крови на уровне порога обнаружения и при одновременном наличии частиц диоксида кремния в пробе крови размером от 1 до 100 нм, соответствующих пику распределения в контрольной пробе, считают наличие нанодисперсных частиц диоксида кремния в цельной крови доказанным или идентифицированным.
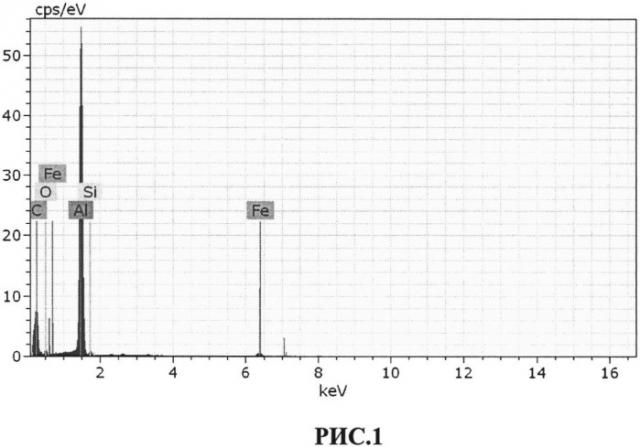
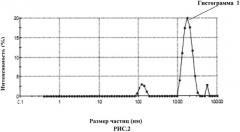
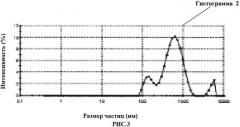
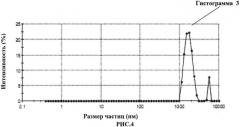
Предлагаемое изобретение иллюстрируется рисунками, где на рис.1 изображена кривая распределения химических элементов в первой пробе крови; на рис.2 изображена первая гистограмма распределения размеров частиц во второй пробе крови; на рис.3 - вторая гистограмма распределения размеров частиц в первом контрольном образце; на рис.4 - третья гистограмма распределения размеров частиц во втором контрольном образце; на рис.5 - пример наложения первой, второй и третьей гистограмм друг на друга с целью установления факта совпадения или несовпадения пиков на них.
При реализации предлагаемого способа была исследована цельная кровь 10 работающих Чусовского металлургического завода. Пробы атмосферного воздуха показали, что содержание диоксида кремния в нем превышает ПДК среднесменное.
Далее приведен пример по результатам обследования одного из работающих.
1) Электронная микроскопия с рентгеновским энергодисперсионным микроанализом позволила установить наличие в цельной пробе крови кремния (таблица 1 и рис. 1).
| Таблица 1. | |||
| Данные о содержании элементов в первой пробе цельной крови работающего Чуковского металлургического завода | |||
| Элемент | Атомарная масса | Соотношение элементов (массовые проценты) | Сигма (массовые проценты) |
| C | 6 | 60,59 | 12,40 |
| O | 8 | 6,23 | 1,57 |
| Al | 13 | 30,62 | 2,65 |
| Si | 14 | 0,43 | 0,06 |
| Fe | 26 | 2,14 | 0,13 |
2) Оценка второй пробы крови методом динамического светорассеяния с фотонной корреляционной спектроскопией позволила выявить на первой графической гистограмме (рис.2) три основных пика (здесь под пиком подразумевается максимальное количество частиц с данным значением размера) распределения частиц в пробе: первый 128,8 нм, второй 1790 нм, третий 5560 нм.
3) Оценка первого контрольного образца (водная суспензия наночастиц диоксида кремния) методом динамического светорассеяния с фотонной корреляционной спектроскопией позволила выявить на второй графической гистограмме (рис.3) три основных пика распределения частиц в пробе: первый 149,2 нм; второй 637,8 нм, третий 4982 нм.
4) Оценка второго контрольного образца методом динамического светорассеяния с фотонной корреляционной спектроскопией позволила выявить на третьей графической гистограмме (рис.4) два основных пика распределения частиц в пробе: первый 1667 нм; второй - 5524 нм.
5) При проведении сравнительного анализа всех указанных трех гистограмм (рис.5) установлено совпадение части пиков по показателю распределения частиц. Это свидетельствует о наличии нанодисперсных частиц в исследуемой пробе и о корректном проведении пробоподготовки.
6) А учитывая, что в первой пробе крови установлено наличие кремния, и принимая во внимание результаты совпадения пиков по показателю распределения частиц, был сделан вывод о наличии наночастиц диоксида кремния в цельной крови работника Чусовского завода.
Таким образом, предлагаемый способ может быть использован для обоснования санитарно-гигиенических мероприятий по предупреждению и устранению воздействия нанодисперсных соединений диоксида кремния для лиц, работающих в условиях риска воздействия соединений кремния, обуславливающих формирование неинфекционной патологии.
1. Способ идентификации нанодисперсных частиц диоксида кремния в цельной крови, характеризующийся тем, что у работника, к факторам риска в воздухе рабочей зоны которого относится диоксид кремния, отбирают венозную цельную кровь и делят ее на две исследуемые пробы, первую пробу подвергают исследованию рентгеновским энергодисперсионным микроанализом, устанавливая при этом наличие в пробе кремния на уровне порога обнаружения, вторую пробу крови, смешанную в объемном соотношении 1:1 с раствором гепарина в концентрации 5000 МЕ/мл, подвергают исследованию методом динамического светорассеяния с фотонной корреляционной спектроскопией, определяя при этом размер выявленных частиц диоксида кремния и выполняя графическое построение первой гистограммы распределения их размеров, далее также методом динамического светорассеяния с фотонной корреляционной спектроскопией исследуют первый контрольный образец, представляющий собой водную суспензию нанодисперсного диоксида кремния, с построением второй гистограммы распределения размеров частиц и затем исследуют второй контрольный образец, представляющий собой смешанную в объемном соотношении 1:1 с раствором гепарина в концентрации 5000 МЕ/мл венозную цельную кровь индивида, не подвергавшегося воздействию диоксида кремния, с построением третьей гистограммы распределения размеров частиц, производят графическое наложение первой, второй и третьей гистограмм и при совпадении хотя бы части пиков по показателю распределения частиц первой гистограммы с пиками на второй и третьей указанных гистограммах при одновременном установлении наличия в пробе крови кремния на уровне порога обнаружения рентгеновским энергодисперсионным микроанализом считают наличие нанодисперсных частиц диоксида кремния в цельной крови доказанным.
2. Способ по п.1, характеризующийся тем, что первый контрольный образец представляет собой водную суспензию нанодисперсного диоксида кремния, синтезированного методом жидкокристаллического темплатирования.