Нейропротекторное фармакологическое средство
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и фармакологии, а именно к средствам для профилактики и лечения нейродегенеративных заболеваний, вызываемых оксидативным повреждением мозга. Предложено применение магниевой соли коменовой кислоты в качестве профилактического и лечебного нейропротекторного средства в количестве 2 мг на 1 кг массы тела в течение 3-х дней перорально натощак один раз в день. Технический результат: показаны антиоксидантная и нейропротекторная активности комената магния, а также его стимулирующее действие на ростовые процессы спинальных ганглиев, превосходящее действие коменовой кислоты. 7 табл.
Реферат
Изобретение относится к экспериментальной медицине и фармакологии, а именно к средствам для профилактики и лечения нейродегенеративных заболеваний, вызываемых оксидативным повреждением мозга.
В настоящее время цереброваскулярные патологии (геморрагический и ишемический инсульт, окклюзии и стенозы сосудов головного мозга, аневризмы и пр.) занимают второе место среди причин смерти людей после заболеваний сердечно-сосудистой системы во всем мире, в России в том числе [Гусев Е.И. Проблемы инсульта в России // Журнал неврологии и психиатрии им. С.С. Корсакова (ИНСУЛЬТ приложение к журналу) 2003. №9. С.3-7; Исайкин А.И. Патогенетические аспекты терапии ишемического инсульта // Трудный пациент. 2010. Т.8. №4. С.27-30]. Ведущими факторами гибели нервных клеток при тяжелом гипоксическом воздействии являются глутаматная эксайтотоксичность и окислительный стресс. Окислительный стресс рассматривается в последнее время как один из наиболее значимых факторов патогенеза нейродегенеративных заболеваний таких как болезнь Альцгеймера, амиотрофический боковой склероз и другие типы деменций, болезнь Паркинсона [Матвеев А.Г. Феномен цитотоксичности и механизмы повреждения нейронов новой коры при гипоксии ишемии // Медицинский журнал. 2004. №9. С.18-23; Большаков А.П. Глутаматная нейротоксичность: нарушения ионного гомеостаза, дисфункция митохондрий, изменение активности клеточных систем // Нейрохимия. 2008. Т.25. №3. С.157-169]. Основные механизмы нейронального повреждения включают истощение энергетических ресурсов в условиях ацидоза ткани мозга, нарушение ионного гомеостаза, избыточное накопление возбуждающих аминокислот и гиперпродукцию активных форм кислорода. Последние индуцируют развитие окислительного стресса, который характеризуется повышенным образованием свободных радикалов и снижением активности антиоксидантной системы. Перевозбуждение глутаматных рецепторов, сопровождающее гипоксию, ишемию, оказывает поражающее действие на нейроны, приводит к нарушениям кальциевого гомеостаза [Смирнова И.Н., Федорова Т.Н., Танашян М.М., Суслина З.А. Клиническая эффективность и антиоксидантная активность Мексидола при хронических цереброваскулярных заболеваниях // Клиническая фармакология. 2006. №1. С.33-36; Зозуля Ю.А., Барабой В.А., Сутковой Д.А. Свободнорадикальное окисление и антиоксидантная защита при патологии головного мозга. М.: Знание. 2000. С.221-226; Calabrese V., Bates Т.Е., Stella A.M. NO synthase and NO-dependet signal pathways in brain aging and neuredegenerative disorders: the role of oxidant/antioxidant balance // Neurochem. 2000. V.25. P.1315-1341].
Отсроченная кальциевая дизрегуляция является одним из ключевых сигналов, приводящих к усилению генерации активных форм кислорода (АФК) и перекисного окисления липидов (ПОЛ) после токсического действия глутамата, снижению уровня эндогенных антиоксидантов, повреждению и гибели клеток мозга при ишемических состояниях.
Воздействие на эксайтотоксические механизмы повреждения нервной ткани при ишемии мозга предполагает: блокаду глутаматных рецепторов с помощью прямых ингибиторов, воздействие на ионный гомеостаз, применение антиоксидантов и подавление активных форм кислорода [Суслина З.А., Максимова М.Ю. Концепция нейропротекции: новые возможности ургентной терапии ишемического инсульта. Симпозиум НИИ неврологии РАМН «Лечение ОНМК: состояние проблемы» // Нервные болезни. 2004. №3. С.4-7].
Известно применение лекарственного средства мемантин - 3,5-диметил-1-адамантанамин (в виде гидрохлорида), он действует как неконкурентный антагонист NMDA-рецепторов с высокой селективностью и низкой аффинностью. Мемантин является одним из немногих низкоаффинных терапевтических агентов, использующихся в клинической практике. Обладает ноотропным, церебровазодилатирующим, противогипоксическим и психостимулирующим действием. Клинические исследования показали, что мемантин (20 мг/сут) эффективен при умеренной и тяжелой стадиях болезни Альцгеймера и даже при более тяжелых состояниях [Lipton S.A. Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond // Nat Rev. 2006. Vol.5. P.161-170; Reisberg В., Doody R., Stoffler A., Schmitt F., Ferris S., Mobius H.J. Memantine in moderate-to-severe Alzheimer's disease // N. Engl. J. Med. 2003. Vol.348. P.1333-1341]. Обладает побочным действием: головокружение, повышенная возбудимость, усталость, повышение внутричерепного давления, тошнота. Меры предосторожности: с осторожностью применять во время работы водителям транспортных средств и людям, профессия которых связана с повышенной концентрацией внимания [http://slovari.yandex.ru].
Известен лекарственный препарат нимодипин (Nimodipine) - 3-(метоксиэтил) 5-пропан-2-ил 2,6-диметил-4-(3-нитрофенил)-1,4-дигидропиридин-3,5-дикарбоновая кислота. Синонимы: нимотоп, nimotop. Нимодипин является эффективным церебральным блокатором Ca2+, избирательно блокирующим потенциалзависимые Ca2+ L-каналы [Dorhout Mees S.M., Rinkel G.J., Feigin V.L., et al. Calcium antagonists for aneurysmal subarachnoid haemorrhage // Cochrane Database Syst. Rev. 2007. Vol.18. N3. P. CD000277]. Применяется при ишемическом нарушении мозгового кровообращения (в т.ч. при гипертоническом кризе), неврологических расстройствах вследствие спазма сосудов головного мозга, обусловленного субарахноидальным кровоизлиянием, сенильной деменции. Имеет противопоказания: гиперчувствительность, выраженная гипотензия, отек мозга, повышенное внутричерепное давление, тяжелые нарушения функции печени, оказывает побочные действия: гипотензия, спазм периферических сосудов, гипертензия, анемия и тромбоцитопения и другие. Не рекомендуется применять во время работы водителям транспортных средств и людям, профессия которых связана с повышенной концентрацией внимания [Нимодипин (Nimodipine): инструкция, применение и формула http://www.rlsnet.ru/mnn_index_id_1024.htm#protivopokazaniya].
Известно применение лекарственного препарата мексидол (3-окси-6-метил-2-этилпиридин сукцинат). Действие мексидола заключается в антиоксидантном и мембранопротекторном эффектах. Мексидол существенно уменьшает повреждение липопротеиновых структур, восстанавливая активность эндогенной антиоксидантной системы [Смирнова И.Н., Федорова Т.Н., Танашян М.М., Суслина З.А. Клиническая эффективность и антиоксидантная активность мексидола при хронических цереброваскулярных заболеваниях // Нервные болезни. 2006. №1. С.33-36]. Следует соблюдать осторожность при отеке мозга и остром повышении внутричерепного давления, а также при нарушении функции почек.
Не следует назначать препарат внутрь одновременно с его инфузией. Не рекомендуется применять при беременности [Универсальный справочник лекарственных средств http://lekarstwo.ru/preparati/nimodipine.htm].
В медицинской практике в качестве антистрессорных, нейропротекторных средств применяют магнийсодержащие препараты. Магний рассматривается как эндогенный антагонист кальция, нейропротективный эффект которого связывается с целым рядом механизмов: блокадой NMDA-рецепторов, ингибированием высвобождения эксайтотоксических медиаторов, блокированием кальциевых каналов, а также расслаблением гладкой мускулатуры [Ovbiagele B., Kidwell C.S., Starkman S., Saver J.L. Neuroprotective agents for the treatment of acute ischemic stroke. Curr. Neurol. Neurosci. Rep. 2003. V.3. P.9-20].
Известно применение Магне-B6. В его состав входят два основных действующих компонента: 1) лактат магния (в составе таблеток) или магния пилодат (в ампулированной форме) - наиболее легко усвояемые биоорганические соли магния; 2) пиридоксина гидрохлорид (витамин B6). Последний компонент, помимо общеметаболического, обладает также хорошо известным антистрессорным эффектом, реализуемым в том числе и на уровне периферических органов (например, подавление желудочно-кишечной ульцерации на моделях экспериментального стресса). В неврологии основным показанием к применению Магне-B6 является экзогенная реакционная тревожность легкой или средней тяжести, связанная «текущими стрессами и еще не закрепленная в патологические формы [Громова О.А., Никонов А.А. Значение магния в патогенезе заболеваний нервной системы // Журнал неврологии и психиатрии. 2002. №12. С.62-61]. Имеются противопоказания: гиперчувствительность, фенилкетонурия, выраженные нарушения работы почек, возраст до 6 лет, при нарушении усваиваемости углеводов (фруктозы, сахарозы, глюкозы и молочного сахара - галактозы). С осторожностью препарат применяют при небольших изменениях в работе почек ввиду риска накопления в организме избытка магния и развития нежелательных побочных эффектов.
Наиболее близким к заявляемому нейропротекторному средству является сульфат магния. Сульфат магния - один из самых известных и давно используемых в клинической практике лекарственных средств. Он используется при нарушениях мозгового кровообращения, при синдроме внутричерепной гипертензии, широко используется в терапии и профилактике гипоксически-ишемимических поражений мозга у новорожденных [Иллариошкин С.Н. Недостаточность магния: некоторые неврологические аспекты и пути коррекции. Нервные болезни. 2005. №1. С.37-40; Кудрин А.В., Громова О.А. Микроэлементы в неврологии. М.: ГЭОТАР-Медиа. 2006. 304 с.].
При приеме внутрь он плохо всасывается, действует как слабительное средство. Препарат понижает возбудимость дыхательного центра, большие дозы продукта при парентеральном (минуя пищеварительный тракт) введении легко могут вызвать паралич дыхания.
Технический результат изобретения заключается в создании нового нейропротекторного фармакологического средства, обладающего антиоксидантным, нейротрофическим и стресс-протекторным свойствами для профилактики и лечения нейродегенеративных заболеваний, вызываемых оксидативным повреждением мозга.
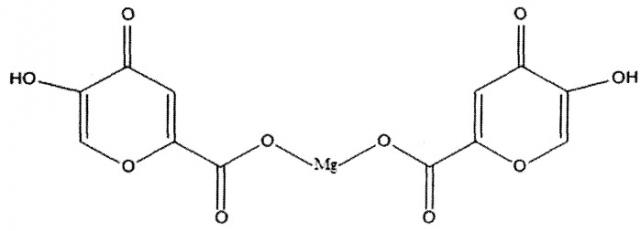
Для достижения технического результата предлагается применять магниевую соль коменовой кислоты (коменат магния). Коменат магния применяют при ишемическом повреждении мозга в качестве профилактического и лечебного нейропротекторного средства в количестве 2 мг на 1 кг массы тела ежедневно в течение 3-х дней перорально натощак один раз в день.
Коменат магния получен смешением раствора коменовой кислоты, подогретого до температуры 80±2°C, с раствором ацетата магния в объемах, взятых из стехиометрического расчета, до значения pH раствора 4,6 и окрашивания раствора в желтый цвет [патент РФ №2477722, МПК C07D 309/40 (20012.01), A61K 31/35 (20012.01), A61P 25/00 (20012.01)]. Магниевую соль коменовой кислоты
выделяют из раствора упариванием до начала кристаллизации в горячем растворе (примерно на 75% первоначального объема), а затем перекристаллизовывают.
Известно соединение коменат магния [Пирогова А.Н. Синтез, строение и свойства соединений коменовой кислоты с некоторыми щелочными и щелочноземельными элементами. Автореф. дисс. канд. хим. наук. Краснодар. 2011. 20 с.], однако фармакологические свойства его не изучались.
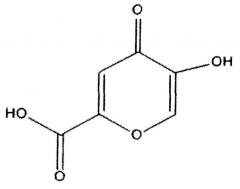
Известно, что коменовая (5-гидрокси-γ-пирон-2-карбоновая) кислота
обладает выраженным антиоксидантным свойством [Кравцов А.А., Шурыгин А.Я. Сравнительное изучение антиоксидантных свойств коменовой кислоты и ее солей // Сборник научных докладов I Международной научно-практической конференции «Научно-техническое творчество молодежи - путь к обществу, основанному на знаниях». М. 2009. С.268-269]. Установлен ее выраженный ростстимулирующий эффект на культуры нейронов верхнего шейного краниального ганглия пренатально стрессированных животных [Шурыгин А.Я. Препарат бализ. Краснодар. 2002. 416 с.]. Коменовая кислота обладает мягким седативным действием, не вызывающим привыкания [патент РФ на изобретение №2209062, МПК (7) A61K 31/351, A61P 25/20], является высокоэффективным ненаркотическим анальгетическим средством, не имеющим негативных побочных эффектов, не вызывающих зависимости и привыкания, приводящим к долговременному снятию болевого синдрома [патент РФ №2322977, A61K 31/351 (2006.01), A61P 29/02 (2006.01)]. Обладает антиабстинентным, анксиолитическим и антидепрессантным свойствами [Панова Т.И. Механизмы влияния коменовой кислоты на интегративную деятельность мозга // Теоретическая экспериментальная медицина. Медицина сегодня и завтра. 2005. №1. С.28-33].
Известно, что ионы магния обеспечивают нормальную физиологию нервной системы. Магний участвует в формировании каталитических центров и стабилизации регуляторных сайтов в составе многочисленных ферментов нервной и глиальной тканей, а также в процессах синтеза и деградации многочисленных нейромедиаторов: катехоламинов (норадреналин), ацетилхолина. Магний вовлечен в различные антиоксидантные функции нейронов и глиальных элементов. Кроме того, ионы магния непосредственно участвуют в процессе стабилизации NMDA-, аспартатных и глициновых рецепторов на постсинаптической мембране нейронов и в их защите от повреждения свободными радикалами, токсичными веществами и лекарствами [Спасов А.А. Магний в медицинской практике. Волгоград. 2000. 268 с.; Громова О.А., Никонов А.А. Значение магния в патогенезе заболеваний нервной системы // Журнал неврологии и психиатрии. 2002. №12. С.62-67].
Влияние комената магния на глутаматную эксайтотоксичность и на нейротрофические процессы изучали с использованием модели культивируемых нейронов мозжечка и спинальных ганглиев, антиоксидантные свойства с использованием модельной системы, генерирующей свободные радикалы - система «цитрат-фосфат-люминол» (ЦФЛ), а также на модели комбинированного стрессирования экспериментальных животных.
Глутаматную нейротоксичность изучали на 7-8-дневной культуре зернистых клеток мозжечка, полученной из головного мозга 7-9-дневных крысят линии Wistar методом ферментно-механической диссоциации. Среда для культивирования состояла из минимальной среды Игла с добавлением 10% эмбриональной телячьей сыворотки, 0,8% глюкозы, 2 мМ глутамина, 0,5 МЕ/мл инсулина, 10 мМ HEPES, 22 мМ NaHCO3, 25 мМ KCl [Викторов И.В., Хаспеков Л.Г., Шашкова Н.А. // Руководство по культивированию нервной ткани: методы, техника, проблемы. М.: Наука. 1986. С.141-166].
После 7 дней культивирования клетки подвергали действию глутамата и/или магниевой соли коменовой кислоты, коменовой кислоты, сульфата магния. Воздействие глутаматом осуществляли в сбалансированном солевом растворе (ССР) следующего состава (в мМ): NaCl - 154, KCl - 25, Na2HPO4 - 0,35, CaCl2 - 2,3, NAHCO3 - 3,6, глюкоза - 5,6, HEPES - 5 (pH 7,5). Длительность воздействия составляла 10 минут, контрольные культуры помещались на 10 минут в солевой раствор без глутамата. После этого культуры возвращали в питательную среду для культивирования и помещали в CO2-инкубатор на 4,5 часа. Коменат магния, коменовую кислоту и сульфат магния вносили в культуры сразу после их возвращения в питательную среду для культивирования в конечных концентрациях от 1 до 0,001 мМ. По истечении 4,5 часов культуры фиксировали ФУСом (формалин 20%, ледяная уксусная кислота 10%, спирт 70%) и окрашивали трипановым синим. Морфологический анализ проводили на инвертированном микроскопе ID 03, учитывали количество живых и погибших нейронов. Результаты представляли как процентную долю неповрежденных нейронов. Статистическую обработку данных проводили с использованием t-критерия Стьюдента.
Были сформированы следующие группы культур:
1.1 контроль - ССР;
1.2 ССР, коменат магния - 1 мМ;
1.3 ССР, коменат магния - 0,1 мМ;
1.4 ССР, коменат магния - 0,01 мМ;
1.5 ССР, коменат магния - 0,001 мМ;
1.6 ССР, коменовая кислота - 1 мМ;
1.7 ССР, коменовая кислота - 0,1 мМ;
1.8 ССР, коменовая кислота - 0,01 мМ;
1.9 ССР, сульфат магния - 1 мМ;
1.10 ССР, сульфат магния - 0,1 мМ;
1.11 ССР, сульфат магния - 0,01 мМ;
1.12 ССР, сульфат магния - 0,001 мМ;
2.1 контроль - ССР с глутаматом 100 мкМ;
2.2 ССР с глутаматом 100 мкМ, коменат магния - 1 мМ;
2.3 ССР с глутаматом 100 мкМ, коменат магния - 0,1 мМ;
2.4 ССР с глутаматом 100 мкМ, коменат магния - 0,01 мМ;
2.5 ССР с глутаматом 100 мкМ, коменат магния - 0,001 мМ;
2.6 ССР с глутаматом 100 мкМ, коменовая кислота - 1 мМ;
2.7 ССР с глутаматом 100 мкМ, коменовая кислота - 0,1 мМ;
2.8 ССР с глутаматом 100 мкМ, коменовая кислота - 0,01 мМ;
2.9 ССР с глутаматом 100 мкМ, сульфат магния - 1 мМ;
2.10 ССР с глутаматом 100 мкМ, сульфат магния - 0,1 мМ;
2.11 ССР с глутаматом 100 мкМ, сульфат магния - 0,01 мМ;
2.12 ССР с глутаматом 100 мкМ, сульфат магния - 0,001 мМ.
Результаты исследований (таблица 1) показали, что число выживших нейронов при воздействии на интактные зернистые клетки мозжечка комената магния, коменовой кислоты и сульфата магния (группы 1.1-1.12) независимо от их концентрации, практически не отличаются от контроля (группа №1.1).
Резкое снижение выживаемости нейронов (на 64,54%) наблюдается после обработки интактных культур глутаматом. При этом число живых нейронов снижается до 31,2%. При применении исследуемых препаратов (комената магния, коменовой кислоты и сульфата магния) на фоне глутаматной цитотоксичности во всех исследуемых нами дозах число выживших нейронов превышало число таковых в группе №2.1 (контроль-глутамат). При этом наиболее выраженное защитное действие на нейроны мозжечка в условиях глутаматной цитотоксичности (выживаемость нейронов составила 63,8%) оказал коменат магния в концентрации 0,1 мМ (группа №2.3). Несколько меньший защитный эффект комената магния отмечался при применении его в концентрациях 1, 0,01 и 0,001 мМ (группы №№2.2, 2.4, 2.5). Высокая выживаемость нейронов мозжечка в условиях глутаматной цитотоксичности наблюдалась также при применении коменовой кислоты в концентрации 1 мМ (группа №2.6), выживаемость нейронов составила 63,2%, p<0,05. Снижение гибели нейронов в культурах, обработанных глутаматом, отмечалось и при применении коменовой кислоты в более низких концентрациях (0,1 и 0,01 мМ, группы №2.7 и 2.8), однако число выживших нейронов было в 2 раза меньше, чем от применения комената магния в этих же концентрациях (группы №2.3 и 2.4).
Повышению выживаемости нейронов в культуре на фоне глутаматной цитотоксичности способствовало также применение сульфата магния в концентрациях от 1 до 0,001 мМ (группы №№1.9-1.12). При этом число выживших нейронов при применении всех исследуемых концентраций сульфата магния было примерно одинаково и не превышало 47,2%.
Таким образом установлено, что применение комената магния на фоне глутаматной цитотоксичности оказывает выраженный нейропротекторный эффект - выживаемость нейронов на 32,6% выше, чем в группе №2.1. Максимальное защитное действие комената магния проявляется в концентрации 0,1 мМ. У коменовой кислоты максимальный защитный эффект при глутаматной цитотоксичности проявляется в концентрации 1 мМ. Выживаемость нейронов при применении сульфата магния во всех исследуемых концентрациях в 2 раза ниже, чем у комената магния.
Хорошо известно, что одним из ведущих факторов гибели нервных клеток при тяжелом гипоксическом воздействии является окислительный стресс. В этой связи нами выполнены исследования влияния комената магния на ростовые процессы нейронов спинальных ганглиев в условиях окислительного стресса. Нейротрофическое действие комената магния изучали на модели культивируемых спинальных ганглиев эмбрионов цыплят в сравнении с коменовой кислотой и сульфатом магния. Спинальные ганглии эмбрионов цыплят культивировали по методикам [Козлова М.В., Шурыгин А.Я., Сидоренко И.П., Каленчук В.У. Влияние препарата «Бализ-2» на рост культуры симпатических ганглиев крыс различных линий // Нейрофизиология. 1988. Т.20. С.550-557; Чалисова Н.И., Мелькишев В.Ф., Акоев Г.Н. и др. Стимулирующее влияние пролактина на рост нейритов чувствительных нейронов в органотипической культуре // Цитология. 1991. Т.33. С.29-31; Ikeda K., Kinoshta M., Iwasaki G. et al. Neurotrophic effect of angiotensin II, vasopressin and oxytocin on the ventral spinal cord of the rat embryo // Intern. J. Neurosci. 1989. V.48. P.19-23]. Для культивирования нейронов использовали питательную среду следующего состава: сыворотка эмбриональная телячья - 30%; среда Игла (DMEM) - 55%; раствор Хэнкса - 12%; раствор глюкозы (40%) - 2%; раствор L-глутамина (0,2 M) - 1%. Оксидативный стресс получали через 24 часа от начала культивирования спинальных ганглиев добавлением в питательную среду перекиси водорода в концентрации 10 мМ на 30 мин. Через 30 мин питательную среду с перекисью водорода удаляли, культуры помещали в свежую питательную среду и в опытные культуры добавляли раствор комената магния в конечной концентрации в культуре 1, 0,1, 0,01 мМ; коменовую кислоту в концентрации 0,1 и 0,01 мМ и раствор сульфата магния в конечной концентрации 0,1 мМ.
Количественный анализ показателей роста нейритов в культуре спинальных ганглиев эмбрионов цыплят производили через 48 часов от начала культивирования на инвертированном микроскопе Invertoscopes ID 03 путем прижизненной микроскопии в фазовом контрасте. Согласно описанным ранее методикам были определены следующие параметры в относительных единицах:
- максимальная величина зоны роста (МВЗР), равная расстоянию от края эксплантата до кончика самого длинного нейрита;
- относительная величина зоны роста (ОВЗР), равная отношению МВЗР к диаметру эксплантата;
- количество нейритов в пучке (КНП), которое определялось подсчитыванием количества отростков на отрезке 200 мкм на расстоянии 250 мкм от края ганглия;
- плотность пучка нейритов (ППН), определяемая по числу нейритов в зоне роста на отрезке 200 мкм на расстоянии 250 мкм от края эксплантата и градуированная по шкале: менее 10 пучков - 1; 10-30 - 2; 30-50 - 3; более 50 - 4;
- интенсивность зоны роста (ИЗР), определяемая как произведение МВЗР на ППН.
Статистический анализ результатов проводили с использованием t-критерия Стьюдента.
Результаты исследований представлены в таблицах 2, 3, 4.
Анализ данных показал, что коменат магния (табл.2) во всех исследуемых концентрациях (1, 0,1 и 0,01 мМ) оказывает стимулирующий эффект на ростовые процессы спинальных ганглиев эмбрионов цыплят. При этом наиболее выраженный и статистически значимый эффект комената магния отмечался в 4 группе культур (0,1 мМ). Все показатели нейритного роста (МВЗР, КПП, ППН, ОВЗР, ИЗР) значительно превышали таковые в группе культур, обработанных перекисью водорода (гр.2).
| Таблица 2 | |||||
| Влияние комената магния на ростовые процессы спинальных ганглиев эмбрионов цыплят | |||||
| Показатели нейритного роста | Группы культур | ||||
| Контроль | Перекись водорода | Перекись + коменат магния | |||
| 1 | 2 | 3 | 4 | 5 | |
| 0,01 мМ | 0,1 мМ | 1 мМ | |||
| МВЗР | 1090,54±39,29 | 607,66±35,70∗ | 793,18±46,29 | 885,27±45,00 | 843,86±49,49 |
| ОВЗР | 3,41±0,05 | 2,81±0,10∗ | 2,95±0,11 | 3,30±0,10 | 3,10±0,10 |
| КНП | 29,32±1,12 | 8,35±1,67∗ | 18,16±1,93 | 25,91±2,28 | 20,29±2,75 |
| ППН | 2,60±0,07 | 1,33±0,10∗ | 1,95±0,11 | 2,36±0,13 | 2,05±0,18 |
| ИЗР | 2863,80±128,49 | 859,68±122,05∗ | 1683,95±167,8 | 2246,90±199,15 | 1834,71±235,90 |
| Примечание: | |||||
| 1. ∗ - p<0,001 перекись в сравнении с группой «контроль»; | |||||
| 2. - p<0,01; - p<0,001 - коменат магния в сравнении с группой «перекись». |
Несколько слабее была стимуляция нейритного роста в условиях окислительного стресса при применении комената магния в концентрациях 0,01 и 1 мМ (гр.3, 5). Статистически достоверное повышение нейритного роста спинальных ганглиев по всем показателям отмечалось и при применении коменовой кислоты в концентрации 0,1 мМ (табл.3). При этом, если уровень таких показателей нейритного роста, как МВЗР и ОВЗР (гр.3), практически не отличались от таковых при применении комената магния в этой же концентрации, то рост таких показателей, как КПП, ИЗР и ППН, при сравнении с группой культур, обработанной перекисью, были ниже, чем в группе культур с применением комената магния в концентрации 0,1 мМ. Более слабая стимуляция ростовых процессов в культуре наблюдалась при применении коменовой кислоты в концентрации 0,01 мМ. В то же время показатели МВЗР, КНП и ППН были достоверно выше, чем в группе культур, обработанных перекисью водорода (гр.2).
| Таблица 3 | ||||
| Влияние коменовой кислоты на ростовые процессы спинальных ганглиев эмбрионов цыплят | ||||
| Показатели нейритного роста | Группы культур | |||
| Контроль | Перекись водорода | Перекись + коменовая кислота | ||
| 1 | 2 | 3 | 4 | |
| 0,1 мМ | 0,01 мМ | |||
| МВЗР | 1140,43±67,22 | 701,84±41,07∗ | 1006,39±86,91 | 880,27±66,91 |
| ОВЗР | 3,16±0,09 | 2,70±0,08∗ | 3,00±0,09 | 2,92±0,12 |
| КНП | 26,47±1,89 | 11,02±1,30∗ | 21,50±2,79 | 19,42±2,56 |
| ППН | 2,39±0,11 | 1,57±0,09∗ | 2,07±0,16 | 1,96±0,16 |
| ИЗР | 2914,53±239,38 | 1233,80±132,18∗ | 2396,71±336,19 | 1912,15±261,37 |
| Примечание: | ||||
| 1. ∗ - p<0,001 группа «перекись» в сравнении с группой «контроль», | ||||
| 2. - p<0,05; - p<0,01; - p<0,001 - коменовая кислота в сравнении с группой «перекись». |
Влияние сульфата магния на ростовые процессы спинальных ганглиев исследовали в концентрации 0,1 мМ, то есть в концентрации, оказавшей наиболее высокий ростстимулирующий эффект при применении комената магния и коменовой кислоты.
Результаты исследований, представленные в таблице 4, показывают, что сульфат магния в концентрации 0,1 мМ влияния на ростовые процессы спинальных ганглиев не оказывает.
| Таблица 4 | |||
| Влияние сульфата магния на ростовые процессы спинальных ганглиев эмбрионов цыплят | |||
| Показатели нейритного роста | Группы культур | ||
| Контроль | Перекись водорода | Перекись водорода + сульфат магния 0,1 мМ | |
| 1 | 2 | 3 | |
| МВЗР | 1285,94±106,35 | 765,00±80,58∗∗ | 736,31±60,95 |
| ОВЗР | 3,35±0,12 | 2,88±0,13∗ | 2,75±0,11 |
| КНП | 31,41±3,67 | 15,06±2,88∗ | 14,50±2,40 |
| ППН | 2,76±0,20 | 1,69±0,18∗∗ | 1,75±0,17 |
| ИЗР | 3782,65±519,45 | 1455,19±287,14∗∗ | 1420,31±236,25 |
| Примечания: | |||
| * - p<0,01; ** - p<0,001 перекись в сравнении с группой «контроль». |
Таким образом установлено, что коменат магния стимулирует ростовые процессы спинальных ганглиев. При этом по таким показателям ростовых процессов, как КПП, ИЗР и ППН, он превосходит действие коменовой кислоты. Наиболее выраженное стимулирующее действие коменат магния оказывает в концентрации 0,1 мМ. Не оказывает влияния на ростовые процессы спинальных ганглиев в условиях окислительного стресса сульфат магния.
Антиокислительные свойства магниевой соли коменовой кислоты in vitro изучали с использованием модельной системы, генерирующей свободные радикалы - система «цитрат-фосфат-люминол» (ЦФЛ) следующего состава: 4 мл фосфатного буфера (105 мМ KCl, 20 мМ KH2PO4, 4 мМ цитрата натрия; pH=7,45) с добавлением люминола (10 мМ). Образование активных форм кислорода (АФК) инициировали введением при постоянном перемешивании 30 мкл 35 мМ раствора сернокислого железа. В данной модели окисление ионов железа в присутствии ортофосфата и цитрата сопровождается образованием АФК и при этом возникает хемилюминесценция (ХЛ), избирательно усиливающаяся люминолом, которая подавляется в присутствии антиоксидантов. Регистрацию ХЛ осуществляли прибором SmartLum 5773 в течение 5 минут. Оценивали светосумму хемилюминесценции. Результаты экспериментов определяли по интенсивности хемилюминесценции (в у.е.) и рассчитывали в процентах от контроля. Антиокислительную активность магниевой соли коменовой кислоты оценивали по угнетению ХЛ модельной системы при добавлении водных растворов препарата в сравнении с раствором коменовой кислоты и сульфата магния. Конечная концентрация вещества в кювете составляла 0,1 мг/мл и 0,01 мг/мл. Хемилюминесценция свободных радикалов модельной системы ЦФЛ (контроль) принимается за 100% [Фархутдинов P.P., Лиховских В.А. Хемилюминесцентные методы исследования свободно-радикального окисления в биологии и медицине. 1995. Уфа. 90 с.]. Достоверность отличий оценивали с помощью t-критерия Стьюдента [Лакин Г.Ф. Биометрия. М. 1990. 352 с.]. Результаты исследования представлены в таблице 5.
| Таблица 5 | |||
| Уровень снижения свободных радикалов в модельной системе ЦФЛ в присутствии коменовой кислоты, комената магния и сульфата магния (% от контроля). | |||
| № п/п | Препарат | Концентрация вещества, мг/мл | |
| 0,01 | 0,01 | ||
| 1 | Коменат магния | 30,67±1,20∗ ∗∗ | 30,67±1,20∗ ∗∗ |
| 2 | Коменовая кислота | 33,29±1,36∗ ∗∗ | 33,29±1,36∗ ∗∗ |
| 3 | Сульфат магния | 0,65±0,54 | 0,65±0,54 |
| Примечания: | |||
| 1. ∗ p<0,001 в сравнении с сульфатом магния; | |||
| 2. ∗∗ p<0,001 в сравнении с 0,01 мг/кг. |
Анализ данных, представленных в таблице 5, показывает, что магниевая соль коменовой кислоты значительно снижает содержание свободных радикалов в сравнении с контролем в модельной системе ЦФЛ. Уровень снижения свободных радикалов коменатом магния практически не отличается от уровня гашения свободных радикалов коменовой кислотой. При этом антиокислительные свойства магниевой соли коменовой кислоты так же, как и коменовой кислоты, зависят от концентрации вещества. Так, увеличение концентрации как коменовой кислоты, так и комената магния в испытуемом растворе с 0,01 мг/мл до 0,1 мг/мл способствует значительному (на ≈36%) повышению уровня гашения свободных радикалов. Применение сульфата магния в этих же концентрациях влияния на уровень свободных радикалов не оказывает.
Таким образом, коменат магния обладает выраженным антиоксидантным действием, при этом его антиокислительные свойства практически не отличаются от антиокислительных свойств коменовой кислоты. Сульфат магния не проявил в испытуемой нами концентрации антиокислительных свойств в модельной системе ЦФЛ.
Известно, что при стрессе происходят нарушения в нервных клетках как метаболические, так и морфологические вплоть до их гибели. При этом повреждение нейронов в основном связано с гипоксией, оксидативным стрессом.
Для оценки состояния оксидативных механизмов наиболее часто используют определение продуктов перекисного окисления липидов (ПОЛ), промежуточным продуктом которого является малоновый диальдегид (МДА), а также исследование хемилюминесценции биологических сред, интегрально отражающей баланс про- и антиоксидантных процессов в организме [Барабой В.А., Сутковой Д.А. Окислительно-антиоксидантный гомеостаз в норме и патологии. Киев.: Наукова думка. 1977. 420 с.].
Уровень свободнорадикального окисления (СРО) в мозге стрессированных крыс определяли хемилюминесцентным методом [Фархутдинов У.Р., Фархутдинов P.P. // Бюл. экспер. биол. и мед. 2000. Т.129. №3. С.260-264] на приборе SmartLum 5773. Результаты экспериментов оценивали по интенсивности хемилюминесценции (светосумма хемилюминесценции в у.е.). Содержание МДА определяли по методу Гаврилова Б.В. и соавт. [Гаврилов В.Б., Гаврилова А.Р., Мажуль Л.М. Определение содержания продуктов перекисного окисления липидов в тесте с тиобарбитуровой кислотой // Вопросы мед. химии. 1987. №1. С.19-21]. Статистический анализ результатов проводили с использованием критерия Стьюдента [Лакин Г.Ф. Биометрия. М.: 1990. 352 с.].
Антиоксидантная активность комената магния исследовалась на модели комбинированного стрессового воздействия на крыс.
Животных содержали в виварии при свободном доступе к пище и воде. Опыты проводили с соблюдением принципов гуманности в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР от 12.08.1977 г. №755). Эксперименты проведены на 35 крысах-самцах линии Wistar массой 240-250 г.
Крыс подвергали иммобилизационно-холодовому стрессированию путем многократного воздействия голода и иммобилизации в пенале при температуре +6 - +8°C в течение 5 часов. Стрессирование осуществляли по схеме: 1-е сутки - 24 часа голод, 2-е сутки голод-пенал (+6 - +8°C), кормление, голод - 16 часов, 3-и сутки голод-пенал (+6 - +8°C) в течение 5 часов, декапитация, определение СРО и МДА. Животные в течение всего периода стрессирования имели свободный доступ к воде.
Коменат магния вводили крысам per os, натощак, в течение 3-х суток один раз в сутки в период стрессирования в дозах 1, 2 и 4 мг/кг.
Были сформированы следующие группы самцов крыс:
1. Интактные, контроль;
2. Интактные, коменат магния 1 мг/кг массы тела;
3. Интактные, коменат магния 2 мг/кг массы тела;
4. Интактные, коменат магния 4 мг/кг массы тела;
5. Стресс, контроль;
6. Стресс, коменат магния 1 мг/кг массы тела;
7. Стресс, коменат магния 2 мг/кг массы тела;
8. Стресс, коменат магния 4 мг/кг массы тела.
Анализ данных, представленных в таблице 6, показывает, что при применении комената магния в дозах 1, 2 и 4 мг/кг массы тела у интактных животных (группы №2, 3, 4) уровень свободнорадикального окисления в мозге практически не отличается от интактного контроля - группа №1.
| Таблица 6 | |||
| Влияние комената магния на СРО и содержание МДА в мозге стрессированных крыс (М±m) | |||
| № п/п | Группы животных | СРО (светосумма, у.е.) | МДА (нМ/1 г белка) |
| 1 | Интактные, контроль | 203,0±3,71 | 3,83±0,16 |
| 2 | Интактные, коменат магния 1 мг/кг | 203,99,56±11,75 | 3,78±0,09 |
| 3 | Интактные, коменат магния 2 мг/кг | 193,56±6,93 | 3,92±0,16 |
| 4 | Интактные, коменат магния 6 мг/кг | 202,52±21,07 | 3,98±0,03 |
| 5 | Стресс, контроль | 235,94±8,72∗∗ | 4,43±0,27∗∗ |
| 6 | Стресс, коменат магния 1 мг/кг | 218,86±4,14 | 4,03±0,13 |
| 7 | Стресс, коменат магния 2 мг/кг | 197,03±6,57 | 3,77±0,15 |
| 8 | Стресс, коменат магния 4 мг/кг | 216,17±0,71 | 4,24±0,15 |
| Примечания: | |||
| 1. ∗ - p<0,05; ∗∗ - p≤0,01 - по сравнению с интактным контролем; | |||
| 2. - p<0,05; - p≤0,01 - по сравнению со стрессом. |
Значительное и достоверное (p≤0,05) повышение уровня СРО и МДА в головном мозге крыс в сравнении с интактным контролем наблюдалось при комбинированном стрессовом воздействии (гр. №5).
В то же время в группах крыс №№6, 7, 8, получавших в течение всего периода стрессирования магниевую соль коменовой кислоты в дозах 1, 2 и 4 мг/кг, эти показатели были значительно ниже, чем в группе «стресс, контроль» (гр. №5). При этом наиболее низкие (на уровне интактного контроля) и статистически значимые показатели СРО и МДА отмечались в головном мозге крыс, получавших коменат магния в концентрации 2 мг/кг массы. Менее выраженное антиокислительное действие коменат магния оказал в концентрации 1 и 4 мг/кг.
Таким образом установлено, что коменат магния в концентрациях 1, 2 и 4 мг/кг не оказывает влияния на окислительные процессы в мозге интактных животных. Применение его в этих же концентрациях на фоне длительного комбинированного стрессирования способствует стабилизации окислительных процессов в головном мозге крыс. Максимальный статистически значимый антиокислительный эффект отмечается при применении комената магния в концентрации 2 мг/кг.
Токсичность исследуемых доз магниевой соли коменовой кислоты мы оценивали по показателям лейкограммы крови [Справочник. Лабораторные методы исследования в клинике. Под ред. Меньшикова В.В. Москва.: Медицина. 1987. 368 с.], показателям свобод