Соединение сальвианоловой кислоты л, способ его приготовления и применения
Иллюстрации
Показать всеИзобретение относится к новому соединению сальвианоловой кислоты Л с общей формулой (I), к его фармацевтически приемлемым солям и гидролизуемым эфирам, причем соединение сальвианоловой кислоты Л имеет одну пару протонов двойной связи транс-формы и один протон однозамещенной двойной связи; причем соединение сальвианоловой кислоты Л предназначено для лечения сердечно-сосудистых заболеваний, захвата свободных радикалов и/или предупреждения чрезмерного окисления. Изобретение также относится к способу его приготовления, лекарственному препарату, содержащему сальвианоловую кислоту Л, и его применению для приготовления медикамента для лечения сердечно-церебрально-сосудистых заболеваний.
Формула (I)
6 н. и 9 з.п. ф-лы, 13 ил., 17 табл., 10 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Данное изобретение относится к области традиционной китайской медицины (ТКМ), а именно к новому виду соединения сальвианоловой кислоты.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Radix Salviae Miltiorrhizae (Китайское лекарственное сырье, далее именуемое "Danshen"), сухой корень Salvia miltiorrhiza Bge. (Fam. Labiatae), горький на вкус и немного охлажденный, действует на каналы сердца и печени и имеет функцию остановки боли путем удаления стаза, активизируя ток крови и снижая возбуждение, очищая сердце. На Danshen был проведен ряд современных фармакологических исследований, которые показали, что он способен расширять коронарную артерию, улучшая микроциркуляцию и защищая сердце, а также может ингибировать и устранять агрегацию тромбоцитов, повышая выносливость организма в условиях недостатка кислорода, а также способность к антигепатитной, антиопухолевой и антивирусной функции и т.д.
В 2001 г. Л.Н.Ли и др. в Институте фармакологии, Китайской академии медицинских наук и Пекинского объединенного медицинского колледжа [Бюллетень медицинского исследования, 2001, Том 30(7)], сообщили, что существует 13 водорастворимых биоактивных компонентов производных соединений фенолокислоты, извлеченных из Danshen или растений с таким же геном, включая сальвианоловую кислоту A, B, C, D, Е, F, G, Н, I, J, литоспермовую кислоту, розмариновую кислоту, изосальвианоловую кислоту C и т.д. К тому же, раскрывалось фармакологическое действие таких компонентов. Рена, Касиму и др. [Журнал Синьцзянского медицинского университета, 2002, Том 25(3)] сообщили о химической структуре сальвианоловой кислоты К.
Иностранные исследователи также изучали водорастворимые биоактивные компоненты Danshen. В 1999 году Университет Джорджа Вашингтона подал заявку и в итоге получил патент США относительно действия 13 производных соединений сальвианоловой кислоты на анти-ВИЧ интегразу и другие вирусы. Пришли к выводу, что Danshen является растительным сырьем с большим потенциалом, которое просто необходимо изучать далее.
Указанная сальвианоловая кислота Л данного изобретения является всего лишь новым соединением, найденным в Danshen в процессе обширного скрининга. До сегодняшнего дня еще не сообщалось о структуре и фармакологических эффектах данного соединения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью данного изобретения является предоставить новое соединение сальвианоловой кислоты Л.
Следующей целью данного изобретения является предоставить фармацевтический препарат, содержащий сальвианоловую кислоту Л.
Третьей целью данного изобретения является предоставить способ приготовления сальвианоловой кислоты Л.
Четвертой целью данного изобретения является предоставить способ использования сальвианоловой кислоты Л при приготовлении медикамента для лечения сердечно-сосудистых заболеваний.
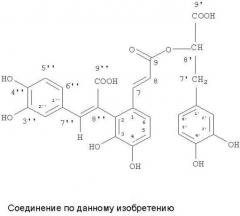
Данное изобретение относится к новому соединению, которое представлено общей формулой (I), как показано ниже, с фармацевтически приемлемыми солями, сольватами и гидролизуемыми эфирами:
Согласно данному изобретению, структура нового соединения фенолокислоты была определена физико-химическими свойствами, масс-спектрометрией с высоким разрешением (QFT-ESI), масс-спектрометрией с ионизацией электрораспылением (ESI-MS), 1H ЯМР, 13С-ЯМР, НУПП, gCOSY (корреляционной спектроскопией), дНМВС (гетероядерной многополосной корреляцией) и gHMQC (гетероядерной многоквантовой корреляцией).
Соединение по данному изобретению является бледно-желтоватой пудрой.
Соединение согласно данному изобретению демонстрирует положительный результат при тонкослойной хроматографии (ТСХ), реакции проявления цвета с FeCl3, что говорит о том, что оно может быть фенольным соединением.
При масс-спектрометрии с высоким разрешением (QFT-ESI), которая показала пики квазимолекулярных ионов при м/з 537.1034, была подтверждена молекулярная формула C27H22O12 с ненасыщенной степенью Ω в 17.
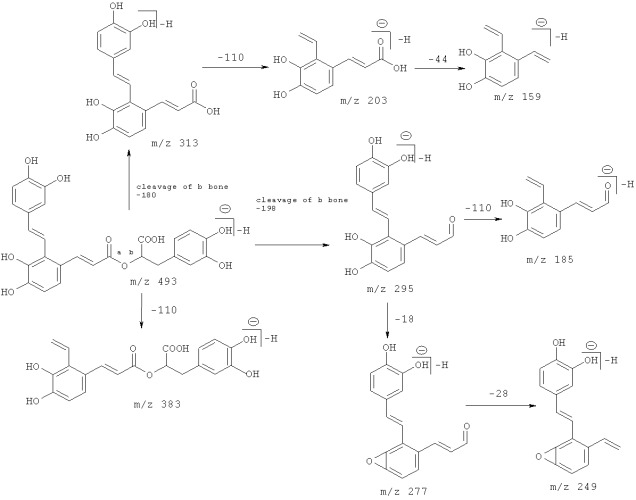
При масс-спектрометрии с ионизацией электрораспылением (ESI-MS) пик молекулярных ионов соединения согласно данному изобретению при м/з 537 может вначале легко потерять 8-карбоксильную группу (-44), и образовать пик фрагментарных ионов при м/з 313,295 в соответствии с фрагментативной регулярностью сальвианоловой кислоты A.
Согласно данному изобретению, фрагментативная регулярность сальвианоловой кислоты A представлена следующим образом:
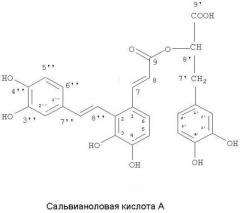
Понятно, что основные пики фрагментарных ионов при м/з 493, 313, 295 являются основными пиками ионов сальвианоловой кислоты A в ее масс-спектре. Таким образом, соединение данного изобретения имеет такую же структуру основной цепи, как и сальвианоловая кислота A.
Спектр протонного ядерного магнитного резонанса (1Н-ЯМР) дает 1 сигнал метенильного протона, присоединенного к кислороду при δ 5.09 (1Н, dd, J=8.0, 4.5 Гц); 11 сигналов ароматического протона при δ 6.8 8 (1Н, d, J=8.5 Гц), δ 7.25 (1Н, d, J=8.5 Гц), δ 7.59 (1Н, d, J=16.0 Гц), δ 6.22 (1Н, d, J=16.0 Гц), δ 6.68 (1Н, s), δ 6.55 (2Н, d, J=8.0 Гц), δ 6.5 (1H, d, J=2.0 Гц), δ 6.69 (1H, d, J=8.0 Гц), δ 6.54 (1H, dd, J=8.5, 2.0 Гц), δ 7.92(1H, s); 2 сигнала алифатического протона при δ 3.01 (2Н, ddd, J=14.0, 8.0, 4.5 Гц).
Спектр ядерного магнитного резонанса углерода-13 (13С-ЯМР) показал 27 сигналов углерода, включая 1 сигнал алифатического углерода при δ 39.6, 1 сигнал метенильного углерода, присоединенного к кислороду при δ 7 6.4, 3 сигнала карбонильного углерода при δ 170.1, δ 173.0, δ 175.1, и 22 сигнала углерода с двойной связью при δ 117.4, δ 117.8, δ 117.8, δ 118.2, δ 119.2, δ 120.2, δ 121.7, δ 123.7, δ 125.7, δ 126.6, δ 128.0, δ 128.8, δ 129.9, δ 130.9, δ 146.2, δ 146.5, δ 146.9, δ 147.4, δ 147.7, δ 147.8, δ 150.3, δ 150.9.
Спектр неискаженного усиления переносом поляризации (НУПП) показал, что в молекуле существует 1×CH2, 12×CH и 14×C.
В свете химического сдвига и взаимного связывания ароматического протона в спектре 1Н-ЯМР, вместе с информацией, предоставленной спектром 13С-ЯМР, считается, что соединение данного изобретения имеет два 1,3,4-три-замещенных бензольных кольца, одно 1,2,3,4-тетра-замещенное бензольное кольцо, 1 двойную связь транс-формы и 1 единозамещенную двойную связь. Все это соответствует спектрометрическим характеристикам соединений сальвианоловой кислоты из Radix Salviae Miltiorrhizae.
Из вышесказанного следует, что соединение по данному изобретению, скорее всего, является соединением феноловой кислоты, демонстрируя структурные сходства с отмеченными соединениями сальвианоловой кислоты в Radix Salviae Miltiorrhizae.
По сравнению с предыдущим уровнем техники и соответствующими спектральными исследованиями, было выявлено, что соединение по данному изобретению имеет такие же спектральные свойства, как и сальвианоловая кислота A, за исключением того, что 1Н-ЯМР показал 2 пары протонов с двойной связью транс-формы в сальвианоловой кислоте A, и лишь 1 пару протона с двойной связью транс-формы и 1 протон с единозамещенной двойной связью в соединении по данному изобретению; а 13С-ЯМР показал на один карбонильный сигнал больше в соединении по данному изобретению, по сравнению с сальвианоловой кислотой A, причем C-1″ и C-8″ сдвигаются в сторону слабого поля на 8 м.д. и 6 м.д., соответственно. В результате, разница между соединением по данному изобретению и сальвианоловой кислотой A состоит в том, что C-1″ или C-8″ замещается карбоксильной группой. Для того чтобы далее подтвердить замещение C-1″ и C-8″, были проведены 2D-ЯМР исследования данного соединения, а результаты его спектроскопии ГМПК показали, что присутствует длительное связывание между H-7″ и C-9″, H-7″ и C-2″, H-7″ и C-2, а также H-7″ и C-6″. Таким образом, можно вычислить, что C-8″ было замещено карбоксильной группой в данном соединении.
Соответственно, по сравнению с предыдущим уровнем техники, соединение по данному изобретению является новым соединением сальвианоловой кислоты, получившим название «сальвианоловой кислоты Л».
Фактически, из-за изменений в конфигурации и конформации, которые произошли в данном соединении в процессе извлечения, соответствующие изменения также произошли бы с его спектральными данными, однако различные виды изомеров, произведенные при помощи конфигурационных и конформационных изменений, относятся к области защиты данного изобретения. Сальвианоловая кислота Л данного изобретения, согласно обычным техническим знаниям и существующему уровню техники, также может использоваться в форме ее фармацевтически приемлемых солей и сольватов. Указанные фармацевтически приемлемые соли сальвианоловой кислоты Л согласно данному изобретению включают обычные и фармацевтически приемлемые соли, полученные из неорганического или органического основания, произведенные при помощи обычного способа получения соли. К примерам таких солей относятся натриевая соль, калиевая соль, соль лития, магниевая соль, алюминиевая соль, кальциевая соль, цинковая соль, или соли, полученные в результате реакции с N, N'-дибензинэтилендиамином, хлорпрокаином, холином, диэтаноламином, этилендиамином, N-метил глюкозамином, прокаином и берберином. Нижеописанная сальвианоловая кислота Л включает сальвианоловую кислоту Л, представленную формулой (I) и ее фармацевтически приемлемыми солями, сольватами и гидролизуемыми эфирами.
Указанная сальвианоловая кислота Л данного изобретения должным образом вводится в форме лекарственного препарата, который может быть использован обычным образом при помощи одного или нескольких видов фармацевтически приемлемых носителей или вспомогательных веществ. К тому же, при возможности, указанная сальвианоловая кислота Л данного изобретения может быть введена в качестве сырьевого медикамента, желательно, чтобы активные компоненты прямо использовались как фармацевтический препарат. С точки зрения совместимости с другими компонентами и безопасности для пациента, носители должны быть фармацевтически приемлемыми. Таким образом, данное изобретение предлагает лекарственные препараты сальвианоловой кислоты Л, которые включают сальвианоловую кислоту Л по данному изобретению и один или несколько фармацевтически приемлемых носителей с использованием или без использования других терапевтических и/или профилактических компонентов. Такие препараты могут вводиться перорально, парентерально (включая подкожно в форме инъекций или таблеток резервуарного типа, внутрикожно, внутритекально, внутримышечно в форме капсулы и внутривенно), ректально и поверхностно, как, например, под язык. Однако наиболее подходящий способ введения зависит от заболевания пациента. Такие лекарственные препараты могут быть приготовлены индивидуально, а также любым способом, известным в области фармацевтики. Все эти способы включают этап объединения сальвианоловой кислоты Л по данному изобретению с носителем, который представляет один или несколько видов вспомогательных компонентов. В общем, указанные препараты по данному изобретению производятся следующим образом: однородное, плотное соединение сальвианоловой кислоты Л данного изобретения с жидкостью или измельченными твердыми носителями или их смесью для получения полуфабриката; при необходимости дальнейшее формирование указанного полуфабриката в желаемые препарат.
Обычно можно использовать ряд стандартных фармацевтических технологий, чтоб получить лекарственный препарат по данному изобретению, используя сальвианоловую кислоту Л и лекарственные носители. К таким технологиям относится смешивание, гранулирование и прессование. Как известно специалистам в этой сфере, характеристики и формы фармацевтически приемлемых носителей или разбавителей зависят от следующих факторов: количества смешиваемых активных компонентов, способа введения и других известных факторов. Указанные фармацевтически приемлемые носители в рамках данного изобретения относятся ко всем типам органических или неорганических носителей, которые могут быть введены вместе с препаратом, например, наполнитель, смазка, связывающее вещество, вещество для улучшения распадаемости и покрывающее вещество, используемое для препаратов в твердой форме; или фармацевтические добавки, такие как краситель и подсластитель. Указанные фармацевтические носители могут быть выбраны из группы, состоящей из сахарных спиртов, таких как маннитол или сорбитол, пиросульфита натрия, бисульфита натрия, тиосульфата натрия, цистеин гидрохлорида, тиогликолевой кислоты, метионина, витамина С, двунатриевой ЭДТК, ЭДТА кальция-натрия, карбонатов, ацетатов, фосфатов одновалентных щелочных металлов или их водных растворов, хлористоводородной кислоты, уксусной кислоты, серной кислоты, фосфорной кислоты, аминокислоты, хлорида натрия, хлорида калия, лактата натрия, ксилитола, мальтозы, глюкозы, фруктозы, декстрана, глицина, крахмала, сахарозы, лактозы, маннитола, производных кремния, целлюлозы и ее производных, альгината, желатина, поливинилпирролидона (ПВП), глицерина, Твин-80, агара, карбоната кальция, поверхностно-активного вещества, ПЭГ, циклодекстрина, бета-циклодекстрина, фосфолипидных материалов, каолина, тальковой пудры, стеарата кальция, стеарата магния и т.д.
Вышеуказанный медицинский препарат может быть сформирован в любую фармацевтически приемлемую лекарственную форму, включая таблетки, такие как таблетки в сахарной оболочке, таблетки с пленочной оболочкой и таблетки с энтеросолюбильным покрытием; капсулы, такие как твердые и мягкие капсулы; растворы для перорального приема; таблетки для медленного растворения в щечном кармане; гранулы, гранулы, которые принимаются после растворения в кипятке; драже; порошки; пасты; пеллеты; суспензии; растворы; инъекции; свечи; пасты, такие как мази и пластыри; кремы; спреи; капли и повязки. Желательно, чтоб препараты были в лекарственной форме для перорального применения, как, например, в форме капсул, таблеток, растворов для перорального применения, гранул, драже, порошков, пеллетов и паст; а также в форме инъекций, как, например, инъекционные порошки, инъекции, переливания и т.д. Наиболее предпочтительно, чтоб препараты были в форме таблеток.
Среди таких предпочтительных препаратов, указанные препараты для перорального введения могут содержать обычно используемые вспомогательные вещества, связывающие вещества, наполнители, разбавители, таблетирующие вещества, смазки, вещества для улучшения распадаемости таблеток, красители, ароматизаторы и смачивающие вещества, а при необходимости на таблетки может быть нанесено покрытие.
Желательно, чтоб примеры указанных вспомогательных веществ включали лактозу, Д-маннитол, Д-сорбитол, крахмал (такой как альфа-крахмал), декстрин, кристаллическую целлюлозу, гидроксипропилцеллюлозу с низкой степенью замещения, натриевую карбоксиметилцеллюлозу, аравийскую камедь, амилопектин, легкую безводную кремниевую кислоту, синтетический силикат алюминия или алюмосиликат натрия и т.д. Предпочтительные примеры указанных смазочных материалов включают стеарат магния, стеарат кальция, тальковую пудру и силикагель и т.д.
Предпочтительные примеры указанных связывающих веществ включают альфа-крахмал, сахарозу, желатин, аравийскую камедь, метилцеллюлозу, карбоксиметилцеллюлозу, натрия карбоксиметилцеллюлозу, кристаллическую целлюлозу, сахар, Д-маннитол, трегалозу, декстрин, амилопектин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, пирролидон и т.д.
Предпочтительные примеры указанных веществ для улучшения распадаемости таблеток включают лактозу, сахар, крахмал, карбоксиметилцеллюлозу, кальция карбоксиметилцеллюлозу, аминоалкил натрий, натрия карбоксиметил крахмал, легкую безводную кремниевую кислоту, гидроксипропилцеллюлозу с низкой степенью замещения, и т.д.
Предпочтительные примеры указанных покрывающих веществ включают гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, этилцеллюлозу, карбоксиметилцеллюлозу, поливиниловый спирт и т.д.
Предпочтительные примеры указанных красителей включают водорастворимые пищевые тартазиновые красители (пищевые красители, такие как пищевой красный №2 и №3, пищевой желтый №4 и №5, пищевой синий №1 и №2); нерастворимые в воде красочные лаки (такие как алюминиевая соль вышеуказанных водорастворимых пищевых тартазиновых красителей) и натуральные красители (такие как бета-каротин, хлорофилл и крокус) и т.д.
Предпочтительные примеры указанных подсластителей включают сахарин натрия, глицирретиновую кислоту, аспартам, стевиозид и т.д.
Обычный способ приготовления таблеток включает соединение сальвианоловой кислоты Л данного изобретения с одним или несколькими видами фармацевтически приемлемых вспомогательных веществ и дальнейшее прессование или формирование. Помимо этого, сальвианоловая кислота по данному изобретению также может быть составлена как жидкие препараты для перорального применения, например, водорастворимые или маслорастворимые суспензии, растворы, эмульсии, сиропы и т.д. Сальвианоловая кислота Л данного изобретения может также быть приготовлена в форме сухого продукта, который перед употреблением смешивается с водой или другим подходящим носителем. Жидкие препараты такого типа также могут содержать обычные добавки, включая суспендирующие вещества такие как сорбитовый сироп, метилцеллюлозу, глюкозу/сироп, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрогенизированный пищевой жир; эмульгирующие вещества, такие как лецитин, сорбитанмоноолеат или аравийская камедь; безводные носители (включая пищевое масло), такие как миндальное масло, фракционированное кокосовое масло, маслянистый эфир, пропиленгликоль или этанол; а также консерванты, такие как метилпарабен, нипазол и сорбиновую кислоту.
Парентерально вводимые препараты включают водные и безводные стерильные инъекции, и по желанию такие препараты могут содержать антиоксиданты, буферные вещества, бактериостатические средства, изотонические средства и т.д.; а также парентерально вводимые препараты включают водные и безводные стерильные суспензии, и по желанию такие препараты могут содержать суспендирующие вещества и загустители. Такие препараты могут храниться в сосуде с разовой и многоразовой дозировкой, как, например, в герметичных ампулах и флаконах; и могут храниться в леофилизированном состоянии и разводиться перед использованием стерильным жидким носителем, например, водой для инъекций.
Препараты с ректальным введением могут быть представлены суппозитариями с обычной суппозитарной основой, такой как масло какао, стеариновая кислота или другие глицериды или этиленгликоль.
Препараты местного действия, вводимые в полость рта, как, например, препараты для растворения в щечном кармане или под языком, включают пастилки, активный компонент которых включен в ароматизированную основу, такую как сахарозу и аравийскую камедь; а также пастилки, в которых активные компоненты содержатся в такой основе, как желатин и глицерин или сахароза и аравийская камедь.
Сальвианоловая кислота Л данного изобретения может быть сформирована в препараты резервуарного типа, и такие препараты с замедленным высвобождением могут быть введены путем имплантации (как, например, подкожной имплантации или внутримышечной имплантации) или внутримышечной инъекции. Таким образом, сальвианоловая кислота Л данного изобретения может быть приготовлена с использованием подходящих полимеров, водоотталкивающих материалов (например, эмульсия в приемлемом масле) или ионообменных смол, или же приготовлена в форме слаборастворимых производных, например, слаборастворимой соли.
Согласно общим техническим знаниям и известному уровню техники, медицинское действие, связанное с данным изобретением, включает профилактику и лечение определенных заболеваний или симптомов. Терапевтически эффективное количество сальвианоловой кислоты Л данного изобретения зависит от особенностей заболеваний и непосредственного состояния пациента, или же необходимо следовать указаниям врача. Обычно терапевтически эффективное количество для взрослых составляет от 0,02 до 5000 мг в день, желательно - от 1 до 1500 мг в день. Как сказано выше, такое количество может быть введено единоразово или несколькими дозами через определенные промежутки времени, например, дважды в день, трижды в день, четырежды в день и более. Указанный препарат по данному изобретению содержит 0,1-99% активного компонента по весу, желательно 30-95% по весу для таблеток и капсул; и желательно 3-50% по весу для жидких препаратов.
Данное изобретение осуществляется следующим образом:
а) извлечение: извлечение лекарственного сырья Radix Salviae Miltiorrhizae или смеси Radix Salviae Miltiorrhizae и другого лекарственного сырья с водой, добавление спирта для осаждения и получения надосадочного слоя, после чего надосадочный слой выпаривается для получения экстракта;
б) разделение: растворение экстракта, полученного на этапе (а), в воде, нанесение на макропористую абсорбирующую смолу и элюирование смолы водой для получения элюента, окисление элюента, нанесение окисленного элюента опять на макропористую абсорбирующую смолу, промывание смолы кислым водным раствором для удаления загрязнений, элюирование смолы этанолом для получения этанолового элюента, выпаривание этанолового элюента для получения экстракта;
в) очистка: нанесение экстракта, полученного на этапе (б), на колонку с силикагелем при помощи способа высушивания, изократическое элюирование с подвижной фазой хлороформа, метанола и муравьиной кислоты; сбор элюента; контроль за ходом процесса при помощи тонкослойной хроматографии, объединение аналогичных по характеристикам элюентов для получения сальвианоловой кислоты Л.
На этапе (а) указанное лекарственное сырье Radix Salviae Miltiorrhizae или смесь Radix Salviae Miltiorrhizae с другим лекарственным сырьем можно разделить на части для декоктирования, растереть на гранулы или порошок, желательно - разделить на части для декоктирования. Предпочтительно, чтоб корень Radix Salviae Miltiorrhizae использовался в форме указанного лекарственного сырья Radix Salviae Miltiorrhizae. Указанное другое лекарственное сырье относится к китайскому лекарственному сырью, известному профессионалам в этой сфере, которое совместимо с Radix Salviae Miltiorrhizae, желательно Radix Notoginseng, Radix Astragali и/или Radix Polygoni Multiflori.
На этапе (а) указанное извлечение водой происходит следующим образом: декоктирование лекарственного сырья в воде, объем которой превышает объем лекарственного сырья в 4-8 раз, желательно - в воде, объем которой превышает объем лекарственного сырья в 4 раза, в течение 1,5-3,5 часов, желательно - 2 часов, фильтрование; декоктирование остатка лекарственного сырья в воде, объем которой превышает объем лекарственного остатка в 3-6 раз, в течение 1-3 часов, желательно - в воде, объем которой превышает объем лекарственного остатка в 3 раза, в течение 1 часа, фильтрование; и объединение фильтрата, выпаривание фильтрата для получения экстракта с относительной плотностью 1,11-1,28 (80°С), желательно 1,2 (80°С).
Для того, чтобы образовать соль веществ фенолкислоты для более легкого отделения, на указанном этапе извлечения водой желательно использовать щелочной водный раствор, предпочтительно, чтоб такая щелочь была представлена как минимум одним веществом из группы, состоящей из бикарбоната натрия, карбоната натрия, гидроксида натрия, бикарбоната калия, карбоната калия и гидроксида калия, а более предпочтительно - бикарбонатом натрия или гидроксидом натрия. Указанный щелочной водный раствор является водным раствором бикарбоната натрия с концентрацией 0,30%-0,68% или водным раствором гидроксида натрия с концентрацией 0,0025%-0,004%, желательно - водным раствором бикарбоната натрия с концентрацией 0,45%.
На этапе (а) указанное осаждение спиртом происходит следующим образом: в экстракт для осаждения добавляется 95% этанол до тех пор, пока содержание этанола не составит 65%-70% (25°С), желательно - 70%, и отстаивается в течение 12-36 часов, желательно - 24 часов; выпаривание надосадочного слоя при помощи удаления этанола в условиях пониженного давления, и получение экстракта с относительной плотностью 1,30-1,38 (60°С), желательно - 1,37 (60°С).
Для того чтобы лучше удалить жирорастворимые загрязнения, извлечение спиртом желательно проводить перед этапом извлечения водой. На этапе извлечения спиртом выполняется дважды декоктирование 50-95% этанолом, объем которого в 5-8 раз превышает объем лекарственного сырья, каждый раз в течение 1-2 часов, фильтрование, удаление раствора для извлечения этанолом и извлечение лекарственного остатка при помощи вышеуказанного извлечения водой.
На этапе (б) указанная колонка макропористой смолы может быть представлена неполярной или слабо-полярной смолой, например АВ-8, HPD450, HPD700, D101, D4020 или Х5, желательно АВ-8. Массовая доля лекарственного сырья по отношению к макропористой абсорбирующей смоле составляет 5:1-1:1, желательно 4:1. Колонка смолы промывается водой, объем которой в 8-15 раз превышает объем слоя, желательно превышает объем слоя в 12 раз, в результате чего получается водный элюент.
Соляная кислота добавляется в водяной элюент, чтоб установить его показатель рН на отметку 2,2-3,5, желательно 3,0. Указанный кислый элюент опять подают в колонку макропористой абсорбирующей смолы, причем массовая доля лекарственного сырья по отношению к макропористой абсорбирующей смоле составляет 5:1-1:1, желательно 4:1; колонка промывается соляной кислотой с показателем рН 2,2-3,5, желательно 3,0, до тех пор, пока растворитель станет практически бесцветным. Далее используется в 3-8 раз больше 50%-95% этанола, чтоб промыть колонку, желательно - в 4 раза больше 95% этанола, и элюент выпаривается для получения экстракта без запаха спирта.
На этапе (в) экстракт, выпаренный на этапе (б), растворяется в органическом растворителе, желательно метаноле, смешивается с хроматографическим силикагелем, и желательно, чтоб вес добавленного хроматографического силикагеля с размером частиц 200-300 меш равнялся весу экстракта. Хорошо перемешанный образец наносится на хорошо наполненную колонку с силикагелем, желательно, чтоб нанесенный силикагель имел размер ячеек 200-300 меш, колонка элюируется подвижной фазой хлороформ:метанол:муравьиная кислота (объемное соотношение: 90:10:3-40:10:0.5), желательно хлороформ:метанол:муравьиная кислота (объемное соотношение: 85:15:3). Такое элюирование может быть изократическим элюированием (пропорция элюента неизменна) или градиентным элюированием (пропорция элюента изменяется со временем). При этом градиентное элюирование может регулироваться в соответствии с полярностью собираемого вещества, используя общие знания в этой области, например, полярность элюента может постепенно увеличиваться. Для того, чтобы точно контролировать процесс элюирования, предпочтительно применять ТСХ с растворителем хлороформ:метанол:муравьиная кислота (объемное соотношение: 50:10:2).
Элюенты с аналогичными характеристиками объединяются для получения сальвианоловой кислоты Л.
Для достижения лучшего эффекта разделения, в качестве устройства для разделения можно использовать препаративную жидкостную хроматографию. Например, сальвианоловая кислота Л готовится при следующих условиях разделения:
полупрепаративная жидкостная хроматография Waters Delta prep 4000, колонка: Agilent Zorbax XDB-C18 (21.2×150 мм, 5 мкм), подвижная фаза: ацетонитрил: 0,1% водного раствора муравьиной кислоты (15: 85), скорость потока: 20 мл/мин., длина волны детектирования: 280 нм.
Как показал тест на фармакодинамическое воздействие, способность сальвианоловой кислоты удалять свободные радикалы намного больше, чем у витамина C (см. Таблицу 3, Фиг.9). Более того, сальвианоловая кислота по данному изобретению имеет намного большую восстановительную способность, чем витамин С (см. Фиг.10). Сальвианоловая кислота Л по данному изобретению имеет антиоксидантные свойства и способна захватывать свободные радикалы. Следовательно, сальвианоловая кислота Л по данному изобретению может быть приготовлена в форме медикамента, который обладает функциями захвата свободных радикалов и имеет профилактичиское антиоксидантное действие.
Помимо того, данное изобретение также относится к применению указанной сальвианоловой кислоты Л при приготовлении медикаментов для лечения сердечно-сосудистых заболеваний. К указанным сердечно сосудистым заболеваниям относятся: вазодилатационная дисфункция, вызванная гипоксией; повреждение нервных клеток in vitro, вызванное кислородной недостаточностью, глюкозной недостаточностью и состоянием чрезмерного окисления; и острая ишемия миокарда. Как показал тест на фармакодинамическое воздействие данного изобретения, лиофилизированный порошок сальвианоловой кислоты Л может вызвать некоторый сдвиг вправо вазоконстрикционной кривой норэпинефрина, однако без значительного отличия. Лиофилизированный порошок сальвианоловой кислоты Л значительно повысил вазодилатационный эффект на сосудистое кольцо при гипоксии при концентрации ГКН ((10-5, 10-4, 10-3 моль/л) (P<0.05)). Это иллюстрирует то, что сальвианоловая кислота Л играет значительную роль в облегчении вазодилатационной дисфункции, вызванной гипоксией (см. Таблицы 7-8 и Фиг.11-12).
Сальвианоловая кислота Л по данному изобретению имеет обширное фармакологическое действие на сердечно-сосудистую систему, включая уменьшение повреждения эндотелия сосудов, вызванное ишемией или гипоксией, активацию сосудистой эндотелиальной гиперплазии, облегчение повреждения миокардиальных клеток, вызванного ишемией или гиперплазией, развитие устойчивости к атеросклерозу, подавление агрегации тромбоцитов и противодействие тромбообразованию. Более того, сальвианоловая кислота Л способна расширять коронарную артерию, усиливая коронарный кровоток и предотвращая повреждения, вызванные церебральной ишемией.
Как показал тест на фармакодинамическое воздействие данного изобретения, сальвианоловая кислота по данному изобретению оказывает значительный положительный эффект на поврежденные нервные клетки in vitro, когда такое повреждение вызвано кислородной недостаточностью, глюкозной недостаточностью и перекисью водорода, и способна повышать коэффициент выживаемости клеток, а также имеет функцию защиты нервных клеток от кислородной недостаточности, глюкозной недостаточности и положения чрезмерного окисления (см. Таблицы 12-15). К тому же сальвианоловая кислота Л по данному изобретению способствует лечению острой ишемии миокарда (см. Таблицы 16-17).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 иллюстрирует масс-спектрограмму с высоким разрешением сальвианоловой кислоты Л.
Фиг.2 иллюстрирует масс-спектрограмму с ионизацией электрораспылением сальвианоловой кислоты Л.
Фиг.3 иллюстрирует 1Н-ЯМР диаграмму сальвианоловой кислоты Л при 500 МГц, используя CD3OD.
Фиг.4 иллюстрирует 13С-ЯМР диаграмму сальвианоловой кислоты Л при 125 МГц, используя CD3OD.
Фиг.5 иллюстрирует диаграмму неискаженного усиления переносом поляризации для сальвианоловой кислоты Л при 125 МГц, используя CD3OD.
Фиг.6 иллюстрирует диаграмму корреляционной спектроскопии (gCOSY) сальвианоловой кислоты Л при 500 Мгц, используя CD3OD.
Фиг.7 иллюстрирует диаграмму гетероядерной многополосной корреляции (дНМВС) сальвианоловой кислоты Л при 500 Мгц, используя CD3OD.
Фиг.8 иллюстрирует диаграмму гетероядерной многоквантовой корреляции (gHMQC) сальвианоловой кислоты Л при 500 Мгц, используя CD3OD.
Фиг.9 иллюстрирует способность тестируемого вещества захватывать свободные радикалы.
Фиг.10 иллюстрирует восстановительную способность сальвианоловой кислоты Л по сравнению с витамином C.
Фиг.11 иллюстрирует воздействие лиофилизированного порошка сальвианоловой кислоты Л на сужение сосудов.
Фиг.12 иллюстрирует воздействие лиофилизированного порошка сальвианоловой кислоты Л на расширение сосудов.
Фиг.13 иллюстрирует электрокардиограмму (ЭКГ) после лечения гипофиза питуитрином, где A) - это нормальная ЭКГ контрольной группы, B) - это ЭКГ контрольной группы на 15-й секунде после введения питуитрина, а C) - это ЭКГ контрольной группы на 30-й секунде после введения питуитрина.
ПРИМЕРЫ
Благоприятное воздействие сальвианоловой кислоты Л по данному изобретению, связанное с антиоксидантным действием и захватом свободных радикалов, далее иллюстрируется конкретными экспериментальными данными.
Если не указано иначе, обозначения % и ‰ в рамках данного изобретения означают массовое соотношение.
Пример 1. Приготовление сальвианоловой кислоты Л
Части Дан Шень (Danshen) для декоктирования были помещены в экстрактор. Вода (содержащая 0,45% бикарбоната натрия), объем которой в 4 раза превышал объем лекарственного сырья, была добавлена в экстрактор для декоктирования в течение 2 часов, после чего отфильтрована. Остаток лекарственного вещества продолжали декоктировать в воде, объем которой в 3 раза превышал объем лекарственного остатка, в течение 1 часа и отфильтровали, фильтрат объединили и выпарили для получения экстракта с относительной плотностью 1,2 (80°С). В экстракт добавляли 95% этанол для осаждения до тех пор, пока окончательное содержание этанола не составило 70% (25°С), и оставили отстаиваться на 12 часов или более. Этанол извлекли в условиях пониженного давления для получения экстракта с относительной плотностью 1,37 (60°С).
Полученный выше экстракт развели водой и нанесли на колонку макропористой абсорбирующей смолы АВ-8, и колонку элюировали водой, объем которой в 12 раз превысил объем слоя, после чего получили водный элюент. Уровень рН водного элюента откорректировали при помощи соляной кислоты до уровня РН 3,0. Подкисленный водный элюент опять нанесли на колонку макропористой абсорбирующей смолы АВ-8. Кислый водный раствор с показателем рН 3,0 был использован для промывания колонки до тех пор, пока элюент стал практически бесцветным. Далее 95% этанол объемом, в 4 раза превышающим объем слоя, использовали для элюирования и получения элюента, после чего элюент выпаривали до получения густого экстракта без запаха спирта. Полученный экстракт развели метанолом, добавили хроматографический силикагель с размером частиц в 200-300 меш и перемешали, причем вес добавленного хроматографического силикагеля равнялся весу экстракта. Перемешанный образец нанесли на хорошо наполненную колонку с силикагелем, и колонку элюировали подвижной фазой хлороформ:метанол:муравьиная кислота (в объемном соотношении 85:15:3). ТСХ использовалась для контроля всего процесса элюирования, и элюенты с аналогичными характеристиками были объединены для получения сальвианоловой кислоты Л.
Используя масс-спектрометрию с высоким разрешением (QFT-ESI), был установлен пик квазимолекулярных ионов [М-Н]+м/з 537.1034.
| Таблица 1 | ||||
| Данные по lH (500М, CD3OD) и 13С-ЯМР (125М, CD3OD) относительно сальвианоловой кислоты Л | ||||
| № | δH | δc | H-H COSY | C-H COSY |
| 1 | - | 128.0 | H-5, H-8 | |
| 2 | - | 128.8 | H-6, H-7, H-7″ | |
| 3 | - | 146.2 | H-5 | |
| 4 | - | 150.9 | H-5, H-6 | |
| 5 | 6.88 (1H, d, J=8.5 Гц) | 117.8 | H-6 | |
| 6 | 7.25 (1H, d, J=8.5 Гц) | 121.7 | H-5 | H-7 |
| 7 | 7.59 (1H, d, J=16.0 Гц) | 147.4 | H-8 | H-6 |
| 8 | 6.22 (1H, d, J=16.0 Гц) | 117.4 | H-7 | |
| 9 | - | 170.1 | H-7, H-8 | |
| 1' | - | 130.9 | H-2′, H-5′, H-8′, H-7′ | |
| 2′ | 6.68 (1H, s) | 119.2 | H-6′, H-7″ | |
| 3′ | - | 146.9 | H-5′ | |
| 4′ | - | 147.8 | H-2″, H-5′, H-6′ | |
| 5′ | 6.55 (1H, d, J=8.0 Гц) | 117.8 | ||
| 6′ | 6.55 (1H, d, J=8.0 Гц) | 123.7 | H-2′ | |
| 7′ | 3.01 (1H, ddd, J=14.0, 8.0, 4.5 ГЦ) | 39.6 | H-8′ | H-2′ |
| 8′ | 5.09 (1H, dd, J=8.0, 4.5 Гц) | 76.4 | H-7′ | H-7′ |
| 9′ | - | 175.11 | H-7′, H-8′ | |
| 1″ | - | 129.9 | H-2″ | |
Спектр НУПП показал, что в молекуле было 1×CH2, 12×CH и 14×С.
Пример 2. Приготовление сальвианоловой кислоты Л
Части Дан Шень (Danshen) и Sanqi для декоктирования были помещены