Способ получения культуры гладкомышечных клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, клеточным технологиям и тканевой хирургии. Способ получения культуры гладкомышечных клеток заключается в том, что вырезают фрагмент кровеносного сосуда, измельчают его на кусочки до размеров не более 2 мм в любом измерении и инкубируют кусочки в культуральном флаконе с предварительно нанесенными на дно флакона царапинами, содержащем среду для культивирования, содержащую 10% эмбриональной фетальной сыворотки, в течение по меньшей мере 10 дней, но не более 24 дней, при температуре 37°С в условиях СО2-инкубатора, отличающийся тем, что упомянутым фрагментом кровеносного сосуда является фрагмент восходящего отдела грудной аорты, вырезаемый в ходе процедуры аортокоронарного шунтирования, а упомянутые кусочки фрагмента восходящего отдела грудной аорты перед инкубированием выдерживают в среде для культивирования, содержащей 0,1% коллагеназы, в течение по меньшей мере 30 минут, но не более 60 минут, при температуре 37°С, после чего промывают средой для культивирования клеток. Изобретение позволяет получить клетки из тканей аорты для целей трансплантологии непосредственно из прижизненных тканей пациента. 3 ил.
Реферат
Изобретение относится к области биологии, а именно к клеточным технологиям, и может быть использовано для культивирования клеток человека и животных, применяемых в научных исследованиях.
Культура гладкомышечных клеток (ГМК) широко применяется в фундаментальных и прикладных научных исследованиях. Так при исследовании аневризмы восходящего отдела грудной аорты, культуру ГМК получают из вырезанного участка аневризмы аорты пациента в ходе оперативного медицинского вмешательства. При этом в качестве контрольного образца необходимо использовать культуру клеток, полученную из здоровой грудной аорты. Как правило, в исследовательских целях используют культуры клеток, полученные из сосудов, взятых во время посмертных мультиорганных донорских заборов. Обычно для получения культуры ГМК из здоровой грудной аорты используют грудную аорту, вырезанную целиком у донора тканей после смерти. Это описано в работах, посвященных получению культуры ГМК, например в: Inamoto S, et al (2010) TGFBR2 mutations alter smooth muscle cell phenotype and predispose to thoracic aortic aneurysms and dissections. Cardiovascular Research, Vol.88, No 3, Pages 520-529. Однако этот способ остается недоступен большинству исследовательских лабораторий из-за организационных проблем, так как для взятия посмертного донорского материала требуется длительная процедура получения разрешительных документов.
Известны способы получения культуры гладкомышечных клеток (ГМК) из участков кровеносных сосудов: ферментативный способ и “способ выселения в культуру”, описанные в: Kirschenlohr HL, Metcalfe JC, Grainger DJ (1996) Cultures of Proliferating Vascular Smooth Muscle Cells from Adult Human Aorta. Human Cell Culture Protocols (Methods in Molecular Medicine) edited by Gareth E. Jones, Part 24, Pages 319-334.
При осуществлении ферментативного способа фрагмент кровеносных сосудов механически измельчают до кусочков размером не более 2×2 мм, помещают в раствор, содержащий 0,1% коллагеназы и 0,1% эластазы, и инкубируют при температуре 37°С и постоянном помешивании в течение от 2 до 6 часов до полного расщепления внеклеточного матрикса. Затем внеклеточный матрикс удаляют путем фильтрации и последующего центрифугирования, а оставшиеся ГМК помещают в культуральный флакон, заполненный средой для культивирования. Дальнейшее культивирование клеток осуществляют в соответствии со стандартным протоколом, описанным там же. При осуществлении этого способа практически все клетки из участка кровеносного сосуда попадают в среду для культивирования.
Однако недостатком этого способа является то, что при последующем культивировании отмечается высокая гибель клеток, низкий пролиферативный потенциал клеток и преимущественно синтетический фенотип клеток вследствие агрессивного воздействия протеолитических ферментов коллагеназы и эластазы на клетки. Таким образом, клетки, полученные данным способом, невозможно использовать для исследования дифференцировки, поскольку такое исследование обычно проводят на недифференцированных клетках с сократительным фенотипом.
При "способе выселения в культуру" фрагменты кровеносных сосудов механически измельчают до кусочков размером не более 2x2 мм, затем помещают в культуральный флакон с предварительно поцарапанным дном, заполненный средой для культивирования, и инкубируют в течение от 10 до 24 дней при температуре 37°С. За это время ГМК выселяются на дно культурального флакона, локализуясь преимущественно вблизи царапин. Дальнейшее культивирование клеток осуществляют в соответствии со стандартным протоколом, описанным там же. При использовании этого способа можно получить культуру ГМК обоих существующих фенотипов -сократительного и синтетического.
Недостатком этого способа является необходимость использования больших участков кровеносных сосудов, поскольку количество получаемых таким способом клеток невелико для получения культуры ГМК. При осуществлении данного способа невозможно получить культуру ГМК из маленького фрагмента аорты. Данный способ является наиболее близким к заявляемому изобретению и выбран в качестве прототипа.
Задачей настоящего изобретения является получение культуры гладкомышечных клеток из маленького участка восходящего отдела грудной аорты, вырезаемого во время процедуры аорто-коронарного шунтирования.
Выполнение поставленной задачи достигается тем, что в способе получения культуры гладкомышечных клеток, заключающемся в том, что вырезают фрагмент кровеносного сосуда, измельчают его на кусочки до размеров не более 2 мм в любом измерении и инкубируют кусочки в культуральном флаконе с предварительно нанесенными на дно флакона царапинами, содержащем среду для культивирования, содержащую 10% эмбриональной фетальной сыворотки, в течение по меньшей мере 10 дней при температуре 32°С-37°С, упомянутым фрагментом кровеносного сосуда является фрагмент восходящего отдела грудной аорты, вырезаемый в ходе процедуры аортокоронарного шунтирования, а упомянутые кусочки фрагмента восходящего отдела грудной аорты перед инкубированием выдерживают в среде для культивирования, содержащей 0,1% коллагеназы, в течение по меньшей мере 20 минут, но не более 60 минут, при температуре в диапазоне 25°С-37°С, после чего промывают средой для культивирования клеток.
Поставленная задача достигается также и за счет того, что перед измельчением фрагмент восходящего отдела грудной аорты хранят в сбалансированном солевом растворе с добавлением антибиотика.
В отличие от прототипа в предлагаемом способе получения культуры гладкомышечных клеток в качестве материала для получения культуры ГМК используют фрагмент восходящего отдела грудной аорты пациента, вырезанный в ходе процедуры аортокоронарного шунтирования (АКШ). До настоящего времени ничего неизвестно о возможности использования вырезанного фрагмента восходящего отдела грудной аорты в качестве материала для получения культуры ГМК. Известно только использование фрагмента восходящего отдела грудной аорты, вырезанного в ходе АКШ, в качестве контрольного образца при исследовании аневризмы аорты методами полимеразной цепной реакции и иммуногистохимии (Ailawadi G et аl' 2009. Smooth muscle phenotypic modulation is an early event in aortic aneurysms. The Journal of Thoracic and Cardiovascular Surgery, Vol.138, No 6, Pages 1392- 1399). Обычно вырезанный участок ткани больше нигде не используется.
Отсутствие информации об использования вырезанного фрагмента восходящего отдела грудной аорты в качестве материала для получения культуры ГМК может быть связано с тем, что существующими способами получения культуры ГМК невозможно получить достаточное количество клеток из настолько небольшого участка ткани.
Вырезанный участок представляет собой фрагмент приблизительно кубической формы объемом от 2 мм до 5 мм, а в существующих способах получения культуры ГМК используют целые участки восходящего отдела грудной аорты объемом приблизительно 4000÷7000 мм3.
В предлагаемом способе получения культуры гладкомышечных клеток в результате измельчения фрагмента восходящего отдела грудной аорты формируются кусочки размером 1÷2 мм в каждом измерении, что позволяет воздействовать одновременно на весь объем ткани. После инкубирования кусочков в растворе коллагеназы часть внеклеточного матрикса разрушается. В результате последующей промывки удаляются излишки коллагеназы, таким образом большая часть клеток сохраняется от ее повреждающего воздействия. Дальнейшее инкубирование обработанных и промытых кусочков на дне поцарапанного флакона приводит к выселению клеток на дно флакона, причем то, что внеклеточный матрикс был частично разрушен, позволяет клеткам легче выселяться из кусочков ткани и увеличивает количество выселившихся на дно культурального флакона клеток. При осуществлении настоящего способа увеличивается количество выселившихся клеток по сравнению со способом выселения в культуру, что позволяет получить культуру ГМК из такого небольшого фрагмента аорты, как фрагмент, вырезаемый в ходе аорто-коронарного шунтирования. ГМК культуры, полученной при осуществлении настоящего способа, сохраняют свою жизнеспособность и пролиферативный потенциал и в большинстве своем обладают сократительным фенотипом и пригодны для изучения дифференцировки.
Предложенные в заявляемом способе последовательность операций обработки полученного фрагмента восходящего отдела грудной аорты пациента, вырезанного в ходе процедуры АКШ, выбранные режимы и вещества, используемые при этом, обеспечивают достижение поставленной задачи.
Изобретение иллюстрируется следующими графическими материалами.
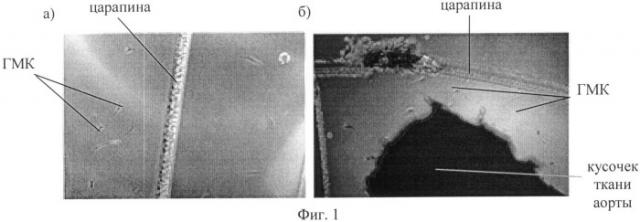
На Фиг.1 представлены полученные с помощью микроскопа изображения клеток, выселившихся на 10-й день от начала инкубации; на Фиг.1а и Фиг.1б представлены изображения разных участков дна культурального флакона.
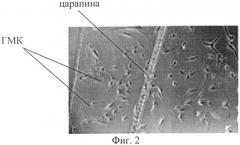
На Фиг.2 представлены полученные с помощью микроскопа изображения клеток, выселившихся на 15-й день от начала инкубации.
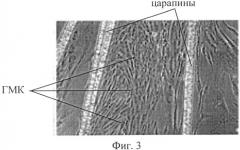
На Фиг.3 представлены полученные с помощью микроскопа изображения клеток, выселившихся на 24-й день от начала инкубации.
Изображения получены с помощью микроскопа биологического для лабораторных исследований (микроскоп серии Axiovert 40 со штативом Axiovert 40 CFL Carl Zeiss, ФРГ) и фотокамеры для микроскопа (Camera Set Canon Compact Digital PowerShot A640 for M52 (D)). Способ осуществляли следующим образом.
Полученный в ходе операции АКШ фрагмент восходящего отдела здоровой грудной аорты помещали в сосуд, содержащий сбалансированный солевой раствор, например PBS, с добавлением антибиотика, например 0,2% гентамицина. После транспортировки из операционной в лабораторию фрагмент восходящего отдела грудной аорты промывали средой для культивирования, например средой Игла в модификации Дульбекко, содержащей глютамин, пируват (DMEM), путем плавного встряхивания фрагмента аорты с помощью пинцета. Процедура повторялась дважды со свежей средой для культивирования. Затем образец перенесли на поцарапанную чашку Петри. В чашке было достаточно среды для того, чтобы образец оставался влажным. Ткань прижимали пинцетом к дну чашки и удаляли эндотелий путем соскабливания с помощью стерильного скальпеля. Явно видимую интиму аорты удаляли с помощью пинцета. Тонкие полоски поперечных мышечных волокон (около 1-2 мм в толщину) аккуратно обдирали до тех пор, пока примерно 2/3 среднего слоя по всей длине образца не были содраны, и поместили в пластиковую чашку Петри диаметром 90 мм, куда добавили 10 мл среды для культивирования.
Когда все гладкомышечные волокна были собраны, чашку Петри наклоняли так, чтобы все волокна были с одной стороны, и удаляли лишнюю жидкость так, чтобы ткань оставалась влажной. Ткань резали скальпелем на кусочки со стороной, равной 1 мм. Полученные кусочки промывали дважды в среде для культивирования. Среду для культивирования удаляли, оставляя кусочки влажными. Затем кусочки помещали в чашку Петри, содержащую среду для культивирования с добавлением 0,1% коллагеназы и инкубировали в течение 30 минут при температуре 37°С. После этого кусочки промывали в сбалансированном солевом растворе, например фосфатно-солевом буфере (PBS). Промытые кусочки мышц помещали в культуральные флаконы площадью 25 см2 с предварительно поцарапанным дном непосредственно на царапины, в количестве не меньше 20 кусочков на флакон. Кусочки, находящиеся в флаконе, промывали средой для культивирования с 10% телячьей эмбриональной сывороткой (FCS) путем плавного покачивания флакона. Процедуру повторяли дважды, меняя среду для культивирования на свежую среду с 10% FCS. Затем кусочки мышц раскладывали непосредственно на дно культурального флакона в количестве 2-4 кусочка на 1 см, располагая их непосредственно на царапины. Далее добавляли минимальный объем среды для культивирования с 10% FCS, чтобы кусочки мышц не плавали, но оставались влажными.
Культуральный флакон с кусочками мышц помещали в СО2-инкубатор (например, MCO-18AIC фирмы Sanyo Electric Co., Ltd., Япония) при температуре 37°С не менее чем на 2 часа. Это время, необходимое для того, чтобы кусочки ткани прикрепились к пластиковому дну флакона. Как только происходило прикрепление, в культуральные флаконы доливали такое количество среды для культивирования с 10% FCS, чтобы глубина слоя жидкости была 1÷2 мм или 1÷2 мл на флакон с площадью дна 25 см.
Кусочки мышц оставляли в СО2-инкубаторе при температуре 37°С на 3 дня, регулярно проверяя и доливая среду для культивирования с 10% FCS до глубины 1-2 мм. Клетки начинали мигрировать не раньше, чем на 4-й день. Появление клеток может занять до недели времени.
После третьего дня флакон встряхивали, в результате чего неприкрепленные кусочки перемещались в угол флакона. Остатки среды и не прикрепившиеся кусочки удаляли. Затем доливали такое количество среды для культивирования с 10% FCS, чтобы глубина слоя жидкости была 1÷2 мм или 1÷2 мл на флакон с площадью дна 25 см. Среду продолжали менять каждые три дня до тех пор, пока значительное число клеток не мигрировало из кусочка мышцы. После этого среду меняли каждые два дня.
Через 2-3 недели, когда 50-70% поверхности дна флакона оказывалось покрыто клетками, среду для культивирования удаляли и добавляли 5 мл свежей среды для культивирования. Это приводило к откреплению большинства кусочков от пластикового дна флакона. Через 18 часов среду для культивирования и кусочки ткани удаляли пипеткой Пастера. Затем снова добавляли среду для культивирования и, аккуратно покачав вперед-назад или по кругу флакон, удаляли оставшиеся кусочки. Процедуру повторяли, пока все кусочки ткани не были удалены. После этого добавляли свежую среду для культивирования с 10% FCS и помещали клетки в инкубатор. Далее среду продолжали менять каждые 2 дня. В течение этого периода клетки мигрировали, пролиферировали и образовывали сплошной монослой. В результате получилась культура гладкомышечных клеток.
Способ получения культуры гладкомышечных клеток, заключающийся в том, что вырезают фрагмент кровеносного сосуда, измельчают его на кусочки до размеров не более 2 мм в любом измерении и инкубируют кусочки в культуральном флаконе с предварительно нанесенными на дно флакона царапинами, содержащем среду для культивирования, содержащую 10% эмбриональной фетальной сыворотки, в течение, по меньшей мере, 10 дней, но не более 24 дней, при температуре 37°С в условиях СО2-инкубатора, отличающийся тем, что упомянутым фрагментом кровеносного сосуда является фрагмент восходящего отдела грудной аорты, вырезаемый в ходе процедуры аортокоронарного шунтирования, а упомянутые кусочки фрагмента восходящего отдела грудной аорты перед инкубированием выдерживают в среде для культивирования, содержащей 0,1% коллагеназы, в течение по меньшей мере 30 минут, но не более 60 минут, при температуре 37°С, после чего промывают средой для культивирования клеток.