Новые производные инсулина с сильно замедленным профилем время/действие
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к новым аналогам инсулина, и может быть использовано в медицине. Указанный аналог инсулина характеризуется одной из следующих структур: Arg(A0), His(A8), Gly(A21), Arg(В31), Arg(В32)-NH2-инсулин; His(A8), Gly(A21), Arg(В31), Arg(В32)-NH2-инсулин; Arg(А0), Glu(A15), His(A8), Gly(A21), Arg(В31), Arg(В32)-NH2-инсулин. Изобретение относится также к способу получения указанного аналога, фармацевтической композиции и лекарственному средству, предусматривающим его использование для лечения сахарного диабета. Изобретение позволяет получить аналог инсулина, характеризующийся задержанным высвобождением и ровным и более длительным действием, например, по сравнению с человеческим инсулином или инсулином гларгином. 6 н. и 12 з.п. ф-лы, 2 ил., 24 пр.
Реферат
Изобретение относится к новым аналогам инсулина с базальным профилем время/действие, их получению и использованию.
В последние годы количество случаев заболевания диабетом достигло практически эпидемических масштабов. Данное заболевание может приводить к серьезному укорочению средней продолжительности жизни. Страдающие диабетом люди вынуждены часто вводить в организм инсулин, следовательно, было бы полезным оптимизировать лечение инсулином. В настоящее время доступны различные разновидности инсулина с определенными фармакологическими параметрами. В частности, по длительности действия различные разновидности инсулина делятся на инсулин кратковременного действия, быстродействующий инсулин, инсулин длительного действия и инсулин смешанного типа. Синонимично используемым обозначением инсулина длительного действия является медленно действующий инсулин, медленно всасывающийся инсулин или базальный инсулин. Многие из этих инсулиновых препаратов содержат активные ингредиенты, называемые аналогами инсулина, которые получают из человеческого инсулина путем замены, делеции и/или добавления одной или нескольких аминокислот. Термины “аналог инсулина” и “разновидность инсулина” в настоящем описании используются синонимично.
При проведении интенсивной инсулиновой терапии предпринимается попытка снизить риск здоровью благодаря постоянному контролю уровня глюкозы в крови путем заблаговременного введения базального инсулина. Одним из примеров современного базального инсулина является препарат Лантус (Lantus®) (активный ингредиент: инсулин Гларгин = Gly(A21),Arg(B31),Arg(B32) - инсулин человека). Основной целью при разработке новых улучшенных видов базального инсулина является минимизация количества гипогликемических событий. В этой связи идеальный базальный инсулин представляет собой инсулин, действующий надежно у каждого пациента в течение по меньшей мере 24 часов. В идеале инсулиновый эффект является замедленным и имеет такой профиль время/действие, который значимо уменьшает риск кратковременной гипогликемии и может вводиться без предварительного приема пищи. Хорошее снабжение инсулином достигается в том случае, когда эффект инсулина сохраняется на одном и том же уровне настолько долго, насколько это возможно, т.е. в организм поступает постоянное количество инсулина. Таким образом, уменьшается риск возникновения гипогликемических событий и минимизируются суточные изменения состояния пациента. Таким образом, фармакокинетический профиль идеального базального инсулина следует определять замедленным высвобождением и замедленным, т.е. продолжительным и ровным действием.
Однако несмотря на уже достигнутые терапевтические преимущества, ни один из описанных медленно действующих разновидностей инсулина не проявляет фармакокинетические свойства, присущие идеальному базальному инсулину. Необходимы такие разновидности инсулина, которые имеют такой профиль ровного и длительного действия, который минимизирует риск гипогликемических событий и суточных изменений у пациента и к тому же увеличивает продолжительность действия, исключая таким образом необходимость в дополнительном ежедневном введении инсулина. Это позволило бы упростить лечение страдающих диабетом пациентов, особенно страдающих диабетом пациентов преклонного возраста и нуждающихся в уходе пациентов, которые не способны вводить инсулин самостоятельно, что таким образом привело бы к большой экономии средств. Такие разновидности базального инсулина могли бы дать дополнительные преимущества на начальной стадии развития диабета 2 типа. Клиницисты сообщают о том, что многие пациенты испытывают страх перед инъекцией, что удерживает их от получения инсулиновой терапии в благоприятный период времени. Как следствие, контроль уровня глюкозы в крови ослабевает, что впоследствии приводит к развитию диабета. Базальный инсулин, благодаря которому уменьшается количество инъецируемых доз инсулина, может помочь пациентам принять инсулиновую терапию.
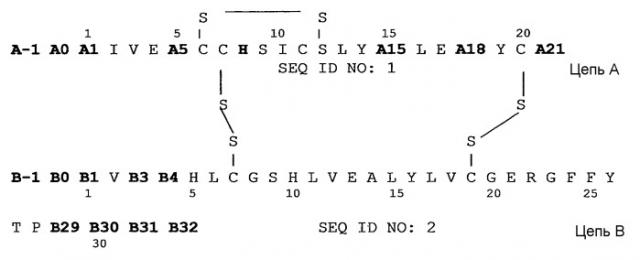
Kohn et al. (Peptides 28 (2007) 935-948) описывает возможность оптимизации фармакодинамики инсулина путем получения аналогов инсулина со сдвинутой в щелочную область изоэлектрической точкой (pI), относительно изоэлектрической точки человеческого инсулина (pI=5,6), для уменьшения его растворимости в физиологических условиях и получения пролонгированного профиля время/действия путем добавления лизина или аргинина на конце B цепи или на N-терминальном конце A и B цепей. Соединение 18 по Kohn et al. (Arg(A0),Gly(A21),Arg(B31),Arg(B32)-инсулин человека с экспериментально определенной pI=7,3; вычисленной pI=7,58) описано, как самое лучшее соединение с точки зрения идеального. Следовательно, при разработке новых аналогов инсулина Kohn et al. основную задачу видел в добавлении положительно заряженных аминокислот в аминокислотную последовательность человеческого инсулина для смещения изоэлектрической точки pI=5,6 в нейтральную область.
Однако неожиданно было обнаружено, что такие инсулиновые аналоги дают описанный требуемый профиль время/действие базального инсулина, который может быть охарактеризован следующими признаками:
• конец B цепи состоит из амидированных основных аминокислотных остатков, таких как лизин аргининамид, т.е. у амидированного основного аминокислотного остатка карбоксильная группа терминальной аминокислоты, расположенной на конце B цепи, находится в амидированной форме и
• положение A8 аминокислоты занято гистидиновым остатком и
• положение A21 аминокислоты занято глициновым остатком, аланиновым остатком, сериновым остатком или треониновым остатком, и
• не более чем один аминокислотный остаток из группы, состоящей из A5, A15, A18, B-1, B0, B1, B2, B3 и B4, соответствует Asp или Glu.
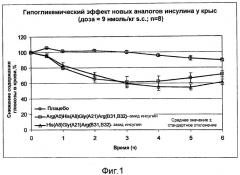
Неожиданным было то, что именно описанные инсулиновые аналоги имели близкий к идеальному требуемый благоприятный профиль время/действие, т.е. задержанное высвобождение и ровное и более длительное действие. Таким образом, значимо минимизируется риск возникновения гипогликемических событий. Задержка была столь явно выраженной, что эффект можно было наблюдать даже на экспериментальной крысиной модели. Напротив, замедленное действие инсулина Гларгина, как показано на фиг.2, не было зарегистрировано однозначно. На фиг.1 показан гипогликемический эффект соединений YKL202 и YKL203 по изобретению. Результаты, полученные в экспериментах на крысах, были подтверждены в экспериментах на собаках. Снова наблюдаемая длительность действия была значительно длиннее, чем длительность действия инсулина Гларгина. Таким образом, были предоставлены новые разновидности базального инсулина, частота приема которых существенно ниже. Помимо описанных фармакокинетических преимуществ аналоги по изобретению проявляют улучшенные фармакологические свойства по сравнению с инсулином Гларгином. Помимо этого, разновидности инсулина по изобретению имеют преимущества с точки зрения физико-химических свойств.
Неожиданно было обнаружено, что аналоги инсулина формулы I
где
A-1 соответствует Lys, Arg или аминогруппе;
A0 соответствует Lys, Arg или химической связи;
A1 соответствует Arg или Gly;
A5 соответствует Asp, Glu или Gln;
A15 соответствует Asp, Glu или Gln;
A18 соответствует Asp, Glu или Asn;
A21 соответствует Ala, Ser, Thr или Gly;
B-1 соответствует Asp, Glu или аминогруппе;
B0 соответствует Asp, Glu или химической связи;
B1 соответствует Asp, Glu, Phe или химической связи;
B3 соответствует Asp, Glu или Asn;
B4 соответствует Asp, Glu или Gln;
B29 соответствует Arg, Lys или аминокислоте, выбранной из группы, состоящей из следующих аминокислот: Phe, Ala, Thr, Ser, Val, Leu, Glu или Asp, или химической связи;
B30 соответствует Thr или химической связи;
B31 соответствует Arg, Lys или химической связи;
B32 соответствует Arg-амид или Lys-амид,
где не более чем один аминокислотный остаток группы, состоящей из: A5, A15, A18, B-1, B0, B1, B2, B3 и B4, состоящей из Asp или Glu,
имеют требуемый фармакологический профиль, т.е. замедленное высвобождение и более длительное и ровное действие. Следовательно, эти аналоги инсулина являются объектом изобретения.
Другим объектом изобретения является описанный выше аналог инсулина, у которого один аминокислотный остаток из группы, содержащей A5, A15, A18, B-1, B0, B1, B2, B3 и B4, соответствует Asp или Glu.
Другим объектом изобретения является описанный выше аналог инсулина, у которого предпочтительно A-1 соответствует Arg, A0 соответствует Arg, A5 соответствует Glu, A15 соответствует Glu, A18 соответствует Asp, A8 соответствует His, A21 соответствует Gly, B0 соответствует Glu, B3 соответствует Asp, B4 соответствует Glu, B30 соответствует Arg или B30 соответствует Lys.
Другим объектом изобретения является описанный выше аналог инсулина, который выбирают из группы, состоящей из
Arg(A-1),Arg(A0),Glu(A5),His(A8),Gly(A21),Arg(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),Glu(A5),His(A8),Gly(A21),Lys(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),Glu(A15),His(A8),Gly(A21),Arg(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),Glu(A15),His(A8),Gly(A21),Lys(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),Asp(A18),His(A8),Gly(A21),Arg(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),Asp(A18),His(A8),Gly(A21),Arg(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),His(A8),Gly(A21),Glu(B0),Arg(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),His(A8),Gly(A21),Glu(B0),Lys(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),His(A8),Gly(A21),Asp(B3),Arg(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),His(A8),Gly(A21),Asp(B3),Lys(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),His(A8),Gly(A21),Glu(B4),Arg(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),His(A8),Gly(A21),Glu(B4),Lys(B30)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Arg(B31),Arg(B32)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Arg(B31),Lys(B32)-NH2-инсулин человека,
Arg(A0),Glu(A5),His(A8),Gly(A21),Arg(B31),Arg(B32)-NH2-инсулин человека,
Arg(A0),Glu(A5),His(A8),Gly(A21),Arg(B31),Lys(B32)-NH2-инсулин человека,
Arg(A0),Asp(A18),His(A8),Gly(A21),Arg(B31),Arg(B32)-NH2-инсулин человека,
Arg(A0),Asp(A18),His(A8),Gly(A21),Arg(B31),Lys(B32)-NH2-инсулин человека,
Arg(A0),Glu(A15),His(A8),Gly(A21),Arg(B31),Arg(B32)-NH2-инсулин человека,
Arg(A0),Glu(A15),His(A8),Gly(A21),Arg(B31),Lys(B32)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Asp(B3),Arg(B31),Arg(B32)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Asp(B3),Arg(B31),Lys(B32)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Glu(B4),Arg(B31),Arg(B32)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Glu(B4),Arg(B31),Lys(B32)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Glu(B0),Arg(B31),Arg(B32)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Glu(B0),Arg(B31),Lys(B32)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Arg(B30)-NH2-инсулин человека,
Arg(A0),His(A8),Gly(A21),Lys(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),His(A8),Gly(A21),Arg(B30)-NH2-инсулин человека,
Arg(A-1),Arg(A0),His(A8),Gly(A21),Lys(B30)-NH2-инсулин человека,
Arg(A0),Arg(A1),His(A8),Gly(A21),Arg(B30)-NH2-инсулин человека,
Arg(A0),Arg(A1),His(A8),Gly(A21),Lys(B30)-NH2-инсулин человека,
His(A8),Gly(A21),Arg(B31),Arg(B32)-NH2-инсулин человека.
В настоящем описании термин “инсулин человека” при обозначении аналогов инсулина охватывает аминокислотные последовательности цепи A и цепи B человеческого инсулина, а все его варианты (добавления, замены, делеции) называются аналогом инсулина.
Объектом изобретения также является способ получения описанного выше аналога инсулина, где предшественник аналога инсулина получают рекомбинантным способом, при этом указанный предшественник подвергают ферментативной обработке для получения двухцепочечного инсулина, образуют связь с аргининамидом в присутствии фермента, обладающего трипсиновой активностью, и выделяют аналог инсулина.
Объектом изобретения также является применение описанного выше аналога инсулина для получения лекарственного средства для лечения сахарного диабета, в частности сахарного диабета типа I или типа II.
Объектом изобретения также является лекарственное средство, содержащее описанный выше аналог инсулина и/или его физиологически приемлемую соль.
Объектом изобретения также является лекарственное средство, содержащее описанный выше аналог инсулина, который используется в терапии для регенерации хряща.
Объектом изобретения также является лекарственное средство, содержащее описанный выше используемый в терапии аналог инсулина, способствующий регенерации бета-клеток.
Объектом изобретения также является композиция описанного выше аналога инсулина, где композиция находится в виде водного раствора, содержащего растворенный аналог инсулина.
Объектом изобретения также является композиция описанного выше аналога инсулина, где композиция находится в виде порошка, в частности в кристаллическом и/или аморфном виде.
Объектом изобретения также является композиция описанного выше аналога инсулина, где композиция находится в виде суспензии.
Объектом изобретения также является композиция описанного выше аналога инсулина, где композиция дополнительно содержит химический шаперон.
Объектом изобретения также является ДНК, кодирующая предшественник описанного выше аналога инсулина.
Объектом изобретения также является ДНК, кодирующая цепь A описанного выше аналога инсулина.
Объектом изобретения также является ДНК, кодирующая цепь В описанного выше аналога инсулина.
Объектом изобретения также является вектор, содержащий описанную выше ДНК.
Объектом изобретения также является организм хозяина, содержащий описанную выше ДНК или описанный выше вектор.
Объектом изобретения также является аналог препроинсулина, в котором C-пептид несет аминокислотный остаток аргинина на N-терминальном конце, а для его C-терминального конца характерен следующий вид: Arg Arg, Arg Lys или Lys Arg Arg.
Объектом изобретения также является описанная выше композиция, которая дополнительно содержит глюкагон-подобный пептид-1 (GLP1) или его аналог, или производное, или эксендин-3, или эксендин-4, или его аналог или производное, предпочтительно эксендин-4.
Объектом изобретения также является описанная выше композиция, в которой аналог эксендина-4 выбирают из группы, содержащей
H-desPro36-эксендин-4-Lys6-NH2,
H-des(Pro36,37)-эксендин-4-Lys4-NH2 и
H-des(Pro36,37)-эксендин-4-Lys5-NH2,
или их фармакологически приемлемые соли.
Объектом изобретения также является описанная выше композиция, в которой аналог эксендина-4 выбирают из группы, содержащей
desPro36[Asp28]эксендин-4(1-39),
desPro36[IsoAsp28]эксендин-4(1-39),
desPro36[Met(O)14,Asp28]эксендин-4(1-39),
desPro36[Met(O)14,IsoAsp28]эксендин-4(1-39),
desPro36[Trp(O2)25,Asp28]эксендин-2(1-39),
desPro36[Trp(O2)25,IsoAsp28]эксендин-2(1-39),
desPro36[Met(O)14Trp(O2)25,Asp28]эксендин-4(1-39) и
desPro36[Met(O)14Trp(O2)25,IsoAsp28]эксендин-4(1-39),
или их фармакологически приемлемые соли.
Объектом изобретения также является описанная выше композиция, в которой пептид-Lys6-NH2 прикреплен к C-терминальному концу аналога эксендина-4.
Объектом изобретения также является описанная выше композиция, в которой аналог эксендина-4 выбирают из группы, содержащей
H-(Lys)6-desPro36[Asp28]эксендин-4(1-39)-Lys6-NH2
desAsp28Pro36,Pro37,Pro38эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Trp(O2)25,Asp28]эксендин-4(1-39)-Lys6-NH2,
H-desAsp28Pro36,Pro37,Pro38[Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Met(O)14,Asp28]эксендин-4(1-39)-Lys6-NH2,
desMet(O)14Asp28Pro36,Pro37,Pro38эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-Lys6-NH2,
H-Asn-(Glu)5desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-Lys6-NH2,
desAsp28Pro36,Pro37,Pro38[Met(O)14,Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
или их фармакологически приемлемые соли.
Объектом изобретения также является описанная выше композиция, которая дополнительно содержит Arg34,Lys26(Nε(γ-глутамил(Nα-гексадеканоил)))GLP-1(7-37)[лираглутид] или его фармакологически приемлемую соль.
Специалисту в данной области техники ясно, что разновидности инсулина по изобретению могут быть компонентом фармацевтической композиции, которая после введения дает благоприятный эффект. Как правило, они представляют собой водные растворы, в которые добавляют другие соответствующие компоненты. Риск заражения вирусами животных минимизирован благодаря тому, что препарат не содержит никаких компонентов, полученных из животных источников. Другим преимуществом является предотвращение микробного загрязнения благодаря добавлению консервантов. Могут быть добавлены изотонические агенты для компенсации возможного негативного эффекта на физиологию клеток ткани в месте введения композиции. Кроме того, протамин может оказывать стабилизирующий эффект, и благодаря добавлению протамина в композицию может быть получен препарат инсулина, по существу не содержащий соли. Добавление фенольного компонента может стабилизировать структуру используемого аналога инсулина и таким образом, помимо прочего, дать эффект замедленного действия. В композицию также можно добавлять вещества, которые стабилизируют пространственную структуру разновидностей медленного инсулина по изобретению и дают улучшенную термостабильность. Такие химические шапероны могут представлять собой, например, короткие синтетические пептиды, которые также могут содержать аминокислотные аналоги или включать, например, последовательности пептидов, полученные из C-пептида инсулина.
Разновидности инсулина по изобретению могут быть включены в наночастицы для разработки форм замедленного всасывания. Возможными также являются так называемые лекарственные формы с замедленным высвобождением, в которых медленный инсулин по изобретению является обратимо связанным с полимерным носителем.
Разновидности инсулина по изобретению могут вводиться параллельно с быстродействующим инсулином, таким как Apidra®, NovoRapid®, Humalog®, или находящимися в разработке производными инсулина или композициями с соответствующим профилем время/действие или ингаляционной формой инсулина или назально или перорально вводимыми разновидностями инсулина, которые находятся в разработке. Специалистам в данной области очевидно, что для этой цели можно использовать соответствующим образом составленные смеси быстродействующего и медленного инсулина по изобретению. Аналоги инсулина по изобретению также можно использовать в фармацевтических препаратах, которые содержат один из описанных пептидов, таких как GLP-1 (глюкагон-подобный пептид-1) или эксендин-4 или эксендин-3 с аналогичной активностью. Примерами таких пептидов являются GLP-1 (7-37), эксенатид (Byetta®) или пептиды, получение которых описано в заявках на патент WO 2006/058620, WO 2001/04156, WO 2004/005342 и WO 98/08871. В частности, предпочтительными являются композиции, которые содержат эти пептиды в форме замедленного всасывания. Преимущественной, в частности на ранней стадии диабета типа II, является терапия, при которой предусмотрено параллельное введение фармацевтических веществ, усиливающих действие инсулина, например, таких как метформин. Также возможна комбинированная терапия с ингибиторами дипептидил пептидазы-4, которые увеличивают уровень инкретина, в комбинации с сульфонилмочевиной, стимулирующей секрецию инсулина в поджелудочной железе. Особенно предпочтительным является применение разновидностей медленного инсулина по изобретению, при котором в результате введения различных факторов запускается регенерация бета-клеток из соответствующих стволовых клеток. Все эти применения приведены в качестве примеров терапии диабета и являются объектом изобретения. Таким образом, изобретение также относится к использованию разновидностей инсулина по изобретению в комбинации с другими активными ингредиентами для лечения диабета, в частности диабета типа I или диабета типа II.
Объектом изобретения также является использование разновидностей инсулина по изобретению в процессах регенерации, которые имеют отношение к скелету, например, регенерации хряща. При таком использовании очень важно для получения положительных результатов контролировать митогенный потенциал разновидностей инсулина, не вызывая при этом сильного метаболического ответа.
Другим объектом изобретения является лекарственное средство, содержащее аналог инсулина по изобретению, которое представляет собой, в частности, композицию в виде водного раствора или порошка.
Лекарственное средство представляет собой фармацевтическую композицию, которая предпочтительно является раствором или суспензией для инъекции; при этом лекарственное средство отличается содержанием по меньшей мере аналога инсулина по изобретению и/или по меньшей мере одной из его физиологически приемлемых солей, находящихся в растворенном, аморфном и/или кристаллическом виде, предпочтительно в растворенном виде.
Препарат предпочтительно имеет рН, находящийся в пределах от примерно 2,5 до 8,5, преимущественно от примерно 4,0 до 8,5, содержит подходящий изотонический агент, подходящий консервант и, при необходимости, подходящий буфер, и предпочтительно также определенную концентрацию ионов цинка, в стерильном водном растворе. Совокупность компонентов препарата, помимо активного агента, образует носитель препарата. Подходящим изотоническим агентом являются, например, глицерин, глюкоза, маннит, NaCl, соединения кальция или магния, такие как CaCl2 и т.п. Путем выбора изотонического агента и/или консерванта можно влиять на растворимость разновидностей инсулина по изобретению или их физиологически приемлемых солей при значениях pH, соответствующих слабокислой среде.
Примерами подходящих консервантов являются фенол, м-крезол, бензиловый спирт и/или сложные эфиры п-гидроксибензойной кислоты.
Буферные вещества, которые могут быть использованы в частности для доведения значения pH до примерно 4,0-8,5, представляют собой, например, ацетат натрия, цитрат натрия, фосфат натрия и т.д. С другой стороны, для доведения значения рН подходящими также являются физиологически приемлемые кислоты-разбавители (обычно HCl) или щелочи (обычно NaOH).
Если препарат содержит цинк, предпочтительным является содержание цинка от 1 мкг/мл до 2 мг/мл, более предпочтительно от 1 мкг/мл до 200 мкг цинка/мл. Добавление цинка может неожиданным образом повлиять на профиль действия аналогов инсулина по изобретению. Это дает возможность получать препараты, которые отличаются по общей продолжительности действия, скорости воздействия и профиля кривой влияния, что таким образом позволяет подбирать препарат индивидуально для каждого пациента.
С целью изменения профиля активного агента препарата по изобретению также можно добавлять немодифицированный инсулин, предпочтительно бычий, свиной или человеческий инсулин, в частности человеческий инсулин или аналоги инсулина и его производные. Также можно добавлять один или несколько производных эксендина-4 или пептидов, которые характеризуются активностью, сравнимой с GLP-1 (глюкагонподобным пептидом-1). Такие фармацевтические вещества (препараты) также являются объектами изобретения.
Предпочтительная концентрация активного агента находится в пределах 1-1500, более предпочтительно в пределах примерно 5-1000 и, в частности, в пределах примерно 40-400 МЕ/мл.
Аналоги инсулина по изобретению сначала получают биотехнологическим способом в виде предшественника, который пока еще не содержит амид. Специалистам в данной области известны многие возможные способы получения инсулина. При этом в качестве систем клеток-хозяев используются бактерии, дрожжи и высшие растения и/или культивированные клетки растений для ферментации. В случае если позволяет стоимость системы экспрессии, то в качестве системы-хозяина также можно использовать животные клетки. Однако одним из условий в этом случае является отсутствие у животного вирусов. Таким образом, очевидно, что системы экспрессии, описанные в качестве примеров, представляют только небольшой сегмент систем хозяев/векторов, разработанных для получения белков рекомбинантным способом. Например, в данной заявке не описаны биотехнологические методы, использующие дрожжевые или растительные системы, такие как мхи, водоросли или высшие растения, например табак, горох, сафлор, ячмень, кукуруза или рапс. Тем не менее, изобретение может включать системы хозяев/векторов и кодирующие последовательности ДНК, которые дают возможность получить целевые пептиды в подходящих биотехнологических системах экспрессии. Таким образом, организмы хозяина могут быть выбраны в частности из царства растений из организмов первого отдела Schizophyta (дробянки), содержащего Schizomycetes, бактерии или сине-зеленые водоросли, организмов второго отдела Phycophyta (настоящие водоросли) класса V Chlorophyceae (зеленые водоросли), организмов второго отдела Phycophyta класса VII Rhodophyceae (красные водоросли), организмов третьего отдела Mycophyta (грибы), организмов пятого отдела Bryophyta (моховидные) и организмов седьмого отдела Spermatophyta (семенные растения).
В европейской заявке на патент EP-A 1222207 описана плазмида pINT358d, кодирующая препроинсулин, который включает модифицированный C-пептид. Сегодня с помощью полимеразной цепной реакции (ПЦР) можно селективно модифицировать кодирующую проинсулин последовательность для получения возможности выполнить экспрессию разновидностей препроинсулина, которые могут служить в качестве предшественников разновидностей инсулина по настоящему изобретению. При этом отсутствует необходимость во внутриклеточном продуцировании соответствующих слитых белков. Специалистам в данной области очевидно, что такие белки также могут быть получены с помощью бактериальной экспрессии с последующей секрецией в периплазму и/или в супернатанте культуры, что описано в одном из примеров в европейской заявке на патент EP-A 1364029. Объектом настоящего изобретения также являются предшественники проинсулина, которые дают аналоги инсулина по изобретению.
Полученный таким способом проинсулин в принципе может быть преобразован в предшественник аналога инсулина, который содержит лизин или аргинин в положении A0 и несет лизин или аргинин на С-терминальном конце цепи B. В качестве альтернативы, возможно добавление положительно заряженной аминокислоты полусинтетическим методом на N-терминальном конце цепи A, если еще не присутствует лизин или аргинин.
Если разновидности проинсулина по изобретению после внутриклеточной экспрессии в бактериях находятся в виде телец включения или в растворенном виде, эти предшественники должны приобрести in vitro нормальную конформацию до возможного процессинга и биохимической модификации. К тому же описанный слитый белок способен к правильной сборке после денатурации с использованием мочевины или гуанидин гидрохлорида, и сборка промежуточных соединений также является объектом изобретения.
Для увеличения концентрации отдельных промежуточных соединений используются биохимические способы, в частности используются способы разделения, основные принципы которых опубликованы и даже изложены в учебных пособиях. Специалистам в данной области очевидно, что такие принципы могут быть последовательно объединены и таким образом могут привести к способам, последовательность этапов которых ранее не была опубликована. Таким образом, объектом настоящего изобретения также являются способы, которые приводят к очистке аналогов по изобретению.
Объектом изобретения также является способ получения аналогов инсулина по изобретению, в котором предшественник аналога инсулина получают рекомбинантным способом и ферментативно преобразуют в двухцепочечный предшественник инсулина, который в качестве аминокислоты 1 на N-терминальном конце цепи A имеет лизин или аргинин, а на C-терминальном конце цепи B несет лизиновый или аргининовый остаток, который с помощью аргининамида или лизинамида в присутствии фермента с трипсиновой активностью превращается в амид и таким образом в медленно действующий инсулин по изобретению, высокая степень очистки которого достигается с помощью биохимических способов очистки.
Белки, которые отличаются от соответствующего, иными словами, идентичного встречающегося в природе белка замещением по меньшей мере одного из встречающихся в природе аминокислотных остатков другими аминокислотными остатками и/или добавлением и/или делецией по меньшей мере одного аминокислотного остатка называются “аналогами” этого белка. Также возможно добавление и/или замещение аминокислотных остатков другими не встречающимися в природе аминокислотными остатками.
Белки, полученные с помощью химической модификации конкретных аминокислотных остатков исходных белков, называются “производными” этих белков. Химическая модификация может заключаться, например, в добавлении одной или нескольких химических групп в одну или несколько аминокислот.
Краткое описание чертежей
Фиг.1: гипогликемический эффект аналогов инсулина по изобретению у крыс.
Фиг.2: гипогликемический эффект инсулина Гларгина у крыс.
Нижеприведенные примеры предназначены для иллюстрации сути изобретения, а не для его ограничения.
Пример 1: Получение производного вектора pINT3580, который кодирует Gly(A21)-инсулин и модифицированный C-пептид, несущий Arg Arg на C-конце цепи A.
В европейской заявке на патент EP-A 1222207 описаны плазмиды pINT358d, pINT91d и последовательность праймера Tir. ДНК этих продуктов используется для разработки плазмиды pINT3580. Кроме того, плазмида pINT358d характеризуется генной последовательностью, которая кодирует модифицированный C-пептид, имеющий характерные свойства. Были синтезированы три последовательности праймеров:
pint3580_glya21rev
5'-CAAAGGTCGACTATTA GCC GCAGTAGTTCTCCAGCTGG-3' (SEQ ID NO:3)
Этот праймер используется для введения глицина (выделено подчеркнутым жирным шрифтом) вместо аспарагина в положении 21 цепи A последовательности проинсулина, кодируемой pINT358d.
arg_cjuncf
5'-GTCCCTGCAGCGTCGCGGCATCGTGGAGCAG-3' (SEQ ID NO:4)
Этот праймер, аналогично праймеру arg_cjunc_rev, служит для введения аргинина вместо лизина в конце A/B цепей инсулина.
arg_cjunc_rev
5'-CCACGATGCC GCGACGCTGC AGGGACCCCT CCAGCG-3' (SEQ ID NO: 5)
Кодон вводимого обоими праймерами аргинина выделен жирным шрифтом.
ПЦР выполняли согласно европейской заявке на патент EP-A 1222207 с каждой парой праймеров Tir/arg_cjunc_rev и arg_cjuncf/pint3580_glya21rev и в качестве матрицы использовали ДНК плазмиды pINT358d. Аликвоты продуктов двух реакций объединяли и использовали вместе с парой праймеров Tir/pint3580_glya21rev в третьей ПЦР. После фракционирования реакционной смеси очищали продукт этой реакции гель-электрофорезом и переваривали рестрикционными ферментами Sal1/Nco1 согласно инструкции производителя в одной и той же реакции, реакционную смесь фракционировали гель-электрофорезом, и выделяли фрагмент ДНК, кодирующий последовательность проинсулина. Затем, используя реакцию ДНК-лигаза, этот фрагмент вставляли в Nco1/Sal1-разомкнутую ДНК вектора pINT91d.
Для трансформации компетентных клеток бактерии E. coli использовали смесь для легирования. Смесь для трансформации наносили на селекционные планшеты, которые содержали 25 мг/л ампициллина. Из колоний выделяли плазмидную ДНК и определяли ее с помощью анализа последовательности ДНК. Целевую плазмиду обозначили pINT3580.
Пример 2: Конструкция плазмиды pINT3581, кодирующая His(A8),Gly(A21)-препроинсулин
Конструкцию получали способом, описанным в примере 1, с помощью трех полимеразных цепных реакций. После расщепления ферментами Nco1/Sal1 продукт третьей реакции вставляли в Nco1/Sal1-разомкнутую ДНК вектора pINT91d. Использовали праймеры Tir и pint3580_glya21rev. Синтезировали дополнительно два других праймера:
pint3580_Ha8f
5'-AGCAGTGCTGCCACAGCATCTGCTCCCTCTAC-3' (SEQ ID NO:6)
pint3580_Ha8rev
5'-GAG CAGATGCT GTG GCAGCACTG CTCCACGATG-3' (SEQ ID NO:7)
Кодон, кодирующий гистидин в положении 8 цепи A в каждом из праймеров, выделен жирным шрифтом. Конструкцию получали способом, описанным в примере 1. В ПЦР 1 и 2 в качестве матрицы служила ДНК плазмиды pINT3580. ПЦР 1 выполняли с парой праймеров Tir/pint3580_Ha8rev, а ПЦР 2 выполняли с парой праймеров pint3580_Ha8f/pint3580_glya21rev. ПЦР 3 выполняли с парой праймеров Tir/pint3580_glya21rev. В этом случае в качестве матрицы использовали смесь продуктов реакций ПЦР1 и ПЦР2. Целевую плазмиду обозначили pINT3581.
Препроинсулин, кодируемый этой плазмидой, является предшественником соединения YKL202, которое характеризуется как Arg(A0),His(A8),Gly(A21),Arg(B31),Arg(B32)-NH2-инсулин человека и которое получается после амидирования аргининамидом.
Препроинсулин, кодируемый этой плазмидой, является предшественником соединения YKL202b, которое характеризуется как Arg(A0),His(A8),Gly(A21),Arg(B31),Lys(B32)-NH2-инсулин человека и которое получается после амидирования лизинамидом.
Пример 3: Конструкция плазмиды pINT3582, кодирующая His(A8),Glu(A5),Gly(A21)-препроинсулин
Конструкцию получали тремя полимеразными цепными реакциями, как описано в примерах 1 и 2. Продукт третьей реакции после расщепления с помощью Nco1/Sal1 вставляли в Nco1/Sal1-разомкнутую ДНК вектора pINT91d. Использовали праймеры Tir и pint3580_glya21rev. Синтезировали два дополнительных праймера.
pint3581_Ea5f
5'-GCATCGTGGAGGAGTGCTGCCACAGCATCTG-3' (SEQ ID NO:8)
pint3581_Ea5rev
5'-CTGT GGCAGCACTC CTCCACGATG CCGCGACG-3' (SEQ ID NO:9)
Кодон, кодирующий глутаминовую кислоту в положении 5 цепи A, выделен жирным шрифтом. Конструкт получали способом, описанным в примере 1. В качестве матрицы служила ДНК плазмиды pINT3581. Целевую плазмиду обозначили pINT3582.
Препроинсулин, кодируемый этой плазмидой, является предшественником соединения YKL202-1, которое характеризуется как Arg(A0),Glu(A5),His(A8),Gly(A21),Arg(B31),Arg(B32)-NH2-инсулин человека и которое получается в результате амидирования аргининамидом.
Препроинсулин, кодируемый этой плазмидой, является предшественником соединения YKL202-1b, которое характеризуется как Arg(A0),Glu(A5),His(A8),Gly(A21),Arg(B31),Lys(B32)-NH2-инсулин человека и которое получается в результате амидирования лизинамидом.
Пример 4: Конструкция плазмиды pINT3583, кодирующей His(A8),Asp(A18),Gly(A21)-препроинсулин
Конструкция отличается от примера 1 тем, что проводили только одну полимеразную цепную реакцию. Продукт этой реакции после расщепления с помощью Nco1/Sal1 вставляли в Nco1/Sal1- разомкнутую ДНК вектора pINT91d. Использовали праймер Tir. Синтезировали один дополнительный праймер:
pint3580_Da18rev
5'-CAAAGGTCGACTATTAGCCGCAGTAGTCCTCCAGCTGGTAGAGGGAG-3' (SEQ ID NO:10)
Кодон, кодирующий аспарагиновую кислоту в положении 18 цепи A, выделен жирным шрифтом. В качестве матрицы служила ДНК плазмиды pINT3581. Целевую плазмиду обозначили pINT3583.
Препроинсулин, кодируемый этой плазмидой, является предшественником соед