Способ детекции стволовых раковых клеток
Иллюстрации
Показать всеИзобретение относится к молекулярной биологии, генной инженерии, медицине и онкологии. Предложен способ детекции стволовых раковых клеток, основанный на инкубации образцов клеток с флуоресциентными красителями и последующей идентификации раковых клеток в ультрафиолетовом свете, где при инкубации образцов клеток, которая проводится с флуоресцентным красителем, ковалентно инкорпорированным во фрагменты двуцепочечной ДНК, обеспечивается интернализация экстраклеточных экзогенных фрагментов двуцепочечной ДНК во внутриклеточное пространство стволовых клеток, входящих в состав образцов клеток, путем проведения инкубации образцов клеток в растворе препарата фрагментированной двуцепочечной ДНК в соотношении 0.5-1 мкг ДНК на 1000000 клеток, находящихся в суспензии или на срезе ткани в течение 60-120 минут, а идентификацию раковых клеток в качестве стволовых осуществляют в ультрафиолетовом свете с длиной волны, соответствующей максимуму поглощения введенного в молекулы фрагментов двуцепочечной ДНК флуорохрома, причем, в качестве фрагментов двуцепочечной ДНК используют фрагменты ДНК Alu повтора человека, энзиматически меченые предшественником, содержащим ковалентно пришитый флуорохромный краситель, или меченые прямым химическим введением флуорохрома. Благодаря увеличению эффективности выявления раковых стволовых клеток в инициирующем состоянии изобретение может быть использовано в медицине. 1 з.п. ф-лы, 11 ил.
Реферат
Изобретение относится к медицине, в частности к онкологии и молекулярной биологии, и может быть использовано для детекции (обнаружения) популяции раковых клеток, обладающих инициирующими свойствами (стволовые - туморогенные раковые клетки).
Представление о существовании стволовой (инициирующей) раковой клетки ставит основной вопрос, связанный с возможностью терапевтического изменения статуса раковой клетки или ее прямой элиминации. Первым и необходимым условием целевого воздействия на стволовую (инициирующую) раковую клетку является ее индивидуализация в массе опухолевых клеток. Существует несколько подходов и методов идентификации стволовых (инициирующих) раковых клеток.
Наиболее общепринятым способом считается метод лимитирующих разведений (LDA) [1, 2]. Используя многочисленные разведения, клеточную культуру титруют до разведения, когда при пересадке трансплантата развития опухоли не происходит. Тестирование большого числа разведений в многочисленных повторах и статистическая обработка результатов позволяют выбрать образец, содержащий одну клетку с необходимым признаком. Указанный способ трудоемкий, занимает много времени и имеет ограниченность применения, поскольку не все опухоли могут быть диссоциированы до индивидуальной клетки.
Также известен способ, называемый методом формирования сфер [3, 4]. Метод формирования сфер является классическим способом определения плюрипотентной стволовой клетки, которая в полужидкой среде формирует вокруг себя сферу из клеток-потомков. Для оценки туморогенных (инициирующих) свойств полученных сфер используется их последующая трансплантация и цитологическая и биохимическая характеристика опухолевого графта. Указанный способ также трудоемкий, занимает много времени и имеет ограниченность применения, поскольку также не может быть применен к опухолям, которые не могут быть диссоциированы до индивидуальной клетки.
Другой способ, широко использующийся в экспериментальной онкологической практике, основан на применении биохимических маркеров стволовых (инициирующих) раковых клеток. Наиболее широко распространенными являются CD133 (проминин-1), CD44 (рецептор для гиолуронана), CD166, CD34, CD38 (маркеры острого миелогенного лейкоза), CD138 (маркер для терминально дифференцированных В лимфоцитов), CD24 (маркер фактора эпителиальной клеточной адгезии ЕрСАМ или ESA), В5 (АВСВ5 АТР связывающий белок) [5]. К сожалению, до настоящего времени не обнаружены универсальные опухолевые маркеры. В этом проявляется недостаточная эффективность использования биохимических маркеров для идентификации инициирующих (стволовых) раковых клеток.
Еще одним способом выявления стволовых (инициирующих) раковых клеток является подход, реализованный на примере двух типов клеток MDA-MB-436 и MCF-7, позволяющий сортировать раковые клетки по их способности к деформации. Известно, что раковая клетка, обладающая инициирующими характеристиками, способна к миграции и имеет многочисленные нарушения в системах формирования актинового цитоскелета. Подверженные деформации раковые клетки обладают повышенной метастазирующей способностью и способностью формировать мамосферы. Используя метод проточной селекции по деформационной способности раковых клеток, была получена популяция клеток, обладающая характеристиками стволовой (инициирующей) раковой клетки [6]. Указанный способ определения стволовых (инициирующих) раковых клеток технически сложен, трудно адаптируется к клеткам других опухолей, имеющих различный физический размер и плоидность, и имеет ограниченность применения, поскольку также не может быть применен к опухолям, которые не могут быть диссоциированы до индивидуальной клетки.
Близким к предложенному является способ, при котором для выявления стволовых (инициирующих) раковых клеток используется их способность выбрасывать из цитоплазмы определенные липофильные флуоресцентные красители, такие, как Хехст (Hoechst) 33342 или родамин-123. Эта особенность позволяет не только идентифицировать стволовые клетки при проточной цитофлуориметрии, но и собирать их для различных исследований как фракцию неокрашенных или слабоокрашенных клеток с помощью сортировки клеток. Однако близкий способ также имеет ограниченность применения, поскольку при такого рода детекции теряется возможность таргетного воздействия на стволовую (инициирующую) раковую клетку, поскольку способ основан на использовании, во-первых, одиночных липофильных молекул и, во-вторых, связан с их исключением из состава клетки. Обе характеристики предполагают отсутствие принципиальной возможности использования этих красителей в качестве курьерных агентов, доставляющих в раковую клетку активные химические молекулы, способные разрушить стволовую (инициирующую) раковую клетку.
Указанные характеристики свидетельствуют о том, что на настоящий момент времени не существует универсального способа детекции всей совокупности или части популяции инициирующих (раковых) клеток или они трудоемки, занимают много времени и в этой связи неприменимы в реальных клинических условиях.
Наиболее близким но своей сущности к предложенному является способ, основанный на использовании соединения, содержащего, по крайней мере, один направляющий модуль, который способен к взаимодействию со специфическим молекулярным маркером рака, выбранным из группы, состоящей из DD3 и теломеразной обратной транскриптазы (TERT), и, по меньшей мере, один детектируемый компонент, выбранный из группы, состоящей из флуоресцеина или других родственных производных [RU 2450832, A61K 49/14, A61K 49/18, 20.05.2012].
Недостатком способа является относительно узкая область применения, поскольку способ не позволяет выявить раковые клетки с инициирующими свойствами (стволовые - туморогенные раковые клетки).
Целью настоящего изобретение является расширение области применения.
Требуемый технический результат заключается в расширении области применения путем введения технических средств, позволяющих осуществить детекцию стволовых раковых клеток.
Поставленная цель реализуется, а требуемый технический результат достигается тем, что в способе детекции стволовых раковых клеток, основанном на инкубациии образцов клеток с флюоресциентными липофильными красителями и последующей идентификации раковых клеток в ультрафиолетовом свете, при инкубации образцов клеток, которая проводится с флуоресцентным красителем, ковалентно инкорпорированным во фрагменты двуцепочечной ДНК, обеспечивается интернализация экстраклеточных экзогенных фрагментов двуцепочечной ДНК во внутриклеточное пространство стволовых клеток, входящих в состав образцов клеток, путем проведения инкубации образцов клеток в растворе препарата фрагментированной двуцепочечной ДНК в соотношении 0.5-1 мкг ДНК на 1000000 клеток, находящихся в суспензии или на срезе ткани в течение 60-120 минут, а идентификацию раковых клеток в качестве стволовых осуществляют в ультрафиолетовом свете с длиной волны, соответствующей максимуму поглощения введенного в молекулы фрагментов двуцепочечной ДНК флуорохрома (в частности, TAMRA), причем, в качестве фрагментов двуцепочечной ДНК используют фрагменты, энзиматически меченые предшественником, содержащим ковалентно пришитый флуорохромный краситель, или меченые прямым химическим введением флуорохрома.
Кроме того, требуемый технический результат достигается тем, что в качестве флуорохромного красителя используют флуорохромный краситель, который может быть ковалентно объединен с предшественником полимерной формы ДНК в местах, не мешающих процессу инкорпорации трифосфата в нуклеотидную цепь, или введен химимческим путем непосредственно в молекулу фрагмента двуцепочечной ДНК.
Предложенный способ основан на естественной способности стволовых (инициирующих) раковых клеток интернализовать экзогенные экстраклеточные не объединенные в компартменты фрагменты двуцепочечной ДНК и на совместной инкубации индивидуальных клеток опухоли или сегмента ткани опухоли или культуры опухолевых или асцитных клеток с мечеными флуорохромным красителем фрагментами двуцепочечной ДНК.
Предложенный способ характеризуется возможностью использования фрагментов двуцепочечной ДНК в качестве курьера, доставляющего биологически или химически активные молекулярные группы, ковалентно присоединенные к этим фрагментам и вступающие во взаимодействие с компонентами раковой инициирующей клетки, приводящие к ее апоптотической, некротической или иной гибели.
В современной литературе отсутствуют указания на предлагаемый способ обнаружения, идентификации, сортинга и разрушения или необратимой обратной трансформации популяции раковых клеток, обладающих инициирующими свойствами (стволовые-туморогенные раковые клетки), в популяции свободно существующих раковых клеток и в клетках опухолей, растущих в массе ткани.
Следовательно, предложение отвечает критериям новизны и изобретательского уровня.
Ниже приводятся теоретические и экспериментальные данные, подтверждающие, что изобретение отвечает критерию практической (промышленной) применимости.
На чертеже представлены:
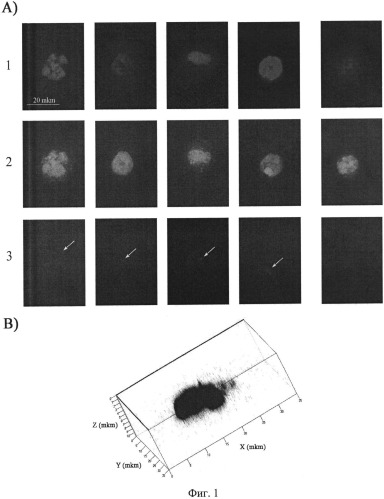
на фиг.1 - Цитологический анализ содержания TAMRA меченой ДНК Alu повтора человека в CD34+ клетках костного мозга после совместного инкубирования ex vivo. А) Двумерное изображение CD34+ клеток, полученное при помощи микроскопа Axioskop 2 plus (Zeiss) и программы Axio VisionLE. 1 - DAPI, окраска на хроматин, 2 - FITC, специфический маркер CD34+ клеток, 3 - TAMRA, сигнал экзогенных фрагментов двуцепочечной ДНК. Стрелками указаны сигналы TAMRA, свидетельствующие о присутствии экзогенной ДНК в CD34+ клетках. Приведенный масштаб является одинаковым для всех блоков. В) Объемное изображение ядра CD34+ клетки, полученное при помощи конфокального микроскопа LSM 510 МЕТА (Zeiss). DAPI (синий цвет) - окраска на хроматин, показывает границы ядра; TAMRA (красный цвет) - специфичная окраска фрагментов экзогенной ДНК. Как видно из рисунка, сигнал TAMRA локализуется внутри ядра.
на фиг.2 - Цитологический анализ содержания TAMRA-меченой ДНК во фракции клеток костного мозга, не содержащей CD34+ клеток (CD34- клетки костного мозга). А) Двумерное изображение CD34- клеток, полученное при помощи микроскопа Axioskop 2 plus и программы Axio VisionLE; 1 - сигнал TAMRA, свидетельствующий о присутствии в ядерном пространстве клеток костного мозга фрагментов экзогенной ДНК, 2 - сигнал DAPI, окраска на хроматин. В) Изображение ортогональных проекций ядер CD34- клеток костного мозга (X - область справа, Y - область сверху, Z - центральное изображение), полученное при помощи конфокального микроскопа LSM 510 МЕТА (Zeiss). Из рисунка видно, что сигнал TAMRA, свидетельствующий о присутствии экзогенной ДНК Alu повтора человека, располагается внутри ядерного пространства клетки.
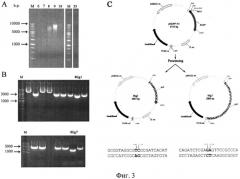
на фиг.3 - Анализ геномной ДНК, выделенной из клеток костного мозга после коинкубирования с экзогенной ДНК плазмиды pEGFP-N1. A) Фракционированная геномная ДНК, выделенная из клеток костного мозга мышей после совместного инкубирования с экзогенной ДНК плазмиды pEGFP-N1 и центрифугирования в градиенте NaCl; 6-10, 23 - номера фракций; М - маркер молекулярного веса 1 kb. В) Плазмиды, полученные в результате трансформации компетентных клеток ДНК 8 фракции, выделенной из клеток костного мозга после совместного инкубирования с ДНК плазмиды pEGFP-N1 и последующего лигирования саму на себя; плазмиды 8lig1 и 8lig7 - меньше по размеру, чем исходная форма плазмиды pEGFP-N1. С) Анализ нуклеотидной последовательности укороченных плазмид 8lig1 и 8lig7. Карта исходной плазмиды pEGFP-N1, а также двух плазмид, выделенных из геномной ДНК клеток костного мозга, после совместного инкубирования клеток с исходной формой указанной плазмиды, линеаризованной по сайту рестрикции HindIII.
на фиг.4 - Цитологический анализ содержания TAMRA-меченой ДНК в асцитных клетках опухоли Кребс-2. А) Двумерное изображение асцитных клеток, полученное при помощи микроскопа Axioskop 2 plus и программы Axio VisionLE; 1 - сигнал TAMRA, свидетельствующий о присутствии в ядерном пространстве асцитных клеток фрагментов экзогенной ДНК, 2 - контрольные клетки. Правые блоки - сигнал DAPI, окраска на хроматин. В) Изображение ортогональных проекций ядер асцитных клеток (X - область справа, Y - область сверху, Z - центральное изображение), полученное при помощи конфокального микроскопа LSM 510 МЕТА (Zeiss). Из рисунка видно, что сигнал TAMRA, свидетельствующий о присутствии экзогенной ДНК Alu повтора человека, располагается внутри ядерного пространства клетки.
на фиг.5 - Интернализация фрагментов экзогенной, экстраклеточной двуцепочечной ДНК в клетки опухоли Кребс-2, растущей в форме асцита. А) Радиоавтографы, демонстрирующие интернализацию αР32 ПЦР меченого GFP гена в асцитные клетки Кребс-2. Два левых блока - маркеры молекулярных весов: gGFP - ПЦР меченый ген GFP (1) и HindIII гидролизат ДНК фага λ (2). (3) - (5): левые блоки - электрофореграмма, правые блоки - радиоавтография этих же блоков после высушивания и экспонирования на фосфоиммеджере. Для электрофореза использовалась ДНК, выделенная из асцитных клеток, взятых из асцитной жидкости мышей через 18 часов после обработки цитостатиком циклофосфаном (3), выделенная из асцитных клеток, взятых из асцитной жидкости мышей без обработки цитостатиком циклофосфаном (4) и выделенная из клеток костного мозга мышей без обработки цитостатиком циклофосфаном (5). Клетки инкубировались различное время (указано вверху блоков) с αР32 ПЦР меченым геном GFP. Везде видно очевидное присутствие меченого фрагмента ДНК в исходной форме. Сила сигнала в раковых клетках намного интенсивнее, чем в клетках костного мозга. В) Блоты, демонстрирующие интернализацию линеаризованной по HindIII плазмиды pGFP в асцитные клетки опухоли Кребс-2. 1) маркер молекулярных весов HindIII гидролизат ДНК фага λ. (2)-(4): левые блоки - электрофореграмма, правые блоки - радиоавтография блотов после гибридизации фракционированной ДНК асцитных клеток (2, 3) и клеток костного мозга (4) с αР32 меченой по HindIII концу ДНК плазмиды pGFP после ее рестрикции по указанной рестриктазе. Для электрофореза использовалась ДНК, выделенная из асцитных клеток, полученных из асцитной жидкости мышей через 18 часов после инъекции цитостатика циклофосфана (2), выделенная из асцитных клеток, полученных из асцитной жидкости мышей без обработки цитостатиком (3) и выделенная из клеток костного мозга мышей (4). С) Диаграммы, демонстрирующие количество (%) экзогенной двуцепочечной ДНК, доставляемой во внутренние компартменты асцитных клеток и клеток костного мозга, из расчета на общее количество клеток в образце.
на фиг.6 - А) Плоты, демонстрирующие зависимость количества клеток, интернализующих меченый двуцепочечный ДНК зонд, от количества экстраклеточной ДНК, присутствующей в культуральной среде. В) График, отражающий эту зависимость. При логарифмическом возрастании количества ДНК происходит линейное увеличение % клеток с содержанием TAMRA.
на фиг.7 - А) Клеточный цикл клеток ацита Кребс-2. В) Плоты, демонстрирующие присутствие в асцитных клетках двух популяций клеток, содержащих TAMRA сигнал (фрагменты двуцепочечной ДНК) и несущие маркер CD34+, характерный для гемопоэтических стволовых клеток мыши. С) Цитологический анализ, демонстрирующий совместную локализацию CD34+ сигнала и сигнала TAMRA.
на фиг.8 - Приведены результаты оценки вероятности существования промежутка времени в клеточном цикле, в течение которого клетки асцита приобретают, сохраняют и теряют свойство интернализации фрагментов экстраклеточной экзогенной дцДНК. Многократно показано, что в течение первого часа от 1 до 2% клеток асцита становятся TAMRA позитивными. Если интернализация фрагментов ДНК связана с временным, переходящим состоянием клеток, то при инкубации с меченым ДНК зондом в течение нескольких часов можно было бы наблюдать линейное (или близкое к таковому) увеличение количества клеток интернализующих TAMRA-ДНК зонд, поскольку через «временные ворота» ежечасно проходило бы в развитии клеточного цикла количество клеток, равное количеству, получившему TAMRA-маркер в течение первого часа. Из результатов анализа следует, что при длительной инкубации (1-4 часа) клеток асцита с ДНК зондом количество TAMRA позитивных клеток увеличивается на приблизительно 10%-30%. Такое увеличение скорее связано с завершением интенализации маркера во все компетентные клетки, чем с проходом асцитных клеток через «компетентный» промежуток времени клеточного цикла и приобретением ими способности к интернализации. А) Результаты проточной цитометрии TAMRA обработанных клеток асцита Кребс-2. На плотах представлена динамика изменения популяции TAMRA позитивных клеток на протяжении 1-4 часа инкубации. Б) Графическое изображение результатов проточной цитометрии клеток асцита Кребс-2, обработанных на протяжении 1-4 часа TAMRA меченным фрагментом дцДНК.
на фиг.9 - Инициирующая способность двух популяций асцитных клеток опухоли Кребс-2 инициировать рост новой опухоли. А) Плоты, характеризующие распределение двух клеточных популяций и процентное соотношение клеток после сортировки содержащих сигнал TAMRA (фрагменты двуцепочечной ДНК) и не содержащих сигнал TAMRA. В) Время появления трансплантатов у мышей после перевивки двух различных популяций клеток, содержащих сигнал TAMRA (фрагменты двуцепочечной ДНК) и не содержащих сигнал TAMRA.
на фиг.10 - Инициирующая способность CD34+ популяций асцитных клеток опухоли Кребс-2 инициировать рост новой опухоли. А) Плоты, характеризующие количество CD34 позитивных клеток в популяции асцитных клеток опухоли Кребс-2. В) Время появления трансплантатов у мышей после перевивки сортированной СВ34+ популяции клеток в сравнении с перевивкой суммарной популяции клеток асцита.
На фиг.11 - Интернализация меченого TAMRA ДНК зонда в клетки солидной формы опухоли Кребс-2. На рисунке представлена серия срезов опухолевой капсулы, содержащей островок клеток, интернализующих TAMRA ДНК зонд. Стрелками отмечены области скопления раковых клеток, интернализующих TAMRA ДНК. Масштаб указан в барах. Слева от панелей указаны флуорохромы DAPI, TAMRA, DAPI+TAMRA.
Актуальность данного изобретения подтверждается обобщающим, наиболее полным и вместе с тем лаконичным обзором, характеризующим общие положения концепции раковых стволовых клеток, описывающим способы выявления и характеристики раковых стволовых клеток из различных опухолей и, наконец, определяющих значение раковых стволовых клеток в биомедицинских исследованиях [7]. Основные положения обзора можно суммировать в следующих тезисах.
В настоящее время существует две модели, характеризующие (описывающие) опухоль как иерархическую систему организации популяции неотрансформированных клеток. Стохастическая модель предполагает, что все клетки опухоли имеют одинаковый потенциал в индукции развития новой опухоли [8-11]. Вторая модель предполагает иерархическую организацию опухоли, где наверху иерархической лестницы находятся стволовые раковые клетки [12, 13].
Предположение о существовании стволовой или инициирующей раковой клетки было впервые выдвинуто в работах Дайка с коллегами [12, 13], где было показано, что только незначительное количество CD34-CD38- клеток, выделенных из крови больных лейкемией, имеют перевивочный потенциал. Остальные клетки оказались не в состоянии индуцировать развитие рака. В дальнейшем это предположение получило свое подтверждение в исследованиях, проведенных на опухолях различной этиологии [14-26].
Основными свойствами, характерными для стволовых раковых клеток, являются самоподдержание в ряду неограниченного числа делений, способность производить коммитированную дочернюю клетку, обладающую высоким пролиферативным потенциалом, но не способной инициировать новую опухоль, устойчивость к многократной пересадке с сохранением гистологических характеристик опухоли.
Предлагаемый способ обнаружения, идентификации, сортинга и разрушения или необратимой обратной трансформации популяции раковых клеток, обладающих инициирующими свойствами (стволовые-туморогенные раковые клетки) в популяции свободно существующих раковых клеток и в клетках опухолей, растущих в массе ткани, реализуется следующим образом.
Основываясь на обнаруженном свойстве стволовых (инициирующих) раковых клеток интернализовать экзогенные экстраклеточные фрагменты двуцепочечной ДНК, проводится совместная инкубация индивидуальных клеток опухоли, или сегмента ткани опухоли, или культуры опухолевых или асцитных клеток с мечеными флуорохромным красителем (например, TAMRA) фрагментами двуцепочечной ДНК. Стволовые инициирующие раковые клетки интернализуют фрагменты двуцепочечной ДНК, содержащие ковалентно связанный с ними краситель. Клетки, интернализовавшие меченый ДНК субстрат, могут быть идентифицированы, выделены как популяция клеток или как индивидуальная клетка любым известным способом, где в качестве маркера селекции используется флуорохром (цитологические манипуляции, проточная цитометрия, клеточный сортинг). В ткани стволовые (инициирующие) клетки могут быть обнаружены после инкубации сегмента опухоли с ДНК зондом, стандартной процедурой получения замороженных срезов ткани толщиной в 1-10 клеток и анализом на конфокальном или флуоресцентном микроскопе. Для целей воздействия на инициирующую (стволовую) раковую клетку к фрагментам двуцепочечной ДНК ковалентно присоединяется активная химическая группа или молекула, находящаяся в неактивном состоянии в результате блокировки ее активных центров блокирующими реагентами. После доставки в клеточное пространство блокирующие группы диссоциируют либо под действием метаболических процессов раковой клетки, либо в результате дополнительной обработки. Также в результате дополнительных обработок может быть произведена активация активных химических групп, ассоциированных с фрагментами двуцепочечной ДНК непосредственно в стволовой (инициирующей) раковой клетке после их интернализации.
Ниже приводятся экспериментальные доказательства обнаружения, идентификации, сортинга стволовых (инициирующих-туморогенных) раковых клеток в популяции свободно существующих раковых клеток и в клетках опухолей, растущих в массе ткани.
Используемые методики.
Приготовление TAMRA-меченой ДНК Alu повтора человека проводили при помощи ПЦР [27]. В качестве матрицы использовали клонированную в плазмиде pUC19 последовательность Alu-повтора человека, которая состоит из конечной и начальной частей двух тандемно расположенных повторов: AluJ и AluY (АС002400.1, 53494-53767). В качестве праймеров использовали стандартные М13 праймеры: М13 for: GTAAAACGACGGCCAGT; М13 rev: CAGGAAACAGCTATGAC. От не включившихся нуклеотидов избавлялись переосаждением ДНК.
Для очистки ПЦР продукта от невключившихся нуклеотидов объем реакционной смеси доводили до 100 мкл, добавляли равный объем фенол-хлороформа, и после встряхивания центрифугировали при комнатной температуре в течение 2 мин, 3000 g. Верхнюю фазу переносили в новую пробирку. Добавляли ¼ объема 10М ацетата аммония и перемешивали. Добавляли равный объем изопропанола и инкубировали в течение 10 мин при комнатной температуре. ДНК осаждали центрифугированием при комнатной температуре, 12000 g, в течение 15 мин. Осадок промывали 70% этанолом и растворяли в 200 мкл воды [27]. Концентрацию ДНК и включение dUTP-TAMRA проверяли на спектрофотометре Nanodrop (Eppendorf, США), высчитывая процент сигнала до и после переосаждения препарата.
Для анализа интернализации TAMRA-меченой экзогенной ДНК в CD34+ и в CD34- клетках клетки костного мозга вымывали из трубчатых костей интактных мышей средой RPMI-1640, осаждали при 400 g, 4°C в течение 5 мин и промывали в 1 мл среды RPMI-1640 один раз. После разрушения эритроцитов при помощи лизирующего буфера (0,15 М NH4Cl; 10 мМ Tris-HCl pH 7,5; 0,5 мМ ЭДТА) 10 млн. клеток инкубировали с 0,8-1 мкг ДНК TAMRA-меченого Alu повтора человека в 0,5 мл среды в течение 3 часов. По окончании инкубирования клетки промывали 3-4 раза средой, как описано выше. Затем клетки ресуспендировали в PBS с 0,1% NaN3, 1% FBS. К образцам добавляли антитела (FITC Rat anti-Mouse CD34, BD Pharmingen) и изотип контроль (FITC Rat IgG2a, к Isotype Control, BD Pharmingen) из расчета 3 мкг на 3 млн. клеток в 1 мл и инкубировали в течение 40 мин при 4°C. Затем клетки селектировали на CD34+ и CD34- при помощи проточного цитофотометра BD FACSAria. Границу разделения на CD34+ и CD34- устанавливали с учетом результатов измерения при окрашивании изотип контролем. После сортировки клетки осаждали при 400 g, 4°С в течение 5 мин, фиксировали метанол: уксусная кислота (3:1) в течение часа. Суспензию клеток наносили на влажное обезжиренное стекло, препарат высушивали на воздухе, добавляли каплю Antifade DABCO, содержащего 0,4 мкг/мл DAPI, и анализировали на флуоресцентном микроскопе Axioskop 2 plus с использованием программы Axio VisionLE, либо на лазерном сканирующем микроскопе LSM 510 МЕТА.
Для проведения процедуры инкубирования клеток костного мозга с pEGFP-N1 плазмидную ДНК pEGFP-N1 (200 мкг) вскрывали по находящемуся в полилинкере сайту рестрикции HindIII. Мышам внутрибрюшинно была сделана инъекция цитостатика циклофосфана в дозе 200 мг/кг. Через 18 часов после инъекции цитостатика были вымыты клетки костного мозга средой для стволовых клеток (D-MEM+Glu+NEAA+LIF+antibiotics). Клетки были дважды промыты этой же средой и ресуспендированы в 4 мл среды. Далее клетки инкубировали с 100 мкг плазмидной ДНК 4 часа в СО2-инкубаторе, при 95%-ной влажности воздуха, 37°С (Memmert, Германия).
Выделение и фракционирование ДНК проводили следующим образом. После инкубации клетки отмывали 3 раза PBS и ресуспендировали в 1 мл буфера А [28], дополненного 0.1% тритоном Х-100. Клетки инкубировали 5 мин на льду и аккуратно наслаивали на 3V 10% сахарозы. Градиент центрифугировали 20 мин при 500 g, 4°C. Осадок ядер промывали 1 раз буфером А, дополненным 0,1% Triton-X100, и центрифугировали при 1000 g, 4°C в течение 5 мин. Осадок клеток ресуспендировали в лизирующем буфере (10 мМ Tris-HCl pH 7.4; 50 мМ ЭДТА, 1% SDS, 200 мкг/мл Протеиназы К) и инкубировали 2 часа при 58°С. ДНК очищали фенолом, хлороформом, осаждали этанолом и растворяли в воде. Полученная геномная ДНК была фракционирована в градиенте NaCl, приготовленном на 50 мМ ЭДТА. Градиент готовили наслаиванием 1 мл каждой фракции: 30%, 25%, 20%, 15%, 10% (по массе), затем на градиент аккуратно наслаивали ДНК и центрифугировали 43000 rpm 2,5 часа на ультрацентрифуге. Отбирали фракции объемом 250 мкл, ДНК переосаждали и анализировали электрофорезом.
Электрокомпетентные клетки XLBlue-MRF' трансформировали различными фракциями ДНК: выделенной из клеток костного мозга после совместного инкубирования с экзогенной ДНК либо предварительно лигированной саму на себя ДНК-лигазой Т4. Всю суспензию клеток высевали на чашку Петри с LB агаром и селективным антибиотиком канамицином (25 мкг/мл). Из всех выросших колоний выделяли плазмидную ДНК методом щелочного лизиса [29] и анализировали гель-электрофорезом.
Для анализа интернализации TAMRA-меченой экзогенной ДНК в асцитной форме клеток опухоли Кребс-2 клетки опухоли отбирали из брюшной полости мышей с помощью шприца, дважды промывали PBS, после чего инкубировали с ДНК TAMRA-меченого Alu повтора человека аналогично методу, описанному для клеток костного мозга. Содержание меченого материала в клетках Кребс-2 оценивали также аналогичным образом.
Для анализа доставки меченой ДНК в клетки асцитной формы опухоли мыши Кребс-2 клетки опухоли отбирали из брюшной полости у одной мыши без обработки и у одной мыши после инъекции цитостатика циклофосфана (200 мг/кг) с помощью шприца, дважды промывали PBS, при 400 g, 4°C. Затем клетки считали в камере Горяева и инкубировали определенный интервал времени (1, 2, 4 и 8 часов) в количестве 10 млн клеток в 500 мкл среды RPMI-1640 с предварительно подготовленной ДНК - 32Р-меченый в ПНР ген GFP размером 1162 п.н., а также линейную форму pEGFP-N1, гидролизованную рестриктазой HindIII. По окончании инкубации клетки собирали, промывали два раза этой же средой, заливали в блоки легкоплавкой агарозы и, в случае добавления 32P меченой ДНК, блоки считали на счетчике 1209 Rackbeta (Wallac, Финляндия). Затем материал в блоках фракционировали электрофорезом и, в зависимости от эксперимента, либо высушивали гель и проводили засветку на Molecular Imager FX Pro+ (при добавлении меченого материала), либо переносили по Саузерну на мембрану Zeta-ProbeGenomicTestedBlottingMembrane (Bio-Rad) (при добавлении гидролизата плазмиды) и проводили гибридизацию с меченой ДНК. В качестве контроля доставки ДНК в данном эксперименте аналогичные процедуры были проделаны с клетками костного мозга мыши.
При анализе количества материала, доставленного в клетки асцитной формы опухоли Кребс-2, в программе QuantityOne оценивали процент засветки, приходящийся на размер добавленного фрагмента по отношению ко всему меченому материалу, вошедшему в гель или оставшемуся на старте. При известных силах радиактивного сигнала добавленной к клеткам меченой ДНК и блока, содержащего определенное количество этих клеток, вычисляли количество чистых фрагментов, доставленных в клетку.
Анализ количества клеток Кребс-2, содержащих меченую TAMRA-ДНК, после совместной инкубации в культуральной среде проводили при помощи проточного цитофлуориметра BD FACSAria (Becton Dickinson, США).
Для анализа распределения клеток асцитной формы опухоли мыши Кребс-2 по клеточному циклу клетки опухоли отбирали из брюшной полости мышей с помощью шприца, дважды промывали PBS при 400 g, 4°C в течение 5 мин. Далее клетки фиксировали в 60% метаноле в течение 1 часа при 4°С. Клетки осаждали, промывали PBS и обрабатывали РНКазой (200 мкг/мл) в течение 30 мин при 37°С. Затем клетки осаждали, осадок ресуспендировали в PBS с 0,1% NaN3, 1% FBS (Fetal Bovine Serum) и красили антителами против CD34+, как описано выше. Затем к суспензии клеток добавляли 20 мкл пропидиума йодида (5 мг/мл) и окрашивали клетки в течение 10 мин при комнатной температуре. Клеточный цикл CD34+ клеток определяли при помощи проточного цитофлуориметра BD FACSAria (Becton Dickinson, США).
Для проведения процедуры перевивки клеток асцитной формы опухоли мыши Кребс-2 после коинкубации клеток Кребс-2 с TAMRA-меченой ДНК или обработки суммарной популяции асцитных клеток CD34 AT клетки сортировали на содержащие и не содержащие TAMRA-меченую ДНК или на клетки, маркированные CD34+ при помощи проточного цитофлуориметра BD FACSAria (Becton Dickinson, США). Затем клетки осаждали центрифугированием в течение 5 минут при 400 g, 4°C и ресуспендировали в небольшом объеме среды. Количество клеток считали в камере Горяева. Далее два полученных типа клеток прививали мышам в количестве 170 тыс. (1 эксперимент) или 60 тыс. клеток (2 эксперимент) для TAMRA ДНК и 60 тыс. клеток для CD34+ клеток. Измерение объема опухоли проводили с помощью штангенциркуля. Размеры опухоли подсчитывали, используя стандартную формулу: длина × высота × ширина.
Для анализа интернализации TAMRA-меченой экзогенной ДНК в клетки солидной опухоли, капсула Кребс-2 размером около 1 см3 препарировалась. Опухоль разрезалась на две части, после чего одна половина делилась еще на две части. Сегменты опухоли инкубировали с ДНК TAMRA-меченого Alu повтора человека аналогично методу, описанному для клеток костного мозга. После инкубации сегменты ткани промывались трижды PBS. Обработанная опухолевая ткань замораживалась, после чего при помощи микротома нарезалась на пластины толщиной 7 мкм. Срезы заливались в антифейд, содержащий 0.4 мкг/мл DAPI, и анализировались на конфокальном микроскопе.
Рассмотрим более подробно феномен интернализации фрагментов экзогенной ДНК во внутренние компартменты стволовых клеток высших организмов.
Ранее были выполнены многочисленные исследования, характеризующие доставку экзогенной ДНК в эукариотическую клетку [30-34]. В частности, были исследованы на способность интернализовать экзогенные экстраклеточные фрагменты двуцепочечной ДНК стволовые гемопоэтические клетки мыши, человеческие эмбриональные стволовые клетки, дендритные клетки человека и мыши, клетки культуры клеток аденокарциномы молочной железы человека MCF-7 [30-34]. В цитируемых источниках показано, в клеточное пространство может интернализоваться двуцепочечная ДНК, в состав которой входят различные дополнительные молекулярные группы - биотин, различные флуорохромы, радиоактивно меченый предшественник. Также установлено, что в клетку могут быть доставлены молекулы ДНК, достигающие размера 10000 п.о.
В ходе исследования способности стволовых гемопоэтических клеток интернализовать фрагменты экзогенной двуцепочечной ДНК проводился анализ взаимодействия двуцепочечной ДНК как с интактными клетками костного мозга, так и с клетками костного мозга, находящимися под воздействием или цитостатика, или гамма радиации. Было показано, что клетки костного мозга взаимодействуют с фрагментами двуцепочечной ДНК, и что такие фрагменты интернализуются во внутренние компартменты клеток. Действие фрагментов экзогенной ДНК на клетку было различным в зависимости от типа обработок и времени попадания ДНК в клетку после воздействия повреждающего фактора. В случае облучения инъекции препарата двуцепочечной ДНК спасали стволовые клетки крови от повреждений, вызванных радиацией. В случае обработки кросслинкирующим цитостатиком циклофосфаном стволовые клетки изменяли свою генетическую моду и становились неспособными длительное время развиваться в лимфоидный кроветворный росток, что сопровождалось возникновением иммунодефицита и гибелью экспериментальных животных. Полученные многочисленные данные свидетельствовали, что фрагменты двуцепочечной ДНК достигают стволовых клеток крови и принимают участие в происходящих в клетке молекулярных процессах. Поскольку действие экзогенной ДНК ярко проявлялось на фоне повреждающих агентов, приводящих к формированию двуцепочечных разрывов, то было сделано предположение, которое было обосновано экспериментально, что фрагменты двуцепочечной ДНК принимают участие в репарационных процессах при репарации двуцепочечных разрывов [33].
Исследуя свойство клеток костного мозга интернализовать фрагменты экстраклеточной экзогенной ДНК, было обнаружено, что из всей популяции клеток костного мозга только 2% клеток демонстрировали интернализацию меченых фрагментов. Из определенных двух процентов 1% составляли CD34- клетки, а 1% составляли CD34+. При этом общее содержание CD34+ клеток было равно 2.2%. Это означало, что 40% гемопоэтических стволовых клеток интернализуют фрагменты экстраклеточной экзогенной ДНК. На долю CD34- клеток приходится 1% (фиг.1, 2).
Для доказательства того, что меченый внутриклеточный материал представляет собой именно интернализованные фрагменты, а не является следствием инкорпорации меченых предшественников, образованных в результате деградации ДНК фрагментов в хромосомы клетки в результате происходящих в ней синтетических процессов, была проведена серия экспериментов, результаты которых свидетельствуют о том, что в клетку доставляются и депонируются в ядерном пространстве целые фрагменты экстраклеточной двуцепочечной ДНК [33] (фиг.5).
При анализе судьбы фрагментов двуцепочечной ДНК, интернализованных во внутренних компартментах стволовых клеток крови, было установлено, что линейные фрагменты двуцепочечной ДНК подвергаются процессингу, связному с активностью репарирующих систем клетки. Это было прямым доказательством того, что фрагменты экзогенной ДНК, доставляемые во внутриядерное пространство, участвуют в репаративных процессах в качестве субстрата для репаративно-рекомбинационной молекулярной машины клетки (фиг.3) и что благодаря такому участию в стволовой гемопоэтической клетке происходят изменения, нарушающие механизмы клеточной дифференцировки, как это было показано в работе [33]. Характер продуктов процессинга предполагал, что активированные молекулярные репаративные факторы могут нарушать структуру двуцепочечных концов хромосом, существующих как интермедиаты репарации межцепочечных сшивок в случае обработки циклофосфаном, таким образом, что функциональная топология хроматина будет необратимо нарушена.
Как было отмечено выше, проведенный анализ клеток костного мозга на способность различных клеточных популяций интернализовать экзогенные фрагменты двуцепочечной ДНК показал, что основным типом клеток, интернализующим фрагменты ДНК, являются CD34+ стволовые клетки крови. Это привело нас к предположению, что этот признак, а именно способность интернализовать экзогенные фрагменты двуцепочечной ДНК, является характерным признаком д