Стимуляция иммунного ответа энантиомерами катионных липидов
Иллюстрации
Показать всеПредложена группа изобретений: фармацевтическая композиция, содержащая иммунологически активный энантиомер компонента катионного липида R-DOTAP или S-DOTAP, способ применения указанного энантиомера для вызова иммуностимулирующего адъювантного эффекта в иммунной системе, способ индукции иммунного ответа у пациента с его использованием и способ лечения или предотвращения заболевания у пациента путем индукции липидом иммуностимулирующего адъювантного эффекта. Технический результат: R-DOTAP и S-DOTAP индуцировали продукцию цитокинов IL-2, IL-8, IL-12, хемокинов CCL-5, CCL-19 и регрессию опухоли у мышей. 4 н. и 19 з.п. ф-лы, 15 ил., 8 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки США № 61/045837, поданной 17 апреля 2008 г. авторами Elizabeth Vasievich, Weihsu Chen, Kenya Toney, Gregory Conn, Frank Bedu-Addo и Leaf Huang, под названием «Стимуляция иммунного ответа энантиомерами катионных липидов», описание которой включено в настоящую заявку в качестве ссылки в полном объеме.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в основном относится к стимуляции иммунного ответа и более конкретно к применению R- и S-энантиомеров липидов в стимуляции иммунного ответа.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Этот раздел предназначен для введения в различные аспекты уровня техники, которые могут быть связаны с различными аспектами настоящего изобретения, которые описаны и/или заявлены ниже. Считается, что это обсуждение будет полезно для предоставления вводной информации для облегчения лучшего понимания различных аспектов настоящего изобретения. Соответственно, должно быть понятно, что эти положения следует толковать в этом аспекте, а не как признание существующего уровня техники.
Разработка безопасных и эффективных иммунотерапевтических средств для применения у людей остается крайне необходимой медицинской потребностью для пациентов во всем мире. Для индукции соответствующих иммунных реакций иммунологические модификаторы («иммуномодификаторы»), которые усиливают, направляют или стимулируют иммунный ответ, могут быть использованы в создании вакцин или для иммунотерапии [Gregoriadis, G., Immunological adjuvants: a role for liposomes. Immunol Today 11:89 (1990)]. Например, вакцины могут включать антигены для стимуляции иммунного ответа. Однако некоторые потенциальные вакцины, которые содержат антигены, являются слабыми стимуляторами иммунного ответа, поскольку эти вакцины эффективно не доставляют антиген к антиген-презентирующим клеткам («APC») иммунной системы и/или антиген является слабо иммуногенным. Таким образом, необходимы иммунотерапевтические средства, которые эффективно доставляют антигены к APC, а также стимулируют иммунную систему, для ответа на антиген. Иммуномодификаторы имеют возможность действовать в качестве иммунотерапевтических средств. Такие иммунотерапевтические средства могут обладать этими и другими полезными свойствами. Например, при включении в качестве части терапевтической вакцины иммуномодификатор по меньшей мере должен (1) улучшать доставку антигена и/или процессирование в APC [Wang, R. F., and Wang, H. Y., Enhancement of antitumor immunity by prolonging antigen presentation on dendritic cells. Nat Biotechnol 20:149 (2002)], (2) индуцировать продукцию иммуномодулирующих цитокинов, которые способствуют развитию иммунных реакций на антиген вакцины, таким образом стимулируя клеточно-опосредованный иммунитет, в том числе цитотоксические Т-лимфоциты («CTL»), (3) уменьшать количество иммунизаций или количество антигена, необходимого для эффективной вакцины [Vogel, F. R. Improving vaccine performance with adjuvants. Chin Infect Dis 30 Suppl 3:S266 (2000)], (4) увеличивать биологический или иммунологический период полужизни антигена вакцины и (5) преодолевать иммунологическую толерантность к антигену путем ингибирования иммуносупрессирующих факторов [Baecher-Allan, C., and Anderson, D. E. Immune regulation in tumor-bearing hosts. Curr Opin Immunol 18:214 (2006)].
В настоящее время основным классом веществ, используемых для усиления эффективности антигенов, таких как пептидные или белковые антигены, в индукции иммунного ответа, являются адъюванты, такие как эмульсии вода-в-масле, квасцы и другие химические вещества, которые усиливают антигенные реакции; однако эти адъюванты не являются иммуномодификаторами, как описано выше, поскольку сами они не обладают прямым иммуномодулирующим действием [Vogel, F. R., and Powell, M. F. A compendium of vaccine adjuvants and excipients, Pharm Biotechnol 6:141 (1995)]. Некоторые такие адъюванты доступны для применения у животных, а некоторые из них были протестированы в клинических испытаниях. Помимо традиционных адъювантов, таких как соли алюминия, продаются такие продукты, как виросомы гриппа [Gluck, R., and Walti, E. 2000. Biophysical validation of Epaxal Berna, a hepatitis A vaccine adjuvanted with immunopotentiating reconstituted influenza virosomes (IRIV). Dev Biol (Basel) 103:189 (2000)] и MF59 Широна (Chiron) [Kahn, J. O., et al. Clinical and immunologic responses to human immunodeficiency virus (HIV) type 1SF2 gpl20 subunit vaccine combined with MF59 adjuvant with or without muramyl tripeptide dipalmitoyl phosphatidylethanolamine in non-HIV-infected human volunteers. J. Infect Dis 170:1288 (1994)], которые обладают присущими им иммунными эффектами. Например, препарат MF59, который представляет собой адъювант на основе субмикронной эмульсии, интернализуется дендритными клетками [Dupuis, M., et al., Dendritic cells internalize vaccine adjuvant after intramuscular injection. Cell Immunol 186:18 (1998)]. Однако в соответствии с отчетами о клинических испытаниях по вакцинам против HSV и вируса гриппа [Jones, C. A., and Cunningham, A. L. Vaccination strategies to prevent genital herpes and neonatal herpes simplex virus (HSV) disease. Herpes 11:12 (2004); Minutello, M. et al., Safety and immunogenicity of an inactivated subunit influenza virus vaccine combined with MF59 adjuvant emulsion in elderly subjects, immunized for three consecutive influenza seasons. Vaccine 17:99 (1999)] данные, полученные от модели на животных, дают возможность предположить, что адъювант MF59 усиливает продукцию нейтрализующих антител, а не усиливает Т-клеточные ответы. Таким образом, необходимы новые способы стимуляции клеточно-опосредованных иммунных ответов.
Далее, как указано выше, некоторые антигены являются слабыми стимуляторами иммунного ответа. Таким образом, помимо совместного введения антигена с веществами, которые стимулируют иммунные ответы, как описано выше, слабоиммуногенный антиген может быть модифицирован для повышения его иммуногенности. Например, слабый иммуногенный антиген может быть соединен с иммуногенными пептидами, полисахаридами или липидами для повышения его иммуногенности. Однако простого соединения слабо иммуногенных антигенов с этими типами соединений может быть недостаточно для индукции иммунного ответа. Например, полученный в результате иммунный ответ может быть направлен на иммуногенные эпитопы на присоединенном соединении, а не на слабом антигене, или присоединенный антиген может не быть эффективно доставлен к APC иммунной системы. Таким образом, дополнительные способы необходимы для стимуляции иммунных ответов на антигены, которые являются слабо иммуногенными.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Некоторые аспекты настоящего изобретения, приводимые в качестве примера, изложены ниже. Должно быть понятно, что эти аспекты приведены просто для предоставления краткого изложения некоторых форм изобретения, которые оно может принимать, и что эти аспекты не предназначены для ограничения объема этого изобретения. В действительности, настоящее изобретение может охватывать целый ряд аспектов, которые могут не быть явным образом изложены ниже.
Настоящее изобретение относится к хиральности катионных липидов и применению R- и S-энантиомеров катионных липидов, которые в определенной дозе и условиях композиции действуют как новый класс иммуностимуляторов, для (1) эффективной презентации или доставки антигена к иммунной системе и (2) стимуляции иммунной системы в ответ на этот антиген.
Липосомы были широко использованы для доставки лекарственных средств с низкой молекулярной массой, плазмидной ДНК, олигонуклеотидов, белков и пептидов. Вакцины, используя липосомные везикулы в качестве невирусных антигенных носителей, предпочтительны по сравнению с традиционными иммунизациями с использованием живых аттенуированных вакцин или вирусных векторов, таких как вирус оспы или вирус гриппа. В патентной заявке США № 12/049957, переданной правопреемнику настоящей заявки, описывается простой набор эффективных иммунотерапевтических средств на основе липидов, включающих комплекс катионного липида и антигена, который имеет две молекулы, катионный липид и антиген, и воздействие дозы липида на полученный в результате иммунный ответ. Полученные результаты демонстрируют, что катионная липосома, образовавшая комплекс с антигеном, служит для стимуляции иммунных ответов и инициации взаимодействия дендритных клеток (APC) с T-клетками.
В настоящем изобретении дополнительные исследования, проведенные с двумя энантиомерами выбранного катионного липида, привели к открытию того, что существуют различия в способности R и S-энантиомеров катионных липидов действовать в качестве эффективных иммунных активаторов в различных условиях. В сочетании с антигеном комплекс катионного липида с антигеном, содержащий R-энантиомер, в различных условиях дозирования (включая условия низкой дозы) индуцирует сильные иммунные ответы, специфичные в отношении антигена, находящегося в этом комплексе, и в результате приводит к регрессии опухоли. Комплексы, состоящие из S-DOTAP и антигена, однако, были способны индуцировать только ограниченную регрессию опухоли, а вовсе не дозы, при которых R-DOTAP был эффективным. Оба энантиомера DOTAP, однако, являются равно эффективными в индукции созревания и активации дендритных клеток, которая является первым этапом в индукции клеточного иммунного ответа.
Таким образом, один аспект настоящего изобретения относится к композиции по меньшей мере одного энантиомера катионного липида в дозе, эффективной для индукции иммунного ответа у пациента.
Другой аспект настоящего изобретения относится к способу индукции иммунного ответа у пациента путем введения специфического энантиомера или смеси энантиомеров катионных липидов пациенту.
Другой аспект настоящего изобретения относится к композиции R- или S-энантиомера катионного липида в дозе, достаточной для индукции иммунного ответа у пациента.
Дополнительные аспекты настоящего изобретения включают добавление по меньшей мере одного антигена к R- или S-энантиомеру для образования комплекса катионного липида с антигеном, в случае которого иммунный ответ является антиген-специфичным.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Различные особенности, аспекты и преимущества настоящего изобретения будут лучше понятны при прочтении следующего подробного описания со ссылкой на сопровождающие фигуры, на которых:
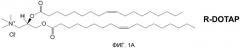
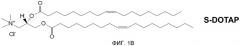
На фиг. 1А и 1В представлена хиральность 1,2-диолеоил-3-триметиламмония пропана («DOTAP»).
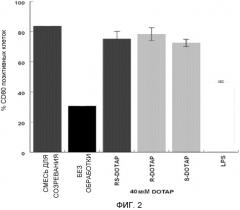
На фиг. 2 представлен график, на котором изображена активация дендритных клеток человека, приводящая в результате к экспрессии костимулирующей молекулы CD80 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 3 представлен график, на котором изображена активация дендритных клеток человека, приводящая в результате к экспрессии костимулирующей молекулы CD83 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 4 представлен график, на котором изображена активация дендритных клеток человека, приводящая в результате к экспрессии костимулирующей молекулы CD86 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 5 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции хемокина CCL-3 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 6 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции хемокина CCL-4 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 7 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции хемокина CCL-5 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP
На фиг. 8 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции хемокина CCL-19 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 9 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции цитокина IL-2 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 10 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции цитокина IL-8 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 11 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции цитокина IL-12 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 12 представлен график, демонстрирующий противоопухолевое действие in vivo различных доз комплекса катионного липида с антигеном на основе размера опухоли и времени после инъекции.
На фиг. 13 представлен график, демонстрирующий действие дозы S-DOTAP на противоопухолевую эффективность in vivo комплекса катионного липида и антигена.
На фиг. 14 представлен график, демонстрирующий действие дозы R-DOTAP на противоопухолевую активность in vivo комплекса катионного липида и антигена.
На фиг. 15 представлен график, на котором изображены ответные эффекты дозы липида рацемической смеси DOTAP, R-DOTAP и S-DOTAP на противоопухолевый иммунный ответ in vivo комплекса катионного липида и антигена с дозой антигена 20 мкг. Действие дозы антигена также продемонстрировано рацемической смесью DOTAP. R-DOTAP по сравнению с S-DOTAP: * p<0,05, **p<0,01, n=5-6.
ПОДРОБНОЕ ОПИСАНИЕ
Один или более специфических вариантов настоящего изобретения будет описано ниже. С целью обеспечения краткого описания этих вариантов осуществления все особенности фактического воплощения могут быть не описаны в этом описании. Должно быть понятно, что при разработке любого такого фактического воплощения многочисленные решения, специфичные для такого воплощения, должны быть сделаны для достижения особых целей разработчиков, которые могут варьировать от одного воплощения к другому. Более того, должно быть понятно, что такая опытная работа могла быть сложной и длительной, но тем не менее была бы обычной практикой, предпринимаемой специалистами, которым полезно это описание.
При введении элементов настоящего изобретения (например, его приводимых в качестве примера вариантов осуществления) формы единственного и множественного числа и «указанный» означают, что существует один или несколько элементов. Термины «содержащий», «включающий» и «имеющий» являются инклюзивными и означают, что могут быть дополнительные элементы, отличные от перечисленных элементов.
Один аспект настоящего изобретения относится к энантиомеру катионного липида для стимуляции иммунного ответа у млекопитающего для профилактики или лечения заболевания. Отдельные хиральные липиды могут функционировать независимо в качестве иммуномодуляторов дозозависимым образом, например, в отношении продукции хемокинов и/или цитокинов, путем активации различных компонентов сигнального пути MAP киназы. Определяют диапазон доз, который эффективно индуцирует иммунный ответ, для того чтобы провести различие между R- и S-энантиомерами, а также в пределах различных видов млекопитающих. Например, у грызунов R-энантиомер DOTAP эффективно ослабляет рост опухоли в диапазоне от примерно 30 нмоль до примерно 400 нмоль. Напротив, S-энантиомер DOTAP является эффективным в том же диапазоне доз у тех же видов грызунов, хотя менее, чем R-энантиомер. В другом аспекте хиральный катионный липид может быть ассоциирован с антигенами или лекарственными средствами для презентации клеткам иммунной системы, одновременно стимулируя сильный антиген-специфичный иммунный ответ. В некоторых аспектах настоящего изобретения антигеном является липопептид.
В патенте США № 7303881, включенном в качестве ссылки в полном объеме, описывается, что было показано, что многочисленные катионные липиды, образовавшие комплекс с антигенами, связанными с патологическими состояниями, стимулируют профилактический иммунный ответ, который предупреждал болезнь, вызываемую специфическим патогеном (например, HPV-позитивный рак), а также терапевтический иммунный ответ, который уничтожает клетки, экспрессирующие конкретный антиген, и приводит в результате к эффективному лечению этого заболевания. В настоящее время исследования проводились для дальнейшего понимания действия хиральности на иммуностимулирующую способность катионных липидов, путем использования R- и S-энантиомеров DOTAP. (R- и S-энантиомеры DOTAP показаны на фиг. 1A и 1B.) Эти исследования привели к открытию того, что отдельные энантиомеры катионных липидов могут действовать независимо в качестве иммуномодуляторов для стимуляции иммунного ответа с (или без) антигенов. Далее, когда энантиомеры катионных липидов образуют комплексы с антигеном, генерируется антиген-специфичный иммунный ответ, степень иммунного ответа, специфичного для заболевания, существенно различается между R- и S-энантиомерами катионного липида.
В другом аспекте хиральный катионный липид в дозе, достаточной для стимуляции иммунного ответа, вводят в сочетании с антигеном или антигенами. В этом случае сочетание катионного липида и антигена способно генерировать иммунный ответ, который специфичен в отношении этого антигена (антигенов), доставляемого(ых) в сочетании с катионным липидом. Вызываемый ответ может включать продукцию специфических цитотоксических Т-клеток, Т-клеток памяти или В-клеток, приводящую в результате к профилактическому или терапевтическому ответу на конкретное заболевание, связанное с этим антигеном (антигенами).
Хиральные катионные липиды по настоящему изобретению могут быть в форме катионных липидных комплексов. Катионный липидный комплекс может принимать вид различных везикул, таких как липосомы, мицеллы или эмульсии. Катионные липидные комплексы могут быть однослойными или многослойными. При включении антигена антиген может быть инкапсулирован в катионный липидный комплекс или может быть неинкапсулированным. Под инкапсулированным подразумевается, что антиген может содержаться во внутреннем пространстве комплекса и/или может быть включен в липидные стенки комплекса.
Другой аспект настоящего изобретения относится к способу получения этих комплексов, где указанный способ необязательно может включать стадию очистки этих составов от избытка отдельных компонентов.
В некоторых вариантах осуществления катионные липидные комплексы имеют общий положительный заряд и/или положительно заряженную поверхность при pH 6,0-8,0.
Производный «антиген», который может быть включен в катионные липидные комплексы по изобретению, может представлять собой нуклеиновые кислоты, пептиды, липопептиды, белки, липопротеины, полисахариды и другие макромолекулы, которые могут образовывать комплексы непосредственно с катионными липидами. Однако катионные лекарственные средства (например, крупный катионный белок) могут непосредственно образовывать комплекс с анионным липидом или последовательно образовывать комплекс сначала с анионным липидом или полимером, после чего с хиральным катионным липидом. Применение этого процесса позволяет осуществлять доставку положительно или нейтрально заряженных лекарственных средств к клеткам посредством комплексов по настоящему изобретению.
Один аспект настоящего изобретения включает применение хиральных катионных липидных комплексов для активации дендритных клеток, а также для стимуляции продукции хемокинов и цитокинов. Хемокины и цитокины являются важными регуляторами иммунных реакций. Хемокины первоначально идентифицированы как мощные хемоаттрактанты для воспалительных клеток, в том числе нейтрофилов, эозинофилов и моноцитов/макрофагов. Последующие исследования показали, что хемокины оказывают сильное действие на иммунные реакции путем регуляции направленной миграции дендритных клеток и других лимфоцитов в лимфоидные органы. Дендритные клетки представляют собой мигрирующие клетки, которые выбирают антигены в ткани, мигрируют к дренирующим лимфоузлам и созревают для стимуляции Т-клеточного ответа. CCL2, представитель CC хемокинов, первоначально был идентифицирован в качестве хемотактического и активирующего фактора для моноцитов/макрофагов. Последующие исследования показали, что он также может влиять на функцию Т-клеток, естественных клеток-киллеров и нейтрофилов. Дальнейшее исследование обнаружило, что CCL2 был наиболее мощным активатором активности CD8+ цитотоксических Т-лимфоцитов («CTL»), в присутствии Th1 цитокинов, интерлейкина-12 («IL-12») и интерферона-γ («IFN-γ»). Это можно объяснить позитивным двухсторонним взаимодействием между системами CCL2 и IFN-γ. Отсутствие любого из цитокина или хемокина может препятствовать поляризации Th1 и последующей выработке специфического опухолевого иммунитета. Также было показано, что другой CC хемокин, CCL-4, осуществляет рекрутинг и распространение дендритных клеток in vivo и потенцирование иммуногенности плазмидных ДНК вакцин. В последнее время было показано, что хемокины усиливают иммунитет путем направления наивных CD8+ T-клеток к местам взаимодействия CD4+ T-клеток-дендритных клеток и способствуют генерации CD8+ T-клеток памяти. Некоторыми примерами хемокинов, которые могут стимулироваться катионными липидными комплексами по настоящему изобретению, являются CCL-2, CCL-3 и CCL-4. Примерами цитокинов, которые могут стимулироваться катионными липидными комплексами по настоящему изобретению, являются IL-2, IL-8, IL-12 и IFN-γ. Авторы изобретения считают, что катионные липидные комплексы по настоящему изобретению могут стимулировать хемокины и цитокины в дополнение к тем, которые приведены в настоящем описании.
ЛИПИДЫ
Хиральные катионные липидные комплексы по настоящему изобретению могут образовывать липосомы, которые необязательно перемешивают с антигеном, и могут содержать хиральные катионные липиды отдельно или хиральные катионные липиды в сочетании с нейтральными липидами. Виды подходящих хиральных катионных липидов включают, но не только, R- и S-энантиомеры: 3-β[4N-(1N,8-дигуанидиноспермидин)карбамоил]холестерин (BGSC); 3-β[N,N-дигуанидиноэтил-аминоэтан)карбамоил]холестерин (BGTC); N,N1N2N3тетра-метилтетрапальмитилспермин (cellfectin); N-трет-бутил-N'-тетрадецил-3-тетрадецил-аминопропион-амидин (CLONfectin); диметилдиоктадецил аммония бромид (DDAB); 1,2-димиристилоксипропил-3-диметил-гидроксиэтил аммония бромид (DMRIE); 2,3-диолеоилокси-N-[2(сперминкарбоксамидо)этил]-N,N-диметил-1-п-ропанаминия трифторацетат) (DOSPA); 1,3-диолеоилокси-2-(6-карбоксиспермил)пропиламид (DOSPER); 4-(2,3-бис-пальмитоилокси-пропил)-1-метил-1H-имидазол (DPIM) N,N,N',N'-тетраметил-N,N'-бис(2-гидроксиэтил)-2,3-диолеоилокси-1,4-бутандиаммония йодид) (Tfx-50); N-1-(2,3-диолеоилокси)пропил-N,N,N-триметил аммония хлорид (DOTMA) или другие N-(N,N-1-диалкокси)-алкил-N,N,N-тризамещенные аммонийные поверхностно-активные вещества; 1,2 диолеоил-3-(4'-триметиламмонио)бутанол-sn-глицерин (DOBT) или холестерил (4'триметиламмоний)бутаноат (ChOTB), где триметиламмонийная группа соединена через бутанольное спейсерное плечо либо с двойной цепью (для DOTB), либо группой холестерила (для ChOTB); DORI (DL-1,2-диолеоил-3-диметиламинопропил-β-гидроксиэтиламмоний) или DORIE (DL-1,2-О-диолеоил-3-диметиламинопропил-β-гидроксиэтиламмоний) (DORIE) или их аналоги, как описано в WO 93/03709; 1,2-диолеоил-3-сукцитинил-sn-глицерин холин сложный эфир (DOSC); сложный эфир холестерил гемисукцината (ChOSC); липополимамины, такие как диоктадециламидоглицилспермин (DOGS) и дипальмитоил фосфатидилэтаноламилспермин (DPPES), или катионные липиды, описанные в патенте США № 5283185, холестерил-3β-карбоксил-амидо-этилентриметиламмония йодид, 1-диметиламино-3-триметиламмонио-DL-2-пропил-холестерил карбоксилат йодид, холестерил-3-O-карбоксиамидоэтиленамин, холестерил-3-β-оксисукцинамидо-этилентриметиламмония йодид, 1-диметиламино-3-триметиламмонио-DL-2-пропил-холестерил-3-β-оксисукцината йодид, 2-(2-триметиламмонио)этилметиламино этил-холестерил-3-β-оксисукцинат йодид, 3-β-N-(N',N'-диметиламиноэтан)карбамоилхолестерин (DC-chol) и 3-β-N-(полиэтиленимин)карбамоилхолестерин; О,О'-димиристил-N-лизил аспартат (DMKE); О,О'-димиристил-N-лизил-глутамат (DMKD); 1,2-димиристилоксипропил-3-диметил-гидроксиэтил аммония бромид (DMRIE); 1,2-дилауроил-sn-глицеро-3-этилфосфохолин (DLEPC); 1,2-димиристоил-sn-глицеро-3-этилфосфохолин (DMEPC); 1,2-диолеоил-sn-глицеро-3-этилфосфохолин (DOEPC); 1,2-дипальмитоил-sn-глицеро-3-этилфосфохолин (DPEPC); 1,2-дистеароил-sn-глицеро-3-этилфосфохолин (DSEPC); 1,2-диолеоил-3-триметиламмония пропан (DOTAP); диолеоил диметиламинопропан (DODAP); 1,2-пальмитоил-3-триметиламмония пропан (DPTAP); 1,2-дистеароил-3-триметиламмония пропан (DSTAP), 1,2-миристоил-3-триметиламмония пропан (DMTAF) и додецилсульфат натрия (SDS). В настоящем изобретении рассматривается применение структурных вариантов и производных катионных липидов, описанных в настоящей заявке.
Некоторые аспекты настоящего изобретения включают нестероидные хиральные катионные липиды, имеющие структуру, представленную следующей формулой:
,
где R1 представляет собой четвертичную аммонийную группу, Y1 выбран из углеводородной цепи, сложного эфира, кетона и пептида, C* представляет собой хиральный атом углерода, R2 и R3 независимо выбраны из насыщенной жирной кислоты, ненасыщенной жирной кислоты, углеводорода, связанного сложноэфирной связью, фосфор-диэфиров и их сочетаний. DOTAP, DMTAP, DSTAP, DPTAP, DPEPC, DSEPC, DMEPC, DLEPC, DOEPC, DMKE, DMKD, DOSPA, DOTMA являются примерами липидов, имеющих эту общую структуру.
В одном варианте осуществления хиральные катионные липиды по настоящему изобретению представляют собой липиды, в которых связи между липофильной группой и аминогруппой являются стабильными в водном растворе. Таким образом, отличительной чертой комплексов по настоящему изобретению является их стабильность при хранении (т.е. их способность сохранять небольшой диаметр и сохранение биологической активности на протяжении периода времени после их образования). Такие связи, используемые в катионных липидах, включают амидные связи, сложноэфирные связи, эфирные связи и карбамоильные связи. Специалистам в данной области будет понятно, что липосомы, содержащие более одного вида катионных липидов, могут быть использованы для получения комплексов по настоящему изобретению. Например, липосомы, содержащие два вида катионных липидов, лизил-фосфатидилэтаноламин и сложный эфир β-аланилхолестерина, были описаны для некоторых применений в доставке лекарственных средств [Brunette, E. et al., Nucl. Acids Res., 20:1151 (1992)].
Далее должно быть понятно, что в рассматриваемых хиральных катионных липосомах, подходящих для применения в настоящем изобретении и необязательного смешивания с антигеном, способы по настоящему изобретению не ограничиваются только применением катионных липидов, приведенных выше, а скорее любая липидная композиция может быть использована при условии получения катионной липосомы, и полученная в результате плотность катионного заряда является достаточной для активации и индукции иммунного ответа.
Таким образом, комплексы по изобретению могут содержать другие липиды помимо хиральных катионных липидов. Эти липиды включают, но не только, лизолипиды, примером которых является лизофосфатидилхолин(1-олеоиллизофосфатидилхолин), холестерин, или нейтральные фосфолипиды, в том числе диолеоилфосфатидилэтаноламин (DOPE) или диолеоилфосфатидилхолин (DOPC), а также различные липофильные поверхностно-активные вещества, содержащие группы полиэтиленгликоля, примерами которых являются Tween-80 и PEG-PE.
Комплексы хиральных катионных липидов по настоящему изобретению также могут содержать отрицательно заряженные липиды, а также катионные липиды, при условии, что конечный заряд образованных комплексов является положительным и/или поверхность комплекса является положительно заряженной. Отрицательно заряженные липиды по изобретению представляют собой липиды, содержащие по меньшей мере одну разновидность липидов, имеющих конечный отрицательный заряд в физиологичном рН или близкий к нему, или их сочетания. Подходящие отрицательно заряженные разновидности липидов включают, но не только, CHEMS (холестерилгемисукцинат), NGPE (N-глутарилфосфатидилэтаноламин), фосфатидилглицерин и фосфатидную кислоту или сходный фосфолипидный аналог.
Способы получения липосом, используемых в получении липидсодержащих комплексов для доставки лекарственных средств по настоящему изобретению, известны специалистам в данной области. Обзор методик получения липосом можно найти в Liposome Technology (CFC Press New York 1984); Liposomes by Ostro (Marcel Dekker, 1987); Methods Biochem Anal. 33:337-462 (1988) и патенте США № 5283185. Такие способы включают экструзию замораживания-оттаивания и обработку ультразвуком. Как однослойные липосомы (в среднем менее чем примерно 200 нм в диаметре), так и многослойные липосомы (в среднем примерно более чем 300 нм в диаметре) могут быть использованы в качестве исходных компонентов для получения комплексов по настоящему изобретению.
В катионных липосомах, используемых для получения катионных липидных комплексов по настоящему изобретению, хиральный катионный липид находится в липосоме в концентрации от примерно 10 мол.% до примерно 100 мол.% от общего липосомного липида, или от примерно 20 мол.% до примерно 80 мол.%. Нейтральный липид при включении в липосому может находиться в концентрации от примерно 0 мол.% до примерно 90 мол.% общего липосомного липида, или от примерно 20 мол.% до примерно 80 мол.%, или от 40 мол.% до 80 мол.%. Отрицательно заряженный липид при включении в липосому может находиться в концентрации в интервале от примерно 0 мол.% до примерно 49 мол.% от общего липосомного липида или от примерно 0 мол.% до примерно 40 мол.%. В одном варианте осуществления липосомы содержат хиральный катионный и нейтральный липид в соотношении примерно от 2:8 до примерно 6:4.
Далее понятно, что комплексы по настоящему изобретению могут содержать модифицированные липиды, белок, поликатионы или рецепторные лиганды, которые функционируют в качестве фактора направленной доставки, направляющего комплекс на конкретный тип ткани или клетки. Примеры факторов для направленной доставки включают, но не только, асиалогликопротеин, инсулин, липопротеин низкой плотности (LDL), фолат и моноклональные и поликлональные антитела, направленные против молекул клеточной поверхности. Более того, для модификации циркулирующего периода полужизни комплексов, положительный поверхностный заряд может быть стерически защищен путем включения липофильных поверхностно-активных веществ, которые содержат функциональные группы полиэтиленгликоля.
Катионные липидные комплексы могут храниться в изотоничном растворе сахарозы или декстрозы при получении из градиента сахарозы, или они могут быть лиофилизированы, а затем восстановлены в изотоничном растворе перед применением. В одном варианте осуществления катионные липидные комплексы хранят в растворе. Стабильность катионных липидных комплексов по настоящему изобретению измеряется специфическими анализами для определения физической стабильности и биологической активности катионных липидных комплексов на протяжении периода хранения. Физическая стабильность катионных липидных комплексов измеряют путем определения диаметра и заряда катионных липидных комплексов способами, известными специалистам в данной области, в том числе, например, электронной микроскопией, гельфильтрационной хроматографией или посредством квазиупругого рассеяния света, используя, например, анализатор размера частиц Coulter N4SD, как описано в Примере. Физическая стабильность катионного липидного комплекса является «по существу неизменной» при хранении, когда диаметр сохраняемых катионных липидных комплексов не увеличивается более чем на 100%, или не более чем на 50%, или не более чем на 30%, свыше диаметра катионных липидных комплексов, определенного во время очистки катионных липидных комплексов.
Хотя возможно применять хиральные катионные липиды в чистой или по существу чистой форме, предпочтительно представить их в виде фармацевтической композиции, состава или препарата. Фармацевтические составы с использованием хиральных катионных липидных комплексов по настоящему изобретению могут содержать катионные липидные комплексы в физиологически совместимом стерильном буфере, например, таком как фосфатно-солевой буферный раствор, физиологический раствор или буфер с низкой ионной силой, например ацетатный или Hepes (в качестве примера рН находится в диапазоне от примерно 3,0 до примерно 8,0). Хиральные катионные липидные комплексы могут применяться в виде аэрозолей или в виде липидных растворов для внутриопухолевого, внутриартериального, внутривенного, внутритрахеального, внутрибрюшинного, подкожного или внутримышечного введения.
Составы по настоящему изобретению могут включать любой стабилизатор, известный из уровня техники. Характерными стабилизаторами являются холестерин и другие стеролы, которые могут помочь сделать бислой липосомы более жестким и предотвратить дезинтеграцию или дестабилизацию этого бислоя. Также вещества, такие как полиэтиленгликоль, поли- и моносахариды, могут быть включены в липосому для модификации поверхности липосомы и предохранения ее от дестабилизации вследствие взаимодействия с компонентами крови. Другими иллюстрирующими стабилизаторами являются белки, сахариды, неорганические кислоты или органические кислоты, которые могут быть использованы либо как таковые, либо в смесях.
Ряд фармацевтических способов может быть использован для контроля, модификации или пролонгирования длительности иммунной стимуляции. Препараты с контролируемым высвобождением могут быть получены путем использования полимерных комплексов, таких как сложные полиэфиры, полиаминокислоты, метилцеллюлоза, поливинил, поли(молочная кислота) и гидрогели для инкапсулирования или задержки катионных липидов и медленного их высвобождения. Аналогичные полимеры также могут быть использованы для адсорбции липосом. Липосомы могут содержаться в эмульсионных составах для изменения профиля высвобождения стимулирующего вещества. Альтернативно длительность нахождения стимулирующего вещества в кровотоке может быть увеличена путем покрытия поверхности липосомы соединениями, такими как полиэтиленгликоль или другие полимеры и другие вещества, такие как сахариды, которые способны увеличить время циркуляции или период полужизни липосом и эмульсий.
В тех случаях, когда требуются пероральные препараты, хиральные катионные липиды могут быть объединены с обычными фармацевтическими носителями, известными из уровня техники, такими как, например, сахароза, лактоза, метилцеллюлоза, карбоксиметилцеллюлоза или аравийская камедь, среди прочих. Катионные липиды также могут быть инкапсулированы в капсулы или таблетки для системной доставки.
Введение хирального катионного липида по настоящему изобретению может осуществляться либо с профилактической, либо с терапевтической целью. При введении профилактически катионный липид вводят раньше каких-либо признаков или симптомов заболевания. При введении терапевтически катионный липид вводят во время или после начала болезни. Терапевтическое введение иммуностимулятора служит для ослабления или лечения заболевания. Для обеих целей катионный липид можно вводить с дополнительными терапевтическими средствами (средством) или антигенами (антигеном). При введении катионных липидов с дополнительным терапевтическим средством или антигеном профилактический или терапевтический эффект может быть вызван против конкретного заболевания.
Составы по настоящему изобретению, как для ветеринарного применения, так и для применения у людей, содержат хиральный катионный липид в чистом виде, как описано выше, или в виде смеси R- и S-энантиомеров, или также, необязательно, с одним или несколькими терапевтическими ингредиентами, такими как антиген(ы) или молекула(ы) лекарственного средства. Составы удобно предоставлять в единичной лекарственной форме, и они могут быть получены любым способом, известным в фармацевтической области.
АНТИГЕНЫ
В одном варианте осуществления хиральный катионный липид вводят без каких-либо дополнительных средств для усиления или ослабления различных иммунных реакций, включая продукцию других иммунных модуляторов, и для усиления иммунного ответа для борьбы с заболеванием. В другом варианте осуществления хиральный катионный липид вводят в сочетании с антигеном или антигенами. В этом случае целью является индукция иммунного ответа, который является специфичным в отношении антигена(ов), доставляемых в сочетании с катионным липидом. Индуцируемый ответ может включать продукцию специфических цитотоксических Т-клеток, Т-клеток памяти или В-клеток, приводя в