Способ дифференциальной диагностики злокачественной и доброкачественной патологии молочной железы
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии и клинической биохимии. Сущность способа заключается в том, что фиксированные клетки периферической крови обрабатывают первичными антителами к эстроген-связываюшему белку, специфически взаимодействующими с антигенами на поверхности сегментоядерных гранулоцитов, затем к полученному комплексу антиген-антитело добавляют вторичные антивидовые флуоресцентно-меченные антитела, и при наличии окрашивания поверхности сегментоядерных гранулоцитов диагностируют злокачественные новообразования, а при отсутствии окрашивания поверхности сегментоядерных гранулоцитов диагностируют доброкачественные новообразования. Способ неинвазивен, позволяет быстро и со 100%-ной точностью дифференцировать пациенток, имеющих злокачественные опухоли молочной железы, от пациенток с доброкачественными новообразованиями и здоровых женщин. Данный тест может быть использован для экспресс-диагностики наличия рака молочной железы. 6 пр., 6 ил.
Реферат
Изобретение относится к медицине, а именно к онкологии и клинической биохимии, и касается способов дифференциальной диагностики злокачественной и доброкачественной патологии молочной железы.
Статистические данные последних лет свидетельствуют о неуклонном, интенсивном росте заболеваемости и смертности от рака молочной железы в различных странах [Рак молочной железы //под ред. Н. Е. Кушлинского, С.М. Портного, К.П. Лактионова. М.: Издательство РАМН. - 2005. - C.480]. В Российской Федерации рак молочной железы занимает первое место в структуре заболеваемости женщин злокачественными новообразованиями, причем частота его неуклонно растет, особенно у женщин в пожилом возрасте.
Общепризнанными в организации выявления рака молочной железы являются следующие диагностические манипуляции: физикальный осмотр, пальпация и маммография [Е.Г.Пинхосевич и др. Основные проблемы развития маммологии //Маммология. - 1995. - №1. - С. 3-11]. Эти исследования могут быть дополнены дуктографией, УЗИ, цитологическим исследованием мазка отделяемого. Физикальный осмотр и пальпация молочной железы в большинстве случаев позволяют выявить опухоли диаметром не менее 1-1,5 см. При таком размере первичного очага метастазы в регионарные лимфатические узлы определяются более чем в 30% случаев [В.И.Апанасевич. Оптимизация диагностики заболеваний молочной железы. //Дис.доктора мед. наук. - Владивосток. -2001. - C.350].
Внедрение в практику программ маммографического скрининга позволило сократить смертность в различных странах на 20-40% [В.Ф.Левшин и др. Исследование возможностей внедрения и эффективности различных видов маммологического скрининга //Маммология. - 1997.- №4. - C. 25-31]. Однако нельзя не отметить, что разрешающая возможность этого метода ограничена. По данным различных авторов, этот метод выявляет в основном опухоли размером 5-6 мм и более, и лишь исключительно редко удается обнаружить опухоли меньшего размера. Причем у женщин репродуктивного возраста с выраженным фиброзом железы некоторые опухоли могут расти до 20-30 мм в диаметре, не будучи определимы на маммограммах [R. Holland et al. Mammographically occult breast cancer //Cancer (Philad.) 1983, vol. 52, p. 1810 - 1819].
Большинство опухолей молочной железы возникает в протоковой системе, от 73 до 92% опухолей являются инвазивными протоковыми раками различного строения. Распознавание ранних внутрипротоковых изменений на маммограммах затруднено. Для их визуализации используется метод искусственного контрастирования протоков - дуктография. Эта методика позволяет детально исследовать протоковую систему молочной железы и в 96% установить причину патологической секреции [K.S. Baker et al. Ductal abnormalities detected with galactography: frequency of adequate excisional biopsy/Department of Diagnostic Radiology, University of Kentucky Medical Center, AGR-Am-J-Roentgenol. Apr., 1994, p. 821-824]. Однако дуктография - весьма трудоемкая процедура, требующая специальной подготовки, определенных технических навыков, является инвазивным методом исследования, связана с введением ксенобиотика, проводится в условиях специализированной клиники и не применима для проведения массового скрининга.
Ультразвуковое исследование молочной железы является легкодоступным и неинвазивным методом, но отличается низкой специфичностью и не имеет большого значения для диагностики заболеваний, сопровождающихся синдромом галактореи [В.П. Харченко и др. Рентгеносонографическая диагностика заболеваний молочной железы, сопровождающихся микрокальцинатами //Маммология. - 1996. - №4. - с. 36-40].
Цитологическое исследование мазка отделяемого из молочной железы, являясь рутинным методом исследования, широко применяется в клинической практике. По данным некоторых авторов, этот метод дает возможность распознать изменения млечных протоков у 77% больных, но выявить внутрипротоковые новообразования позволяет лишь у 17% [В.В. Мартынюк и др. Диагностическая тактика при выделениях из соска. //Вестник хирургии им. Грекова. - 1990. - №2. - C. 140-142]. Так как цитологические находки в выделениях являются неспецифическими и неадекватными для диагностики, цитология выделений должна проводиться в сочетании с другими методами исследований, а именно физикальным осмотром, маммографией, дуктографией, и не может иметь самостоятельного значения при проведении скрининга.
Для диагностики рака молочной железы в разное время предлагалось значительное количество различных маркеров. Наиболее известные из них это - ферритин, муциноподобный антиген (МСА) и антиген, ассоциированный с раком молочной железы (СА-15-3).
Было выявлено, что уровень ферритина в ткани злокачественной опухоли молочной железы был статистически выше, чем в неизмененной ткани. При анализе данных была выявлена корреляция между уровнем прогрессирования рака молочной железы и сывороточным уровнем ферритина [Claustres M. et al. Ferritin and breast cancer //Pathol. Biol. 1984. Vol.32, N4.P265-268].
В последние годы все большее внимание уделяется использованию в скрининге рака молочной железы и предраковых заболеваний, определению в крови уровня маркера опухолевого роста СA 15-3 [Safi F. et al. The value of the tumor marker CA 15-3 in diagnosing and monitoring breast cancer //Cancer (Phila.), 68: 574-582, 1991]. Он повышаются незначительно (менее 10%) на ранних стадиях заболевания. При высокой специфичности (95%) по отношению к доброкачественным заболеваниям молочной железы этот маркер имеет чувствительность 20-30% при первичной диагностике. Возможно повышение данного онкомаркера при других видах опухолей, патологий печени и беременности. Таким образом, низкая специфичность и чувствительность, а также возможная интерференция результатов за счет постоянного синтеза опухолевых маркеров нормальными тканями, значительно ограничивают возможность применения этого метода [В.И. Апанасевич. Оптимизация диагностики заболеваний молочной железы. //Дис.доктора мед. наук. Владивосток.- 2001. - С.350].
В качестве маркера для диагностики рака молочной железы была предпринята попытка использования раково-эмбриональный антиген (РЭА). Его пытались использовать для скрининга рака молочной железы [ et al. Carcinoembryonic antigen in serum of unselected breast-cancer patients and of non-hospitalized controls. //Br J Cancer. 1979; 39(2): 109-115]. Отмечалось, что уровень РЭА находится в зависимости от стадии и распространенности заболевания [Macolm S. Michel. Immunology and immunjtherapy of the breast cancer //Diseases of the breast. Philadelphia, 1996. P. 298-300. Silva E., Lurrida S. Breast Cancer. A practical guide.//Amsterdam-Lauzanne-New York-Oxford, 2000. P.70-271; 370-372].
Однако при раке молочной железы исследование РЭА не получило широкого распространения в связи с низкими показателями специфичности и чувствительности. Гораздо более существенный успех сопровождало использование РЭА в качестве инструмента мониторинга за качеством лечения и развитием рецидива заболевания [Высоцкая И.В. Опухолевые маркеры РЭА, ТПА, СА 153, МСА, ферритин в сыворотке крови больных раком молочной железы. С. 216-227. Рак молочной железы /под ред.Н.Е. Кушлинского, С.М. Портного, К.П. Лактионова. М.: Издательство РАМН. 2005. С.480].
Другим опухолевым маркером является тканевой полипептидный антиген (ТПА). Находясь в эндоплазматической сети клеточных мембран, ТПА довольно быстро попадает в сыворотку крови, где его можно определить радиоимунным способом. ТПА не обладает видовой специфичностью и определяется во всех типах опухолей [Biorklund B. et al. Assey of TPA as an aid in the managerment of breast cancer //Int. J. Biol. Markers. 1989. Vol.4. №4. P 510]. Отмечалось, что уровень маркера ТПА имеет корреляцию с прогрессированием заболевания или с неблагоприятным прогнозом.
В 1987 году был выделен маркер МСА (муциноподобный антиген), который оказался высокомолекулярным гликопротеидом с молекулярной массой 350 кД [Beiglmayer C. Szepesi T. Mucin-like tumor markers for metastatic breast cancer //J.Tumor markers Oncol. 1990, Vol.5, №3, P 214]. При его исследовании возникла надежда, что этот маркер может стать инструментом выявления «малого рака», так как значимое повышение уровня маркера наблюдалось даже при ранней стадии заболевания. Однако большинство авторов определяют МСА только как показатель прогрессирования заболевания с хорошими мониторинговыми характеристиками заболевания [Высоцкая И.В. Опухолевые маркеры РЭА, ТПА, СА 153, МСА, ферритин в сыворотке крови больных раком молочной железы. С. 216-227. Рак молочной железы /под ред.Н.Е. Кушлинского, С.М. Портного, К.П. Лактионова. М.: Издательство РАМН. 2005. С.480].
Таким образом, опухолевые маркеры, предлагаемые ранее для диагностики рака молочной железы (РЭА, ТПА MCA, CA 15-3, ферритин), показали низкую чувствительность при ранних стадиях заболевания. Однако эти маркеры имели хорошо выраженную корреляцию между сывороточным уровнем и стадией заболевания. Это сделало их надежным инструментом качественного мониторинга лечения рака молочной железы.
Наиболее близким к заявляемому способу является способ дифференциальной диагностики гиперпластических процессов и рака молочной железы на гистологических срезах [RU 2107911 С1, 27.03.1998]. Способ основан на окраске цитоплазмы паренхиматозных клеток в гистологических срезах. При указанном способе диагностики проводят детекцию ассоциированного с беременностью альфа2-гликопротеина (АБГ) путем иммуногистохимической реакции с использованием первичных антител против ассоциированного с беременностью альфа2-гликопротеина в концентрации 8-10 мкг/мл.
Сущность иммуногистохимической детекции АБГ в гистологических срезах молочной железы, ее пролифератов и рака заключаются в следующем.
1. Регидратация срезов и удаление из них остатков парафина. Для этого срезы проводят через три порции о-ксилола, абсолютный этанол, спирт 70 и 56%-ный, а также забуференный физиологический раствор (ЗФР) - по три минуты в каждой порции жидкости.
2. Блокирование эндогенной пероксидазы осуществляют путем внесения на срез нескольких капель 3% перекиси водорода на 10 мин.
3. Блокирование неспецифической сорбции иммуноглобулинов достигают путем нанесения на срез лошадиной сыворотки в разведении 1:20 на 30 мин.
4. Этап обработки гистологических срезов первичными антителами в концентрации 8-10 мкг/мл, разведенными в ЗФР с добавлением 3% альбумина и 0,01% азида натрия. Инкубация срезов осуществляется в течение 30 мин при 37oC.
5. Инкубация гистологических срезов вторичными антителами в разведении 10 мкг/мл ЗФР на 30 мин.
6. Обработка срезов комплексом авидин-пероксидаза в концентрации 25 мкг/мл в течение 30 мин.
7. Проявление пероксидазной активности 3,3-диаминобензидином тетрахлоридом (ДАБ) и ЗФР в соотношении 500 мкг ДАБ на 1 мл ЗФР. К свежеприготовленному раствору прибавляют 0,03% перекись водорода, и срезы инкубируют с субстратом в течение 10 мин. Реакцию останавливают погружением срезов в дистиллированную воду. В дальнейшем срезы обезвоживают, последовательно помещая в 70%, 90% и абсолютный этанол, просветляют в трех порциях о-ксилола и заключают в канадский бальзам.
Результат читают под разными увеличениями светового микроскопа по наличию окраски цитоплазмы клеток в опытных микропрепаратах и «положительном контроле», при отсутствии окраски - в «отрицательном контроле». Использование способа показало, что цитоплазма клеток нормальной ткани эпителия протоков и долек молочной железы не имеет окраски. В очагах гиперплазии цитоплазма эпителиальных клеток окрашена в золотисто-желтый цвет. Разные клетки данной зоны имеют неравномерную окраску, что объясняется различной степенью их гиперплазии. Полученные данные позволяют объективнее различать зоны интактного и гиперплазированного эпителия, за счет чего повышается точность диагностики гиперпластических процессов в молочной железе.
К основному недостатку способа-прототипа относится его высокая инвазивность, так как для приготовления гистологических срезов требуется биопсийный материал. В патенте №2107911 не приведены показатели точности этого способа диагностики.
Задача, решаемая изобретением - упрощение способа дифференциальной диагностики злокачественной и доброкачественной патологии молочной железы, увеличение его точности.
Согласно заявляемому способу задача дифференциальной диагностики злокачественной и доброкачественной патологии молочной железы решается на основе иммуноокрашивания фиксированных клеток периферической крови антителами к эстроген-связываюшему белку, специфически взаимодействующими с антигенами на поверхности сегментоядерных гранулоцитов и визуализации комплексов антиген-антитело с помощью вторичных антивидовых флуоресцентно-меченных антител. Окрашивание поверхности сегментоядерных гранулоцитов на мазках периферической крови коррелирует с наличием у пациенток злокачественных новообразований молочной железы, а отсутствие такого окрашивания указывает на доброкачественные новообразования.
Предлагаемый метод основан на использовании антител, специфически взаимодействующих с эстроген-связывающим белком (ЭСБ), выделенным из абортивной крови способом, разработанным заявителем (ТИБОХ ДВО РАН) [RU 2012126721, 26.06.2012]. ЭСБ относится к группе гормон-связывающих белков и характеризуется как белок онкофетальной природы, связывающий женские половые гормоны.
В заявляемом способе анализируют мазки периферической крови, взятой из пальца пациента. После фиксации клеток препарат обрабатывают первичными антителами к ЭСБ, специфически взаимодействующими с антигенами на поверхности сегментоядерных гранулоцитов. Далее образовавшийся комплекс антиген-антитело выявляют вторичными антивидовыми антителами, меченными флюоресцентным красителем, например Alexa 488. Флюоресцентное свечение, а следовательно, взаимодействие антител с лигандом - ЭСБ, наблюдается на поверхности сегментоядерных гранулоцитов у пациенток с диагнозом рак молочной железы, тогда как у пациенток с доброкачественными новообразованиями и у здоровых женщин из контрольной группы такого взаимодействия не происходит. Для регистрации флуоресцентного свечения метки достаточно наличие микроскопа, снабженного флуоресцентным модулем.
Реактивы и растворы, используемые в заявляемом способе.
Бычий сывороточный альбумин - БСА (AMRESCO, USA).
Фосфатно-солевой буфер (ФСБ): для приготовления раствора используют готовые таблетки PBS (Helicon, Russia). Раствор ФСБ(+) готовят добавлением к ФСБ до концентрации 0,02% TWEEN 20 (Helicon, Russia).
Первичные антитела: иммуноглобулины кролика, содержащие антитела к ЭСБ. Маточный раствор: 1 мг иммуноглобулинов растворяют в 1 мл ФСБ, содержащего 1% БСА, аликвоты раствора хранят при температуре -20°С. Рабочий раствор антител: 1 мкл маточного раствора антител разводят в ФСБ, содержащем 10% БСА в соотношении 1:150.
Вторичные антитела: антивидовые антитела против иммуноглобулинов кролика, меченные Alexa 488 (Invitrogen, Molecular Probes, USA). Рабочее разведение составляет 1:500 на ФСБ, содержащем 1% БСА.
Светозащитная среда для хранения препаратов: Vestashield Mounting Medium (Vector Laboratories, USA).
Заявляемый способ дифференциальной диагностики рака молочной железы состоит в следующем.
1. Приготовление мазков из образцов периферической крови (кровь из пальца).
Небольшую каплю крови (40-50 мкл) наносят на край покрытого полилизином предметного стекла, мазок готовят с использованием стекла со шлифованным краем согласно стандартной методике. Препарат подсушивают на воздухе непродолжительное время, до исчезновения влаги с поверхности. Затем препарат фиксируют в метаноле в течение 5 мин. После высушивания мазки хранят при температуре 4°С.
2. Разведение антител.
Маточный раствор антител: 1 мг лиофильно-высушенных иммуноглобулинов кролика, содержащих антитела к ЭСБ, растворяют в 1 мл ФСБ, содержащего 1% БСА. Рабочий раствор антител: 1 мкл маточного раствора разводят в 150 мкл ФСБ, содержащем 10% БСА.
3. Методика окраски мазков.
а. Промывка в ФБС(+) 3 раза по 5 мин.
б. Обработка 0,1% раствором Triton X 100 на ФСБ для снижения неспецифического связывания антител - 30 мин.
в. Блокировка неспецифического связывания антител ФСБ, содержащем 10% БСА, в течение 1,5 -2 час при комнатной температуре.
г. Обработка первичными антителами к ЭСБ в рабочем разведении - 12 час при 4°С.
д. Промывка в ФБС(+) 3 раза по 15 мин.
ж. Обработка вторичными антителами, меченными Alexa 488, в разведении 1:500 при комнатной температуре 1,5 час.
з. Промывка в ФБС(+) 3 раза по 15 мин.
После заключения в светозащитную среду препараты анализируют с использованием микроскопа, оснащенного флуоресцентным модулем (Axio Imager Z.2 (Carl Zeiss) с системой COLIBRI).
Результаты исследования.
В исследовании принимали участие три группы пациентов - 11 здоровых женщин (без новообразований молочных желез), которые были использованы в качестве контроля; 22 женщины с доброкачественными новообразованиями в тканях молочной железы (группа сравнения) и 17 пациенток с диагностированным раком молочной железы.
Иммуноцитохимическое окрашивание мазков периферической крови антителами к ЭСБ позволило строго дифференцировать пациенток, имеющих злокачественные опухоли молочной железы, от пациенток с доброкачественными новообразованиями и здоровых женщин.
У всех пациенток больных раком молочной железы наблюдался принципиально-сходный характер окрашивания мазков клеток крови. Антитела к ЭСБ адсорбировались на поверхности сегментоядерных гранулоцитов, при этом цитоплазма агранулярных лейкоцитов (лимфоциты, моноциты) не проявляла сродства к антителам. Кроме того, на некоторых препаратах наблюдалось фоновое окрашивание, что, очевидно, отражало повышенное содержание ЭСБ в плазме крови пациентов больных раком. У здоровых женщин и у женщин, имеющих доброкачественные новообразования, окрашивание антителами цитоплазмы сегментоядерных гранулоцитов не наблюдали ни в одном из исследованных случаев. Окрашивание фона также было либо незначительным, либо полностью отсутствовало. Таким образом, окрашивание антителами к ЭСБ сегментоядерных гранулоцитов на мазках периферической крови, фоновое окрашивание разной интенсивности коррелирует с наличием злокачественных новообразований молочной железы у женщин.
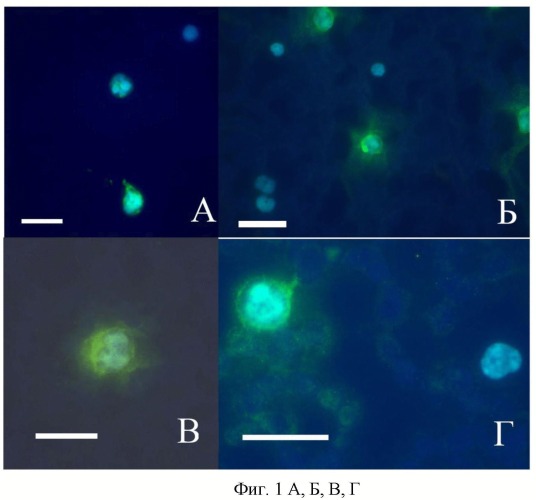
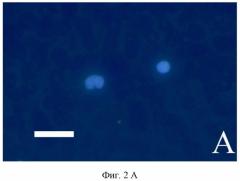
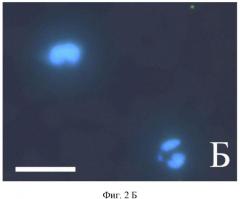
Ниже приводятся типичные примеры иммунохимического окрашивания мазков периферической крови, взятой у женщин из трех групп: с диагностированным раком молочной железы (фиг. 1 А, Б, В, Г), с доброкачественными новообразованиями молочной железы (фиг. 2 А), здоровых (фиг. 2 Б).
Примеры диагностики.
Пример 1. Фиг. 1 А. Пациентка 48 лет, рак молочной железы, стадия Т1N0M0;
Пример 2. Фиг. 1 Б. Пациентка 47 лет, рак молочной железы, стадия T2N1M0;
Пример 3. Фиг. 1 В. Пациентка 67 лет, рак молочной железы, стадия T2N0M0;
Пример 4. Фиг. 1 Г. Пациентка 63 года, рак молочной железы, стадия T3N0M0.
Фотографии получены с использованием микроскопа Axio Imager Z.2 (Carl Zeiss) с системой COLIBRI. Антитела метят поверхность сегментоядерных гранулоцитов, другие типы лейкоцитов не окрашиваются. Зеленая иммунофлуоресценция маркирует места взаимодействия антигена (ЭСБ) с антителами, вторичные антивидовые антитела мечены Alexa 488 (Invitrogen, Molecular Probes, USA), для визуализации ядер использовали DAPI (Invitrogen, Molecular Probes, USA) окрашивающую ядерную ДНК - голубая флуоресценция. Масштабная линейка соответствует 10 мкм.
Пример 5. Фиг. 2 А. Пациентка 44 года, доброкачественная фиброаденома молочной железы.
Пример 6. Фиг. 2 Б. Пациентка 62 года, здоровая женщина из контрольной группы.
Фотографии получены с использованием микроскопа Axio Imager Z.2 (Carl Zeiss) с системой COLIBRI. Антитела к ЭСБ не выявляют наличия антигена на поверхности сегментоядерных гранулоцитов, что выражается в отсутствии зеленой иммунофлуоресценции. Ядерная ДНК окрашена DAPI (Invitrogen, Molecular Probes, USA), голубая флуоресценция. Масштабная линейка соответствует 10 мкм.
Таким образом, технический результат заявляемого способа дифференциальной диагностики злокачественной и доброкачественной патологии молочной железы заключается в следующем:
1. упрощение процедуры взятия биологического материала для исследования (кровь из пальца пациента в небольшом объеме (40-50 мкл) вместо биопсийного материала в способе-прототипе), т.е. заявляемый способ в отличие от прототипа является неинвазивным;
2. способ отличается более быстрым проведением иммуноцитохимического окрашивания и получения результатов по сравнению со способом-прототипом, т.к. отсутствует длительный процесс подготовки пробы, связанный с взятием биопсийного материала, его иссечения, заливкой материала в парафин и приготовлением гистологических срезов.
В предлагаемом способе иммуноцитохимическое окрашивание мазков периферической крови антителами к ЭСБ характеризуется 100%-ной степенью специфичности и позволяет однозначно выявлять пациенток, имеющих злокачественные опухоли молочной железы, и дифференцировать пациенток с доброкачественными новообразованиями и здоровых женщин.
Низкая инвазивность и быстрота проведения предлагаемого теста позволит использовать его для экспресс-диагностики наличия рака молочной железы.
Способ дифференциальной диагностики злокачественной и доброкачественной патологии молочной железы на основе иммуноокрашивания биологического материала, отличающийся тем, что фиксированные клетки периферической крови обрабатывают первичными поликлональными антителами к эстроген-связываюшему белку, взаимодействующими с ним на поверхности сегментоядерных гранулоцитов, затем к полученному комплексу антиген-антитело добавляют вторичные антивидовые флуоресцентно-меченные антитела, и при наличии окрашивания поверхности сегментоядерных гранулоцитов диагностируют злокачественные новообразования, а при отсутствии окрашивания поверхности сегментоядерных гранулоцитов диагностируют доброкачественные новообразования.