Способы лечения склеродермии
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к терапии, и может быть использована для лечения склеродермии. Для этого пациенту, нуждающемуся в этом, вводят терапевтически эффективное количество антагониста интерферона типа I (ИФН), где указанным антагонистом является антитело. Группа изобретений относится также к способу уменьшения интенсивности одного или более симптомов, ассоциированных со склеродермией. Использование антагониста интерферона типа I, а именно антитела, позволяет подавлять передачу сигнала ИФН с участием рецептора άИФН, что существенно снижает вероятность развития и тяжесть воспалительного заболевания кожи и способствует восстановлению кожных покровов. 2 н.п. и 18 з.п. ф-лы, 8 пр., 9 ил.
Реферат
В данной заявке испрашивается более ранний приоритет, основанный на предварительных заявках США сер. номер 60/996175 и 61/100545, каждая из которых включена в описание в полном объеме в качестве ссылки.
Область техники, к которой относится изобретение
В настоящем изобретении предлагаются способы лечения склеродермии и уменьшения интенсивности ассоциированных с ней симптомов.
Предпосылки создания изобретения
Склеродермия, или системный склероз (ССК), является прогрессирующим изнуряющим аутоиммунным нарушением, которое характеризуется избыточным отложением белка фибробластами кожи в межклеточном матриксе, называемым также дермальный фиброз. В организме пациентов с обширным кожным заболеванием часто присутствуют уникальные маркеры, такие как регуляция с повышением в коже генов, индуцированных интерфероном типа I (ИФН), а также присутствие в сыворотке антиядерных аутоантител, специфичных в отношении топоизомеразы I. В пользу предположения о том, что ИФН играет роль в развитии кожного фиброза, свидетельствуют последние сообщения о том, что склеродермия возникает у пациентов, которые прошли курс лечения ИФН от хронической вирусной инфекции. Материалы по системной склеродермии приводятся в обзоре Varga и Abraham, J. Clin. Invest., 117, 557-567 (2007).
ИФН типа I, α, β, θ, κ и ω представляют собой цитокины, экспрессированные 13 функциональными генами ИФНα, одним геном ИФНβ, одним геном ИФНθ, одним геном ИФНκ и одним геном ИФНω (Theofilopoulos A.M., Baccala R., Beutler В., Kono D.H.. Type I Interferons (α/β) in immunity and autoimmunity. Immunol. Rev., 204 (апрель), 9-26 (2005)). Известно по меньшей мере 28 подтипов ИФНα, таких, например, как, но не ограничиваясь только ими, α1, α2a, α2b, α4, α5, α6, α7, α8, α10, α16, α17 и α21. В некоторых случаях ссылка на интерферон подтипа α2 включает α2a и α2b.
Все интерфероны человека типа I связываются с рецептором клеточной поверхности (рецептором ИФНα, ИФНαР), состоящим из двух трансмембранных белков, ИФНαР1 и ИФНαР2 (Uze и др., Cell, 60, 225 (1990), Novick и др., Cell, 77, 391 (1994)). Связывание с указанным рецептором приводит к активации внутриклеточных путей передачи сигнала (Stark G.R., Kerr I.M., Williams B.R., Silverman R.H., Schreiber R.D., Annu. Rev. Biochem., 67, 227-264 (1998)), инициируемых благодаря активации киназ Jak, Jaki и Tyk2. Указанные киназы последовательно фосфорилируют переносчика сигнала и белки-активаторы транскрипции (STAT), STAT1 и 2. Фосфорилированные белки STAT образуют комплекс фактора транскрипции, ИФН-стимулированный фактор 3 (ISGF3), который вместе с белком р48 транслоцируется в ядро. Указанные комплексы активируют ИФН-стимулированный респонсивный элемент (ИСРЭ), который индуцирует экспрессию ИФН-индуцибельных генов.
Наряду со специфическими противовирусными функциями ИФН типа I играют решающую роль в регуляции иммунной системы (Theofilopoulos A.N., Baccala R., Beutler В., Kono D.H.. Type I Interferons (a/p) in immunity and autoimmunity, Immunol. Rev., 204 (апрель), 9-26 (2005) и Belardelli F., Gresser I., The neglected role of type I Interferon in the T-cell response: implications for its clinical use, Immunol. Today, 17? 369-372 (1996)). Интерфероны типа I продуцируются различными типами клеток, включающих моноциты, макрофаги, дендритными клетками и лимфоцитами, а также другими гематологическими клетками в ответ на действие противовоспалительных цитокинов, а также компонентов различных патогенов. Указанные клетки также реагируют на ИФН типа I и усиливают экспрессию иммунологически важных соединений, таких как компоненты ГСТС класса I, CD38, интерлейкины (BLyS, IL-6, IL-10 и IL-15) и хемокины (IL-8, МСР-1, МСР-2, MIG, MIP1a, MIP1b и IP10). Кроме того, ИФН типа I индуцируют многие биологические функции ключевых компонентов иммунной системы, включающих дендритные клетки Т и В клетки и природные клетки-киллеры (ПК). Например, ИФН типа I стимулируют созревание дендритных клеток, пролиферацию CD8+Т клеток памяти, подавление апоптоза CD4+ Т клеток, активацию клеток ПК и дифференцировку В клеток (Banchereau J., Pascual V., Palucka А.К., Autoimmunity through Cytokine-induced dendritic cell activiation. Immunity, 20 (май), 539-550, (2004) и Taki S., Cytokine and Growth Factor Reviews, 13, 379-391 (2002) и Mailliard R.B„ Son Y.I., Redlinger R., Coates P.T., Giermasz A., Morel P.A., Storkus W.J., Kalinski P., J. Immunol., Sep 1, 171(5), 2366-2373 (2003).
В то время как почти все клетки могут продуцировать ИФН типа I в ответ на стимуляцию компонентами вирусов или бактерий, плазмацитоидные дендритные клетки (ПДК) или "природные ИФН-продуцирующие клетки" продуцируют ИФН типа I в 1000 раз эффективнее, чем другие типы клеток. Продуцирование ИФН типа I можно индуцировать за счет стимуляции эндосомальных Toll-Like рецепторов (TLR), таких как TLR7 и TLR9, моноцепочечной РНК (мцРНК), гипометилированных CpGs в бактериальной ДНК или иммунных комплексов аутоантиген/антитело.
Существует необходимость в более подробном изучении роли интерферонов типа I в патогенезе склеродермии для разработки новых способов лечения указанного заболевания и его клинических проявлений.
Подразумевается, что цитирование или обсуждение публикаций, упомянутых в качестве ссылок, не означает, что они являются известным уровнем техники для настоящего изобретения.
Краткое изложение сущности изобретения
В настоящем изобретении предлагаются композиции и способы лечения склеродермии и симптомов, ассоциированных со склеродермией, благодаря введению пациенту, который нуждается в лечении, терапевтически эффективного количества антагониста типа ИФН типа I. В настоящем изобретении также предлагаются способы ингибирования экспрессии гена, индуцибельного ИФН типа I, ассоциированного со склеродермией.
Краткое описание фигур
Некоторые варианты осуществления изобретения иллюстрируются следующими фигурами, не ограничивающими его объем.
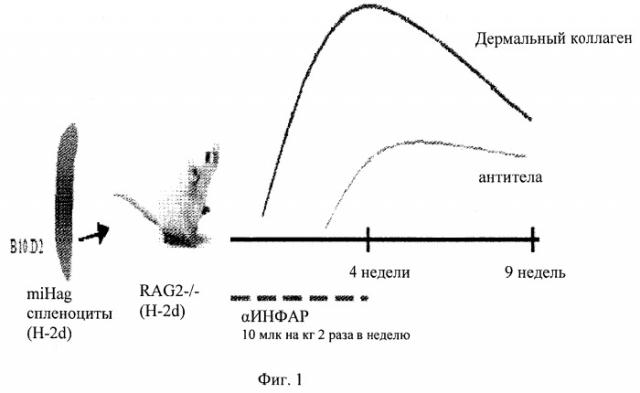
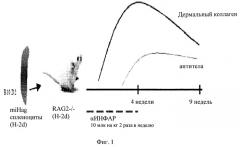
На фиг.1 представлена схема развития модели системного склероза (ССК) у мышей, т.е. индукции заболевания, где RAG2-/-мышам вводили общий пул спленоцитов, по гистосовместимости (miHag), а симптомы ССК, такие как отложение дермального коллагена и аутоантитела, развивались в течение определенного времени.
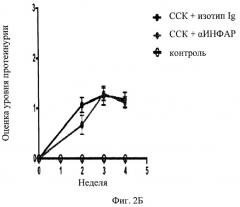
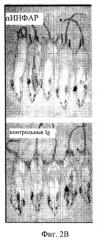
На фиг.2А и Б представлены графики развития клинических признаков склеродермии в течение определенного времени у мышей в отсутствие заболевания (контроль) и у мышей с индукцией заболевания в присутствии антител против рецептора α-интерферона (ССК+αИФНАР) или у мышей с индукцией заболевания в присутствии изотипа Ig в качестве контрольного антитела (ССК+изотип Ig, фиг.2А) или (ССК+изотип Ig, фиг.2Б). На оси Y приводится оценка состояния кожи (фиг.2А) и протеинурии (фиг.2В). На фиг.2 В представлена фотография ткани мыши после индукции заболевания в присутствии антител против рецептора α-интерферона (ССК+αИФНАР, верхняя панель) или в присутствии изотипа Ig в качестве контрольного антитела (Ig контроль, верхняя панель).
На фиг.3А представлены в виде столбиков результаты гистопатологического анализа ССК кожи у RАG2-/-мышей в отсутствие заболевания (контроль), у мышей с заболеванием в присутствии антител против рецептора α-интерферона (ССК+αИФНАР) или у мышей с заболеванием в присутствии изотипа Ig в качестве контрольного антитела (ССК+изотип Ig). На оси Y приводятся суммарные оценки степени воспалительного процесса (0=норма, 1=слабый клеточный инфильтрат, 2=умеренный инфильтрат, 3=первазивный кожный инфильтрат) и отложения коллагена (0=норма, 1=слабое, 2=умеренное, 3=тяжелое). На фиг.3Б приводятся результаты иммуногистохимического анализа при стандартном окрашивании Н&Е (гематоксилином и эозином, левая панель) и трихромом по Мэссону (правая панель) образцов кожи мышей в отсутствие индукции заболевания (контроль), мышей с заболеванием в присутствии антител против рецептора α-интерферона (ССК+αИФНАР) или мышей с заболеванием в присутствии изотипа Ig в качестве контрольного антитела (ССК+изотип Ig).
На фиг.4А-4Е приводятся результаты иммуногистохимического анализа срезов кожи, окрашенных козьими анти-мышиными антителами Ig/ФИТЦ (зеленый цвет) или поликлональными крысиными анти-мышиными антителами C1q/PE (красный цвет) и помещенных в DAPI (синий цвет). Срезы кожи получали от сингенных привитых контрольных мышей (фиг.4А и 4Г), мышей с индукцией ССК в присутствии изотипа Ig в качестве контроля (фиг.4Б и 4Д), и мышей с индукцией ССК в присутствии антител против рецептора αИФН (фиг.4В и 4Е).
На фиг.5А приводятся в виде столбиков графики, отражающие уровень в сыворотке аутоантител анти-Scl-70 и анти-SSA (IgG, IgA, IgM) по результатам ИФА сыворотки мышей в отсутствие заболевания (контроль), мышей с индукцией заболевания в присутствии антител против рецептора α-интерферона (ССК+αИФНАР) или мышей с заболеванием в присутствии изотипа Ig в качестве контрольного антитела (ССК+изотип Ig). На фиг.5Б приводятся три графика, отражающие количество анти-Scl-70 IgG1 (верхняя панель), анти-Scl-70 IgG2 (средняя панель) и анти-SSA IgG1 (нижняя панель) в сыворотке мышей в отсутствие заболевания (отсутствие ТПХ), мышей с заболеванием в присутствии антител против рецептора α-интерферона (10 mpk 5A3) или мышей с заболеванием в присутствии изотипа Ig в качестве контрольного антитела ((10 mpk 1A7). На фиг.5В приводятся результаты иммуногистохимического анализа срезов селезенки сингенных привитых контрольных мышей (панели а и г), мышей с индукцией ССК в присутствии изотипа Ig в качестве контроля (панели б и д) и мышей с индукцией ССК в присутствии антител против рецептора αИФН (панели в и е), окрашенных красителем CD45R/B220 (коричневый цвет) и агглютинином из арахиса (красный цвет) с целью идентификации герминальных центров (ГЦ).
На фиг.6А приводятся в виде столбиков графики, отражающие результаты количественного анализа методом проточной цитометрии с использованием клеточного сортера (ПЦКС) плазмацитоидных дендритных клеток селезенки (ПДК, B220+/Gr-1lo/CD11b+/CD11c) у реципиентов, которым вводили общий пул спленоцитов, через 2 недели после прививки (ССК) или у непривитых RAG2-/- контрольных мышей (контроль). На фиг.6Б приводятся графики оценки состояния кожи (слева) и протеинурии (справа) у RAG2-/-мышей, которым прививали общий пул спленоцитов (miHag) или Gr-1 - дефицитный (т.е. ПДЕ-дефициитный) общий пул спленоцитов (miHag), т.е. Gr-1(-)-спленоцитов.
На фиг.7 представлена визуализированная карта, представляющая собой результаты анализа полного геномного микрочипа (ПГМ) генов, которые репрессированы (подавлены) или индуцированы в клетках кожи мышей в отсутствие индукции ССК (контроль), мышей с индукцией заболевания в присутствии изотипа Ig (Ig контроль) и мышей с индукцией ССК в присутствии антител против рецептора α-интерферона (αИФНАР). Клиническая оценка состояния кожи в каждом проанализированном методом ПГМ образце, которую проводили, как показано на фиг.3А, приводится под колонками.
На фиг.8А-8Г приводятся результаты серии экспериментов, направленных на анализ экспрессии в режиме реального времени ИФН типа I в коже ТПХ/ССК-мышей. На фиг.8А показаны результаты анализа методом кПЦР индукции мРНК ИФНα2, α5, α9 и β. На фиг.8Б и 8В показаны результаты анализа методом кПЦР ИФНγ и ИФНλ-2, соответственно (результаты двух исследований по 4 точкам). На фиг.8Г представлено иммуногистохимическое окрашивание ИФНλ-3 при ТПХ/ССК (нижняя панель) и в отсутствие ССК (верхняя панель) дермальных эпителиальных клеток (увеличение 400х).
На фиг.9А-9В представлены результаты ТПХ-индуцированного ССК на модели животных. Анализ методом кПЦР по методике фирмы Fluidigm Corp. проводили с использованием клеток из образцов кожи мышей, которым два раза в неделю вводили в дозе 10 мг/кг массы тела анти-ИФНАR1 мышиные антитела 5А3 (заштрихованные столбики) или контрольный Ig (черные столбики) и сравнивали с образцами из кожи мышей, не пораженных ССК (пустые столбики). На фиг.9А представлены результаты экспрессии четырех ИФН-индуцируемых генов (IFI44, МХ1, OASL, OAS2) по двум точкам, которые свидетельствуют о том, что ранняя экспрессия является ИФНАR1-незавивисимой, а хроническая экспрессия является ИФНАR1 - зависимой. На фиг.9Б представлены результаты, свидетельствующие о том, что экспрессия воспалительных генов (МРО, TNFα, IL-6, INOS) в коже снижается при лечении антителами анти-ИФНАR1. На фиг.9В представлены результаты, свидетельствующие о том, что экспрессия генов, ассоциированных с реконструкцией ткани (KLF10, TIMP, EPGN, ММР9), снижается при лечении антителами анти-ИФНАR1.
Подробное описание изобретения
Лечение склеродермии
В настоящем изобретении предлагаются способы лечения склеродермии или системного склероза, а также способы лечения симптомов склеродермии или системного склероза за счет введения антагониста ИФН типа I.
Введение "терапевтически эффективного количества" или "терапевтически эффективной дозы" антител анти-ИФН типа I, или анти-ИФНα, или анти-ИФНαР по изобретению предпочтительно приводит к снижению интенсивности симптомов заболевания, повышению частоты и продолжительности периодов, свободных от симптомов заболевания, или предотвращению недостаточности или потери трудоспособности из-за поражения болезнью. Например, в случае склеродермии терапевтически эффективное количество или доза предпочтительно предотвращает также ухудшение физических симптомов, ассоциированных со склеродермией или системным склерозом, такие, например, как дермальный фиброз, поражения кожи, алопеция, воспаление, кожные утолщения, отложение коллагена, протеинурия, продуцирование аутоантител и отложение комплемента. Терапевтически эффективное количество или доза предпочтительно предотвращает также или замедляет развитие склеродермии или системного склероза, так как это может потребоваться при наличии ранних или предварительных признаков заболевания. Аналогичным образом лечение включает замедление хронической прогрессии, ассоциированной со склеродермией или системным склерозом. При диагностике склеродермии или системного склероза используются лабораторные методы анализа, включающие методы химического анализа, гематологию, гистопатологию, серологию и радиологию. Соответственно, для определения терапевтически эффективной дозы, пригодной для лечения склеродермии или системного склероза, можно использовать любые клинические или биохимические методы анализа, которые регистрируют любые из вышеуказанных признаков заболевания. Специалист в данной области может определить эффективные количества активных ингредиентов с учетом таких факторов, как масса тела субъекта, интенсивность симптомов заболевания, конкретная композиция или способ введения.
Термин "лечение", используемый в описании заявки, обозначает облегчение, уменьшение интенсивности и/или снижение тяжести склеродермии или системного склероза и ассоциированных симптомов.
В некоторых вариантах изобретения предлагаются способы лечения одного или более симптомов склеродермии, которые включают дермальный фиброз, поражения кожи, алопецию, воспаление, кожные утолщения, отложение коллагена, протеинурию, продуцирование аутоантител и отложение комплемента.
Оценка тяжести и развития заболевания, а также ответной реакции на лечение и других клинических признаков склеродермии обычно включает обследование пациента с использованием оценки состояния кожных покровов по шкале Роднана, состояния Рейно, измерения форсированной жизненной емкости легких как части анализа функции легких, кровяного давления при катетеризации правых отделов сердца (предсердия и желудочка), уровня креатина в сыворотке крови, кровяного давления и числа форменных элементов крови, и уровня креатининкиназы в сыворотке крови (см., например, Furst, Rheumatology, 47, v29-v30 (2008) и Furst и др., J. of Rheumatology, 34, 5, 1194-1200 (2007)).
Анализ состояния кожи по шкале Роднана представляет собой клиническую оценку склеродермии с использованием обычной пальпации с целью выявления у пациента утолщений кожи, при этом обследуют 17 участков кожи и каждый участок оценивают по следующей шкале: 0=норма, 1=утолщенная кожа, 2=утолщенная и стойкая к ущемлению кожа и 3=утолщенная и неспособная к движению кожа, всего 51 балл (см. Czirjak и др., Ann. Rheum. Dis., 66(7), 966-969 (18.01.2007) и Brennan и др., Вr.J. Rheum., 31(7), 457-460 (1992)).
Соответственно, в некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение приводит к улучшению симптомов при оценке состояния кожи по шкале Роднана (т.е. снижению уровня измененной кожи).
В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем у указанного пациента оценивают состояние кожи по шкале Роднана до лечения (на уровне от 1 до 51 балла) и после лечения на уровне от (1 до 51)-х, где х = от 1 до 51 (≥0).
В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем у указанного пациента оценивают состояние кожи по шкале Роднана до лечения на уровне 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или 51, а после лечения на уровне 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 или 0.
В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает оценку состояния кожи по Роднану по меньшей мере на 1 балл. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает оценку модифицированной кожи по Роднану по меньшей мере на 5 баллов. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает оценку модифицированной кожи по Роднану по меньшей мере на 10 баллов. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает оценку модифицированной кожи по Роднану по меньшей мере на 25 баллов.
В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает оценку модифицированной кожи по Роднану по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9, по меньшей мере на 10, по меньшей мере на 11, по меньшей мере на 12, по меньшей мере на 13, по меньшей мере на 14, по меньшей мере на 15, по меньшей мере на 16, по меньшей мере на 17, по меньшей мере на 18, по меньшей мере на 19, по меньшей мере на 20, по меньшей мере на 21, по меньшей мере на 22, по меньшей мере на 23, по меньшей мере на 24, по меньшей мере на 25, по меньшей мере на 26, по меньшей мере на 27, по меньшей мере на 28, по меньшей мере на 29, по меньшей мере на 30, по меньшей мере на 31, по меньшей мере на 32, по меньшей мере на 33, по меньшей мере на 34, по меньшей мере на 35, по меньшей мере на 36, по меньшей мере на 37, по меньшей мере на 38, по меньшей мере на 39, по меньшей мере на 40, по меньшей мере на 41, по меньшей мере на 42, по меньшей мере на 43, по меньшей мере на 44, по меньшей мере на 45, по меньшей мере на 46, по меньшей мере на 47, по меньшей мере на 48, по меньшей мере на 49, по меньшей мере на 50 или 51 балл.
В некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение приводит к улучшению симптомов по оценке состояния Рейно (ОСР). ОСР представляет собой ежедневную самооценку активности феномена Рейно по шкале 0-10 с увеличением баллов по мере ухудшения симптомов, ассоциированных со склеродермией (см., например, Merkel и др., Arthritis и Rheumatism, 46, 9, 2410-2420 (2002)).
В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанный пациент до лечения характеризуется величиной ОСР от 1 до 10, а после лечения величиной ОСР (от 1 до 10)-х, где х = от 1 до 10 (≥0).
В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанный пациент до лечения характеризуется величиной ОСР 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, а после лечения величиной ОСР 9, 8, 7, 6, 5, 4, 3, 2, 1 или 0.
В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 1 балл. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 2 балла. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 3 балла. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 5 баллов. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 6 баллов. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 7 баллов. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 8 баллов. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 9 баллов. В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 10 баллов.
В одном варианте изобретения предлагается способ лечения склеродермии у пациента, который нуждается в таком лечении, заключающийся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает величину ОСР по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9 или 10 баллов.
В некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение приводит к улучшению симптомов по результатам клинических измерений уровня креатинина в сыворотке крови.
В некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение приводит к улучшению симптомов по результатам клинических измерений уровня креатинфосфокиназы в сыворотке крови.
В некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение приводит к улучшению симптомов по результатам клинических измерений форсированной жизненной емкости легких как части анализа функции легких.
В некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение приводит к улучшению симптомов по результатам измерений кровяного давления при катетеризации правых отделов сердца (предсердия и желудочка).
В некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение приводит к улучшению симптомов по результатам измерений кровяного давления и числа форменных элементов уровни.
В некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение приводит к улучшению симптомов по результатам гистопатологического анализа образцов кожи пациента. В одном варианте указанное улучшение оценивают по результатам измерения воспалительного процесса, например, по снижению инфильтрата воспалительных клеток в образце ткани, по снижению отложения коллагена или общего утолщения кожи. В одном варианте лечение антагонистом интерферона типа I снижает воспалительный процесс в 2 раза. В другом варианте лечение антагонистом интерферона типа I снижает воспалительный процесс в 3 раза. В еще одном варианте лечение антагонистом интерферона типа I снижает воспалительный процесс в 5 раз.
В некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение приводит к улучшению симптомов по результатам анализа образцов кожи пациента методом кПЦР. См., например, WO/08070137A2 («Interferon Alpha-Induced Pharmacodynamic Markers»).
В некоторых вариантах изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает экспрессию гена воспалительного процесса, включающего, но не ограничиваясь только ими, МРО, ФНОα, ИЛ-6 и INOS. В одном варианте предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем до лечения указанный пациент характеризуется повышенной экспрессией гена воспалительного процесса, включающего, но не ограничиваясь только ими, МРО, ФНОα, ИЛ-6 и INOS, a после лечения указанный пациент характеризуется снижением экспрессии гена воспалительного процесса, включающего, но не ограничиваясь только ими, МРО, ФНОα, ИЛ-6 и INOS. В одном варианте предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает экспрессию гена воспалительного процесса по результатам измерения методом кПЦР по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз или по меньшей мере в 10 раз. В другом варианте предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает экспрессию гена воспалительного процесса по результатам измерения методом кПЦР по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80% или по меньшей мере на 90%.
В другом варианте изобретения предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает экспрессию гена, относящегося к реконструкции ткани, включающего, но не ограничиваясь только ими, KLF10, TIMP, EPGN и ММР9. В одном варианте предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем до лечения указанный пациент характеризуется повышенной экспрессией гена, относящегося к реконструкции ткани, включающего, но не ограничиваясь только ими, KLF10, TIMP, EPGN и ММР9, а после лечения указанный пациент характеризуется повышенной экспрессией гена, относящегося к реконструкции ткани, включающего, но не ограничиваясь только ими, KLF10, TIMP, EPGN и ММР9. В одном варианте предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает экспрессию гена, относящегося к реконструкции ткани, по результатам измерения методом кПЦР по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз или по меньшей мере в 10 раз. В другом варианте предлагаются способы лечения склеродермии у пациента, который нуждается в таком лечении, заключающиеся в том, что пациенту вводят терапевтически эффективное количество антагониста интерферона типа I, причем указанное лечение снижает экспрессию гена, относящегося к реконструкции ткани, по результатам измерения методом кПЦР по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80% или по меньшей мере на 90%.
В способах лечения пациентов терапевтическим агентом, который связывается с ИФН типа I и подавляет его активность, более предпочтительно активность ИФНα или ИФНαР, в способах идентификации пациентов, которых можно подвергать лечению терапевтическим агентом, который связывается с ИФН типа I и подавляет его активность, более предпочтительно активность ИФНα или ИФНαР, в способах диагностики пациента, страдающего от нарушения, ассоциированного с повышенным уровнем ИФН типа I, более предпочтительно уровнем ИФНα или активности ИФНαР, в способах контроля развития заболевания у пациента, проходящего курс лечения терапевтическим агентом, который связывается с ИФН типа I и подавляет его активность, более предпочтительно активность ИФНα или ИФНαР, и в способах идентификации пациентов, страдающих от нарушений, опосредованных ИФН типа I, более предпочтительно ИФНα или ИФНαР, можно использовать фармакодинамические (ФД) маркеры.
Одним объектом настоящего изобретения являются способы лечения пациента, страдающего от заболевания или нарушения, опосредованного ИФН типа I, заключающиеся в том, что пациенту вводят антагонист активности ИФН типа I, причем пациент характеризуется профилем экспрессии ФД маркера, индуцибельного ИФН типа I, причем указанный антагонист нейтрализует профиль экспрессии ФД маркера, индуцибельного ИФН типа I, в организме субъекта. В конкретном варианте изобретения заболеванием или нарушением является склеродермия или системный склероз.
Изобретение включает способы идентификации, диагностики, лечения и контроля развития заболевания у пациентов. Термин «пациент» включает любое животное, страдающее от заболевания, нарушения или состояния, индуцибельного ИФН типа I или ИФНα. Пациент может страдать от заболевания, нарушения или состояния в процессе доклинических испытаний, например, может представлять собой подопытную модель для испытания заболевания, нарушения или состояния. В другом варианте пациент может страдать от заболевания, нарушения или состояния независимо от каких-либо испытаний. Термин «пациент» включает человека, мышей, крыс, лошадей, свиней, кошек, собак и любое животное, используемое в качестве подопытного.
Способы идентификации, диагностики, лечения и контроля развития заболевания у пациентов с использованием профилей экспрессии ФД маркера, индуцибельного ИФН типа I или ИФНα, и/или с использованием антагониста, который нейтрализует профиль экспрессии ФД маркера, индуцибельного ИФН типа I или ИФНα, в организме субъекта, описаны в WO/08070137 A2 ("Interferon Alpha-induced Pharmacodynamic Markers,"), которая включена в описание заявки в полном объеме в качестве ссылки.
Антагонист ИФН типа I, который связывается с ИФН типа I, или ИФНα, или ИФНαР и блокирует их активность, может нейтрализовать профиль, индуцибельный ИФН типа I или ИФНα. Нейтрализация профиля, индуцибельного ИФН типа I или ИФНα, представляет собой снижение профиля экспрессии по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере пяти, по меньшей мере семи, по меньшей мере восьми, по меньшей мере десяти, по меньшей мере двенадцати, по меньшей мере пятнадцати, по меньшей мере двадцати, по меньшей мере двадцати пяти, по меньшей мере тридцати, по меньшей мере тридцати пяти, по меньшей мере сорока, по меньшей мере сорока пяти или по меньшей мере пятидесяти генов, индуцированных ИФН типа I или ИФНα. Гены, индуцированные ИФН типа I или ИФНα, представляют собой любую группу генов, описанных в WO/08070137A2 ("Interferon Alpha-induced Pharmacodynamic Markers"). Нейтрализация профиля, индуцибельного ИФН типа I или ИФНα, представляет собой понижение любого профиля экспрессии, индуцибельного ИФН типа I или ИФНα, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80% или по меньшей мере на 90% любого одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере пяти, по меньшей мере семи, по меньшей мере восьми, по меньшей мере десяти, по меньшей мер