Ингибитор образования цинк-зависимых димеров бета-амилоида
Иллюстрации
Показать всеНастоящее изобретение относится к использованию эналаприлата, водорастворимого вещества на основе дипептида [L-аланил]-[L-пролин], в области медицины. Предложно применение эналаприлата в качестве средства для ингибирования образования цинк-зависимых димеров бета-амилоида. Технический результат заключается в ингибировании образования цинк-зависимых димеров бета-амилоида. 3 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к использованию эналаприлата для ингибирования цинк-индуцированных димеров бета-амилоида.
Уровень техники
Избыточное накопление бета-амилоида в тканях организма человека в виде внеклеточных надмолекулярных ансамблей - амилоидных бляшек - является одним из главных нейроморфологических признаков ряда нейродегенеративных патологий, включающих, например, болезнь Пика, синдром Дауна [1]. Одним из признанных путей поиска средств лечения таких заболеваний является поиск ингибиторов образования водорастворимых олигомеров бета-амилоида [2]. Необходимым условием образования агрегатов является димеризация мономеров бета-амилоида [3, 4, 5]. Ионы цинка играют критическую роль при агрегировании бета-амилоида in vivo [6]. В настоящее время для моделирования олигомеризации бета-амилоида в отсутствии ионов двухвалентных металлов широко используются оптические биосенсоры [7]. Однако в условиях экспериментов с использованием оптических биосенсоров ионы цинка вызывают необратимую полимеризацию бета-амилоида на поверхности оптического чипа, что приводит этот чип в негодность и, соответственно, не позволяет проводить исследования по скринингу потенциальных ингибиторов цинк-зависимой олигомеризации бета-амилоида.
Сущность изобретения
Настоящее изобретение относится к использованию эналаприлата для ингибирования цинк-индуцированных димеров бета-амилоида. Недавно нами было установлено, что домен 1-16 бета-амилоида является молекулярной детерминантой цинк-зависимой димеризации бета-амилоида [[8, 9]. Эти данные позволили разработать модельную систему цинк-зависимой димеризации бета-амилоида на основе использования биосенсорной системы, в которой иммобилизованный на поверхности оптического чипа фрагмент 1-16 бета-амилоида образует устойчивые цинк-связанные димеры с синтетическим аналогом участка 1-16 бета-амилоида, присутствующим наряду с ионами цинка в качестве водорастворимого аналита в проточной буферной системе при физиологических значениях pH. Таким образом, данная система является моделью цинк-зависимой димеризации бета-амилоида и предоставляет возможность в режиме реального времени оценить способность различных водорастворимых веществ препятствовать образованию цинк-связанных димеров участка 1-16 бета-амилоида. В настоящем изобретении с помощью этой системы было найдено, что эналаприлат является ингибитором цинк-зависимой димеризации бета-амилоида.
Технический результат
Технический результат, достигаемый при использовании патентуемого изобретения, заключается в ингибировании цинк-зависимой димеризации бета-амилоида.
Пример осуществления изобретения
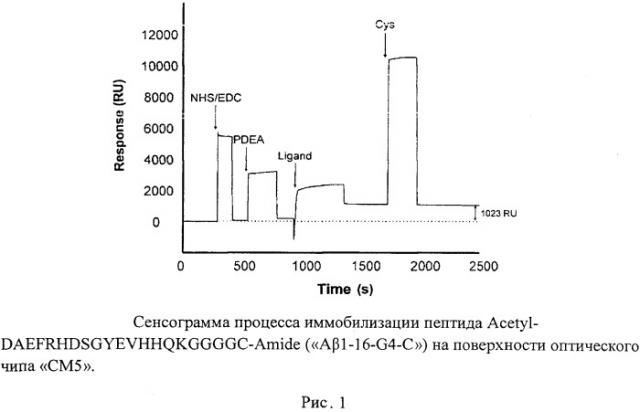
Для определения ингибирующего эффекта эналаприлата на образование цинк-связанных димеров бета-амилоида была задействована экспериментальная модель in vitro цинк-зависимой димеризации бета-амилоида на основе оптического биосенсора поверхностного плазмонного резонанса «BIAcore Т100» (GE Healthcare, США). В качестве оптического чипа, на поверхности которого впоследствии должен находиться иммобилизованный синтетический аналог участка 1-16 бета-амилоида, был использован оптический четырехканальный чип «СМ5» с гидрофильной карбоксиметилированной декстрановой матрицей. Все анализы на этом термостатированном чипе проводились при температуре 25°C. Иммобилизация синтетического пептида Acetyl-DAEFRHDSGYEVHHQKGGGGC-Amide («Aβ1-16-G4-C»), содержащего на своем N-конце фрагмент 1-16 бета-амилоида, на поверхность чипа «СМ5» проводилась в соответствии с протоколом формирования тиольной связи, описанном в «Sensor surface handbook)) (GE Healthcare, США). Пептид был иммобилизован посредством образования тиольной связи в 10 мМ растворе ацетата натрия (pH 4.5). Для регенерации был использован буфер «HBS», содержащий 10 мМ HEPES, 3 мМ EDTA, 0.005% Р20 и 150 мМ NaCl (pH 7.4). Рабочий буфер содержал 50 мМ HEPES (pH 6.8) и 100 мкМ ионов цинка. Перед использованием все буферные растворы фильтровались (0.45 мкм, nylon). Скорость потока при иммобилизации составляла 5 мкл/мин. Карбоксиметилированная декстрановая матрица была активирована инъекцией смеси (1:1) растворов 1-ethyl-3-(3-dimethylaminopropyl)-carbodiimide (EDC) и N-hydroxysuccinimide (NHS): 30 мкл, 400 мМ EDC, 100 мМ NHS, а затем инъекцией раствора 80 мМ 2-(2-pyridinyldithio)-ethaneamine (PDEA) в 0.1 М борате натрия (pH 8.5). Далее раствор пептида «Aβ1-16-G4-C» (0.05 мг/мл в 0.1 М натрий-ацетатном буфере, pH 4.0, содержащем 1 М NaCl был введен в активированный канал чипа. Непрореагировавшие дисульфидные группы на поверхности чипа «СМ5>> были нейтрализованы с помощью раствора 50 мМ цистеина в 0.1 М натрий-ацетатном буфере (pH 4.0). Уровень сигнала иммобилизованного лиганда «Aβ1-16-G4-C)) составил 1023 RU. В контрольном канале чипа процедура иммобилизации была проведена аналогично за исключением этапа активации поверхности. Сенсограмма процесса иммобилизации приведена на рис. 1.
Для проведения экспериментов по оценке ингибирующего эффекта различных соединений на образование цинк-связанных димеров домена 1-16 бета-амилоида было приготовлено несколько рабочих буферов (таблица 1). С учетом тестируемых соединений образцы водорастворимого аналита «Аβ1-16» были приготовлены в соответствующем рабочем буфере. Каждый аналит (общий объем 25 мкл) затем был пропущен над поверхностью чипа при скорости 5 мкл/мин в течение 300 секунд. Далее поверхность чипа подвергалась прохождению рабочего буфера в отсутствии аналита в течение 300 секунд и чип был регенерирован регенерационным буфером (20 мкл). Сигнал из контрольного канала чипа (без иммобилизованного лиганда) вычитался из сигнала, соответствующего каналу с иммобилизованным лигандом.
В качестве контроля образцы водорастворимого аналита «Аβ1-16» были приготовлены в рабочих буферах №1 и №2 (см. табл.1). Ранее уже было показано, что в отсутствие ионов цинка взаимодействие аналита «Аβ1-16» с иммобилизованным «Аβ1-16-G4-C» не наблюдается, тогда как в присутствии ионов цинка на поверхности оптического чипа регистрируется димеризация с участием иммобилизованного «Aβ1-16-G4-C» и аналита «Аβ1-16» [10]. Исходя из данной предпосылки в качестве рабочего буфера, содержащего тестируемые соединения, был использован буфер №2.
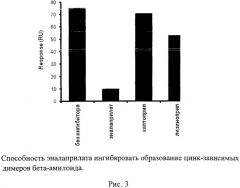
На рис. 2 приведены сенсограммы связывания водорастворимого синтетического аналога участка 1-16 бета-амилоида, Acetyl-DAEFRHDSGYEVHHQK-Amide («Аβ1-16»), с иммобилизованным пептидом «Aβ1-16-G4-C» в присутствии эналаприлата, лизиноприла и каптоприла, а также в их отсутствие. На рис. 3 показана гистограмма (на основании вышеуказанных сенсограмм) уровней сигналов оптического биосенсора, на чипе которого иммобилизован пептид «Aβ1-16-G4-C», а в качестве водорастворимого аналита использовался пептид «Аβ1-16» в присутствии ионов цинка (100 мкМ) при pH pH 6.8 в зависимости от наличия в пробе аналита эналаприлата, каптоприла или лизиноприла. В отсутствие этих веществ уровень сигнала (76 RU) максимальный и соответствует образованию цинк-связанного димера пептидов «Aβ1-16» и «Aβ1-16-G4-C». Наличие эналаприлата в пробе аналита резко снижает количество димеров, что отражается на уменьшении сигнала оптического биосенсора до 10 RU, что по техническим рекомендациям производителя данного прибора находится за порогом достоверности измерений и указывает на отсутствие образования димеров. В то же время остальные протестированные соединения, лизиноприл и каптоприл, которые по своей химической структуре и физико-химическим свойствам являются аналогами эналаприлата [11], показали отсутствие значимого влияния на ингибирование образования димеров бета-амилоида. Полученные данные свидетельствуют, что эналаприлат является специфическим ингибитором образования цинк-зависимых димеров бета-амилоида.
Список использованной литературы
[1] С.И. Гаврилова. Фармакотерапия болезни Альцгеймера. Пульс, Москва, 2007.
[2] Е. Karran, М. Mercken, В.De Strooper, The amyloid cascade hypothesis for Alzheimer's disease: an appraisal for the development of therapeutics, Nat Rev Drug Discov 10 (2011) 698-712.
[3] M.T. Fodero-Tavoletti, V.L. Villemagne, C.C. Rowe, C.L. Masters, K.J. Barnham, R. Cappai, Amyloid-β: The seeds of darkness, The International Journal of Biochemistry & amp; Cell Biology 43 (2011) 1247-1251.
[4] M.E. Larson, S.E. Lesne, Soluble Abeta oligomer production and toxicity, J Neurochem 120 Suppl 1 (2012) 125-139.
[5] G. Shankar, S. Li, T. Mehta, A. Garcia-Munoz, N. Shepardson, I. Smith, F. Brett, M. Farrell, M. Rowan, C. Lemere, C. Regan, D. Walsh, B. Sabatini, D. Selkoe, Amyloid-beta protein dimers isolated directly from Alzheimer's brains impair synaptic plasticity and memory, Nat Med 14 (2008) 837-842.
[6] A.I. Bush, The Metal Theory of Alzheimer's Disease, Journal of Alzheimer's Disease (2012).
[7] X.R. Cheng, V.W. Sze Hung, S. Scarano, M. Mascini, M. Minunni, K. Kerman, Label-free methods for probing the interaction of clioquinol with amyloid-[small beta], Analytical Methods 4 (2012) 2228-2232.
[8] Y. Miller, B. Ma, R. Nussinov, Zinc ions promote Alzheimer Abeta aggregation via population shift of polymorphic states, Proc Natl Acad Sci U S A 107 (2010) 9490-9495.
[9] P.O. Tsvetkov, A.A. Kulikova, A.V. Golovin, Y.V. Tkachev, A.I. Archakov, S.A. Kozin, A.A. Makarov, Minimal Zn(2+) binding site of amyloid-beta, Biophys J 99 (2010) L84-86.
[10] S.A. Kozin, Y.V. Mezentsev, A.A. Kulikova, M.I. Indeykina, A.V. Golovin, A.S. Ivanov, P.O. Tsvetkov, A.A. Makarov, Zinc-induced dimerization of the amyloid-beta metal-binding domain 1-16 is mediated by residues 11-14, Mol Biosyst 7 (2011) 1053-1055.
[11] P.A. Todd, R.C. Heel, Enalapril. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in hypertension and congestive heart failure, Drugs 31 (1986) 198-248.
| № | Состав рабочих буферов |
| 1 | 50 мМ HEPES, pH 6.8 |
| 2 | 50 мМ HEPES, 100 мкМ ZnCl2, pH 6.8 |
| 3 | 50 мМ HEPES, 100 мкМ ZnCl2, 100 мкМ эналаприлат, pH 6.8 |
| 4 | 50 мМ HEPES, 100 мкМ ZnCl2, 100 мкМ каптоприл. pH 6.8 |
| 5 | 50 мМ HEPES, 100 мкМ ZnCl2, 100 мкМ лизиноприл, pH 6.8 |
Применение эналаприлата в качестве средства для ингибирования образования водорастворимых цинк-зависимых димеров бета-амилоида.